2020-2021历年高考化学易错题汇编-硅及其化合物推断题练习题附详细答案
2020-2021高考化学 硅及其化合物推断题 培优 易错 难题练习(含答案)含答案
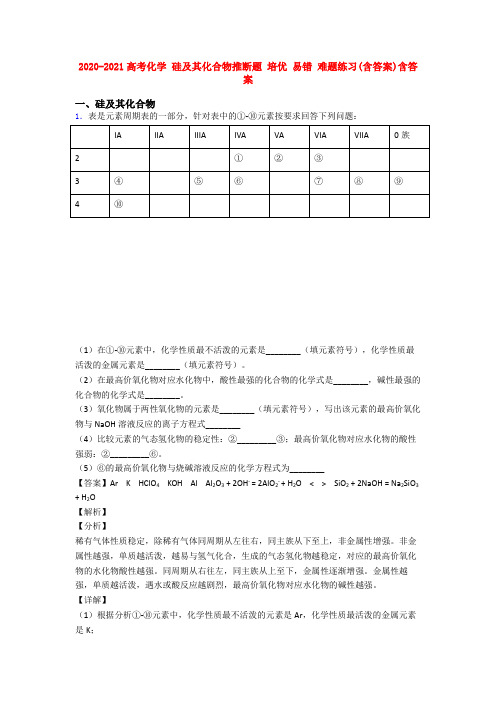
2020-2021高考化学硅及其化合物推断题培优易错难题练习(含答案)含答案一、硅及其化合物1.表是元素周期表的一部分,针对表中的①-⑩元素按要求回答下列问题:(1)在①-⑩元素中,化学性质最不活泼的元素是________(填元素符号),化学性质最活泼的金属元素是________(填元素符号)。
(2)在最高价氧化物对应水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的化学式是________。
(3)氧化物属于两性氧化物的元素是________(填元素符号),写出该元素的最高价氧化物与NaOH溶液反应的离子方程式________(4)比较元素的气态氢化物的稳定性:②_________③;最高价氧化物对应水化物的酸性强弱:②_________⑥。
(5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为________【答案】Ar K HClO4 KOH Al Al2O3 + 2OH- = 2AlO2- + H2O < > SiO2 + 2NaOH = Na2SiO3 + H2O【解析】【分析】稀有气体性质稳定,除稀有气体同周期从左往右,同主族从下至上,非金属性增强。
非金属性越强,单质越活泼,越易与氢气化合,生成的气态氢化物越稳定,对应的最高价氧化物的水化物酸性越强。
同周期从右往左,同主族从上至下,金属性逐渐增强。
金属性越强,单质越活泼,遇水或酸反应越剧烈,最高价氧化物对应水化物的碱性越强。
【详解】(1)根据分析①-⑩元素中,化学性质最不活泼的元素是Ar,化学性质最活泼的金属元素是K;(2)根据分析,①-⑩元素中Cl非金属性最强,故在最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,K金属性最强,碱性最强的化合物的化学式是KOH;(3)铝、氧化铝、氢氧化率均属于两性物质,则氧化物属于两性氧化物的元素是Al,该元素的氧化物与NaOH溶液反应的离子方程式Al2O3 + 2OH- = 2AlO2- + H2O;(4)非金属性越强,气态氢化物的稳定性越强,氧的非金属较强,故水比氨气稳定,②<③;非金属性越强,最高价氧化物对应的水化物的酸性越强,N非金属性强于Si,则HNO3酸性强于H2SiO3,故最高价氧化物对应水化物的酸性强弱:②>⑥;(5)硅的最高价氧化物SiO2与烧碱溶液反应的化学方程式为:SiO2 + 2NaOH = Na2SiO3 +H2O。
2020-2021高考化学易错题专题训练-硅及其化合物推断题练习题附答案解析

2020-2021高考化学易错题专题训练-硅及其化合物推断题练习题附答案解析一、硅及其化合物1.下图中的每一方格表示相关的一种反应物或生成物。
其中B是一种单质,其余物质也都是含有B元素的化合物。
C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为氧化物。
请回答下列问题:(1)A、D、E的化学式分别为________、________、________。
(2)A和B的互相转化在工业上有什么实际意义?_____________________。
(3)写出D→C反应的化学方程式:_____________________。
(4)写出E→D反应的化学方程式:_____________________。
【答案】SiCl4SiO2H2SiO3粗硅提纯SiO2+2NaOH=Na2SiO3+H2O H2SiO3SiO2+H2O 【解析】【分析】B是一种单质,其余物质都是含有B元素的化合物,B的结构类似金刚石,则B属于原子晶体,结合转化关系可以知道B为Si元素,而D为B的氧化物,则D是SiO2,A为 SiCl4,C是一种钠盐,则C是Na2SiO3,E是C对应的酸,则E是H2SiO3,结合对应物质的性质以及题目要求解答该题。
【详解】B是一种单质,其余物质都是含有B元素的化合物,B的结构类似金刚石,则B属于原子晶体,结合转化关系可以知道B为Si元素,而D为B的氧化物,则D是SiO2,A为 SiCl4,C是一种钠盐,则C是Na2SiO3,E是C对应的酸,则E是H2SiO3,(1)由以上分析可以知道A为SiCl4,D为SiO2,E为H2SiO3;因此,本题正确答案是: SiCl4,SiO2,H2SiO3。
(2)四氯化硅与氢气反应生成硅和氯化氢,硅与氯气反应生成四氯化硅,因此A和B的互变实际意义是粗硅提纯;因此,本题正确答案是:粗硅提纯;(3)二氧化硅和NaOH溶液反应生成硅酸钠,方程式为SiO2+2NaOH=Na2SiO3+H2O;因此,本题正确答案是: SiO2+2NaOH=Na2SiO3+H2O。
2020-2021高考化学易错题专题复习-硅及其化合物推断题练习题及答案

2020-2021高考化学易错题专题复习-硅及其化合物推断题练习题及答案一、硅及其化合物1.A、B、C、D、E五种物质中均含有同一种非金属元素,他们能发生如图所示的转化关系。
若该元素用R表示,则A为R的氧化物,D与NaOH溶液反应生成C和H2。
请回答:(1)写出对应物质的化学式:A________________; C________________;E________________。
(2)反应①的化学方程式为_______________________________________。
(3)反应④的离子方程式为_____________________________________。
(4)H2CO3的酸性强于E的,请用离子方程式予以证明:_______________________________。
【答案】SiO2 Na2SiO3 H2SiO3(或H4SiO4) SiO2+2C Si+2CO↑ Si+2OH-+H2O===SiO32-+2H2↑ SiO32-+CO2+H2O===H2SiO3↓+CO32-(或SiO32-+2CO2+2H2O===H2SiO3↓+2HCO3-)【解析】【分析】【详解】A、B、C、D、E五种物质中均含有同一种非金属元素,该元素(用R表示)的单质能与NaOH溶液反应生成盐和氢气,则可推知该元素为硅元素,根据题中各物质转化关系,结合硅及其化合物相关知识可知,A与焦碳高温下生成D,则A为SiO2,D为Si,C为Na2SiO3,根据反应②或反应⑤都可推得B为CaSiO3,根据反应⑥推知E为H2SiO3;(1)由以上分析可知A为SiO2,C为Na2SiO3,E为H2SiO3;(2)反应①的化学方程式为2C+SiO2Si+2CO↑;(3)反应④的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑;(4)H2CO3的酸性强于H2SiO3的酸性,可在硅酸钠溶液中通入二氧化碳,如生成硅酸沉淀,可说明,反应的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-。
2020-2021高考化学 硅及其化合物推断题 综合题含答案解析

2020-2021高考化学硅及其化合物推断题综合题含答案解析一、硅及其化合物1.A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系:其中①②③均为有单质参与的反应。
(1)若A是常见的金属,①③中均有同一种黄绿色气体参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_________________________。
(2)如何检验上述C溶液中的阳离子?______________________。
(3)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。
C的化学式是____________,属于置换反应____________,(填序号)写出反应①的化学方程式____________________。
【答案】Fe+2Fe3+=3Fe2+取少量溶液于试管,加KSCN溶液,无明显现象,再加氯水,溶液变成血红色,则证明含Fe2+ SiCl4①③ 2C+SiO2Si+2CO↑【解析】【分析】(1)由转化关系可知A为变价金属,则A应为Fe,B为氯化铁,C为氯化亚铁,②为Fe与氯化铁的反应;(3)B是太阳能电池用的光伏材料,可知B为Si,①为C与二氧化硅的反应,①②③为工业制备B的反应,则C为SiCl4,③中SiCl4与氢气反应,提纯Si,以此解答该题。
【详解】(1)A是常见的金属,①③中均有同一种气态非金属单质参与反应,且②为化合反应,则该非金属气体为Cl2,B为氯化铁,则反应②的离子方程式为2Fe3++Fe=3Fe2+;(2)由分析知C为氯化亚铁,检验Fe2+的操作方法是取少量溶液于试管,加KSCN溶液,无明显现象,再加氯水,溶液变成血红色,则证明含Fe2+;(3)B是太阳能电池用的光伏材料,可知B为Si,①为C与二氧化硅的反应,①②③为工业制备B的反应,则C为SiCl4,其中②为Si和Cl2化合生成SiCl4,③中SiCl4与氢气反应,提纯Si,则反应①的化学方程式为SiO2+2C Si+2CO↑,其中属于置换反应的有①③。
2020-2021高考化学硅及其化合物推断题综合试题附答案

2020-2021 高考化学硅及其化合物推测题综合试题附答案一、硅及其化合物1.在以下图的物质互相转变关系中, A 是一种固体单质,E是一种白色不溶于水的物质。
据此填空。
(1)写出各物质的化学式:A. ________、 B________、 C________、D. ________、 E________、 F________。
(2) B 与 a 溶液反响的离子方程式是_________。
(3) A 与 a 溶液反响的离子方程式是__________。
【答案】 Si SiONa2SiO3H2O H2SiO3H2 SiO2+-2-+H2O-+22OH =SiO3Si+ 2OHH2O=SiO32-+2H2↑【分析】【剖析】C 中加入过度 HCl 产生不溶于盐酸的白色积淀,推知 E 可能是硅酸, A 可能是 Si,代入题目考证, a 溶液是强碱(如NaOH)溶液或 HF 溶液,而 Si 和 SiO2与 NaOH 溶液反响均生成Na2SiO3. Na2SiO3与过度盐酸反响生成NaCl 和 H2SiO3白色积淀: H2SiO3SiO2+H2O,与题意符合. Si 和 SiO2与 HF 溶液反响均生成SiF4, SiF4与盐酸不反响.所以 A 是 Si, B 是SiO , C 是 Na SiO (或K SiO ), D是 H O, E是 H SiO , F 是 H, a 是 NaOH(或 KOH),223232232据此回答以下问题。
【详解】(1)由以上剖析可知 A 是 Si, B 是 SiO2, C 是 Na2SiO3, D 是 H2O, E 是 H2SiO3, F 是 H2;答案: Si; SiO2; Na2SiO3; H2O; H2 SiO3; H2;(2) B 和 a 溶液反响是二氧化硅和氢氧化钠溶液反响生成硅酸钠和水,反响的离子方程式为SiO2+2OH-=SiO32-+H2O;答案: SiO2 +2OH-=SiO32- +H2O(3) A 和 a 溶液反响是硅和氢氧化钠溶液反响生成硅酸钠和氢气,反响的离子方程式为Si+2OH-+H2O=SiO32+2H2↑;答案: Si+2OH-+H2O=SiO32+2H2↑2.已知 A 是一种装修品的主要成分,是地壳中含量最高的两种元素形成的化合物。
2020-2021高考化学硅及其化合物推断题(大题培优 易错 难题)含答案

2020-2021高考化学硅及其化合物推断题(大题培优易错难题)含答案一、硅及其化合物1.单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:(1)能与X发生化学反应的酸是_________;由X制备Mg2Z的化学方程式为_________。
(2)由Mg2Z生成Y的化学反应方程式为_________,Y分子的电子式为_________。
(3)Z、X中共价键的类型分别是_________。
【答案】氢氟酸 SiO2+Mg O2↑+Mg2Si Mg2Si+4HCl=2MgCl2+SiH4非极性键、极性键【解析】【详解】单质Z是一种常见的半导体材料,则Z为Si,X为Z的氧化物,则X为SiO2,Y为氢化物,分子结构与甲烷相似,则Y为SiH4,加热SiH4分解得到Si与氢气。
(1)能与SiO2发生化学反应的酸是氢氟酸;由SiO2制备Mg2Si的化学方程式为:SiO2+4Mg2MgO+Mg2Si。
(2)由Mg2Z生成Y的化学反应方程式为:Mg2Si+4HCl=2MgCl2+SiH4↑,Y为SiH4,电子式为。
(3)Z为Si,周期表中位于第三周期IVA族,其单质属于原子晶体,化学键类型为非极性共价键;X为SiO2,属于原子晶体,含有的化学键属于极性共价键。
2.有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。
取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为____________,其晶体属于____________晶体。
(2)乙的水溶液可以用来做________________________(写出一种用途)。
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。
2020-2021高考化学复习硅及其化合物推断题专项易错题附答案

2020-2021高考化学复习硅及其化合物推断题专项易错题附答案一、硅及其化合物1.A、B、C、D四种易溶于水的化合物只由表中的八种离子组成,且四种化合物中阴、阳离子各不相同。
阴离子Cl-、SiO32-、OH-、NO3-阳离子H+、Ag+、Na+、K+已知:A溶液呈强酸性,且A溶液与B、C溶液混合均产生白色沉淀,B的焰色反应呈黄色。
回答下列问题:(1)写出A、B、C、D的化学式:A______,B_____,C____,D____。
(2)写出A溶液与B溶液反应的离子方程式: __________。
(3)请选出适合存放A、C、D溶液的试剂瓶的序号:溶液A C D试剂瓶序号_________【答案】HCl Na2SiO3 AgNO3 KOH SiO32-+2H+=H2SiO3↓①③②【解析】【分析】A、B、C、D四种易溶于水的化合物只由表中的八种离子组成,且四种化合物中阴、阳离子各不相同,A溶液呈强酸性,则A为盐酸或硝酸,B的焰色反应呈黄色,则B中含有Na元素,A能和B反应生成白色沉淀,则B为Na2SiO3;盐酸能和AgNO3反应生成白色沉淀,所以C为AgNO3,则A为HCl,根据四种化合物中阴阳离子各不相同,则D为KOH。
【详解】(1)根据以上分析知,四种物质化学式分别为HCl、Na2SiO3、C为AgNO3、D为KOH;(2)A是HCl、B是硅酸钠,二者反应生成硅酸沉淀和氯化钠,离子方程式为SiO32-+2H+=H2SiO3↓;(3)A是HCl、C为AgNO3、D为KOH,KOH能和二氧化硅反应生成粘性物质硅酸钠,不能用含有玻璃塞的试剂瓶盛放;硝酸银见光易分解,应该放置在棕色试剂瓶中;盐酸不分解,且和玻璃中成分不反应,所以放置在一般试剂瓶中即可,所以A、C、D选取试剂瓶序号为①③②。
【点睛】含有钠元素的物质焰色反应为黄色,含有钾元素的物质焰色反应透过蓝色钴玻璃为紫色,钙元素的焰色反应为砖红色;玻璃中含有二氧化硅,能与碱性溶液发生反应,所以碱性溶液的试剂瓶不用玻璃塞。
2020-2021历年高考化学易错题汇编-硅及其化合物推断题练习题及详细答案

2020-2021历年高考化学易错题汇编-硅及其化合物推断题练习题及详细答案一、硅及其化合物1.在下列物质的转化关系中,A是一种固体物质,E是一种白色沉淀,据此填写下列空白:(1)B的化学式是________,B在固态时属于________晶体,1mol 含有的共价键数目是______N A。
(2)E的化学式是_________。
(3)B和a溶液反应的离子方程式是_______________________________(4)A和a溶液反应的化学方程式是___________________________________【答案】SiO2原子4H2SiO3SiO2+2OH-=SiO32-+H2O Si+2NaOH+H2O=Na2SiO3+2H2↑【解析】【分析】A是一种固体单质,与氧气反应得到B为氧化物,E是一种白色沉淀且不溶于盐酸,E加热分解得到B,所以E为H2SiO3,结合转化关系,可知A为Si,B为SiO2,a为强碱溶液,如NaOH溶液,G为Na2SiO3,D为H2O,F为H2。
【详解】(1)由上述分析可知,B是SiO2,SiO2由硅原子和氧原子通过共用电子对形成空间网状结构,在固态时属于原子晶体,每个硅原子和四个氧原子形成四个共价键,1mol 含有的共价键数目是4N A。
故答案为:SiO2;原子;4;(2)由上述分析可知,E为H2SiO3,故答案为:H2SiO3;(3)二氧化硅与强碱溶液反应生成硅酸盐与水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;故答案为:SiO2+2OH-=SiO32-+H2O;(4)Si与氢氧化钠反应生成硅酸钠与氢气,反应方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑,故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑。
【点睛】本题考查无机物推断,B为氧化物、E为不溶于盐酸的白色沉淀为推断突破口,需要学生熟练掌握元素化合物性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020-2021历年高考化学易错题汇编-硅及其化合物推断题练习题附详细答案一、硅及其化合物1.有两种短周期元素X 、Y ,X 元素原子的最外层电子数为a ,次外层电子数为b ;Y 元素原子的M 层(有电子)电子数为()a b -,L 层电子数为()a b +。
(1)推断元素名称和符号:X _______、______,Y ______、_______。
(2)X 、Y 两元素形成的化合物可能具有的性质是_______(填序号)。
A .能与水反应B .能与硫酸反应C .能与氢氧化钠溶液反应 (3)X 元素的原子含有_______个能层,Y 元素的原子含有_______个能层。
【答案】氧 O 硅 Si C 2 3【解析】【分析】短周期元素X 和元素Y ,元素X 原子的最外层电子数为a ,次外层电子数为b ;元素Y 原子的M 层电子数为(a -b ),L 层电子数为(a +b ),则L 层电子数为8,所以a +b =8,所以元素X 原子有2个电子层,故b =2,所以a =8-b =8-2=6,故X 为O 元素;故元素Y 原子的M 层电子数为a -b =6-2=4,Y 为Si 元素,X 、Y 两元素形成的化合物为SiO 2,结合元素化合物的性质判断。
【详解】(1)X 为O 元素,Y 为Si 元素,故答案为:氧;O ;硅;Si ;(2)X 、Y 两元素形成的化合物为SiO 2;A .SiO 2不与水反应,故A 错误;B .SiO 2性质稳定,溶于HF 酸,不溶于其它酸,故B 错误;C .SiO 2与氢氧化钠反应生成硅酸钠与水,故C 正确;D .SiO 2不与氯气反应,故D 错误;故答案为:C ;(3)氧原子和硅原子的原子结构示意图分别为:、,所以氧原子有2个能层,硅原子有3个能层,故答案为:2;3。
【点睛】本题推断元素种类是解题关键,根据每一能层能够排布的电子数多少进行综合判断,注意二氧化硅性质的特殊性。
2.有一应用前景广阔的纳米材料甲,其由A 、B 两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。
取材料甲与熔融的烧碱反应,生成一种含A 元素的含氧酸盐乙和一种含B 元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为____________,其晶体属于____________晶体。
(2)乙的水溶液可以用来做________________________(写出一种用途)。
(3)B 元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。
则①丁的电子式为_____。
②丁可由次氯酸钠与过量氨气反应制得,其化学方程式________________________。
甲的制备过程中氨气需要过量的理由是____________________________________。
③丁的水溶液呈弱碱性,室温下其电离常数K 1≈1.0×10-6,则0.01 mol ·L-1丁水溶液的pH 等于____________(忽略丁的二级电离和H 2O 的电离)。
【答案】Si 3N 4 原子 黏合剂、木材等的防腐剂或防火剂 NaClO + 2NH 3=N 2H 4 + NaCl + H 2O 次氯酸钠有强氧化性,防止N 2H 4继续被氧化 10【解析】【分析】甲由A 、B 两种短周期非金属元素组成,难溶于水,且硬度大,熔点高,考虑甲属于原子晶体。
甲与熔融的烧碱反应生成一种含A 元素的含氧酸盐乙和一种含B 元素的气体丙,且丙能使湿润的红色石蕊试纸变蓝,证明丙气体为NH 3,说明甲中含有氮元素。
含氧酸盐乙由短周期元素组成且为钠盐,能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解,说明生成的沉淀为H 2SiO 3,则乙为Na 2SiO 3,证明甲中含有硅元素,故A 为Si 元素,B 为N 元素,依据元素化合价可推知甲为Si 3N 4,据此分析解答。
【详解】(1)由分析可知,甲的化学式为Si 3N 4,属于原子晶体,故答案为:Si 3N 4;原子;(2)乙的水溶液为硅酸钠溶液,是一种矿物胶,可以做黏合剂、木材等的防腐剂或防火剂,故答案为:黏合剂、木材等的防腐剂或防火剂;(3)①B 元素的一种氢化物丁,相对分子质量为32,常温下为液体,可知丁为N 2H 4,电子式为:,故答案为:;②丁可由次氯酸钠与过量氨气反应制得,反应的化学方程式为:NaClO +2NH 3=N 2H 4+NaCl +H 2O ,次氯酸钠有强氧化性,防止N 2H 4继续被氧化,氨气需要过量,故答案为:NaClO +2NH 3=N 2H 4+NaCl +H 2O ;次氯酸钠有强氧化性,防止N 2H 4继续被氧化;③电离方程式为:N 2H 4+H 2O ⇌N 2H 5++OH -,该溶液中溶质电离程度较小,则c (N 2H 4)≈0.01mol /L ,由平衡常数K =()()+-2524c N H c(OH )c N H ⨯,可知该溶液中c (OH -()24·N H K c 61.0100.1-⨯⨯1.0×10-4,溶液中c (H +)=1441010--mol /L =10-10mol /L ,则溶液的pH =10,故答案为:10。
【点睛】正确推断元素是解答本题的关键。
本题的易错点和难点为(3)③中pH 的计算,要注意电离平衡常数表达式和水的离子积的灵活运用。
3.已知A 是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答:(1)A是______,B是_____,D是_____。
(2)写化学方程式:①_________;⑤_________。
(3)写离子方程式:②__________;③________;④________。
【答案】SiO2 Na2SiO3 H2SiO3 Na2CO3+SiO2Na2SiO3+CO2↑ H2SiO3H2O+SiO2 CO2+H2O+SiO32-=CO32-+H2SiO3↓ SiO2+2OH-=SiO32-+H2O SiO32-+2H+=H2SiO3↓【解析】【分析】由“A是一种不溶于水的固体非金属氧化物”可推知A为SiO2,再结合SiO2的相关性质:SiO2跟Na2CO3在高温下反应生成Na2SiO3和CO2,二者在水中会反应生成H2SiO3沉淀,则D为H2SiO3,H2SiO3受热分解生成SiO2和H2O,说明A为SiO2是正确的,③为SiO2和NaOH的反应,可知B为Na2SiO3,则C为CO2,Na2SiO3可与酸反应生成硅酸,据此答题。
【详解】由以上分析可知A为SiO2,B为Na2SiO3,C为CO2,D为H2SiO3。
(1)由以上分析可知A为SiO2,B为Na2SiO3,D为H2SiO3,故答案为:SiO2;Na2SiO3;H2SiO3。
(2)①SiO2和碳酸钠在高温下反应生成硅酸钠和二氧化碳,反应的方程式为SiO2+Na2CO3Na2SiO3+CO2↑,故答案为:SiO2+Na2CO3Na2SiO3+CO2↑。
⑤H2SiO3受热分解生成SiO2和H2O,反应方程式为:H2SiO3H2O+SiO2,故答案为:H2SiO3H2O+SiO2。
(3)②硅酸酸性比碳酸弱,硅酸钠和二氧化碳、水反应可生成硅酸,反应的方程式为Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3,离子方程式为:CO2+H2O+SiO32-=CO32-+H2SiO3↓,故答案为:CO2+H2O+SiO32-=CO32-+H2SiO3↓。
③二氧化硅和氢氧化钠反应生成硅酸钠和水,反应的化学方程式为SiO2+2NaOH═Na2SiO3+H2O,离子方程式为SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O。
④Na2SiO3可与盐酸反应生成硅酸,方程式为Na2SiO3+2HCl═2NaCl+H2SiO3↓,离子方程式为:SiO32-+2H+=H2SiO3↓,故答案为:SiO32-+2H+=H2SiO3↓。
【点睛】解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等,本题的突破口为:“A是一种不溶于水的固体非金属氧化物”。
4.X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)。
(1)若X的摩尔质量是W的2倍,工业上Z可作优质的耐高温材料。
W为黑色固体,则Y 的化学式________________。
(2)若固体W是紫红色,且向溶液Z中滴入氯水,再滴入2滴KSCN溶液,溶液呈血红色。
则写出X+Y=Z+W 的离子方程式__________________________。
(3)若晶体W是一种重要的半导体材料,实验室可用澄清石灰水来检验Z的燃烧产物。
写出Y与NaOH溶液反应的化学方程式________________________________________。
【答案】CO2 Fe+Cu2+=Fe2++Cu SiO2+2NaOH=Na2SiO3+H2O【解析】(1)X、W为单质,Y、Z为化合物,W为黑色固体,应为C单质,X的摩尔质量是W的2倍,Z可作优质的耐高温材料,X为Mg,Z为MgO,Y为CO2。
(2)向溶液Z中滴入氯水,再滴入2滴KSCN溶液,溶液呈血红色,则Z为Fe2+,W是紫红色固体,则W为Cu,X+Y=Z+W反应方程式为:Fe+Cu2+=Fe2++Cu。
(3)晶体W是一种重要的半导体材料,则W是Si;实验室可用澄清石灰水来检验Z的燃烧产物,则Z的燃烧产物为CO2,化合物Z为CO,则X为C单质,Y为SiO2,Y与NaOH 溶液反应的化学方程式为:SiO2+2NaOH=Na2SiO3+H2O。
5.已知A、D为常见单质,各物质发生如下框图所示变化,回答下列问题:(1)若A、D为短周期同主族非金属元素的单质,则A元素在周期表中的位置为______,D 的晶体类型是______,请写出A+B→C+D的化学方程式______。
(2)若B为气体,其标准状况下密度为1.964g•L-1,C为白色固体,可用来制作耐高温材料。
则B的电子式为______,C中含有的化学键是______(填写“离子键或者共价键”)。
(3)若A为生产生活中用量最大的金属,B在常温下为无色液体,写出C(金属元素有两种不同化合价)与盐酸反应的离子反应方程式____________。
若以A和石墨棒为电极,NaCl 溶液为电解质溶液构成原电池,请写出石墨电极的电极反应式______。
【答案】第二周期第IVA族原子晶体 SiO2+2C Si+2CO 离子键Fe3O4+8H+=Fe2++2Fe3++4H2O O2+2H2O+4e-=4OH-【解析】【详解】(1)若A、D为短周期同主族非金属元素的单质,由转化可知B、C属于氧化物,A与B的反应属于置换反应,可推知A为碳、B为SiO2、C为CO、D为Si,则A元素在周期表中的位置为:第二周期第IVA族,硅的晶体类型是原子晶体,A+B→C+D的化学方程式:SiO2+2C Si+2CO;(2)若B为气体,其标准状况下密度为1.964g•L-1,B的相对分子质量=22.4×1.964=44,C为白色固体,可用来制作耐高温材料,则A为Mg、B为CO2、C为MgO、D为碳,B的电子式为,C(MgO)中含有的化学键是:离子键;(3)若A为生产生活中用量最大的金属,B在常温下为无色液体,则A为Fe、B为H2O、C 为Fe3O4、D为H2,C与盐酸反应的离子反应方程式:Fe3O4+8H+=Fe2++2Fe3++4H2O,若以Fe 和石墨棒为电极,NaCl 溶液为电解质溶液构成原电池,石墨电极为正极,发生还原反应,氧气获得电子市场氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-。
