化工工艺课件
化工工艺学-第三章ppt课件

表观停留时间
tR
包括惰性稀释别)的实际体积流量, L,反应管长度; S,反应管截面积, VR,反应器容积。
平均停留时间:
t A
VR dV 0 VV
tA
VR V V
V╹,原料气(包括水蒸气)在平均反应温 度和平均反应压力下的体积流. 量
3.烃分压和稀释剂的影响 烃分压是指进入裂解反应管的物料中气相碳氢化合物
的分压。 热力学: a降低压力有利于抑制二次反应。裂解反应的一次反应是 摩尔数增加的反应,所以压力降低有利于提高一次反应的 平衡转化率。二次反应,尤其是聚合、缩合、结焦等二次 反应是摩尔数减少的反应 b压力对反应速度和反应选择性的影响:
脱氢反应反应式为:
.
烃类裂解过程的二次反应
(1)烯烃裂解 如大分子烯烃裂解为小分子烯烃 2)烯烃聚合、环化、缩合反应
.
(3)烯烃加氢和脱氢反应,如 (4)烯烃分解生碳反应,如
.
烃类裂解反应机理
(1)链引发:烷烃引发主要是断裂C—C键,而对C一H键的引发较小。 链引发反应的活化能较大,290~330KJ/mol范围。 (2)链的增长反应:自由基的分解反应和自由基的夺氢反应。分 解反应的活化能在120~178KJ/mol范围内,夺氢反应的活化能在29 ~45KJ/mol的范围内。两种链传递反应的活化能都比链引发的活化 能小,而反应是生成烯烃的反应,能使小分子烯烃的收率增多,还 可提高裂解反应的转化率。 (3)链终止反应:自由基与自由基结合成分子的反应。
a提高温度有利于—次反应。 b温度升高,二次反应速度也加快,所以升高温度也能使 焦的量增加。因此,当采用高温时必须相应减少停留时间, 以减少结焦的量和生成乙炔的量。
.
2.停留断间的影响 (1) 停留时间的选择
化工工艺流程图 ppt课件
ppt课件
16
设备类别
表7-2 工艺流程图上的设备、机器图例
代号
图例
塔
T
反应器 R
ppt课件
17
设备类别
代号
图例
容器 (槽、罐) V
泵
P
ppt课件
18
2.管道流程线的表示方法
用规定的图形符号和文字代号,详细表示所需的全部管 道、阀门、主要管件(包括临时管道、阀门和管件)、公用 工程站和隔热等。
ppt课件
7
工艺原pp则t课件流程图
8
工艺原则流程图通常采用按工艺流程 顺序,自左至右展开图的形式表示,设备 以示意的图形或符号表示(表7-2),并用 细实线画出,流程图中的主要物料流程的 流程线用粗实线表示,流程方向用箭头画 在流程线上。
当物料经过设备产生变化时,可在流程 的起始部分和物料产生组分变化的设备之 后,在流程线上用指引线引出并列表标注 (指引线及表格线皆用细实线绘制)。标 注出物料变化前后各组分的名称、流量、 质量分数或摩尔分数和每项的总和数等 (标注项目可按需要酌量增减)。
ppt课件
9
某丙烯酸甲酯装p置pt课局件部工艺原则流程图
10
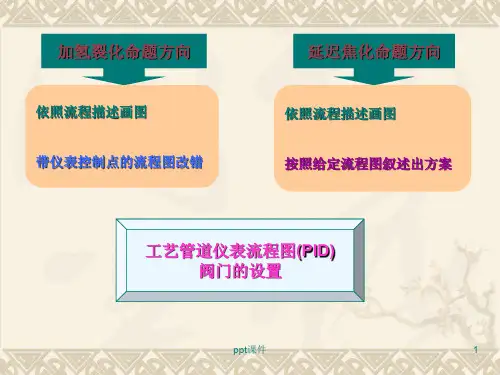
三、工艺管道仪表流程图(PID)
也称带控制点的工艺流程图。是借助统一规定的 图形符号和文字代号,用图示的方法把建立石油化 工工艺装置所需的全部设备、仪表、管道、阀门及 主要管件,按其各自功能,在满足工艺要求和安全、 经济的前提下组合起来,以起到描述工艺装置的结 构和功能的作用。
加氢裂化命题方向
依照流程描述画图 带仪表控制点的流程图改错
化工工艺学课件薛荣书、谭世语主编第7章石油炼制

7.1.6 原油中的固体烃
C16以上正构烷烃为固体,但在石油中是溶解于石油 的。温度降低时可能有部分固体烃类结晶析出,析
出的称为蜡。蜡分为石蜡和地蜡。
石蜡常从柴油、润滑油馏分中分离出来,地蜡从减 压渣油中分出。石蜡和地蜡都是混合物。
蜡的存在使油品低温流动性降低,对输送加工不利。
表7.6 我国几种原油的含蜡量
23
破乳剂一般为非离子型表面活性剂2070等,用 量极少。电压一般为1635kV.
典型脱盐脱水工艺流程如图7.2.
注意:注水的目的是溶解结晶盐。
二次注水
一级脱盐罐
破一 乳次 剂注
水
二级脱盐罐
含盐废水
24
25
电脱盐罐 交直流电脱盐罐的结 构简图如图7.1所示。
防爆高阻抗变压器
必须限流式供电,要
是由一芳香环、一环烷环加一烷基侧链组成。所 以石油中一些复杂分子很难说是一种烃类。可以 将其看成一种平均分子,从它是由多少芳香烃、 环烷烃和烷基侧链组成来分析组成。具体可用各 结构单元C原子数占总C数的比例来表示。如前例: C总=20,C芳=6 C环=4 C侧=10
13
用原C子A、数C占N、总CCP数分的别百表分示比芳。香前、例环有烷和烷基侧链C CA = 6/20=30% CN =4/20=20% CP = 10/20=50% 再环用 烷R环T表的示环总数环。数RT,=2R, AR、A =R1N, R分N别=1表。示芳香环和 由实验测出平均分子量和元素组成后,就可以
一般规律:环烷烃含量随沸点升高而下降, 芳 香烃含量随沸点升高而增加。
沸点范围/°C 烷烃 环烷烃 芳香烃
60~95
56.8 41.1
2.1
95~122
化工工艺学 第一章PPT课件

10
原料
反应
分离
11
12
13
工艺流程图
各个生产单元按照一定的目的要求,有机地组合在 一起,形成一个完整的生产工艺过程,并用图形描绘出 来。
14
生产工艺流程示意图 : 生产工艺流程示意图是用文字或框图形式来 表明物料、设备的名称,并以箭头方式表明 物料的流向。它只是定性地标出由原料转化 成产品的路线、流向顺序以及生产中采用的 工艺过程和设备。
第一章 概 论
化学工业的发展简史
1
2
3
4
5
纯碱工业
近 代
硫酸工业
化
学
煤化工
工
业
染料
……
6
合成氨及化肥工业
现 代
农药工业
化
学
塑料工业
工
业
橡胶工业
……
7
化学工业的分类
无机化工
有机化工
高分子材料化工
精细化工 生物化工
8
化工装置的操作方式 连续操作 间歇操作 半连续操作
9
化工工艺设计 一、化工工艺设计的内容和要求 二、产品生产的反应工艺研究和设计 三、工艺流程设计方案
20
21
22
物料代号
代 号
物料名称
A 空气
AM 氨
BD 排污
BF 锅炉给水
BR 盐水
CS 化学污水
CW
循环冷却 水上水
DM 脱盐水
DR
排液、排 水
DW 饮用水
代
物料
号
名称
F 火炬排放气 FG 燃料气 FO 燃料油 FS 熔盐
G 填料油 O H氢
H 载热体 M HS 高压蒸汽 H 循环冷却水 W 回水 IA 仪表空气
化工工艺教学课件-第3章-原料气制取(天然气制气)

计算基准:1molCH4,水碳比为1:m, 假设转化了的甲烷为x ,变换了的一氧化碳为y
则平衡时各组分的组成见下表
物质 CH4 H2O CO H2
t=0 1
m
0
0
CO2 合计 0 1+m
t=? 组成
1-x m-x-y x-y 3x+y y 1+m+2x
1 x mx y x y x y
y
1m2x 1m2x 1m2x 1m2x 1m2x
预计转化气组成
已知温度 求平衡常数 求平衡组成 选择工艺条件 判断工况
例题:
一段转化炉出口温度820℃、压力3.0MPa(表), 求水碳比为3.5的甲烷转化气成分。 平衡温距15~25℃已知温度、压力、Fra bibliotek碳比 转化气组成
例题:
由转化气组成 确定温度、压力、水碳比参数
反
应
在催化剂的表面,甲烷转化的速度比甲烷分解
1 水蒸汽重整法 CH4+H2O(g) → CO+3H2 2 部分氧化法 CH4+0.5O2 → CO+2H2 3 二氧化碳重整法 CH4+ CO2 → CO+3H2 4 自热重整法 (水蒸汽重整+部分氧化 )
水蒸汽重整法(SRM)
CH4+H2O(g) → CO+3H2+205.7kJ/mol
强吸热反应
第三章 粗原料气制取
重点
掌握粗原料气制取的方法、原理、主要设备;工艺 特点、降耗措施、三废治理
了解
烃类蒸汽转化催化剂的组成, 各种制气反应机理、工艺条件的选择原则
合成气—CO和H2的混合物
用途—纯H2和纯CO的来源、衍生多种化工产品
产品
化工工艺课件

由于农业发展和军工生产的需要,以天然有机肥料及天然硝石作为氮肥主要来源已不能满足需要,迫切要求解决利用空气中氮的问题。20世纪初,很多化学家积极从事氨合成的理论基础研究和工艺条件试验,德国物理化学家F.哈伯和工程师C.博施于高压、高温和有催化剂存在时,利用氮气和氢气成功地直接合成了氨(见合成氨工业发展史)。
随着造纸、染料和印染等工业的发展,对烧碱和氯气的需要不断增加,由苛化法制得的烧碱已不能满足要求。在直流发电机制造成功之后,1893年开始用食盐饱和水溶液以电解法生产烧碱和氯气(见氯碱工业发展史)。 到19世纪末叶,形成了以硫酸、纯碱、烧碱、盐酸为主要产品的无机化工。苛化法 汞阴极法 隔膜法 离子膜法
工艺专业的主要任务
分析研究化工生产过程规 律,根据所学的‘知识’来研究原料最大限度转化为产品的方法、过程、工艺操作条件和生产工艺流程。
理论环节
实践环节
根据工艺操作规程要求,要的控制工艺操作条件,保证原料最大限度的转化为目的产物。
第一章:绪论
化学工业按其生产原料划分
基本有机化工 基本无机化工 高分子化工 精细化工 生物化工
医药 农药 肥料 染料 涂料等
按产品类别及产量划分
按产品的用途划分
按产品类别及产量划分
中国对化学 工业的分类
按化工产品划分19类产品 按行政管理划分20个行业 见表1-1
表1-1中国化学工业范围划分
§1-1 化学工业及其发展概况 §1-1-1化学工业 一、概念 以天然物质或其他物质为原料,通过化学方法和物理方法,使其结构、形态发生变化,生成新的物质,制成生产资料和生活资料的工业。 二、重要性 ☆ 化学工业是国民经济的支柱产业。 ☆ 它不仅和人民生活息息相关,而且对国 家的现代化建设以及人类的生存和发展起 着重要作用。见下页
化工工艺图培训课件ppt52页
7.1化工工艺流程图
7.1.1 工艺方案流程图
工艺方案流程图,又称原理流程图或物料流程图。
1.工艺方案流程图的作用和内容
作用 工艺方案流程图是用来表达整个工厂或车间生产流程的
图样,它是一种示意性的展开图,以表示化工生产中由原料转化为 成品或半成品的来龙去脉及所采用的设备。
内容
(1)设备示意图; (2)设备名称和位号; (3)物料和动力管道的流程线; (4)必要的文字注解。
温度 T TI
TIC TIA TIS TR TRC TRA TRS TC TCT
TA TS TL
温差 TD TdI
TdIC TdIA TdIS TdR TdRC TdRA TdRS
Tdc TdCT
TdA Tds TdL
压力或 真空 P
PI PIC PIA PIS PR PRC PRA PRS PC PCT PA
在图样的右上角画出方向标,作为管道安装的定向基准;
④相同设备序号表示同一设备位号下数台设备的顺序号,用大写英文字母表示。
③设备序号是该车间或工段内设备的顺序号,也要求用两位数表示。
建筑平面图是假想用一水平的剖切面沿门窗洞的位置将房屋剖切后,将留下的部分按俯视方向在水平投影面上作正投影所得到的图样
。
优点:制作简单,施工较快:缺点:金属用量多,造价高并须经常进行维修保养。
AA AS AL
密度 D DI
DIC DIA DIS DR DRC DRA DRS DC DCT DA
DS DL
位置 Z ZI
ZIC ZIA ZIS ZR ZRC ZRA ZRS ZC ZCT ZA
化工工艺学课件第二章化学工业原料及其加工[可修改版ppt]
①链式饱和烃 烃类化合物(碳氢化合物) ②环烷烃
③芳香烃
表2-1 大庆原油的主要理化性质
①硫化物
非烃化合物 ②氮化物
③含氧化合物 ④金属有机化合物
胶质和沥青质
为了充分利用宝贵的石油资源。要对石油进行一次加工和二次加工,在生产 出汽油、航空煤油、柴油、锅炉燃油和液化气的同时,制取各类化工原料。
(2)燃料—润滑油型炼油厂 在生产各种燃料油的同时,还生产各种润滑油原料。通过各 种润滑油生产工艺制得润滑油组分,经调配方法制得各种润 滑油。 (3)燃料—化工型炼油厂 在生产各种燃料油的同时生产炼油气、液化石油气和芳烃等 石油化工原料。除此之外,随着对石油化工产品需求的不断 增长,一类以此生产化工产品为目的的化工型炼油厂也迅速 发展起来。 (4)燃料—润滑油—化工型炼油厂 此类炼油厂既生产燃料、润滑油类石油产品,又生产石油化 工原料。
(1)待处理原油的性质、组成; (2)对石油产品的要求,包括产品种类、质量和数量; (3)资源综合利用; (4)工艺装置对原料变更的适应性; (5)技术先进、能耗低、经济合理。
根据主要产品的类型,炼油厂可分为如下四种类型。
(1)燃料型炼油厂 以生产汽油、喷气燃料、柴油和燃料油,同时副产燃料气、芳烃和石油焦 等。主要加工装置为常、减压蒸馏、催化重整、催化裂化、延迟焦化等。其 特点是通过一次加工尽可能将石油中轻质油品抽出,得到汽油、煤油、柴油 直溜产品,并利用二次加工工艺将原油中的重质油和石油气转化为轻质燃料 油。由于国内燃料产品占石油产品总量的一半以上,故此类型炼厂的数量最 多。
❖ 原油按组,凝
固点高,含硫及胶质较少,大庆原油属于此类。 • 环烷基原油含有较多的环烷烃和芳香烃,密度较大,凝固点
第六章---化工生产工艺流程PPT课件
• 二段炉: CH4+H2O = CO+3H2
• 变换炉: CO+H2O ƒ H2+CO2
• 脱碳塔: CO2+K2CO3 +H2O ƒ 2KHCO3
• 甲烷化炉:CO+3H2 = CH4+H2O
• 合成塔: 3H2+N2 ƒ 2 NH3
37
38
39
14
二、工艺流程配置的方法
1. 原料预处理系统 ⑴原料的选择和利用
化工厂原料的费用一般占60%-80%; 尽可能选用价廉易得的原料; 尽可能提高原料的转化率、反应的选择性和目 的产物的收率。
⑵原料的预处理
①、②、③、④、⑤、
15
二、工艺流程配置的方法
2. 反应系统
理想反应器;适宜的反应条件 辅助设备
4
化工过程:
化工生产从原料到制成目的产物,经过的一系列物理和 化学加工处理步骤。
每个化工生产过程基本包括三个步骤:
包含原料的预处理、化学反应、产物的分离及精制 化工过程是以化学反应过程为中心。 工业生产中,制备产品氨包括以下步骤: 合格氮气、氢气的制备; 氢气和氮气进行化学反应合成氨; 分离混合气中的产品氨;
通常操作压力为25-30 MPa时采用一级氨冷, 进塔氨含量控制在3%-4%;而在20 MPa合成时采 用二级氨冷,15MPa下合成时采用三级氨冷,此 时进塔氨含量可降至1.5%-2.0%。
化工工艺学教学课件--第五章 脱硫与脱碳
(4)聚乙二醇二甲醚法
使用的吸收溶剂是经筛选后的聚乙二醇二甲 醚n=的2~同9。系该物同,系分物子能式选为择CH性3O地(C脱2H除4O气)n体CH中3,式的中 CO2和H2S,无毒且能耗较低。
2、化学吸收法
(1)氨水法
是最原始的一种方法,在我国小氮肥厂,用 浓氨水吸收二氧化碳生产碳酸氢铵,因工艺简 单,脱碳成本低,还有不少小化肥厂使用此法。
活性成分为MoS2,其次
Co9S8
(3)干法脱硫的优缺点
优点:具有极强的脱除有机硫和无机硫能力, 气体净化度高。
缺点:脱硫剂再生困难或不能再生,不适用于 脱除大量无机硫,所以只能用于气态烃、石脑 油及合成气的精细脱硫。
4、湿法脱硫
湿法脱硫是在吸收塔中用液体吸收剂(脱硫剂)吸 收煤气中的硫化氢,而后再将吸收剂再生,再生后的吸 收剂再送回吸收塔中循环使用。
第五章 脱硫与脱碳
各种方法制得的原料气在送去合成氨之前都需经过 净化,以出去其中的有害杂质,如硫化物、CO和CO2等。 净化过程主要包括脱硫、CO变换和脱除CO2和少量CO。 一、脱硫 二、二氧化碳脱除 三、少量一氧化碳脱除
一、脱硫
按分子结构
硫
无机硫 有机硫
存在形式
硫铁矿硫
硫化氢
无机硫90%
硫酸盐硫 脂肪硫 芳香硫
③特点
★溶剂在低温下对CO2、H2S、COS等酸性气体吸收能力 极强,溶液循环量小,功耗少。 ★溶剂不氧化、不降解,有很好的化学和热稳定性。 ★净化气质量好,净化度高,CO2<20ppm,H2S<0.1ppm。 ★溶剂不起泡。 ★具有选择性吸收H2S、COS和CO2的特性,可分开脱除 和再生。 ★溶剂廉价易得,但甲醇有毒,对操作和维修要求严格。 ★该工艺技术成熟,目前全世界约有87套大中型工业化 装置。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化工工艺1.绪论1.3 化工原料与产品1.3.1 原料定义:化工生产中全部或部分转化为产品的物质。
主要有:(1) 空气:包括N2、O2和惰性气体。
(2) 水:最廉价的原料。
(3) 矿物:煤、石油、硫铁矿、盐、石灰石、氟磷灰石、各种有色金属矿等。
(4) 生物原料:粮食、树木、农产品废弃物等。
1.3.2 产品定义:化工原料经过单元过程和单元操作而制得的可作为生产资料或生活资料的成品物质都是产品。
生产出次要的、有一定价值的产品叫叫副产品。
例如:三酸二碱、化肥、农药、塑料、油品、化纤、涂料、药物等。
1.4 化工过程分析1.4.1 工艺过程的选择与确定(1) 化工过程化学过程一般分为三个步骤。
a) 原料处理净化、浓缩、混合、粉碎等。
b) 化学反应获得产品的关键步骤。
将原料转化为产品,应注重产率。
c) 产品精制将得到的混合物产物进行分离和提纯,注重纯度。
一般讲,a)和c)主要是物理过程,称为〝单元操作〞;b)是化学变化过程, 称之为〝单元过程〞。
分离、提纯工程在化工生产中占有非常重要的地位,占总投资的50~80%。
(2) 过程的选择工艺路线有多条,如何选择应考虑:a) 技术上的可行性实验室研究结果≠可以用来设计生产过程,因为放大会带来许多误差,必须逐步放大和完善。
b) 经济上的合理性要进行成本核算,一定要有利润,否则不能生产。
核算成本一定要全面。
例如:原料费(包括运费)、动力费、工资、设备折旧、维修、管理费、财务费用(利息等)、增值税(增值部分17%)、所得税等。
企业规模、管理水平不一样,各项所占比例也不一样。
化工业前2项为主要成本,~70~80%。
(3) 过程的确立过程的确立还需考虑以下因素:a) 生产装置规模及工艺的先进性。
b) 原材料的来源及质量的稳定性。
c) 质量指标、收率、销售数量及价格。
d) 运行的可靠性、安全性、运转周期、开停车方法、失控的对策、公共工程(水、电、汽)的要求。
e) 腐蚀及设备材料选择。
f) 三废排放和治理方法。
思考题1. 什么叫〝单元过程〞?什么叫〝单元操作〞?2. 化工生产的最基本原料有哪些?3. 化工生产的成本组的主要项目有哪些?4. 在选择化工产品工艺路线时,必须从哪几个主要方面考虑问题?5. 一个化学生产过程,可分为哪几个主要步骤?6. 一个化学生产过程的考核指标有哪几个?具体含义如何?3.合成气煤气化有5个过程:(1)上吹空气提高氧化层温度:C + O2 = CO2+Q。
同时将炉顶部吹空气放空;(2) 一次上吹气化剂气化反应:C + H2O = CO + H2在还原层: C + CO2= 2CO得合成气。
氧化层温度降低,高温层向上移动。
(3)一次下吹制气一次上吹气化剂,进行制气。
同时高温层向下移动。
使燃料层温度分布趋于平衡。
(4) 二次从下吹制气将炉底的下吹煤气排净,为下次上吹空气做准备(煤气与空气混合易爆炸)。
(5) 空气吹净此阶段将部分吹风气回收,作为半水煤气中氮的主要来源。
上述5个过程,采用阀门联动系统,如p30的图3-2所示。
每个循环过程约3min。
间歇式固定床煤气发生炉所得半水煤气(CO+ H2)/N2只有1.43,离合成氨所需的 H2/N2=3.1~3.2相距甚远,因此在提高燃料层温度的吹风阶段,应将吹风气放空。
气化装置还有流化床气化炉和气流床气化炉,其结构见p31-32的图3-3和图3-4。
生产甲醇的复合化学生产流程及气化炉激冷流程如图3-5和图3-6所示。
(自学)3.1.2 蒸汽转化主原料是天然气或石脑油等轻质烃类与水蒸气,是世界上主要的技术路线。
由于该法要用催化剂,为防止催化剂中毒,在制合成气之前, 天然气或石脑油必须先行脱硫(如何脱硫,后面再述)。
工业上一般采二段转化(见p36图3-7)。
(1) 一段转化:主要目的是产生CO和H2。
Cn Hm+ nH2O= nCO +(n + m/2)H2和 CH4 + H2O = CO + 3H2-206.2kJ/mol蒸汽转化反应是强吸热反应,温度升高有利于正向反应。
副反应:CO+ H2O = CO2+ H2副反应是放热反应,升高温度可降低副反应的进行。
因此,反应在催化剂存在下,在500~1000o C,才能获得满意的反应速度。
催化剂是技术关键之一。
镍是最有效的、高活性的催化剂。
以NiO状态存在,含量10~25%。
MgO为助催化剂,Al2O3、CaO、K2O等为载体。
在温度为800~820o C、压力2.5~3.5MPa、H2O/C = 3.5时,转化气组成为(体积%):CH4 10%、CO 10%、CO210%、H269%、N21%。
还达不到合成氨等的要求。
(2) 二段转化二段转化的主要目的是将 CH4从8~10%降至0.2~0.5%,同时引入N2,使H 2/N2=3。
达到合成氨的要求。
二段转化的主要反应是:H2 + O2= H2OCO + 1/2 O2 = CO2CH4 + O2= CO +3H2(甲烷转化)二段转化时,首先是一段转化气与空气混合燃烧,可达1200o C。
然后在镍催化下进行甲烷转化。
其反应吸热,所以,转化炉出口气体温度降至900~1000o C。
(3) 连续蒸汽转化流程实例在天然气中配以 0.25~0.5%的氧气,加热到380~400 o C,进入氧化锌脱硫,使S含量降至0.5ppm以下。
原料气配入水蒸汽于400o C下进入一段转化炉的对流段加热至500~520 o C,进入镍催化转化管,管外加热转化(一段转化)。
一段转化气由800~820 o C再加热至850~860 o C,配少量水蒸汽和空气混合,在二段转化炉顶部燃烧区燃烧、放热,升至1200o C左右。
再通过催化床,得到所需合成气(p36图3-7)。
3.1.3 部分氧化法分为非催化和催化〝部分氧化法〞两种。
我国采用后者。
部分氧化法的主原料为烃原料(重油)、富氧空气和水蒸汽。
三者混合气以较高速度进入镍催化剂床层进行氧化和转化反应,使其没有燃烧空间,有效防止炭黑析出,炭黑析出有碍催化剂活性。
工艺条件是:蒸汽/天然气= 0.7~0.8 ,氧气/天然气= 0.6 ,温度800~950 o C ,空间速度(单位时间通过单位体积催化剂的气体的标准状态体积)为300~350h-1。
(p38图3-9)3.2 合成气的净化合成气净化包括脱硫、脱碳(脱CO2)、CO变换。
3.2.1 脱硫硫化物的存在可使催化剂中毒,必须除去。
一般要求硫含量<0.15~0.2mg/m3,,即5~7ppm(以H2S计)。
脱硫的困难之处在于硫化物存在形式复杂:除硫化氢外,还有二氧化硫、硫氧化碳、硫醇、硫醚、噻吩等。
脱硫方法分为干法和湿法两种。
(1) 干法脱硫针对不同的硫可采取不同的干法脱硫方法。
a) 活性炭吸附法可脱除硫醇以外的有机硫及少量硫化氢。
b) 氧化锌等接触反应法除噻吩外,可脱除硫化氢和多种有机硫。
氧化锌表面积大、硫容量高、脱硫能力极强,可使硫含量降低至0.5ppm左右。
ZnO是一种化学反应式脱硫剂:ZnO + H2S = ZnS + H2OZnO + RSH = ZnS + ROHc) 加氢转化氢存在下并经钴钼(或镍) 催化剂催化,二硫化碳、硫氧化碳等有机硫全都转化成硫化氢后再被脱去:CS2 + 4H2= 2H2S + CH4COS + H2 = H2S + CORSH + H2 = H2S + RH干法脱硫的优点:对各种硫均有极强的脱除能力、净化力高。
干法脱硫的缺点:脱硫剂再生困难或无法再生,脱硫成本高,不适于脱除大量的硫。
(2) 湿法脱硫利用溶液吸收进行脱硫。
a) 物理吸收法吸收剂有:甲醇、碳酸丙烯酯、聚乙二醇二甲醚等。
可吸收硫化氢、硫氧化碳、二硫化碳等。
b) 化学吸收法乙醇胺法(MEA)、二乙醇胺法(DEA)、N甲基二乙醇胺法(MDEA)、热钾碱法、催化热钾碱法、蒽醌法、改良ADA法、拷胶法、PDS法等。
用得最多的是后三种。
ADA(或改良法)以碳酸钠作脱硫剂、2,6-蒽醌二磺酸钠或2,7-蒽醌二磺酸钠(ADA)为催化剂、偏钒酸钠为氧载体、酒石酸钾钠为稳定剂、三氯化铁为促进剂、EDTA为络合剂进行反应式脱硫:Na2CO3+ H2S = NaHS + NaHCO32NaHS + 4 NaVO3 + H2O= Na2V4O9+ 4NaOH + 2SNa2V4O9+2ADA (氧化态) +2NaOH+H2O=4 NaVO3+2ADA (还原态)2ADA(还原态) + O2 = 2ADA(氧化态) + 2H2O湿法脱硫优点:脱硫剂均可以再生、ADA法还可回收硫磺、装置体积小、生产连续、投资和运行成本低、可脱除大量无机硫。
湿法脱硫缺点:硫脱除率小于干法脱硫。
3.2.2 一氧化碳变换一氧化碳可以和许多过渡金属催化剂(合成氨的铁、加氢反应的镍等)形成羰基化合物使催化剂中毒失活,必须进行转换。
一氧化碳变换反应方程为:CO + H2O(g)= CO2+ H2+ Q工业上,温度是一氧化碳变换过程中最重要的工艺条件。
在合成氨中,采取二段变换、段间冷却(放热反应)。
使大量CO在第一段较高温度下与水蒸气反应;第二段在较低温度下进行。
加入过量水蒸气有利转换。
但水蒸气太多会使能耗增大、使CO浓度或分压过低,不利于CO转换。
一般H2O/CO = 5~7。
加压对平衡无影响,但反应速度与浓度0.5~0.6次方成正比,因此压力一般采用0.8~3MPa。
一氧化碳变换的催化剂有铁铬系、铜锌系、钴钼系,其性能、效果见p42表3-3。
3.2.3 脱碳一氧化碳变换后要进行二氧化碳的脱除。
方法有:(1) 吸收法a) 物理吸收法水洗法:设备简单,但脱碳效率低等原因已不再采用。
有机溶剂洗涤法:甲醇洗涤法、碳酸丙烯酯、聚乙二醇二甲醚法净化度高、能耗低、回收二氧化碳纯度高,除可以脱硫外,也被广泛采用脱碳。
b) 化学吸收法有氨水法、乙醇胺法、热钾碱法。
应用最广泛的是热钾碱法。
目前应用最多的工艺是本〝苯非尔〞热钾碱法。
试剂有:二乙醇胺(活化剂)、五氧化二钒(缓蚀剂)。
CO2(g)+ K2CO3+ H2O = 2KHCO3两相反应,与相平衡和化学平衡有关。
当有二乙醇胺(DEA)存在时:R2NH + CO2= R2NCOOHR2NCOOH = R2NCOO- + H+R2NCOO- + H2O = R2NH + HCO3-HCO3- + K+ = KHCO3加热 2KHCO3 = K2CO3+CO2+H2O3.2.4 少量CO和CO2的脱除合成氨要求合成气中CO + CO2<10ppm,合成气还需进一步净化。
(1) 铜氨液吸收法在高压和低温下Cu(NH3)2Ac + NH3+ CO = [Cu(NH3)3CO]Ac此法又称〝铜洗〞,铜洗后CO + CO2<20ppm。
