化学平衡图像专题
化学反应速率与化学平衡——图像专题(共52张PPT)

(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
平衡移动:
(1)若V正在V逆的上方,平衡向正反应方向移动 (2)若V逆在V正的上方,平衡向逆反应方向移动 (3)若V正= V逆,平衡向不移动
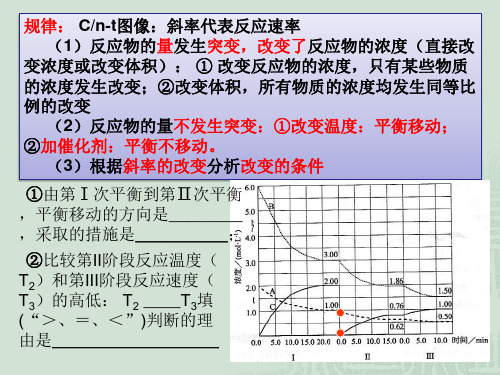
3.速率----T/P图像
1、看图,说出反应起始时是从正反应;还是从逆反 应开始?升温后,化学平衡向什么方向移动?
V mol·(L·s)-1
V正
V逆
(1) v正、v逆均不为0,正、 逆反应同时反应开始。
(2)升温后,v正> v逆,平衡 向正反应方向移动。
T(温度 )
此图合理吗?为什么?
V 在V-T/P图像中,温度或压强改
1.含量——时间图像
③产率——时间图像
mA(g)+nB(g) pC(g)+qD(g) ΔH
产 率
问答1、1、TT12与>TT12的相对大小 题案2、2、放是热吸反热反应应还是ΔH吸>0热反应
0
t1 t2
T2 T1
时间
看图技巧:
(1)看清横纵坐标含义 (2)先拐先平衡数值大 (3)平衡移动
二、化学平衡图像
化
率
1.01107Pa
△H__<__ 0
1.01106Pa 看图技巧:
1.01105Pa (1)看图形趋势
0
T
温度 (2)“定一议二”
课堂练习
1、对于反应mA(g)+nB(g) 象填空:
pC(g)+qD(g),根据图
(完整word版)化学平衡图像专项练习题

化学平衡图像一、选择题(本题包括35小题,每小题2分,共70分。
每小题有一个或两个选项符合题意。
)1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是()A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)2.T℃时,A气体与B气体反应生成C气体。
反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动B.t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大3.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到过化学平衡B.该反应在T2温度时达到过化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动4.右图表示反应N 2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是()A.t0~t1B. t2~t3C. t3~t4D. t5~t65.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是()A .10~15 min 可能是加入了正催化剂B .10~15 min 可能是降低了温度C .20 min 时可能是缩小了容器体积D .20 min 时可能是增加了B 的量6.在一定条件下,将X 和Y 两种物质按不同的比例放入密闭容器中反应,平衡后测得X ,Y 的转化率与起始时两物质的物质的量之比n x /n y 的关系如图所示,则X ,Y 的反应方程式可表示为( )A . 2X +Y 3ZB . 3X +2Y 2ZC . X +3Y ZD . 3X +Y Z7.可逆反应aX (g )+bY (g )cZ (g )在一定温度下的一密闭容器内达到平衡后,t 0时改变某一外界条件,化学反应速率(v )-时间(t )图象如右图。
化学平衡图像专题

化学平衡图像题[专题解读]1.图像类型与解题策略(1)速率-时间图像(vt图像)[解题策略]分清正反应、逆反应及二者反应速率的相对大小,分清“突变”和“渐变”;正确判断化学平衡的移动方向;熟记浓度、压强、温度、催化剂等对化学平衡移动的影响规律。
Ⅰ.v′正突变,v′逆渐变,且v′正>v′逆,说明是增大了反应物的浓度,使v′正突变,且平衡正向移动。
Ⅱ.v′正、v′逆都突然减小,且v′正>v′逆,说明平衡正向移动,该反应的正反应可能是放热反应或气体体积增大的反应。
Ⅲ.v′正、v′逆都突然增大,且增大程度相同,说明该化学平衡没有发生移动,可能是使用了催化剂,也可能是对反应前后气体分子数不变的反应压缩体积(即增大压强)。
(2)百分含量(或转化率)-时间-温度(或压强)图像[解题策略]“先拐先平数值大”。
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图Ⅰ中T2>T1)、压强较大(如图Ⅱ中p2>p1)或使用了催化剂(如图Ⅲ中a使用了催化剂)。
Ⅰ.表示T2>T1,正反应是放热反应,升高温度,平衡逆向移动。
Ⅱ.表示p2>p1,反应物A的转化率减小,说明正反应是气体体积增大的反应,增大压强,平衡逆向移动。
Ⅲ.生成物C的百分含量不变,说明平衡不发生移动,但反应速率a>b,故a使用了催化剂;也可能该反应是反应前后气体体积不变的可逆反应,a增大了压强(压缩体积)。
(3)百分含量(或转化率)-温度(压强)图像[解题策略]“定一议二”。
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个变量,分析方法是确定其中一个变量,讨论另外两个变量之间的关系。
如图Ⅰ中确定压强为105Pa或107Pa,则生成物C的百分含量随温度T的升高而逐渐减小,说明正反应是放热反应;再确定温度T不变,做横轴的垂线,与压强线出现两个交点,分析生成物C的百分含量随压强p的变化可以发现,增大压强,生成物C的百分含量增大,说明正反应是气体体积减小的反应。
化学平衡图像专题(超详细版)

一、浓度 - 时间图:
例:
c
0.9 0.6 0.3
可用于:
1)写出化学反应方程式:
C A B
t
A+2B 3C A的转化率=33.3% B的转化率=66.7%
2)求反应物的转化率:
200℃ 300℃
pC(g)+qD(g)
正反应吸热 m+n=p+q
P
判断m+n与p+q的关系?正反应是放热 还是吸热?
对于2A(g)+B(g) C(g)+3D(g)(正反应 吸热)有如下图所示的变化,图中Y轴可 能表示:
Y
A. B物质的转化率
B. 正反应的速率
300℃
200℃ C. 平衡体系中的A% 100℃ P D. 平衡体系中的C%
2、该反应正向是:啊
(吸、放)热反应。
啊气体物质的量(增大、减源自)的反应。三、某物质的转化率(或百分含量)时间-温度(或压强)图:
对于反应mA(g)+nB(g)
pC(g)+qD(g)
A
的 转
T1
化 率
T2
t
判断正反应是放热还是吸热?
正反应吸热
三、某物质的转化率(或百分含量)时间-温度(或压强)图:
c
练: 0.4
0.3
B
0.2
A
0.1
C
t
1) 写出化学反应方程式: 5A 3B+2C
2) 求反应物的转化率: A的转化率=62.5%
二、速度-时间图: 可用于:
专题6 化学平衡图像

专题 化学平衡图像一、化学平衡图像的类型与解题方法 1、速率—时间图像(v -t 图像)(1)解题方法:分清正反应、逆反应及二者的相对大小,分清“渐变”、“突变”和“平台”;正确判断化学平衡的移动方向;熟记浓度、压强、温度、催化剂等对化学平衡移动的影响规律 (2)常见的三种类型图像 ①“渐变”类v -t 图像图像分析结论t 1时v ′正突然增大,v ′逆逐渐增大;v ′正>v ′逆,平衡向正反应方向移动t 1时其他条件不变,t 1时v ′正突然减小,v ′逆逐渐减小;v ′逆>v ′正,平衡向逆反应方向移动t 1时其他条件不变,t 1时v ′逆突然增大,v ′正逐渐增大;v ′逆>v ′正,平衡向逆反应方向移动t 1时其他条件不变,t 1时v ′逆突然减小,v ′正逐渐减小;v ′正>v ′逆,平衡向正反应方向移动t 1时其他条件不变,②“断点”类v -t 图像:m A(g)+n B(g)p C(g)+q D(g) ΔH =Q kJ·mol -1 图像分析结论t 1时v ′正、v ′逆均突然增大,且v ′正>v ′逆;平衡向正反应方向进行 t 1时其他条件不变,增大反应体系的压强且m +n >p +q (正反应为体积减小的反应) t 1时其他条件不变,升高温度且Q >0(吸热反应)t 1时v ′正、v ′逆均突然增大,且v ′逆>v ′正;平衡向逆反应方向进行 t 1时其他条件不变,增大反应体系的压强且m +n <p +q (正反应为体积增大的反应) t 1时其他条件不变,升高温度且Q <0(放热反应)t 1时v ′正、v ′逆均突然减小,且v ′正>v ′逆;平衡向正反应方向进行 t 1时其他条件不变,减小反应体系的压强且m +n <p +q (正反应为体积增大的反应) t 1时其他条件不变,降低温度且Q <0(放热反应)t1时v′逆、v′正均突然减小,且v′逆>v′正;平衡向逆反应方向进行t1时其他条件不变,减小反应体系的压强且m+n>p+q(正反应为体积减小的反应)t1时其他条件不变,降低温度且Q>0(吸热反应)③“平台”类v-t图像图像分析结论t1时v′正、v′逆均突然增大且v′正=v′逆,平衡不移动t1时刻改变的条件可能是使用了催化剂或增大压强(仅适用于反应前后气体物质的量不变的反应)【对点训练1】1、对于H2(g)+I2(g)2HI(g),ΔH<0,根据下图,下列说法错误的是()A.t2时可能使用了催化剂 B.t 3时可能采取减小反应体系压强的措施C.t5时采取升温的措施 D.反应在t6时刻,HI体积分数最大2、对于反应2SO2(g)+O2(g)2SO3(g)ΔH<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)()3、如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。
化学平衡图像专题

B% %
T2P2 T1P2 T1P1
pC(g)+qD(g)
t
•m+n<p+q •正反应吸热 正反应吸热
练习可逆反应mA(s)+nB(g) 可逆反应
pC(g)+qD(g)。反应中, 。反应中, 当其它条件不变时, 的质量分数与温度 的质量分数与温度( ) 当其它条件不变时 , C的质量分数与温度 ( T) 和压强 ( P)的关系如上图 , 根据图中曲线分析 , 判断下列叙 ) 的关系如上图,根据图中曲线分析, 述中正确的是( 述中正确的是( B )
“定一议二” 定一议二” 定一议二
某物质的转化率(或百分含量 或百分含量)-温度 四、某物质的转化率 或百分含量 温度 (或压强 图: 或压强)图 或压强
•对于反应 对于反应mA(g)+nB(g) 对于反应
A 的 转 化 率
pC(g)+qD(g)
A%
500℃ ℃ 200℃ ℃
1.01*107Pa 1.01*106Pa 1.01*105Pa
时间图: 可用于: 二、浓度 - 时间图: 可用于:
例: c
C A B
1)写出化学反应方程式: 写出化学反应方程式: 写出化学反应方程式 A+2B 3C 2)求反应物的转化率: 求反应物的转化率: 求反应物的转化率 A的转化率 的转化率=33.3% 的转化率 t B的转化率 的转化率=66.7% 的转化率 1)写出化学反应方程式: 写出化学反应方程式: 写出化学反应方程式 5A 3B+2C B 2)求反应物的转化率: 求反应物的转化率: 求反应物的转化率
200℃ ℃ 100℃ ℃
化学反应速率与化学平衡——图像专题(共52张)
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
人教版化学选修四2.3化学平衡---化学平衡图像专题(16张)ppt

人教版化学选修四2.3化学平衡---化 学平衡 图像专 题(16张 )ppt
人教版化学选修四2.3化学平衡---化 学平衡 图像专 题(16张 )ppt
5、百分含量(转化率)--压强
--温度图
等压(温)线
可逆反应 mA(g) + nB(g) pC(g) +qD(g)
C%
C%
400°C
化学平衡图像专题
一 解题步骤
(1)看懂图象:
①看面(即看清纵坐标与横坐标) ②看线(即线的走向和变化趋势) ③看点(即起点、拐点、交点、终点) ④看量(图像中有关量的多少) ⑤看是否要作辅助线(如一等解温题步线骤、等压线)
(2)联想规律:
①外界条件对化学反应速率和化学平衡的影响 ②“先拐先平数值大” ③ “定一议二”原则
人教版化学选修四2.3化学平衡---化 学平衡 图像专 题(16张 )ppt
C
107 Pa
A
500应(放热、吸热)
m+n > p +q (> = < )
正反应是放热反应
P (放热、吸热)
m+n < p+q ( > = <)
“定一议二” 原则分析线的走向 会做辅助线
人教版化学选修四2.3化学平衡---化 学平衡 图像专 题(16张 )ppt
则a表示使用催化剂 (使用、不使用)
C %
t1 t2
B %
人教版化学选修四2.3化学平衡---化 学平衡 图像专 题(16张 )ppt
T1 T2
t
P1 P2
t
(2)含量 — 时间 — 温度
T1 < T2
正反应是
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学平衡图像专题篇一:化学平衡图像专题(精选)【达标检测16】----化学平衡图像问题一、选择题1、下图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断(AB )A、正反应是放热反应B、若A、B是气体,则D是液体或固体C、逆反应是放热反应.D、A、B、C、D均为气体2、在密闭容器中充入A、B或G、H进行可逆反应:aA(气)+bB(气)gG(气)+hH(气);△H=QkJ/mol ,图甲、图乙分别表示在虚线所示部位改变温度(T)或压强对化学平衡与反应速率的影响(t表示时间),则下列结论中正确的是( A )A、开始时充入G和H a+b<g+h Q<0B、开始时充入G和H a+b<g+h Q>0C、开始时充入G和H a+b>g+h Q>0D、开始时充入A和B a+b>g+h Q>0 3、可逆反应A(气)+2B(气)nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是(C )A、P1>P2 ,n >3B、P1>P2 ,n <3 C、P1<P2 ,n >3D、P1<P2 ,n <34、如下图所示a曲线表示一定条件下可逆反应X(g)+Y(g)2Z(g)+W(s)△H<0的反应过程。
若使a曲线变成b曲线,可采取的措施是(AD )A、加入催化剂B、增加Y的浓度C、降低温度D、增大体系压强5、反应A(g)+B(g)C(g)+D(g);△H>0分别在673K 和373K时进行,得C的体积分数和时间的关系曲线如下图所示,其中能正确表示此反应的图象是( C )6、在容器相同的五个容器中,分别充入同量的N2和H2,在不同温度下任其反应:N2+3H22NH3,分别在同时刻测得其中NH3的体积百分比,连成如下图所示曲线,不正确的叙述是(C)。
A、放热反应B、E、F二点尚未达到化学平衡状态C、H、I二点尚未达到化学平衡状态D、G、H、I三点已达到化学平衡状态7、反应:L(s)+ a G(g)b R(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强P1>P2,X轴表示温度,Y轴表示平衡混合气中G 的体积分数。
据此可判断:(BD)A、上述反应是放热反应B、上述反应是吸热反应C、a>bD、a8、如图,条件一定时,反应2NO(g)+O2(g) 2NO2(g)(正反应为吸热)中NO的体积分数与T变化关系曲线图,图中有a、b、c、d 4个点,其中表示未达到平衡状态,且V正A、a B、b C、c D、d9、已知反应m A(g)+n B(g)x C(g)+y D(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是(A )A、正反应吸热m+n>x+yB、正反应吸热,m+nx+y D、正反应放热,m+n11、.如下图所示,反应2SO2(g)+O2(g) (C )3(g);△H压强(p1>p2)下达到平衡,混合气体中SO3的体积分数φ(SO3)随温度变化的曲线应为12、下图表示:x(气)+y(气)2Z(气)(正反应为放热反应)反应变化过程中物质的浓度反应的时间变化关系.图中t2→t3秒间的曲线变化是由于下列哪种条件的改变所引起的(B )A、增大了压强B、降低温度C、增加了x和y的浓度D、使用了催化剂13、图1表示mA(g)+nB(g)pC(g)+q(g);△H=Q,在不同温度下经过一定时间混合体系中C的质量分数与温度T的关系;图2表示在一定条件下达到平衡(v正=v逆)后t时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,判断该反应是(D )图1曲线图图2曲线图A、m+n>p+qQ>0B、m+n>p+qQ<0 C、m+n<p+qQ>0D、m+n<p+qQ<014、等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是(AC )A、4-3-2-1B、1-2-3-4C、3-4-2-1D、1-2-4-315、已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g). △H= —1025KJ/mol 该反应是一个可逆反应。
若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( C )16、合成氨工业对国民经济和社会发展具有重要的意义。
对于密闭容器中的反应:N2(g)+3H2(g)2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
下列叙述正确的是(D )3 22 1A、点a的正反应速率比点b的大B、点c处反应达到平衡C、点d (t1时刻) 和点e (t2时刻) 处n(N2)不一样D、其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大17、汽车尾气净化中的一个反应如下:NO(g)+CO(g)1/2N2(g)+CO2(g) ⊿H=-373.4 Kj/mol在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是(C )A B C D18、对于可逆反应A(g)+2B(g)2C(g)(正反应吸热),下列图象中正确的是( D )19、在密闭容器中进行下列反应:M (g)+N (g) A、正反应吸热,L是气体B、正反应吸热,L是固体R (g)+2 L此反应符合下面图像。
下列叙述正确的是( DC、正反应放热,L是液体D、正反应放热,L是气体20、下图Ⅰ、Ⅱ、Ⅲ分别代表反应①③、②、④,则Y轴是指( AD )①N2(g)+3H2(g) 2NH3(g);△H=-Q ②H2(g)+I2(g) 2HI(g); △H=+Q ③CO(g)+2H2(g)CH3OH(g); △H=-Q ④2SO3(g)22SO2(g)+O2(g); △H=+Q A、平衡混合气中一种生成物的百分含量B、平衡混合气中一种反应物的百分含量C、平衡混合气中一种生成物的转化率D、平衡混合气中一种反应物的转化率21、将3 mol O2加入到V L的反应器中,在高温下放电,经t1 s建立了平衡体系:3O2的是( C )11 D C A B22、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律,则下列说法中正确的是( C ) 反应I:3A(g)+B(g) 2C(g) 反应Ⅱ:A(g)+B(g) 2c(g) A、若反应I中△HT1 B、若反应l中△H>0,则T20,则T22O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系23、在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)2Z(g),并达平衡,以Y的浓度改变表示的反应速度与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)(B)篇二:高中化学——平衡图像题专题编撰人:温江华高二年级(2019.11.16)化学反应速率与化学平衡图像专题化学平衡图像题,一是以时间为自变量的图像;二是以压强或温度为自变量的图像。
从知识载体角度看,其一判断化学平衡特征;其二应用勒夏特列原理分析平衡移动过程;其三逆向思维根据图像判断可逆反应的有关特征;其四综合运用速率与平衡知识进行有关计算。
解题关键:一是读图,弄清图像含义,通过观察弄清横坐标、纵坐标的含义及单位;搞清特殊点的意义,如坐标轴的“0”点,曲线的起点、终点、交叉点、极值点、转折点等;分析曲线的变化趋势如斜率大小、升降。
二是识图,进行信息提取,挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算。
三是用图,联想化学原理解答问题。
一、图象题的一般解题思路这类题目是讨论自变量x(如时间、温度、压强等)与函数值y(如物质的量、浓度、质量分数、转化率)之间的定量或定性关系,因此,要运用数学方法解决此类题目。
1.分析纵横坐标及曲线表示的意义。
2.分析曲线的变化趋势与纵横坐标的关系。
3.分析特殊点(起点、拐点、终点)及其含义。
4.有两个以上变量时,分别讨论两个变量的关系,此时确定其他量为恒量。
5、定压看温度变化;定温看压强变化。
第1 页共10 页编撰人:温江华高二年级(2019.11.16)第2 页共10 页编撰人:温江华高二年级(2019.11.16)第3 页共10 页编撰人:温江华高二年级(2019.11.16)三、图象题的类型1.物质的量(或浓度)—时间图象例1. 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如右图所示,则该反应的化学方程式为,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_0.08mol/(L·S)________、。
2.速率—时间图象例2.把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1~t2速率变化的主要原因是反应是放热反应,温度影响为主,温度升高,反应速率增加;t2~t3速率变化的主要原因是浓度影响为主,随着反应的进行,浓度减小,反应速率减小________。
3. 以速度-时间(v-t)图像计算平衡浓度例4 在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)达平衡,以Y的浓度改变表示的反应速度2Z(g),并与时间t 的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)(B )例5.某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2+O22SO3(正反应放热)的正、逆反应速率的影响如图3所示。
(图A上逆下正、图B上正下逆、图D为跳跃型,上逆下正)①加催化剂对速率影响的图象是(C)。
②②增大O2的浓度对速率影响的图象是(B)③增大反应容器体积对速率影响的图象是(D)。
④④升温对速率影响的图象是( A )第4 页共10 页编撰人:温江华高二年级(2019.11.16)图3 正、逆反应速率的变化曲线4.速率—压强(或温度)图象例6.符合图象4的反应为(ACD )。
A.N2O3(g)NO2(g)+NO(g)B.3NO2(g)+H2O(l)2HNO3(lC.4NH3(g)+5O2(g)4NO(g)+6H2D.CO2(g)+C(s)2CO(g)5.转化率(或质量分数等)—压强、温度图象例7.有一化学平衡mA(g)+nB(g)pC(g)+qD(g),如图5所示是A的转化率同压强、温度的关系,分析图5可以得出的正确结论是(A )。
(图中压强上大下小)A.正反应吸热,m+n>p+qB.正反应吸热,m+n<p+qC.正反应放热,m+n>p+qD.正反应放热,m+n<p+q例8mA(s)+nB(g)qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如图6所示,有关叙述正确的是(AC )。
