2021年高二人教版化学选修4练习册:1.1.2热化学方程式
2020-2021学年人教版选修4 1-1-2 热化学方程式 中和热的测定 作业

课时作业2热化学方程式中和热的测定时间:45分钟满分:100分一、选择题(每小题4分,共44分)1.CO(g)与H2O(g)反应过程的能量变化如图所示,有关两者反应的说法正确的是(B)A.该反应为吸热反应B.CO(g)和H2O(g)所具有的总能量大于CO2(g)和H2(g)具有的总能量C.反应的热化学方程式为:CO(g)+H2O(g)===CO2(g)+H2(g)ΔH=+41 kJ/molD.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ的热量解析:从图中数据可以看出:该反应的ΔH<0,为放热反应,CO(g)和H2O(g)所具有的总能量大于CO2(g)和H2(g)所具有的总能量,反应的热化学方程式为:CO(g)+H2O(g)===CO2(g)+H2(g)ΔH=-41 kJ/mol。
2.已知:H2(g)+F2(g)===2HF(g)ΔH=-270 kJ·mol-1,下列说法正确的是(C)A.氟化氢气体分解生成氢气和氟气的反应是放热反应B.1 mol H2与1 mol F2反应生成2 mol 液态HF放出的热量小于270 kJC.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量D.该反应中的能量变化可用如图所示曲线来表示3.根据热化学方程式:S(s)+O2(g)===SO2(g)ΔH=a kJ·mol-1(a=-297.2)。
分析下列说法,其中不正确的是(D)A.S(s)在O2(g)中燃烧的反应是放热反应B.S(g)+O2(g)===SO2(g)ΔH=b kJ·mol-1,则a>bC.1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和D.16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量解析:由题中条件可知:反应的热效应ΔH=a kJ·mol-1=-297.2 kJ·mol-1,可知该反应的正向反应为放热反应,故D错误。
人教版高中化学选修四 1-1-2 热化学方程式 中和热(课件)

热化学方程式表示的意义
1、反应物和生成物的种类、聚集状态 2、反应中各物质的物质的量比和质量比 3、反应中放出或吸收的热量。
问题:
反应物和生成物前的系数它代表了什么? 在方程式中∆H它表示了什么意义? ∆H 它的值与什么有关系?
热化学方程式中各物质前的化学计量数不 表示分子个数,表示对应物质的物质的量。 ∆H(KJ/mol)它表示每摩尔反应所放出的热 量,∆H它的值与方程式中的计量系数有关,即 对于相同的反应,当化学计量数不同时,其∆H 不同。
1、当1mol气态H2与1mol气态Cl2反应 生成2mol气态HCl,放出184.6KJ的热 量,请写出该反应的热化学方程式。 H2(g)+Cl2(g)=2HCl(g) ∆H =-184.6KJ/mol
而这些书写也是对的!!!
(练习与巩固)依据事实,写出下列反应 的热化学方程式∶
(1)1mol碳完全燃烧放出393.5KJ的热量; (2)1克甲醇燃烧生成二氧化碳和液态水时放热 22.68KJ; (3)1mol氯气和水蒸气通过灼热的炭层反应,生成氯 化氢和二氧化碳放出145KJ的热量。
2Cu(s)+O2(g)=2CuO(s) △H= - 314KJ/mol
2.00gC2H2完全燃烧生成液态水和CO2放 出的热量为99.6KJ,写出C2H2燃烧的热化学 方程式。 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6KJ/mol
人教版高中化学选修四1.1.2热化学方程式中和热的测定课堂10分钟练习.docx

高中化学学习材料1.(对应考点一)已知在1.01×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )A.H2O(g)===H2(g)+12O2(g)ΔH=+242 kJ·mol-1B.2H2(g)+O2(g)===2H2O(l)ΔH=-484 kJ·mol-1C.H2(g)+12O2(g)===H2O(g)ΔH=+242 kJ·mol-1D.2H2(g)+O2(g)===2H2O(g)ΔH=+484 kJ·mol-1解析:在热化学方程式中要注明反应的温度和压强(101 kPa和25℃时可不注明),要注明反应物和生成物的聚集状态,ΔH值要正确且注明“+”与“-”,物质的化学计量数可用分数。
结合以上原则分析:H2燃烧放热(ΔH为负值),H2O分解吸热(ΔH为正值),故A 正确。
答案:A2.(对应考点一)在25℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )A.CH3OH(l)+32O2(g)===CO2(g)+2H2O(l)ΔH=+725.8 kJ/molB.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)·ΔH=-1 452 kJ/molC.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-725.8 kJ/molD.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=+1 452 kJ/mol解析:CH3OH燃烧的化学方程式为2CH3OH+3O2===2CO2+4H2O。
1 g CH3OH燃烧放出22.68 kJ热量,则2 mol CH3OH燃烧放出的热量为22.68 kJ×32×2=1 451.52 kJ≈1 452 kJ。
2021新人教版高中化学选修四1.1.2《热化学方程式》word课后作业

高中化学 1-1-2热化学方程式45分钟作业 新人教版选修4一、选择题(每小题4分,每小题有1~2个正确选项)1.由氢气和氧气反应生成1mol 水蒸气放热241.8kJ ,则反应2H 2(g)+O 2(g)=====点燃2H 2O(g)的ΔH 为( )A .-483.6kJ·mol -1 B .-241.8kJ·mol -1 C .-120.6kJ·mol -1 D .+241.8kJ·mol -1答案:A2.下列说法或表示方法正确的是( )A .等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多B .由C(石墨)===C(金刚石);ΔH =+1.90kJ·mol-1可知,金刚石比石墨稳定C .在101kPa 时,2gH 2完全燃烧生成液态水,放出285.8kJ 热量,氢气燃烧的热化学方程式表示为:2H 2(g)+O 2(g)===2H 2O(l);ΔH =-285.8kJ·mol -1D .在稀溶液中,H +(aq)+OH -(aq)===H 2O(l);ΔH =-57.3kJ·mol -1,若将含0.5mol H 2SO 4的浓硫酸与含1mol NaOH 的溶液混合,放出的热量大于57.3kJ解析:A 中S(s)―→S(g)需要吸热。
B 中ΔH >0石墨稳定,因为能量越高越不稳定。
C 中2g H 2为1mol H 2,热化学方程式应为 H 2(g)+12O 2(g)===H 2O(l);ΔH =-285.8kJ·mol -1。
答案:D3.分析下面的能量变化示意图,下列热化学方程式正确的是( )A .2A(g)+B(g)===2C(g);ΔH =a (a >0)B .2A(g)+B(g)===2C(g);ΔH =a (a <0)C .2A +B===2C ;ΔH =a (a <0)D .2C===2A +B ;ΔH =a (a >0)解析:由图可知A 和B 的总能量高于C 的总能量,则2A +B 转化为2C 时,要放出热量,则ΔH <0,即B 正确,C 、D 中无状态,不正确。
2021年高二人教版化学选修四练习:1.1.2热化学方程式 中和热的测定 Word版含答案

第2课时热化学方程式中和热的测定A组1.热化学方程式是()A.标明反响放热或吸热的式子B.标明反响物和生成物聚集状态的式子C.表示参加反响物质的量和反响热的关系的化学方程式D.注明反响条件的化学方程式解析:根据热化学方程式的含义可以判断只有C项正确.答案:C2.以下说法中不正确的选项是()A.物质发生化学反响的反响热仅指反响放出的热量B.热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数C.所有的燃烧都是放热反响D.热化学方程式中化学式前面的化学计量数可以是分数解析:反响热可以是吸收热量也可以是放出热量.答案:A3.在相同条件下,以下两个反响放出的热量分别用ΔH1和ΔH2表示:2H2(g) +O2(g)2H2O(g)ΔH12H2(g) +O2(g)2H2O(l)ΔH2那么()A.ΔH2>ΔH1B.ΔH1>ΔH2C.ΔH1 =ΔH2D.无法确定解析:气态水液化时需要释放能量,放热越多,ΔH的数值越小 .答案:B4.热化学方程式C(s) +H2O(g)CO(g) +H2(g)ΔH = +131.3 kJ·mol -1表示()A.碳和水反响吸收131.3 kJ能量B.1 mol碳和1 mol水反响生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量C.1 mol固态碳和1 mol水蒸气反响生成1 mol一氧化碳气体和1 mol氢气,吸收热量131.3 kJD.1个固态碳原子和1分子水蒸气反响吸热131.3 kJ解析:依据反响热的概念,反响热表示按照热化学方程式中化学计量数的物质的量反响时,吸收或放出的热量,单位是kJ·mol -1,该热化学方程式表示:1 mol固态碳和1 mol水蒸气反响生成1 mol一氧化碳气体和1 mol氢气,并吸收131.3 kJ的热量.答案:C5.以下说法中正确的选项是()A.中和热一定是强酸跟强碱反响放出的热量B.1 mol酸与1 mol碱完全反响放出的热量是中和热C.在稀溶液中,酸与碱发生中和反响生成1 mol H2O(l)时的反响热叫做中和热D.表示中和热的离子方程式为:H + +OH -H2OΔH = -57.3 kJ·mol -1解析:中和热是指稀酸、稀碱生成1 mol H2O(l)的反响热.答案:C6.在测定中和热的实验中,以下说法正确的选项是()A.使用环形玻璃搅拌棒是为了加大反响速率,减小实验误差B.为了准确测定反响混合溶液的温度,实验中温度计水银球应与小烧杯底部接触C.用50 mL 0.55 mol·L -1的NaOH溶液与60 mL 0.50 mol·L -1的盐酸反响,测得的中和热数值偏大D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计解析:在中和热的测定中,使用环形玻璃搅拌棒搅拌,目的是使反响物混合均匀,加快反响速率,减小误差,A项正确;温度计水银球不能接触烧杯底部,B项错误;中和热的大小与参加反响的酸碱用量无关,C项错误;仪器中不需要天平、滴定管,D项错误.答案:A7.燃烧a g乙醇(液态)生成CO2气体和液态H2O,放出热量为Q kJ,经测定a g乙醇与足量Na反响能生成H25.6 L(标准状况下),那么乙醇燃烧的热化学方程式表示正确的选项是()A.C2H5OH(l) +3O2(g)2CO2(g) +3H2O(l)ΔH(298 K) = -Q kJ·mol -1B.C2H5OH(l) +3O2(g)2CO2(g) +3H2O(l)ΔH(298 K) = -Q kJ·mol -1C.C2H5OH(l) +O2(g)CO2(g) +H2O(g)ΔH(298 K) = -Q kJ·mol -1D.C2H5OH(l) +3O2(g)2CO2(g) +3H2O(l)ΔH(298 K) = -2Q kJ·mol -1解析:据化学方程式2C2H5OH +2Na2C2H5ONa +H2↑2 mol 22.4 Ln(C2H5OH) 5.6 L那么有n(C2H5OH) =0.5 mol,这些乙醇燃烧后放出的热量为Q kJ .因此0.5 mol C2H5OH完全燃烧生成CO2、H2O的反响热为ΔH = -Q kJ·mol -1 .所以该热化学方程式书写如下:C2H5OH(l) +O2(g)CO2(g) +H2O(l)ΔH = -Q kJ·mol -1 .由上述方程式可知D项正确.答案:D8.根据热化学方程式:S(s) +O2(g)SO2(g)ΔH =a kJ·mol -1(a = -297.2) .分析以下说法,其中不正确的选项是()A.S(s)在O2(g)中燃烧的反响是放热反响B.S(g) +O2(g)SO2(g)ΔH =b kJ·mol -1,那么a>bC.1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和D.16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量解析:由题中条件可知:反响的ΔH =a kJ·mol -1 = -297. 2 kJ·mol -1,那么该反响的正反响方向为放热反响,反响物的总能量高于生成物的总能量,故D错误.答案:D9.在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40 kJ的热量.表示上述反响的热化学方程式正确的选项是()A.C8H18(l) +O2(g)8CO2(g) +9H2O(g)ΔH = -48.40 kJ·mol -1B.C8H18(l) +O2(g)8CO2(g) +9H2O(l)ΔH = -5 518 kJ·mol -1C.C8H18(l) +O2(g)8CO2(g) +9H2O(l)ΔH = +5 518 kJ·mol -1D.C8H18(l) +O2(g)8CO2(g) +9H2O(l)ΔH = -48.40 kJ·mol -1解析:在25 ℃、101 kPa下,1 mol C8H18燃烧生成CO2和液态水时放出的热量为×114 g≈5 518 kJ .答案:B10.写出以下反响的热化学方程式:(1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出 1 366.8 kJ热量:.(2)1 mol C(石墨)与适量H2O (g)反响生成CO(g)和H2(g),吸收131.3 kJ热量:.(3)1.7 g NH3(g)发生催化氧化反响生成气态产物,放出22.67 kJ的热量:.解析:解答此类题目关键是要确定与方程式中的化学计量数相对应的ΔH,并注意每种物质的聚集状态.答案:(1)C2H5OH(l) +3O2(g)2CO2(g) +3H2O(l)ΔH = -1 366.8 kJ·mol -1(2)C(石墨,s) +H2O(g)CO(g) +H2(g)ΔH = +131.3 kJ·mol -1(3)NH3(g) +O2(g)NO(g) +H2O(g)ΔH = -226.7 kJ·mol -111.依据实验数据,写出以下反响的热化学方程式 .(1)1 mol C2H4(g)与适量O2(g)反响,生成CO2(g)和H2O(l),放出1 411 kJ的热量.. (2)2 mol Al(s)与适量O2(g)发生反响,生成Al2O3(s),放出1 669.8 kJ的热量.. (3)18 g葡萄糖与适量O2(g)反响,生成CO2(g)和H2O(l),放出280.4 kJ的热量..答案:(1)C2H4(g) +3O2(g) 2CO2(g) +2H2O(l)ΔH = -1 411 kJ·mol -1(2)2Al(s) +O2(g)Al2O3(s)ΔH = -1 669.8 kJ·mol -1(3)C6H12O6(s) +6O2(g)6H2O(l) +6CO2(g)ΔH = -2 804 kJ·mol -112.:H2(g) +F2(g)2HF(g)ΔH = -270 kJ·mol -1,以下说法正确的选项是()A.氟化氢气体分解生成氢气和氟气的反响是放热反响B.1 mol H2与1 mol F2反响生成2 mol液态HF放出的热量小于270 kJC.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量D.该反响中的能量变化可用如下图曲线来表示答案:C13.(1)根据以下图所示,写出反响的热化学方程式.(2)根据如下图情况,判断以下说法中正确的选项是 .A.其热化学方程式为CO(g) +H2O(g)CO2(g) +H2(g)ΔH = +41 kJ·mol -1B.该反响为吸热反响C.该反响为放热反响D.当H2O为液态时,其反响吸收的热量大于41 kJ·mol -1解析:(2)以图示形式将反响CO2(g) +H2(g)CO(g) +H2O(g)的物质变化和能量变化呈现出来,并要求判断反响类型及ΔH情况.根据所给图示可知,A选项的ΔH<0,故错误;生成物的总能量比反响物的总能量高,故该反响为吸热反响,B选项正确,那么C选项错误;D选项,当H2O为液态时,反响吸收的热量将小于41 kJ·mol -1,故错误.答案:(1)CO(g) +H2O(g)CO2(g) +H2(g)ΔH = -41 kJ·mol -1(2)BB组1.25 ℃、101 kPa下,12 g石墨、金刚石完全燃烧分别释放出393.51 kJ、395.41 kJ的热量.据此判断,以下说法正确的选项是()A.由石墨制备金刚石是吸热反响;等质量时,石墨的能量比金刚石的低;石墨比金刚石稳定B.由石墨制备金刚石是吸热反响;等质量时,石墨的能量比金刚石的高;石墨比金刚石稳定C.由石墨制备金刚石是放热反响;等质量时,石墨的能量比金刚石的低;金刚石比石墨稳定D.由石墨制备金刚石是放热反响;等质量时,石墨的能量比金刚石的高;金刚石比石墨稳定解析:由题意可以写出两个热化学方程式:C(石墨,s) +O2(g)CO2(g)ΔH = -393.51 kJ·mol -1C(金刚石,s) +O2(g)CO2(g)ΔH = -395.41 kJ·mol -1对应的能量变化图如下:那么有C(石墨,s)C(金刚石,s)ΔH = +1.90 kJ·mol -1,由图可看出石墨比金刚石能量低,那么石墨比金刚石稳定.答案:A2.在一定条件下,CH4和CO燃烧的热化学方程式分别为:CH4(g) +2O2(g)2H2O(l) +CO2(g)ΔH = -890 kJ·mol -12CO(g) +O2(g)2CO2(g)ΔH = -566 kJ·mol -1如果有CH4和CO的混合气体充分燃烧,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀.那么混合气体中CH4和CO的体积比为() A.1∶2 B.1∶3C.2∶3D.3∶2解析:设燃烧后共生成CO2的物质的量为x,混合气体中CH4、CO的物质的量分别为a、b .石灰水过量时只生成碳酸钙,据CaCO3~CO2得x =0.5 mol,那么:解得a =0.2 mol,b =0.3 mol,a∶b =2∶3 .答案:C3.肼(H2NNH2)是一种高能燃料,有关化学反响的能量变化如下图.断裂1 mol化学键所需的能量(kJ):N≡N为942、O O为500、N -N为154,那么断裂1 mol N -H键所需的能量(kJ)是()A.194B.391C.516D.658解析:由图知N2H4(g) +O2(g)N2(g) +2H2O(g)ΔH= -534 kJ·mol -1,可设断裂1 mol N -H键所需的能量为x,154 kJ +4x kJ +500 kJ -2 752 kJ = -534 kJ,可求得x =391 kJ .答案:B4.下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):物质Cl2Br2I2HCl HBr HI H2能量/kJ243193151432366298436根据上述数据答复以下问题.(1)以下物质本身具有的能量最|低的是()A.H2B.Cl2C.Br2D.I2(2)以下氢化物中,最|稳定的是()A.HClB.HBrC.HI(3)X2 +H22HX(X代表Cl、Br、I)的反响是(填"吸热〞或"放热〞)反响.(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反响,假设消耗等物质的量的氢气时,放出或吸收热量最|多的是.(5)假设无上表中的数据,你能正确答复出问题(4)吗?.你的依据是.(6)写出H2和Cl2反响的热化学方程式:.解析:破坏1 mol物质中的化学键所消耗的能量越大,该物质越稳定.所以在表中的几种分子中,H2能量最|低.答案:(1)A(2)A(3)放热(4)Cl2(5)能Cl2的氧化性最|强,与H2反响最|剧烈,放出的热量多,所以HCl最|稳定(6)H2(g) +Cl2(g)2HCl(g)ΔH = -185 kJ·mol -1。
人教版高中化学选修四1-1-2热化学方程式(课时练)(教师版).doc

1~1~2热化学方程式中和热1.热化学方程式C(s) + H2O(g)=CO(g)+H2(g) AH= +131.3 kJ/mol 表示( )A.碳和水反应吸收131.3 kJ能量B. 1 mol碳和1 mol水反应生成1 mol 一氧化碳和1 mol氢气并吸收131.3 kJ热量C. 1 mol固态碳和1 mol水蒸气反应生成1 mol —氧化碳气体和1 mol氢气,吸收热量131.3 kJD.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ【答案】C【解析】依据反应热的概念,反应热表示按照热化学方程式中化学计量数的物质的量反应吋,吸收或放出的热量,单位是kJ/mol,该热化学方程式表示:1 mol固态碳和1 mol水蒸气反应生成1 mol —氧化碳气体和1 mol氢气,并吸收131.3 kJ的热量,特别要指明水的状态。
2.强酸和强碱的稀溶液的中和热可表示为:H+(aq) + OH~(aq)=H2O(l) -57.3kJ/mol已知:CH3COOH(aq) + NaOH(aq)=CH3COONa(aq) + H2O(l) △/■/=—QikJ/mol1 1尹2SO* ^) + NaOH(aq)=2Na2s°4(aq) + H2O(l)AH=-Q2kJ/molHNO3(aq) + KOH(aq)=KNO3(aq) + H2O(l)AH=-Q3kJ/mol上述反应均为溶液中的反应,则Q、Q、2的绝对值大小的关系为()A.Q = Q2 = Q3B. Q2>Q1>Q3C. Q2>(?3>Q1D. C?2 = Q3>Q1【答案】c【解析】由题意知,HNO3和NaOH反应放出的热量为中和热,CHaCOOII是弱酸,醋酸屮存在电离平衡,英电离过程要吸收热量,故而浓硫酸稀释放热,0>0,故Q1VQ3VQ2。
故答案Co3.在25°C、101 kPa下,0」mol甲醇燃烧生成CO?和液态水时放热72.65 kJ,下列热化学方程式正确的是()3A.CH3OH(1)+2O2(g)=CO2(g)+2H2O(1) +726.5 kJ/molB.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)\H= +1453 kJ/mol3C.CH3OH(1) +^O2(g)=CO2(g)+2H2O(1) 726.5 kJ/molD.2CH3OH(l) + 3O2(g)=2CO2(g)+4H2O(g) \H= -1453 kJ/mol【答案】C【解析】0」mol甲醇燃烧生成CO2和液态水时放出热量为72.65 kJ,则1 mol甲醇放出的热量为726.5 kJo4.为了测定酸碱反应的中和热,计算时至少需要的数据是()①酸溶液的浓度和体积②碱溶液的浓度和体积③比热容④反应后溶液的质量(单位:kg)⑤生成水的物质的量⑥反应前后温度变化⑦操作所需的时I'可A.①②③⑥B.①③④⑤C.③④⑤⑥D.全部【答案】C【解析】根据计算公式△//=可知,C正确。
2020-2021学年高二化学课时同步训练(人教版选修4):1.1.2 热化学方程式

第一章化学反应与能量第一节化学反应与能量变化第2课时热化学方程式(2020·宁夏回族自治区贺兰县景博中学高二月考)已知充分燃烧a g乙炔(C2H2)1.气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ(b>0),则乙炔燃烧的热化学方程式正确的是( )A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1B.C2H2(g)+5/2O2(g)===2CO2(g)+H2O(l) ΔH=2b kJ·mol-1C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=b kJ·mol-1【答案】A【解析】A.充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ(b>0),则生成4mol二氧化碳气体放出4bkJ的热量,故A正确;B.该反应为放热反应,焓变应小于0,故B错误;C.反应的焓变与反应物的计量数对应关系不正确,反应的焓变应为ΔH=-4b kJ·mol-1,故C错误;D.热化学反应方程式中ΔH的符号与数值均不正确,故D错误;答案选A。
2.(2020·寻甸回族彝族自治县民族中学高二月考)某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是( )A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响D.若用NaOH固体测定中和热,则测定中和热的数值偏高【答案】D【解析】A. (a)是金属与酸的反应,是放热反应;(b)是氢氧化钡晶体与氯化铵反应,属于吸热反应; (c) 酸碱中和反应是放热反应;因此放热反应只有(a)和(c),A项错误;B. 铝粉和铝片本质一样,放出热量不变,只是铝粉参与反应,速率加快,B 项错误;C. 相较于环形玻璃搅拌棒,铁质搅拌棒导热快,会造成热量损失,对实验结果有影响,C项错误;D. 氢氧化钠固体溶解时要放出热量,最终使测定中和热的数值偏高,D项正确;答案选D。
人教版高中化学选修四教案:1.1.2热化学方程式
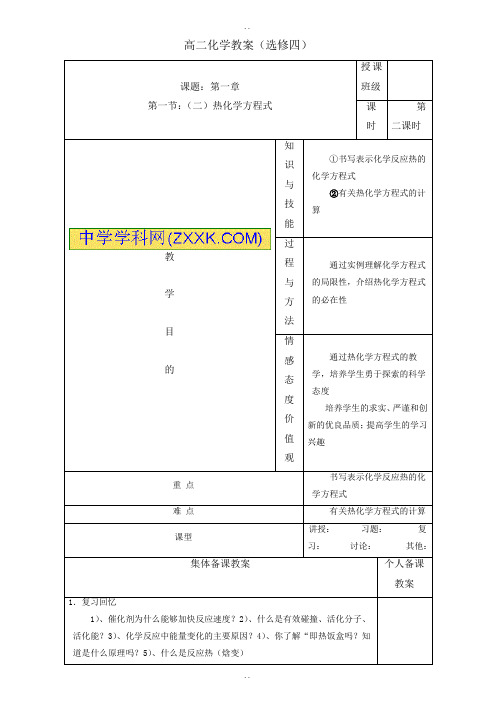
(4)2H2( g )+O2( g )=2H2O( l )ΔH4= d kJ/mol
则a、b、c、d的关系正确的是A C。
A、a<c<0 B、b>d>0 C、2a=b< 0 D、2c=d>0
8)若2.6 g乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130 kJ。则乙炔燃烧的热化学方程式为
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)ΔH=-1300 kJ/mol
2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l)ΔH=-2600 kJ/mol教学回顾Biblioteka 反思高二化学教案(选修四)
课题:第一章
第一节:(二)热化学方程式
授课班级
课时
第二课时
教
学
目
的
知识
与
技能
①书写表示化学反应热的化学方程式
②有关热化学方程式的计算
过程
与
方法
通过实例理解化学方程式的局限性,介绍热化学方程式的必在性
情感
态度
价值观
通过热化学方程式的教学,培养学生勇于探索的科学态度
培养学生的求实、严谨和创新的优良品质;提高学生的学习兴趣
(2)标出了反应物与生成物的状态,(为什么要标出?)(3)写出了反应热,还注明了“+”,“-”
(4)方程式中的计量系数可以是整数也可以是分数。
4.注意点:反应物和生成物前的系数它代表了什么?在方程式中∆H它表示了什么意义?∆H的值与什么有关系?热化学方程式中各物质前的化学计量数不表示分子个数,表示对应物质的物质的量。∆H(KJ/mol)它表示每摩尔反应所放出的热量,∆H的值与方程式中的计量系数有关,即对于相同的反应,当化学计量数不同时,其∆H不同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021年高二人教版化学选修4练习册:1.1.2热化学方程式知识点一 热化学方程式1.热化学方程式C(s)+H 2O(g)===CO(g)+H 2(g)ΔH =+131.3 kJ·mol -1表示( )A .碳和水反应吸收131.3 kJ 能量B .1 mol 碳和1 mol 水反应生成1 mol 一氧化碳和1 mol 氢气并吸收131.3 kJ 热量C .1 mol 固态碳和1 mol 水蒸气反应生成1 mol 一氧化碳气体和1 mol 氢气并吸收131.3 kJ 热量D .1个固态碳原子和1分子水蒸气反应吸热131.3 kJ2.下列热化学方程式中,书写正确的是( )A .2SO 2+O 2===2SO 3 ΔH =-196.6 kJ/molB .H 2(g)+12O 2(g)===H 2O(1) ΔH =-285.8 kJ/molC .2H 2(g)+O 2(g)===2H 2O(1) ΔH =-571.6 kJD .C(s)+O 2(g)===CO 2(g) ΔH =+393.5 kJ/mol3.在25 ℃、101 kPa 下,1 g 甲醇(CH 3OH)燃烧生成CO 2和液态水时放热22.70 kJ ,下列热化学方程式书写正确的是( )A .CH 3OH(1)+32O 2(g)===CO 2(g)+2H 2O(1) ΔH =+726.4 kJ/molB .2CH 3OH(1)+3O 2(g)===2CO 2(g)+4H 2O(1)ΔH =-1 452.8 kJ/molC .2CH 3OH(1)+3O 2(g)===2CO 2(g)+4H 2O(1)ΔH =-726.4 kJ/molD .2CH 3OH(1)+3O 2(g)===2CO 2(g)+4H 2O(1)ΔH =+1 452.8 kJ/mol4.下列各组热化学方程式中,化学反应的ΔH 前者大于后者的是( )①C(s)+O 2(g)===CO 2(g) ΔH 1 C(s)+O 2(g)===CO(g) ΔH 2②S(s)+O 2(g)===SO 2(g) ΔH 3 S(g)+O 2(g)===SO 2(g) ΔH 4③H 2(g)+O 2(g)===H 2O(1) ΔH 5 2H 2(g)+O 2(g)===2H 2O(1) ΔH 6④CaCO 3(s)===CaO(s)+CO 2(g) ΔH 7 CaO(s)+H 2O(1)===Ca(OH)2(s) ΔH 8A .①B .④C .②③④D .①②③知识点二 中和反应反应热的测定5.在测定中和反应反应热的实验中,下列叙述错误的是( )A .向量热计中加入盐酸,搅拌后的温度为初始温度B .实验中可使酸或碱略过量C .向量热计中加入烧碱时,碱液的温度与酸的温度相同D .可以用KOH 代替NaOH ,浓硫酸代替盐酸6.已知25 ℃ 101 KPa 时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol ,下列关于中和热的说法正确的是( )A .中和热指的是酸碱发生中和反应放出的热量B .HCl 和NaOH 反应的热化学方程式为H +(aq)+OH -(aq)===H 2O(l) ΔH =-57.3kJ/molC .若将含0.5 mol H 2SO 4的浓溶液与含1 mol NaOH 的溶液混合,放出的热量等于57.3 kJD .稀硫酸与氢氧化钠溶液反应的热化学方程式为H 2SO 4(aq)+2NaOH(aq)===2H 2O(l)+Na 2SO 4(aq) ΔH =-57.3 kJ/mol7.为了测定酸碱中和反应的反应热,计算时至少需要的数据是( )①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后溶液温度的变化 ⑦操作所需的时间A .①②③⑥B .①③④⑥C .③④⑤⑥D .全部8.已知298 K 时,合成氨反应的热化学方程式为N 2(g)+3H 2(g) 2NH 3(g) ΔH =-92.2 kJ/mol ,在此温度下将1 mol N 2和3 mol H 2放在一个密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)( )A .一定大于92.2 kJB .一定等于92.2 kJC .一定小于92.2 kJD .不能确定9.化学反应N 2+3H 22NH 3的能量变化如图L1-1-9所示,该反应的热化学方程式是( )图L1-1-9A .N 2(g)+3H 2(g) 2NH 3(1)ΔH =2(a -b -c )kJ/molB .N 2(g)+3H 2(g) 2NH 3(g)ΔH =2(b -a )kJ/molC.12N 2(g)+32H 2(g) NH 3(1) ΔH =(b +c -a )kJ/molD.12N 2(g)+32H 2(g) NH 3(g) ΔH =(a +b )kJ/mol10.已知强酸与强碱的稀溶液发生中和反应的热化学方程式为:H +(aq)+OH -(aq)=H 2O(1) ΔH =-57.3 kJ·mol -1,又知电解质的电离是吸热过程。
向1 L 0.5 mol·L -1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。
其焓变ΔH 1、ΔH 2、ΔH 3的关系是( )A .ΔH 1>ΔH 2>ΔH 3B .ΔH 1<ΔH 3<ΔH 2C.ΔH1=ΔH3>ΔH2D.ΔH1>ΔH3>ΔH211.依据实验数据,写出下列反应的热化学方程式。
(1)1 mol C2H4(g)与适量O2(g)反应,生成CO2(g)和H2O(1),放出1411 kJ热量。
________________________________________________________________________。
(2)1 mol C2H5OH(1)与适量O2(g)反应,生成CO2(g)和H2O(1),放出1366.8 kJ热量。
________________________________________________________________________。
(3)2 mol Al(s)与适量O2(g)发生反应,生成Al2O3(s),放出1669.8kJ热量。
________________________________________________________________________。
12.根据如图L1-1-10所示,写出反应的热化学方程式并回答问题。
图L1-1-10(1)反应过程(1)的热化学方程式:______________________;(2)反应过程(2)的热化学方程式:________________________;(3)Q与Q1的关系:Q________Q1(填“大于”“小于”或“等于”)。
13.已知H+(aq)+OH-(aq)===H2O(1)ΔH=-57.3 kJ/mol,回答下列问题。
(1)用含20 g NaOH的稀溶液跟足量稀盐酸反应,放出________ kJ的热量。
(2)用含2 mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热ΔH为________。
(3)如果将(1)反应中的稀盐酸换成稀醋酸,反应放出的热量________(填“大于”、“小于”或“等于”)(1)放出的热量。
14.(1)已知葡萄糖完全燃烧生成1 g液态水时放出的热量为26.0 kJ,则葡萄糖完全燃烧的热化学方程式是________________________________________________。
(2)已知2.00 g C2H2气体完全燃烧生成液态水和CO2,放出99.6 kJ的热量,写出该反应的热化学方程式:____________________。
(3)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时产生大量氮气和水蒸气,并放出大量热,已知0.4 mol液态肼与足量H2O2反应生成氮气和水蒸气,放出256.65 kJ的热量,写出热化学方程式:________________________。
15.实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图L1-1-11所示装置,进行测定中和热的实验,得到表中的数据:实验次数起始温度t1/℃盐酸NaOH溶液终止温度t2/℃1 20.2 20.3 23.7图L1-1-11完成下列问题:(1)实验时用环形玻璃搅拌棒搅拌溶液的方法是________________,不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是________________________。
(2)经数据处理,t2-t1=3.4 ℃。
则该实验测得的中和热ΔH=__________________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
第2课时热化学方程式1.C[解析] 依据反应热的概念,表示按照热化学方程式计量数的物质的量反应时吸收或放出的热量,单位是kJ·mol-1,该热化学方程式表示1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气并吸收131.3 kJ的热量,特别要指明水的状态。
2.B[解析] A项中没有注明各物质的聚集状态;C项中ΔH的单位应为kJ/mol;D项中因为该反应为放热反应,ΔH应为“-”。
3.B[解析] 1 mol甲醇燃烧生成CO2和液态水时放出的热量为22.70 kJ/g×32 g=726.4 kJ,表示为ΔH=-726.4 kJ/mol。
A、D选项符号错误;C选项热化学方程式中的甲醇为2 mol,与ΔH的值不对应,只有B选项符合题意。
4.C[解析] 考查对“ΔH”的理解,明确“ΔH”既有“+”“-”,又有数值大小。
碳与氧气反应放热,即ΔH1<0,ΔH2<0,CO再与O2作用时又放热,所以ΔH1<ΔH2;固态硫变为气态硫蒸气时吸收热量,故在与O2作用产生同样多的SO2时,气态硫放出的热量多,即ΔH3>ΔH4;发生同样的燃烧反应,物质的量越多,放出的热量越多,故ΔH5>ΔH6;碳酸钙分解吸收热量,ΔH7>0,CaO与H2O反应放出热量,ΔH8<0,显然ΔH7>ΔH8。
故本题答案为C。
5.D[解析] 搅拌后使温度稳定,作为初始温度记录,A项正确;反应时使一种反应物稍过量,使另一反应物完全反应,B项正确;加碱时必须使碱与酸的温度相同,才能使实验结果准确,C项正确;可以用KOH代替NaOH,但不能用浓硫酸代替盐酸,因为浓硫酸稀释时要放热,会影响到实验结果。
