想和大家讨论讨论原核表达载体
原核&真核表达载体构建

原核、真核表达载体构建真核表达载体和原核表达载体的区别:主要是因为原核和真核表达系统所需的表达元件不同。
比如说启动子,终止子在两种表达系统中是不一样的。
带有真核表达元件的是真核载体,能在真核生物内表达;带有原核表达元件的是原核载体,能在原核生物内表达。
两者都具有的为穿梭载体。
㈠原核表达载体指:能携带插入的外源核酸序列进入原核细胞中进行复制的载体。
原核表达载体调控原件1.启动子启动子是DNA链上一段能与RNA聚合酶结合并起始RNA合成的序列,它是基因表达不可缺少的重要调控序列。
没有启动子,基因就不能转录。
由于细菌RNA聚合酶不能识别真核基因的启动子,因此原核表达载体所用的启动子必须是原核启动子。
原核启动子是由两段彼此分开且又高度保守的核苷酸序列组成,对mRNA的合成极为重要。
在转录起始点上游5~10 bp处,有一段由6~8个碱基组成,富含A和T的区域,称为Pribnow 盒,又名TATA 盒或-10区。
来源不同的启动子,Pribnow 盒的碱基顺序稍有变化。
在距转录起始位点上游35 bp 处,有一段由10 bp组成的区域,称为-35区。
转录时大肠杆菌RNA聚合酶识别并结合启动子。
-35区与RNA聚合酶s亚基结合,-10区与RNA聚合酶的核心酶结合,在转录起始位点附近DNA被解旋形成单链,RNA聚合酶使第一和第二核苷酸形成磷酸二酯键,以后在RNA聚合酶作用下向前推进,形成新生的RNA 链。
原核表达系统中通常使用的可调控的启动子有Lac(乳糖启动子)、Trp(色氨酸启动子)、Tac(乳糖和色氨酸的杂合启动子) 、lPL (l噬菌体的左向启动子)、T7噬菌体启动子等。
2. SD序列1974年Shine和Dalgarno首先发现,在mRNA上有核糖体的结合位点,它们是起始密码子AUG和一段位于AUG上游3~10 bp处的由3~9 bp组成的序列。
这段序列富含嘌呤核苷酸,刚好与16S rRNA 3¢末端的富含嘧啶的序列互补,是核糖体RNA的识别与结合位点。
重组表达质粒的构建——原核表达载体选择
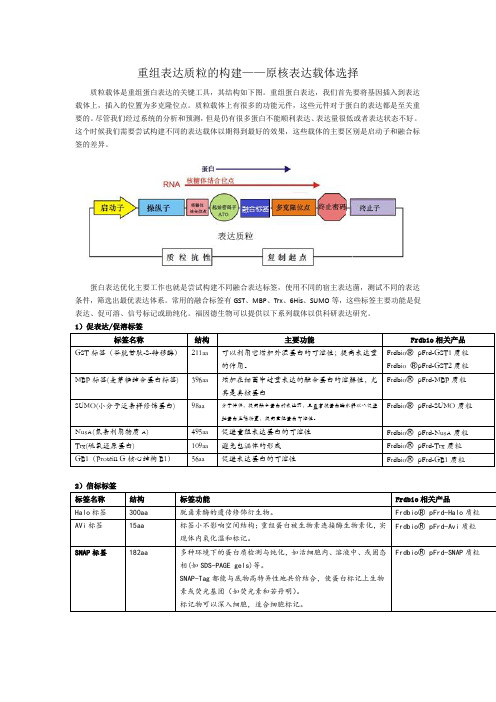
重组表达质粒的构建——原核表达载体选择质粒载体是重组蛋白表达的关键工具,其结构如下图。
重组蛋白表达,我们首先要将基因插入到表达载体上,插入的位置为多克隆位点。
质粒载体上有很多的功能元件,这些元件对于蛋白的表达都是至关重要的。
尽管我们经过系统的分析和预测,但是仍有很多蛋白不能顺利表达、表达量很低或者表达状态不好。
这个时候我们需要尝试构建不同的表达载体以期得到最好的效果,这些载体的主要区别是启动子和融合标签的差异。
蛋白表达优化主要工作也就是尝试构建不同融合表达标签,使用不同的宿主表达菌,测试不同的表达条件,筛选出最优表达体系。
常用的融合标签有GST、MBP、Trx、6His、SUMO等,这些标签主要功能是促表达、促可溶、信号标记或助纯化。
福因德生物可以提供以下系列载体以供科研表达研究。
1)促表达/促溶标签2)信标标签3)纯化标签我们选择表达载体的时候不但要考虑蛋白怎么表达成功,更要考虑蛋白怎么纯化出来,纯化的问题主要是考虑纯化标签和酶切位点的选择,下表我们列举了常见的纯化标签和酶切位点。
4)酶切位点以上为原核表达常用的标签和酶切位点,其性质也都作了简要的介绍,各专业网站或专业书籍已对此做详尽解释,科研工作者可根据具体实验设计方案,组合设计以上标签和酶切位点的使用。
特别值得注意的是,选用和设计蛋白酶切位点的时候首要考虑的是序列内部有没有蛋白酶位点,同时要考虑酶切的效率和蛋白酶试剂成本。
一般商业化载体,在标签蛋白与载体多克隆位点之间都设计有酶切位点。
标签可设计在N-端也可在C-端,设计在N-端的优势是,可通过标签高效翻译起始位点带动插入蛋白的表达,可溶性标签的高效表达更可促进蛋白的可溶性表达;同时,大部分的蛋白内切酶的切割位点在C-端,所以标签设计在N-端可将标签切割完全。
在设计标签序列与酶切位点的时候还要考虑N-端稳定性原则,也就是所谓宿主细胞的N-端规则(N-end rule),这个要避免;同时,还应该检查是否引入了可与别的蛋白相互作用的序列或者蛋白酶切位点。
原核表达技术

原核表达技术原核表达技术是一种基因工程的方法,用于在原核生物(如细菌)中表达外源基因。
它是研究生物学、医学和工业应用的重要工具。
原核表达技术的发展使得我们能够更好地理解基因的功能和调控机制,同时也为蛋白质的生产和应用提供了一种高效可行的方法。
在原核表达技术中,常用的载体是质粒。
质粒是一种环状的DNA分子,能够在细菌中自主复制和表达外源基因。
通过将目标基因插入到质粒的适当位点上,可以利用细菌的表达系统来合成目标蛋白质。
质粒通常包含有启动子、转录终止子、选择性标记基因等功能元件,以便实现基因的高效表达和筛选。
在原核表达技术中,选择适当的宿主菌株也是至关重要的。
常用的宿主菌包括大肠杆菌(E. coli)和酵母菌等。
这些菌株具有良好的生长特性和表达系统,能够提供高效的表达平台。
另外,在选择宿主菌株时还需要考虑到目标蛋白质的特性和表达需求,以确保表达系统的稳定性和产量。
原核表达技术的关键步骤包括基因克隆、转化、筛选、表达和纯化等。
首先,通过PCR等方法将目标基因扩增得到目的片段,并将其插入到质粒的适当位点上。
然后,将重组质粒导入宿主菌株中,使其发生转化。
接下来,通过选择性培养基或标记基因进行筛选,以得到含有目标基因的菌落。
随后,利用诱导剂等方法激活表达系统,使目标蛋白质开始合成。
最后,通过离心、柱层析等手段对目标蛋白质进行纯化和分析,以得到纯度较高的产物。
原核表达技术具有许多优势。
首先,宿主菌株的生长速度快,表达系统稳定,能够提供高产量的蛋白质。
其次,原核表达系统相对简单,易于操作和优化。
此外,原核表达技术还可以用于蛋白质的定点突变、标记和修饰等研究,为蛋白质工程和功能研究提供了重要手段。
然而,原核表达技术也存在一些限制。
首先,由于原核生物的不同表达机制和翻译机器,某些复杂的蛋白质可能无法在原核系统中正确折叠和修饰。
其次,质粒的稳定性和复制效率可能受到限制,影响表达产量。
此外,一些蛋白质可能具有毒性,对细菌的生长和表达产生负面影响。
几种表达载体

表达载体一、原核细胞表达载体1. pBAD载体:特点; 该表达质粒含有araBAD(arabinose)操纵子的P BAD启动子和编码该启动子的正负调控子基因araC,具有紧密调控功能和高水平表达外源蛋白质的原核细胞表达载体。
请注意:1. 当要扦入其他信号肽片段,改建此载体时,请不要利用该载体上的Nde1 EcoR1 BamH1 Kpn1和 Pst1位点,以免造成重组困难,因为前述内切酶在此载体上均有二个位点,最好使用只有一个酶切位点的Sac1和Hind111位点。
同时记住,如在不含任何信号肽的P BAD表达质粒扦入信号肽,其非编码N-末端要包含核糖体结合位点(RBS)核苷酸序列。
2在使用含Omp A分泌信号肽的P BAD表达质粒时,请应用Omp A分泌信号肽上的Sac1以及载体Hind111酶切位点,这些在载体序列上都是单个酶切位点。
本公司目前有含Omp A分泌信号肽和不含任何信号肽的二种P BAD表达质粒,其多克隆位点区域图谱如下:(a)、含Omp A分泌信号肽的P BAD表达质粒多克隆区域SDP BAD….TACCCGTTT TTTTCC….GCTAG CAGGAGGAAACG ATG AAA AAG ACA GCT ATC GCG ATT GCA GTG GCA CTG GCT GGTA M A E LTTC GCT ACC GTA GCC ATG GCC GAG CTC GGTACCCGGGGATCCTCTAGAGTCGCCTGCAGGCATCCAAGCTTNco1 Sac1 Kpn1 Smal1 BamH1 Pst1 Hind111(b)、不含分泌信号肽的P BAD表达质粒多克隆区域EcoR1 Kpn1 BamH1 Pst1P BAD….TACCCGTTTTTTTGG….GCTAGCGAATTCGAGCTCGGTACCCGGGGATCCTCTAGAGTCGCCTGCAGGCATCCAAGCTTNde1 Sac1 Smal 1 Hind111下图显示本公司应用pBAD表达载体完成的实验结果:pBAD载体驱动大分子蛋白质在原核细胞Origami(DE3)内高效表达2. pCAl-n & pCAl-pelB载体特点: 该原核细胞表达载体是来源于以T7 RNA聚合酶为基础的pET载体,含有T7/LacO启动子、编码钙调素结合多肽标鉴和凝血酶切点的核苷酸序列。
原核表达载体构建步骤

原核表达载体构建步骤构建原核表达载体就像是在微观世界里盖房子,而且是给那些超级小的生物分子住的。
咱得先找好“建筑材料”,也就是目的基因啦。
这目的基因就像是一颗特别的种子,我们要把它种到原核生物这个小花园里。
找目的基因有时候就像大海捞针,在基因的海洋里翻来翻去,直到找到那一颗闪闪发光的“金种子”。
然后呢,要有合适的“地盘”,这就是原核表达载体。
这个载体就像是一块神奇的土地,不过它可不是随随便便的土块,而是经过精心设计的,上面有各种功能区域,就像土地上划分好了不同的功能区一样,有启动子区,这就像是房子的大门开关,决定着基因能不能开始工作,还有终止子区,那是工作结束的信号,就像下班的铃声。
接下来要把目的基因和载体连接起来,这过程就像是用超级胶水把种子粘到土地上。
这个胶水就是连接酶啦,它特别神奇,能准确地把基因和载体紧紧地连在一起,就像把两根细细的线完美地缝起来一样。
在这之前,还得对载体和目的基因进行处理,就像给土地松松土,给种子去去壳。
我们要用限制酶在载体和目的基因上切出合适的口子,这限制酶就像一把超级小但无比锋利的剪刀,精确地剪出想要的形状。
构建好之后,还得检查一下有没有问题呀。
这就像是房子盖好了要验收一样。
要看看基因有没有正确地连接,就像检查房子的结构有没有稳固。
有时候如果出了差错,那就像盖歪了房子,一切就得重新来啦。
把构建好的原核表达载体送进原核细胞这个小家园,就像把种好种子的花盆放到温室里。
原核细胞会像勤劳的小园丁一样照顾这个载体,让目的基因开始表达,生产出我们想要的蛋白质。
这蛋白质就像是花朵或者果实,是我们精心构建载体的最终收获。
整个过程充满了各种惊喜和挑战,有时候一个小失误就像在蛋糕里放错了盐,整个味道就全变了。
但当一切顺利的时候,就像是在微观世界里创造了一个小奇迹,那些小小的分子按照我们的意愿开始工作,感觉自己就像一个微观世界的大魔法师呢。
原核表达载体构建虽然复杂又繁琐,但就像一场充满乐趣的微观冒险,每一步都充满了未知和期待。
【原创】原核表达的心得

如下:(我的目的蛋白是
,信心十足往下做,
SDS-PAGE
然目的蛋白也是很少,但是至少
PAGE图如下:
数真的影响表达啊,没有加
,SDS-PAGE
抗,哈哈,老天
是沉淀表达,我是按照分子克隆指南上面的做法,
,沉淀和上清分
很开心,今天时间
上清的目的蛋白会更多一点。
等我
多了,但是杂
未过柱裂解液是菌体裂解后上清的液体(应该算阳性对照吧这个),看出来250mM处蛋白挺多的,这样应该就没有问题了吧,我这个是50ml菌液摇的,5ml裂解上清,上样为10μl,祝大家实验顺利哈。
以后会用lc-ms研究这个蛋白和受体的作用,有什么新的进展我会更新的。
原核表达系统三大要素的选择及优化

原核表达系统三大要素的选择及优化(总4页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--原核表达系统是目前使用最广泛、最完善的重组蛋白表达系统,具有遗传背景清晰、表达周期快、表达量高、成本低等优势,缺点是无法进行蛋白的翻译后修饰,得到具有生物活性蛋白的几率较小。
原核表达系统适用于表达原核来源的蛋白或不需要翻译后修饰的真核来源蛋白。
在原核蛋白表达过程中,需要综合考虑表达菌株、质粒载体、表达条件三大因素,以获得最满意的表达效果。
下面为大家一一介绍这三大因素的选择和优化。
1. 表达菌株菌株的选择往往是大家最容易忽视的,大多数人会选择使用自己实验室有的或用过的表达菌株。
当蛋白表达效果不佳时,大多会在质粒载体或表达条件上找原因,而不会考虑菌株的选择是否合适。
但作为表达宿主,菌株一定会对外源基因表达蛋白产生影响。
图1 大肠杆菌原核表达系统常用的菌株包括大肠杆菌、芽孢杆菌和链霉菌。
其中运用最为广泛的就是大肠杆菌表达系统。
以下为大家列出了一些常用的大肠杆菌表达菌株,可根据不同的需求进行选择。
2. 质粒载体质粒表达载体上的重要元件包括启动子,多克隆位点,终止子,复制子,信号肽,融合标签,筛选标记等。
根据载体上这些元件的特性,有多种质粒可供选择。
图2 大肠杆菌表达质粒pET-22b(+)图谱启动子:根据启动子的强弱考虑,强启动子可以提高蛋白表达量;弱启动子可以降低本底表达、增加可溶表达、表达小量伴侣蛋白等。
根据启动子的作用方式考虑,组成型启动子使宿主不停的表达重组蛋白;诱导型启动子使宿主在特定诱导条件下表达重组蛋白。
终止子:终止子的作用在于保护mRNA在核外不被降解,延长mRNA的寿命,以提高重组蛋白表达量。
对于T7系统来说,由于T7 RNA聚合酶效率非常高,保证一直有充足的mRNA提供翻译,所以终止子对其影响不大,只有一些自身带有起始密码子的外源基因需要终止子。
复制子:复制子决定质粒载体拷贝数,拷贝数越高,重组蛋白表达量就越高。
做原核表达的教训和体会

最近在做原核表达,包涵体。
以前也做过,但经验不多。
从园子里也学到不少。
一点失败的教训以及纯化过程中的体会,贴出来与大家共享,同时希望得到同行们的指正。
1. 首先介绍一下背景。
载体是novagen公司的pET22b,Amp 抗性。
菌株是Invitrogen的BL21 star DE3,是一个蛋白降解酶突变菌株,也就是说是一种优化表达菌株。
2. 第一次失败。
第一次做诱导的时候,重复了很多次,但总是诱导不出来。
PCR、酶切都正确。
但没等测序结果出来就开始做了。
失败了,曾在园子求助。
后来证明是引物错误。
我们实验室合成引物都要先发给purchasing office,然后才由他们与公司交涉。
这个office的老太太把引物弄掉了一个碱基。
教训:在实验过程中,再仔细都是不为过的。
引物来了后管壁上贴有序列,但我忽略了。
3. 第二次失败。
后来重新构建、转化、诱导。
第一次诱导时根本就没带。
见附图(图片质量太差了,下面几个帖会逐渐好转)然后开始闷头找原因。
周一下午5点我就接了DE3菌,由于那天人非常不舒服,去看医生了,等了很久,到第二天中午11点才转接!而且是按1:50转接的!也就是菌在转接之前培养了18 h!Amp产生抗性的机制和其他抗生素的情况是不同的(具体可以翻看分子克隆)。
到菌体生长到足够浓度的时候,培养基的Amp就会慢慢减少。
一旦细菌失去选择压力,就可能造成质粒丢失。
当Amp降到很低,不足以抑制细菌生长时,未携带质粒的菌就会长得比带质粒的快。
所以当培养时间足够长后,培养基中的B-内酰胺酶就会积累到很高的浓度。
转接时(我是1:50转的),高浓度的酶可能破坏新鲜培养基中的Amp(而且我用的浓度是50 ug/ml)。
这样,就造成最后收集的菌中,大部分都是没有带质粒的菌了。
当然还有一个可能的原因就是死亡的菌体分泌一些降解酶,使得表达检测失败。
这两种推测都只是推测,但我觉得第一种情况应该引起我们的重视。
在使用Amp抗性的时候要格外注意。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【建议】想和大家讨论讨论原核表达载体原核表达载体,如pet系列,型号从小到大,那么多,往往让新手选择起来不知所措。
所以希望和大家讨论讨论到底他们是怎么演变的,每个的优缺点,是不是号越大的就越好等新手们往往困惑不已的问题。
希望下面的讨论分系列进行,如pet系列、pgex系列等这篇文章是我从网上找的关于pet载体的介绍,只要你耐心的看完,相信能有个基本的了解关于pet载体及应用。
更详细的内容请高手进行补充pET,原核表达金标准(转)pET 载体中,目标基因克隆到T7 噬菌体强转录和翻译信号控制之下,并通过在宿主细胞提供T7 RNA 聚合酶来诱导表达。
Novagen 的pET 系统不断扩大,提供了用于表达的新技术和选择,目前共包括36 种载体类型、15 种不同宿主菌和设计用于有效检测和纯化目标蛋白的许多其它相关产品。
优点·是原核蛋白表达引用最多的系统·在任何大肠杆菌表达系统中,基础表达水平最低·真正的调节表达水平的“变阻器”控制·提供各种不同融合标签和表达系统配置·可溶性蛋白生产、二硫键形成、蛋白外运和多肽生产等专用载体和宿主菌·许多载体以LIC 载体试剂盒提供,用于迅速定向克隆PCR 产物·许多宿主菌株以感受态细胞形式提供,可立即用于转化阳性pFORCE TM 克隆系统具有高效克隆PCR 产物、阳性选择重组体和高水平表达目标蛋白等特点。
pET 系统概述pET 系统是在大肠杆菌中克隆和表达重组蛋白的最强大系统。
根据最初由Studier 等开发的T7 启动子驱动系统,Novagen 的pET 系统已用于表达成千上万种不同蛋白。
控制基础表达水平pET 系统提供6 种载体- 宿主菌组合,能够调节基础表达水平以优化目标基因的表达。
没有单一策略或条件适用于所有目标蛋白,所以进行优化选择是必要的。
宿主菌株质粒在非表达宿主菌中构建完成后,通常转化到一个带有T7 RNA 聚合酶基因的宿主菌(λ DE3 溶原菌)中表达目标蛋白。
在λ DE3 溶原菌中,T7 RNA 聚合酶基因由lacUV5 启动子控制。
未诱导时便有一定程度转录,因此适合于表达其产物对宿主细胞生长无毒害作用的一些基因。
而宿主菌带有pLysS 和pLyE 时调控会更严紧。
pLys 质粒编码T7 溶菌酶,它是T7 RNA 聚合酶的天然抑制物,因此可降低其在未诱导细胞中转录目标基因的能力。
pLysS 宿主菌产生低量T7 溶菌酶,而pLysE 宿主菌产生更多酶,因此是最严紧控制的λ DE3 溶原菌。
有11 种不同DE3 溶原化宿主菌。
使用最广泛的为BL21 及其衍生菌株,它的优点在于缺失lon 和ompT 蛋白酶。
B834 菌株为甲硫氨酸营养缺陷型,因此可用35 S- 甲硫氨酸和硒代甲硫氨酸对目标蛋白进行高特异活性标记。
BLR 为recA - 衍生菌株,改善了质粒单体产量,有助于稳定含有重复序列的目标质粒。
两个硫氧还蛋白还原酶( trxB ) 突变菌株(AD494,BL21 trxB ) ,有利于大肠杆菌胞浆中二硫键形成。
Origami TM 和OrigamiB 菌株为trxB/gor 双突变,这两个酶是主要还原途径的关键酶。
Origami 和OrigamiB 宿主菌的主要优点是能形成正确折迭的含有二硫键的蛋白。
新的Rosetta TM 菌株补充了四种大肠杆菌稀有密码子的tRNA ,改善了由于密码子使用频率不同而引起的一些真核蛋白低表达。
其它菌株背景包括K-12 菌株HMS174 和NovaBlue ,象BLR 一样为recA - 。
这些菌株可稳定表达其产物可能导致DE3 噬菌体丢失的某些目标基因。
由于存在F 附加体编码的高亲和力lacIq 阻遏蛋白,NovaBlue 为一个有用的严紧型宿主菌。
此外,Novagen 提供了λ DE3 溶原化试剂盒,用于制备其它遗传背景的新表达宿主菌。
表达高毒性基因或制备新的λ DE3 溶原菌的另一替代方法是通过l CE6 感染提供T7 RNA 聚合酶。
虽然不如用IPTG 诱导λ DE3 溶原菌方便,这种策略也被优先用于一些应用中。
高严紧性T7 lac 启动子除了在宿主菌水平选择三种基本的表达严紧性,pET 系统中T7 启动子本身提供了两种不同的严紧性选择:普通T7 启动子和T7 lac 启动子。
T7 lac 启动子在启动子区下游17bp 处含有一个25bp 的lac 操纵序列。
该位点结合lac 阻遏蛋白能够有效降低T7 RNA 聚合酶的转录,这样提供了在λ DE3 溶原菌中抑制基础表达的第二种基于lacI 的机制(除了抑制lacUV5 )。
含T7 lac 启动子的pET 质粒还具有它们自己的lacI ,确保足够的阻遏蛋白结合到操纵基因位点上。
在实际应用中,为了获得最高产量的蛋白,通常应该测试多种不同的载体/ 宿主菌组合。
控制诱导的表达水平在许多情况下,表达活性可溶性最好的蛋白依赖于宿主细胞的背景、培养条件和合适的载体配置。
通常,目标蛋白活性最高的条件与产量最高的条件不一致。
除了根据载体/ 宿主菌组合控制T7 RNA 聚合酶的基础表达提供不同严紧性,pET 系统还根据诱导物(IPTG )浓度,对目标蛋白表达提供了真正的“变阻器”控制。
Tuner 和OrigamiB 宿主菌的lacY 突变使这种控制成为可能。
选择pET 载体所有的pET 载体均来自pBR322 ,但彼此间先导序列、表达信号、融合标签、相关限制性位点和其它特点有所不同。
有两大类pET 质粒,即转录载体和翻译载体:转录载体(包括pET-21 、pET-23 和pET-24 )表达目标RNA ,但不提供翻译信号。
它们用于从自身带有细菌翻译信号的目标基因表达蛋白。
(注意:转录载体通过命名后面的一个缺失字母后缀加以区分)翻译载体含有设计用于蛋白表达的有效翻译起始信号。
许多载体在读码框 a 、 b 和 c 中带有克隆位点,分别对应于BamH I 位点的GGA 、GAT 和ATC 三联体。
选择要点选择用于表达的pET 载体通常涉及多种因素。
考虑以下三个主要因素:·所表达蛋白的用途·所表达蛋白的已知信息·克隆策略pET 载体表达的蛋白用途各种各样。
例如,表达量为分析级的蛋白可用于活性研究、突变体筛选和定性、筛选配体相互作用和抗原制备。
大量活性蛋白用于结构研究、试剂或亲和基质制备。
许多载体适合表达用于筛选或抗原制备的分析量蛋白,然而只有载体、宿主菌和培养条件组合十分适宜才可能用于大量纯化。
如果需要活性蛋白连续高产,应该试验多种载体、宿主菌和培养条件组合以找到最优化结果。
任何关于目标蛋白的已知信息都有助于载体选择。
例如,一些蛋白的活性要求一个或两个末端没有外源序列。
许多pET 载体能够克隆非融合序列,然而如果特定翻译起始序列不能在大肠杆菌中有效利用,表达水平可能受影响。
在这些情况下,常可用有效表达的氨基末端序列构建融合蛋白,然后在纯化后用位点特异性蛋白酶消化去除融合序列。
LIC (连接非依赖的克隆)策略对这种方法特别有用,因为克隆操作通过肠激酶和因子Xa 能够去除所有氨基端载体编码序列。
由于限制性位点和读码框相容性的需要,克隆策略也会影响载体选择。
由于许多pET 载体具有共同的限制性位点配置,通常可能将一次制备的目标基因克隆到几个载体中。
采PCR 克隆策略时则有不同的考虑。
LIC 载体试剂盒推荐用于此目的,可通过PCR 制备插入片段,而不需要限制性消化载体或插入片段。
溶解性和细胞定位考虑了目标蛋白的应用和克隆策略,还应该确定目标蛋白的细胞定位和溶解性,这一点十分重要。
在许多实际应用中常希望表达可溶的活性蛋白。
特定目标蛋白的溶解性取决于多种因素,包括各自的蛋白序列。
在许多情况下,溶解性不是有或无的现象,载体、宿主菌和培养条件可被用来增加或减少获得的可溶或不可溶形式的比例。
PET-32 载体系列使目标序列与通常能够增加可溶性蛋白比例的硫氧还蛋白(Trx.Tag ) 融合。
新推出的pET-43.1 系列具有通过大量系统筛选而得到的一种过量表达时具有极高溶解性的大肠杆菌蛋白--Nus.Tag 融合伴侣,从而进一步提高了目标蛋白的可溶性。
此外,trxB 突变株AD494 和BL21 trxB ,或trxB/gor OrigamiTM 和OrigamiB 菌株可用于在胞浆中形成许多真核蛋白正确折迭和活性所要求的二硫键。
低温诱导(15 -25 °C )也可增加可溶性目标蛋白的比例。
获得可溶性活性蛋白的另一策略是使蛋白外泌到胞外周质中,为折迭和二硫键形成有更适宜的环境。
为了达到这一目的,通常使用带信号肽的载体。
一些纯化策略可以优化胞质中不溶性包涵体的产量。
抽提包涵体并溶解,然后目标蛋白在体外重新折迭( 如使用Novagen 的蛋白折迭试剂盒) 。
该过程通常产生高产量初始蛋白并防止宿主细胞中的蛋白降解。
然而,重新折迭成活性蛋白的效率随不同蛋白变化很大,可能相当低。
pET-31b (+ )载体专为产生不可溶融合蛋白而设计,提供了生产小蛋白和多肽的有效方法。
满足不同需要的融合标签如果融合序列不影响应用,生产带有S.Tag 、T7.Tag a 、His.Tag a 和HSV.Tag a 的融合蛋白会很方便后续操作,并易于通过蛋白杂交检测。
这些多肽(融合序列很小),它们的检测试剂极特异和灵敏。
通过使用相应树脂和缓冲液试剂盒,GST.Tag 、S.Tag 和T7.Tag 序列可用于亲和纯化。
使用S.Tag 和GST.Tag 分析试剂盒可对粗提或纯化的融合蛋白准确定量。
采用一种新颖底物的FRETWorks S.Tag 分析试剂盒可通过荧光检测到少于1fmol 的融合蛋白。
His.Tag a 序列作为纯化蛋白的融合伴侣非常有用,尤其对那些以包涵体形式表达的蛋白来说,它可以使亲和纯化可在溶解蛋白的完全变性条件下进行。
CBD.Tag a 在低费用亲和纯化中非常有用。
它们也特别适用于重新折迭(特别是带有CBD clos .Tag a 序列的pET-34b (+ )和35b (+ ))。
因为只有正确重新折迭的CBDs 结合到纤维素基质上,CBIND 亲和纯化步骤能够从制备物中去除不正确折迭的分子。
任何标签可用于固定目标蛋白,但由于CBD.Tag 序列的低非特异性结合以及与纤维素基质的生物相容性,使它更适合用于这一目的。
Nus.Tag 、Trx.Tag 和GST.Tag 序列用来增加其融合伴侣的溶解性。
Nus.Tag 和Trx.Tag 载体与利于在胞浆中形成二硫键的Origami 宿主菌相容。
各种融合标签和相应pET 载体见列表。
一些pET 载体带有数个***的融合标签,作为5' 融合伴侣。
