第17章胺--
第17章 胺

环状胺通常按含氮杂环化合物的氢化衍生物命名。例如:
N H 四氢吡咯
N H 六氢吡啶
§ 17.2 一元胺的物理性质
化合物 熔点/℃ –93 –81 –83 –101 –50 –86 –104 –68 –96 –42 –40 –61 –59 –42 –115 –94 –117 –115 –6 –57 2 54 126 沸点/℃ –7 17 49 33 77.8 68 63 45 134 53 7 37 56 111 84 159 56 3.5 156 90 185 184 196 194 302 365
N-甲基-N-乙基异丁胺
在取代基前加N-(读作氮位),是为了明确取代基所在的位置。
结构比较复杂的胺,可以作为烃类的氨基衍生物命名。
(CH3)2CHCH2CHCH3 NH2 4-甲基-2-氨基戊烷 CH3CH2CHCH3 N(CH2CH3)2 2-(二乙胺基)-丁烷
季铵盐的命名与铵盐相似。
(CH3)4N+Cl氯化四甲铵 C6H5CH2N+C2H5)3Cl 氯化三乙基苄基铵
而芳香族胺的碱性则比氨弱。
17.3.1 脂肪胺
但仍然是弱碱
乙胺的碱性比氨强,这是因为C-N键是极化的,乙胺有偶极矩,方
向是由乙基指向氮原子。在乙胺的共轭酸——乙基铵离子中,氮原子上的正 电荷在偶极的影响下,部分分散到乙基中,使乙基铵离子比铵离子更稳定:
NH3 CH3CH2NH2 H NH3
+ +
H NH2CH2CH3
:
N H
N CH3 CH3 H
HNH=113°
苯胺分子中N原子更接近于平面结构,其杂化状态介于 sp3和sp2杂化之 间,更接近于sp2。这样才能使孤对电子对所在的轨道具有更多的p成分, 与苯环中π电子轨道重叠更多,使N-C具有部分双键的性质,因此,N-C 的键长比甲胺中的N-C键短。苯胺的结构用共振式表示更为恰当:
17胺

2. 1HNMR
RNH HCN H
δH :0.5~5(加入D2O后消失) α-H :2.7~3.1
H C C N H β-H :1.1~1.7 3. MS
南京大学基础学科教育学院
6
南京大学化学化工学院
1
基础有机化学
17.3 胺的化学性质
一、碱性
+ + .. H Cl
+ - NaOH
RNH2
RNH3 Cl
0~5OC
芳香重氮 b.芳 盐只能在 香族 低温下(5oc 重氮 以下)存 盐在 在,否则 有机 分解出N2 合成
中有
与脂肪2O胺类似
出现黄 广泛 色,油状 应用
N(CH3)2 HNO2 ON
N(CH3)2
绿色晶体 对位占据,则进邻位
物 出现绿色 晶体
南京大学基础学科教育学院
南京大学化学化工学院
基础有机化学
RR’R2N 叔胺
N H
H
RR’R2R3N+X季铵盐
南京大学基础学科教育学院
2
南京大学化学化工学院
基础有机化学
三、胺的命名
•简单的胺:用“胺”作官能团,把它所含烃基的名称和数目写 在前面,按简单到复杂先后列出,后面加上“胺”字。
N CH3
甲(基)乙(基)环丙胺
CH2CH3
•复杂的胺:作为烃类的衍生物来命名
基础有机化学
第十七章 胺
南京大学基础学科教育学院
1
南京大学化学化工学院
基础有机化学
17.1 胺的结构和命名 一、胺的结构
氨和胺分子呈角锥型,N:sp3 杂化 苯胺:N:接近sp3 杂化,形成p-π共轭体系
N
H
17章胺

(CH3)2CH CH2
N-甲基-N-乙基异丁胺
Organic Chem
2、比较复杂的胺,把胺 基当作取代基,烃基作为母体来命名
CH3CH CH2CH(CH3)2 NH2 2-氨基-4-甲基戊烷 CH3 N+ CH3 OHC2H5
CH3 N(C2H5)2 CH3CH2CH CHCH3 2-(N,N-二乙胺基)-3-甲基戊烷 氢氧化三甲乙胺
-H
CH3CH
CH2 H2O CH3CHCH3 OH CH3CHCH3
-H
Organic Chem
邻氨基醇的亚硝酸重排
OH NH2 O R C R' C R R'
HNO2 R'
R
C R
C R'
类似Pinacol重排
-H OH R C R C R' R' R OH R' C C R R'
Organic Chem
:N
O: ..
Organic Chem
伯胺与 HNO2 的反应的机理(重氮化反应)
NaNO2, HCl
H
RNH2
R N NCl
H O H N O + H2O NO
R+ + Cl- +N2
机理经过 碳正离子
H O NO +
H O H
NO
N RNH2
O RNH2 H NO
-H RNH NO
H RN
O N
CN,Ph-Cl等)测定确按此顺序) • 从溶剂效应看:N上取代基多,与H2O形成氢键少,与H+结合 形成铵离子后,溶剂化稳定作用弱,碱性减弱。
Organic Chem
第十七章胺1

CH3 C CH3 CH3
7、烯胺的生成及其反应
H C H C O + RNH2 H
H C H
H C H
C
NR
H2 C
C 亚胺
NR2
OH H
C H
H C H C O + R2NH
H
C OH
NR2
C 烯胺
NR2
生成烯胺的反应多用酸催化,二级胺常为:
O N H N H N H
烯胺的共振式有两种
R2N C C R2N C C 具有亲核性
NH 2
(CH3CO) 2O
NHCOCH 3
在乙酸中 NO 2 NH 2 NO 2
HNO 3
NHCOCH 3 NO 2 OH / H 2O
在乙酸酐中 (主要HNO 3
NH3HSO 4 2NaOH NO 2 H2O
+
H2C
CHCH2Cl
N CH2CH CH2
H3O
CH2CH CH2
+
O
N Cl
R
C
O C R
H3O
O CR
反应可看作是在醛酮的α-位的烃基化和酰基化,在合成上 有重要的应用。
O
例:试合成化合物
O + Br COOC2H5 C2H5ONa O
COOC2H5
O
COOC2H5
COOC2H5
有 机 化 学
第十七章
胺
一、分类、结构和命名
1、分类
氨 NH2R 伯胺
CH3 H3C C OH 叔丁醇(叔醇) CH3 H3C
NHR2 仲胺
NR3 叔胺
CH3 C NH2 叔丁胺(伯胺) CH3
邢其毅《基础有机化学》配套题库名校考研真题胺【圣才出品】

第17章胺一、选择题1.把氨(a)、苯胺(b)、苯甲酰胺(c)和苯磺酰胺(d)按碱性强弱顺序排列()。
[上海大学2004研]A.a>b>c>dB.d>c>b>aC.b>a>d>cD.d>a>c>b【答案】A【解析】氨及氨基上氮原子上的电子云密度越大,则碱性越强。
2.下列化合物中哪个碱性最强?()[上海大学2003研]【答案】D【解析】从空间位阻考虑:(D)中由于二甲氨基体积较大,与邻位甲基存在较大的空间位阻,使氨基氮上的孤对电子与苯环不共轭,故氨基氮上的电子云密度较大,(D)的碱性最强。
3.与亚硝酸反应能生成强烈致癌物N一亚硝基化合物的是()。
[武汉大学2001研]A.伯胺B.仲胺C.叔胺D.都可以【答案】B【解析】仲胺与亚硝酸反应生成N一亚硝基化合物。
三级胺的N上无H,不能与亚硝酸反应。
4.主要得到()。
[武汉大学2002研]【答案】C【解析】季胺碱的Hofmann降解,主要消除酸性大、位阻小的β-H,得取代基最少的烯烃。
5.丙酮、甲醛、二甲胺在中性或稍偏酸性的条件下缩合,主要产物是()。
[武汉大学2002研]【答案】C【解析】含活泼α-H的丙酮与甲醛及二甲胺同时反应,丙酮中的一个活泼α-H被一个二甲胺甲基所取代。
二、填空题1.。
[天津大学2000研]【答案】【解析】Gabriel合成法是制备纯净一级胺的一种方法,邻苯二甲酰亚胺中亚胺上的氢显酸性,可与KOH反应形成亚胺盐,亚胺盐与卤代烷进行烷基化反应,生成N一烷基邻苯二甲酰亚胺,后者在碱性条件下水解后即得一级胺和邻苯二甲酸根。
2.。
[南京大学2002研]【答案】【解析】季胺碱的消除反应,主要消除酸性大的β-H。
由于-CN为强吸电子基,与-CN 相连的β-c上的氢酸性较强,故消除产物不服从Hofmann规则。
3.。
[中国科学院-中国科学技术大学2004研]【答案】【解析】季胺碱的消除反应,主要消除酸性大的β-H。
本题中β-C上连有吸电子的酯羰基,使其所连H原子酸性增强,发生消除反应,故消除产物不服从Hofmann规则。
第17章胺-精品文档
C H (C H 3 ) 2
C H (C H 3 ) 2
(2)化学还原
CH3 CH3 NO2 Fe E tO H , H C l h e at NH2 NH2
Sn、Fe/HCl
NO2
选择性还原试剂
硫化铵
硫氢化钠
硫化钠
还原剂计量: 二硝基化合物选择还原
p775
4. 腈及其它含氮化合物的还原
R C l + aC N N N i / H 2 R C H N H R C N 2 2 or L i A l H 4
O N N O
+ R N H + H O 2 2
O
氨基酸合成 p773
3. 硝基化合物还原
(1)催化氢化:污染少,逐步替代化学方法。中性条件下进行,
适于对含有对酸、碱敏感的官能团化合物进行还原
CH3 CH3 NO2 H 2, N i h e at , p re s s u re NH2
制备伯胺
Ni, Pd, Pt
5. 还原氨化——醛(酮)在氨存在下催化氢化生成 胺的反应(reductive amination)
RC O H (R') + NH 3 Ni/H 2 RC H NH 2 H (R')
NH RC H (R')
中间体
R
R ' C N R '' R '''
醛(酮)与伯胺的反应通过半缩胺 (亚胺)中间体发生,与仲胺的反应 则通过半缩胺(亚胺离子)
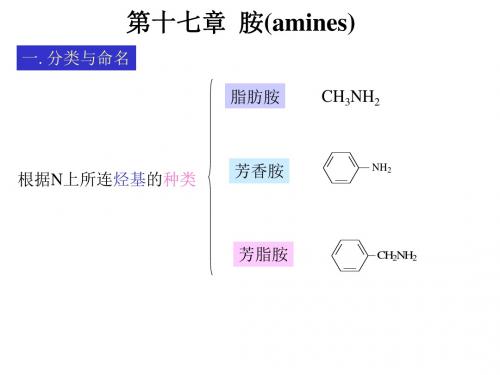
第十七章 胺(amines)
一. 分类与命名
脂肪胺 CH3NH2
根据N上所连烃基的种类
芳香胺
NH2
王积涛著《有机化学》第二版课后习题答案--第十七章 胺

O N-CH3 O LiAlH4 N-CH3
=
CO2H 解: (1) CO2H
CH2
PCl3
CO2Cl CO2Cl
NH3CH3
=
(2)
C CH2 O CH2C-NHCH2
O NH2OH
CH2 C CH2 H3O+ O CH2COH
H+ N-OH △ Beckmann重排
O (3) (C6H5)2CHCOH + NH3
Cl (1) Cl + Na2CO3 (H2O) NO2 NO2 OH Cl
NO2 (2)
CH3
CH3 Zn/OH-
H3C
H3C H+ H N 2
CH3 NH2
NH-NH
NO2 Cl (3) NO2 Cl NH4SH Cl
NH2
NO2 Cl
宁夏大学化学化工学院
6
-
(4) CH3CH2NO2 + CH3CH2CHO
宁夏大学化学化工学院
CH3 Zn NaOH NH NH
CH3 H+ △
20
CH3 H2N CH3
H3PO2
CH3 NH2
NaNO3 HCl,0℃-5℃
CH3 Cl-N N+
CH3 N+ NCl-
CH3
H2O,△
10 . 完成下列转化:
CO2H (1) CO2H N-CH3
(2)(C6H5CH2)2C=O
R-C-N - O-C-R` O R-NH-C-O-H
-R`CO-
O=C=NR O
+ OH -H2O
-
R-NH + C=O +H2O - OH
第十七章 胺和酰胺教材
N+ ≡N Cl-
氯化重氮苯 (重氮盐)
D H2O
OH + N2
+ HCl
仲胺与亚硝酸的反应 生成黄色油状物或黄色固体N-亚硝基胺。
(CH3)2NH + HNO2 ——> (CH3)2N-NO + H2O
N-亚硝基二甲胺(90%)
CH3 N—H
NaNO2 + HCl
(2) 酰化反应和磺酰化反应 伯胺、仲胺易与酰氯、酸酐或羧酸等酰化剂作
用,氨基中的氢原子被酰基取代,生成N-取代酰 胺。叔胺N上没有氢原子,不发生酰化 。
-CH2CH2NH2 +
吡啶 -CO-Cl
-CH2CH2NHCO-
89%~98%
-CO-Cl + HN
NaOH
——>
-CO— N
酰化剂 R3N ——— O
CONH
H2C
CO
CONH
丙二酰脲存在酮式-烯醇式的互变异构现
象,其烯醇式呈酸性所以又称巴比妥酸。
O NH O NH
O
HO N
OH
N HO
R—NH—R’
R’’ R—N—R’
胺类广泛存在于生物界,具有极重要的生 理作用。绝大多数药物都含有胺的官能团—— 氨基。蛋白质、核酸、许多激素、抗生素和生 物碱,都含有氨基,是胺的复杂衍生物,掌握 胺的性质是研究这些复杂天然产物的基础。
一、胺的分类
(1) 根据NH3分子中H被烃基取代的数目将胺分为:
N-甲基乙酰胺
O
CH3
CH3
C
N C2H5
N-甲基-N-乙基乙酰胺
二、酰胺的物理性质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)霍夫曼消除的规律
霍夫曼规则:四级铵碱热解时,若有两种β-H可以发 生消除。总是优先消去取代较少的碳上的β-H。
ββ 2CH3CH2CH2CHCH3 OH-
N+(CH3)3
C2H5OK 130oC C2H5OH -2H+
2CH3CH2CH2CH=CH2 + CH3CH2CH=CHCH3 + 2N(CH3)3
17.4.2 胺与酸的成盐反应
胺有碱性,遇酸能形成盐。
RNH2 + CH3COOH CH3NH2 + HCl
CH3COO- +NH3R
+
CH3 NH3 Cl-
罗氏化学 出品
胺与无机酸成盐反应的应用
1. 用于分离提纯
HCl RNH2 不溶于水
RN+ H3Cl- NaOH RNH2 + H2O + NaCl
罗氏化学 出品
CF3 NH2
CF3 2,5-bis(trifluoromethyl)benzenamine
2,5-双(三氟甲基)苯胺
罗氏化学 出品
3. 胺盐和四级铵化合物的命名:
CH3NH2 HCl methylamine hydrochloride
甲胺盐酸盐
CH3CH2NH2 HOAc ethylamine acetate
N,4-二甲基-N-乙基苯胺
CH3 N(C2H5)2 CH3CH2CH CHCH3
N,N- diethyl-3-methyl-2-pentanamine N,N-二乙基-3-甲基-2-戊胺
NH2既可以作为取代基命名,也可以作为主官能团命名, 作为主官能团命名时,选含氮最长的碳链为母体,称某胺。 N上其它烃基为取代基,并用N定其位。
罗氏化学 出品
(4)芳香胺碱性强弱的分析
首先考虑N上的孤电子对能不能与苯环共 轭,能共轭,碱性弱,不能共轭,碱性强。
HH ON O
N
N
O
O
H3C CH3
ON
N+ O
O
N+ O
NO2
NO2
(1)
(2)
(2)比(1)的碱性强4万倍
具体分析时,既要考虑N上取代基的影响, 也要考虑苯环上取代基的影响。
罗氏化学 出品
(1) 制备:
R4N+I- +; KI
R4N+Cl- + AgOH(或用Ag2O + H2O)
R4N+OH- + AgCl
(2) 性质: 1. 是强碱,在水中能完全电离给出OH-
2. 加热发生霍夫曼消除反应 罗氏化学 出品
2 霍夫曼消除反应
(1)定义
四级铵碱加热分解为三级胺、烯烃和水的反应称为 霍夫曼消除反应。
1普通命名法
CH3NH2 methylamine
甲胺
NH2 aniline
苯胺
CH3 N
CH2CH3 cyclopropylethylmethylamine
甲基乙基环丙胺
罗氏化学 出品
2. IUPAC命名法:
CH3NH2
methylamine
甲胺
CH3
H3C
N
C2H5
N-ethyl-N,4-dimethylbenzenamine
[CH3CH2N+(CH3)3]OH- 100~200oC [RCHN+(CH3)3]OH- 100~200oC
CH3
CH2=CH2 + (CH3)3N + H2O
RCH=CH2 + (CH3)3N + H2O
烯烃
三级胺 水
霍夫曼消除的一个特例:
(CH3)3NOH 100~200oC (CH3)3N + CH3OH
乙胺醋酸盐
CH2CH3
+
CH3CH2-N-CH2CH3
Br -
CH2CH3
Tetraethylammonium bromide
溴化四乙铵
CH2CH3
+
CH3CH2-N-CH2CH3
OH -
CH2CH3
Tetraethylammonium hydroxide
氢氧化四乙铵
罗氏化学 出品
17.2 胺的结构
环上。
CH3 H H
+ N(CH3)3
i-Pr
H
H H3C
H i-Pr i-Pr +
H3C H
89.5 % ~93 %
札依采夫产物
10.5 % ~7 %
霍夫曼产物
罗氏化学 出品
eg 5.
H3C
+ N(CH3)3
OH -
CH3
CH2
+
1%
99 %
符合霍夫曼规则
H
H
CH3
N+(CH3)3
HCH3 H N+(CH3)3
98
L吸电子能力增强,试剂的碱性增强,试剂的体积 增大时, Hofmann烯烃的含量也增大。
罗氏化学 出品
不符合霍夫曼规则的特殊例子
Eg 1.
+
-
C6H5CH2CH2N(CH3)2OH
C2H5
C6H5CH=CH2 + C2H5N(CH3)2
Eg 2.
O RCCH2CHN+(CH3)3 OH-
CH3
55.7%
1.3%
β
+
CH3CH2N(CH3)2
OH-
CH2CH2R β
CH2=CH2 + R CH2CH2N(CH3)2 + H2O
罗氏化学 出品
(3)霍夫曼消除反应的机理
*1 消除反应机理的分类
分类
反应机理
实例
E1
H
C C -L-
(单分子消除)
L
H
C C+
B:
醇失水,三级卤代 C=C + HB 烷在强极性溶剂中
O RCCH CHCH3 + (CH3)3N
罗氏化学 出品
eg 3.
O RCCH2CH2N+(CH2CH3)2 OH-
CH3
O RCCH CH2 + (CH3CH2)2NCH3
碳负离子与共轭体系相连,稳定。 罗氏化学 出品
eg 4.
i-Pr N+(CH3)3 OH -
CH3 H
只有两个-H, 两个-H均在
+N(CH3)3
原因如下:
+N(CH3)3
(1)H2的酸性比H1大。
(2)碱进攻H2空阻小。
(3)碳负离子的稳定性
罗氏化学 出品
(4)C1-C2消除时,消除构象的数目多,消除构象的稳定性好。
C(1)-C(2)与C(2)-C(3)构象分析如下:
罗氏化学 出品
E2消除反应的进一步分析
CH3CH2CH2CH2CHCH 3 L
失卤化氢
BH
E2 似E1
(双 分子 E2
BH
消除)
似E1cb B
H+
+
L是一个好的离去基 热力学控制的产物。
团,L比H易离去, 卤代烷的E2消除(符
L (X) 共轭效应控制
合札依采夫规则)
完全协同,L与H
L
同时离去。
-
H比L易离去, 动力学控制的产物。四
+ L (-NR3)
诱导效应控制 级铵碱的E2消除(符合 霍夫曼规则)
E1cb
(单分子共 轭碱消除)
H CC
L
B: - HB
CC L
LC=C
罗氏化学 出品
碳负离子很不稳定。 按这种机制进行的 情况很少。
-OH
H1
H2
CH3CH2-C3H-C2H-C1 H2 +N(CH3)3
四 级 铵 碱 的 E2 消 除(符合霍夫曼规则,动 力学控制的产物。 )
B:
H1
H2
CH3CH2-C3H-C2H-C1 H2
第 17 章 胺
罗氏化学 出品
17.1 胺的分类
本
17.2 胺的结构
章
17.3 胺的物理性质
提
胺的反应
纲
17.4 胺的成盐反应 四级铵盐的应用
17.5 四级铵碱和霍夫曼消除反应
17.6 胺的酰化、兴斯堡反应
17.7 胺的氧化和科普消除
17.8 胺与亚罗硝酸氏的化反学应出品17.9 重氮甲烷
本
胺的制备
17.4.1 胺的碱性 17.4.2 胺与酸的成盐反应 17.4.3 四级铵盐及其相转移催化作用
罗氏化学 出品
17.4 胺的成盐反应 四级铵盐的应用
17.4.1胺的碱性 (1)产生碱性的原因: N上的孤对电子
(2)判别碱性的方法: 碱的pKb;其共轭酸的pKa; 形成铵正离子的稳定性。
(3)影响碱性强弱的因素: 电子效应:3o胺 > 2o胺 > 1o胺 空间效应:1o胺 > 2o胺 > 3o胺 溶剂化效应:NH3 > 1o胺 > 2o胺 > 3o胺 罗氏化学 出品
100oC
碱
CH3CH2CH2CH2CH=CH2 Hofmann烯烃
L的变化规律 L
I
吸 电 子 能 力 增 强
离 去 能 力 减 弱
Br Cl F
Hofmann烯烃的含量
CH3O-/CH3OH
t-BuO-/t-BuOH
19.3
69.0
27.6
80.0
33.3
87.6
69.9
97.4
+NMe3
