克莱门森还原反应编辑
克莱森重排反应
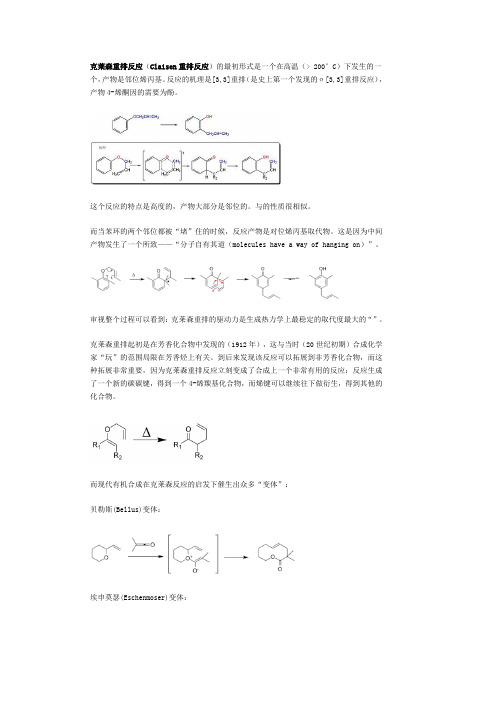
克莱森重排反应(Claisen重排反应)的最初形式是一个在高温(> 200°C)下发生的一个,产物是邻位烯丙基。
反应的机理是[3,3]重排(是史上第一个发现的σ[3,3]重排反应),产物4-烯酮因的需要为酚。
这个反应的特点是高度的,产物大部分是邻位的。
与的性质很相似。
而当苯环的两个邻位都被“堵”住的时候,反应产物是对位烯丙基取代物。
这是因为中间产物发生了一个所致——“分子自有其道(molecules have a way of hanging on)”。
审视整个过程可以看到:克莱森重排的驱动力是生成热力学上最稳定的取代度最大的“”。
克莱森重排起初是在芳香化合物中发现的(1912年),这与当时(20世纪初期)合成化学家“玩”的范围局限在芳香烃上有关。
到后来发现该反应可以拓展到非芳香化合物,而这种拓展非常重要,因为克莱森重排反应立刻变成了合成上一个非常有用的反应:反应生成了一个新的碳碳键,得到一个4-烯羰基化合物,而烯键可以继续往下做衍生,得到其他的化合物。
而现代有机合成在克莱森反应的启发下催生出众多“变体”:贝勒斯(Bellus)变体:埃申莫瑟(Eschenmoser)变体::强生(Johnson)变体:[]天然界的存在在植物代谢的中从到的转换步骤就是一个克莱森重排;该反应受的催化。
预苯酸是一个重要的前体化合物,生物体内含苯环的天然化合物有一大半是由预苯酸转换过来的。
嚬哪醇重排(:pinacol rearrangement)是一个在酸催化下脱水并发生取代基生成羰基化合物的反应。
这一类反应由于(2,3-二甲基-2,3-丁二醇)转换为(3,3-二甲基-2-丁酮)的反应最具代表性,因而得名。
反应的关键步骤是一个的1,2-。
[]反应机理1.两个其中之一接受一个之后脱去一分子水,形成;2.发生1,2-重排,一个基团从未脱去羟基的碳上向有正电荷的碳上转移;3.羟基上脱去一个质子,其氧原子与碳成双键,反应结束。
Claisen克莱森缩合反应

CO
COOC2H5
175℃
C6H5CHCOOC 2H5
COOC2H5
80%~85%
注:
? 用长链的脂肪酸酯和草酸酯反应,一般产 率很低,但如能将产出来的乙醇不断蒸出 ,可以得到产率较高的产物。
? 草酸酯缩合产物,经过处理可以得到α-羰 基酸。利用这个反应,可以合成生物化学 上重要的2-氧代戊二酸。
? 例如:乙酸乙酯和甲酸乙酯缩合的产物,会马 上再发生羟醛缩合作用,得到均苯三甲酸三乙 酯。
注:
? Claisen(克莱森)缩合反应是可逆的,因此 生成的β-二羰基化合物在催化量的碱与一 分子醇作用下,可发生Claisen(克莱森)酯 缩合反应的逆反应,分解为两分子酯。 小结:
?Claisen(克莱森)缩合反应,在合成上很重要,其逆合成在合成 上也是很有用的。
NaH CH3CH2COOC2H5
H
CH3 C6H5COCCOOC2H5
CH3 C6H5COCCOOC2H5
H
2.2 草酸酯与其它酯的反应
? 草酸酯由于一个酯基的诱导作用,增加了另一个羰 基的亲电作用,所以比较容易和其它的酯发生缩合 作用。
δ
O
C2H5OC δ+
O
O
COC 2H5
+
①C2H5ONa CH3CH2COC2H5 ②H+
CLAISEN(克莱森)缩合
定义:两分子酯在碱的作用下失去一 分子醇生成Β- 羰基酯的反应称为酯缩 合反应,也称为CLAISEN(克莱森)缩合 反应。
O R2C OR3
+H
RO CH COR1
O
base
R2C HOAc
O
CHCOR1 + R
第十章 还原反应

O + HNMe2 HO Br Ph COOEt NMe2
(1) P, Br2 Ph COOH (2) EtOH
(1) Zn, Et2O (2) O
Al(OPr-i)3
O
OH
CHO
Al(OPr-i)3
CH2OH
二、炔烃的还原
R'
Na,NH3
R R' R
Lindlar Pd
R
R'
三、羧酸酯的还原
Na,EtOH RCH2COOR' RCH2COOR' Na,C6H6
RCH2CH2OH RCH2CH OH
RH2C C O
四、硼氢化
CH3 H SO 2 4 OH
∆
O
CH3MgI 干醚
H2O H+
CH3
(1) B2H6 (2) H2O2 , OH-
CH3 H H OH (TM)
逆合成分析 (Retrosynthetic Analysis) )
实例分析12: 实例分析12:——烯烃的逆合成分析 12 烯烃的逆合成分析
CHO + Ph3P
•具体合成路线如下: 具体合成路线如下: 具体合成路线如下
O CH2CH2C Cl
CH
AlCl3
(CH3)2CHCOOC2H5 +
HOCH2CH2OH 无水AlCl3
COOC2H5
Ph3CNa
O
Cl
CH2Cl
1)NaCN 2)H2O/H+
clemmensen还原机理

Clemmensen还原机理引言Clemmensen还原机理是有机化学中的一个重要反应机理,由丹麦化学家Erik Christian Clemmensen于1913年首次发现并提出。
这个机理被广泛应用于将酮类化合物还原为相应的烷基化合物。
本文将详细探讨Clemmensen还原机理的原理、条件、反应过程以及应用。
一、Clemmensen还原机理的原理Clemmensen还原机理是一种强还原剂作用下的酮类还原反应。
该机理的核心在于还原剂(一般为锌汞合金)能够将酮类化合物中的羰基还原为烷基,生成烷基化合物。
Clemmensen还原机理的基本步骤如下:1.在酮类化合物的存在下,锌锐矾(Zn(Hg))与盐酸(HCl)反应,生成氯化锌(ZnCl2)和金属汞(Hg)。
这一步骤是整个反应的起始步骤。
2.氯化锌与金属汞反应,生成锌汞合金(Zn(Hg))。
这一步骤是形成还原剂的关键步骤。
3.锌汞合金与酮类化合物反应,发生还原。
锌汞合金中的锌离子(Zn2+)作为还原剂,将酮类化合物中的羰基(C=O)转化为烷基(C-C)。
这一步骤是Clemmensen还原机理的主要反应过程。
4.反应结束后,得到相应的烷基化合物,并生成氯化汞(HgCl2)。
氯化汞可以再次与氯化锌反应,生成锌汞合金,重新进行还原反应。
二、Clemmensen还原的条件Clemmensen还原需要一定的条件才能进行,主要包括以下几个方面:1.温度:Clemmensen还原反应需要在高温条件下进行,温度通常在催化剂的活性温度范围内。
一般来说,反应温度在200-300摄氏度之间。
2.催化剂:Clemmensen还原反应的催化剂主要是锌汞合金,在反应过程中起到了还原剂的作用。
锌汞合金具有良好的还原性能,可以将酮类化合物中的羰基还原为烷基。
3.反应物的选择:Clemmensen还原只适用于酮类化合物的还原,并不适用于其他类型化合物的还原。
因此,在选择反应物时需要注意。
经典合成反应操作--酮还原成亚甲基
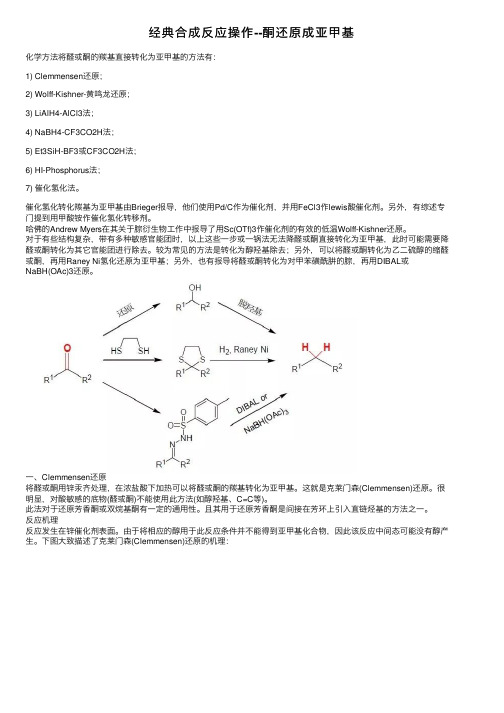
经典合成反应操作--酮还原成亚甲基化学⽅法将醛或酮的羰基直接转化为亚甲基的⽅法有:1) Clemmensen还原;2) Wolff-Kishner-黄鸣龙还原;3) LiAlH4-AlCl3法;4) NaBH4-CF3CO2H法;5) Et3SiH-BF3或CF3CO2H法;6) HI-Phosphorus法;7) 催化氢化法。
催化氢化转化羰基为亚甲基由Brieger报导,他们使⽤Pd/C作为催化剂,并⽤FeCl3作lewis酸催化剂。
另外,有综述专门提到⽤甲酸铵作催化氢化转移剂。
哈佛的Andrew Myers在其关于腙衍⽣物⼯作中报导了⽤Sc(OTf)3作催化剂的有效的低温Wolff-Kishner还原。
对于有些结构复杂,带有多种敏感官能团时,以上这些⼀步或⼀锅法⽆法降醛或酮直接转化为亚甲基,此时可能需要降醛或酮转化为其它官能团进⾏除去。
较为常见的⽅法是转化为醇羟基除去;另外,可以将醛或酮转化为⼄⼆硫醇的缩醛或酮,再⽤Raney Ni氢化还原为亚甲基;另外,也有报导将醛或酮转化为对甲苯磺酰肼的腙,再⽤DIBAL或NaBH(OAc)3还原。
⼀、Clemmensen还原将醛或酮⽤锌汞齐处理,在浓盐酸下加热可以将醛或酮的羰基转化为亚甲基。
这就是克莱门森(Clemmensen)还原。
很明显,对酸敏感的底物(醛或酮)不能使⽤此⽅法(如醇羟基、C=C等)。
此法对于还原芳⾹酮或双烷基酮有⼀定的通⽤性。
且其⽤于还原芳⾹酮是间接在芳环上引⼊直链烃基的⽅法之⼀。
反应机理反应发⽣在锌催化剂表⾯。
由于将相应的醇⽤于此反应条件并不能得到亚甲基化合物,因此该反应中间态可能没有醇产⽣。
下图⼤致描述了克莱门森(Clemmensen)还原的机理:实例1. Clemmensen还原芳基酮于1L的圆底烧瓶中,加⼊120克锌粉、12克氯化汞、200ml⽔,5-6ml浓盐酸,振摇后将液体倒出抛弃。
随后依次加⼊75ml⽔,175ml浓盐酸,100ml甲苯,50克(0.28mol) β-苯甲酰基丙酸。
clemmensen还原反应通式

Clemmensen 还原反应是一种有机化学中常用的反应,通常用于将羰基化合物还原成相应的烷基化合物。
该反应由丹麦化学家埃里克·克莱门森(Eric Christian Clemmensen)于1913年首次报道,因此被命名为Clemmensen 还原反应。
本文将对Clemmensen 还原反应的通式及其反应机理进行详细介绍。
一、Clemmensen 还原反应的通式Clemmensen 还原反应的通式如下:R-C=O + H2 + Zn(Hg) ——> R-CH2 + Zn(OH)2其中,R代表烷基基团,C=O代表羰基化合物,H2代表氢气,Zn(Hg)代表锌银粉。
该反应是通过锌银粉在酸性条件下与羰基化合物反应,发生加成、析氧和脱羧等步骤,最终将羰基化合物还原成相应的烷基化合物。
二、Clemmensen 还原反应的反应机理Clemmensen 还原反应的反应机理主要包括以下几个步骤:1. 锌银粉在酸性条件下与羰基化合物发生加成反应,生成一个亚甲基化合物。
该步骤是反应的关键步骤之一。
2. 生成的亚甲基化合物再与锌银粉和酸继续反应,发生析氧和脱羧等步骤,最终生成烷基化合物。
3. 在反应过程中,锌银粉起到催化剂的作用,加速了反应的进行。
通过上述机理步骤,Clemmensen 还原反应将羰基化合物还原成相应的烷基化合物,是一种重要的化学合成方法。
三、Clemmensen 还原反应的应用Clemmensen 还原反应在有机化学合成中有着广泛的应用。
由于这种反应对含有酮、醛等羰基化合物有较高的还原选择性,并且操作简单、条件温和,因此被广泛用于有机合成中。
Clemmensen 还原反应可以用于合成醇、醚等化合物,对于合成具有特定结构的有机化合物具有重要的应用价值。
在工业上,Clemmensen 还原反应也被用于生产某些有机化合物,如烷基醇的合成等。
由于其反应条件温和、产率高、操作简便等优点,使得Clemmensen 还原反应得到了广泛的应用和推广。
claisen重排应用实例

claisen重排应用实例
克莱森重排(Claisen rearrangement)是一种重要的有机化学反应,它可以将一个醇或酚转化为相应的酯。
这个反应在有机合成
中具有广泛的应用,下面给出一个典型的克莱森重排应用实例:
实例:合成乙酰乙酸异丙酯
步骤1:合成乙酰乙酸乙酯
首先,将乙醇和乙酸酐(酸酐是酸的酯化合物)加入反应瓶中,并加入一定量的碱催化剂,如氢氧化钠(NaOH)。
反应瓶通常使用
玻璃瓶,配有反应器和冷凝器。
乙醇 + 乙酸酐→ 乙酸乙酯 + 乙酸
此反应是一个酯化反应,通过酸催化生成酯。
反应进行时,反
应瓶中的温度应保持在适宜的范围内,通常在60-80摄氏度之间。
步骤2:克莱森重排反应
将合成的乙酸乙酯加入反应瓶中,并加入一定量的碱催化剂,
如氢氧化钠(NaOH)。
反应瓶中的温度应保持在适宜的范围内,通
常在100-150摄氏度之间。
乙酸乙酯→ 乙酸异丙酯
此反应是克莱森重排反应,通过碱催化使酯分子内部的酯基迁移,生成相应的酯。
步骤3:提取产物
反应结束后,将反应瓶中的产物进行提取。
通常使用有机溶剂,如乙醚或氯仿,将产物从反应混合物中分离出来。
步骤4:纯化产物
提取得到的产物可能还含有杂质,需要进行纯化。
可以使用色
谱层析等技术将产物纯化。
通过以上步骤,可以成功合成乙酰乙酸异丙酯。
这个反应实例
展示了克莱森重排的应用,通过酯化和重排反应,可以将乙醇和乙
酸酐转化为乙酰乙酸异丙酯。
clemmensen还原反应机理

clemmensen还原反应机理Clemmensen还原反应是一种有机化学反应,常用于将醛和酮还原为相应的烷烃化合物。
本文将介绍Clemmensen还原反应的机理及其应用。
Clemmensen还原反应的机理主要涉及两个步骤:酸催化的醛和酮的加成,以及氢化反应。
具体来说,首先是酸催化的加成步骤。
在反应中,醛或酮与锌金属在酸性条件下反应,生成相应的醇和锌盐。
这一步骤中,酸的存在起到了催化剂的作用,加速了反应的进行。
接下来是氢化反应步骤。
在这一步骤中,用氢气和酸性条件将醇中的羰基还原为甲基基团。
一般来说,反应中常使用浓热的盐酸作为酸催化剂,并在高温下进行。
氢气的存在使得醇中的羰基被还原为甲基,生成相应的烷烃化合物。
需要注意的是,Clemmensen还原反应只适用于没有活泼亲核试剂存在的情况下,否则可能发生副反应。
Clemmensen还原反应有着广泛的应用。
首先,它可以将醛和酮还原为相应的烷烃,从而合成出具有特定结构和功能的有机化合物。
例如,可以将醛和酮还原为醇,再通过醇的进一步反应合成出其他化合物。
此外,Clemmensen还原反应也可以用于有机合成中的保护基的去除。
通过这种反应,可以将醛和酮中的保护基去除,从而获得所需的目标产物。
Clemmensen还原反应具有一些优点。
首先,它是一种高效的反应,反应条件相对温和,反应时间短。
其次,该反应适用于多种不同类型的醛和酮。
此外,Clemmensen还原反应选择性好,不容易出现副反应。
然而,Clemmensen还原反应也存在一些限制。
首先,该反应只适用于没有活泼亲核试剂存在的情况下。
其次,反应中需要使用浓热的酸性条件,这可能会对一些化合物造成不可逆的破坏。
此外,Clemmensen还原反应生成的产物是烷烃,存在不饱和化合物无法还原的问题。
Clemmensen还原反应是一种常用的将醛和酮还原为烷烃的有机化学反应。
该反应的机理涉及酸催化的加成和氢化反应两个步骤。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
克莱门森还原反应编辑
本词条缺少概述、名片图,补充相关内容使词条更完整,还能快速升级,赶紧来编辑吧!
中文名
克莱门森还原反应
外文名
Clemmensen reduction reaction
性质
化学反应
生成物
亚甲基
克莱门森还原反应
克莱门森还原反应(Clemmensen 还原反应)是在盐酸溶液中,用锌汞齐将醛或酮中的羰基还原为亚甲基的反应。
此反应操作简便,收率很高,以及多数羰基化合物在反应的酸性条件下不会引起严重的副反应,因而应用广泛。
此法对于还原芳香酮效果较好,与傅氏酰基化反应相配合是合成烷基芳烃的重要方法。
为增加反应物在浓盐酸中的浓度,往往添加一些酒精或者醋酸;另外还加入一定量的与水不相容的惰性溶剂,如甲苯,使生成的还原产物及时地由反应体系转移到惰性溶剂中,以促进反应的进行。
主要用于酮的还原,用于醛的实例较少。
该反应必须在强酸性条件下进行。
对酸敏感的羰基化合物不可使用该方法还原,但可考虑采用黄鸣龙还原法。
α、β-不饱和醛酮还原时,碳碳双键一起被还原。
除α、β-不饱和键外,一般对碳碳双键无影响。
锌汞齐(Zn-Hg)用锌粒与汞盐在稀盐酸溶液中反应制得,锌可以把Hg2+还原成Hg,然后Hg与锌在锌的表面上形成锌汞齐。
反应是被活化了的锌的表面上进行的,这个反应的机理不是很简单的,现在还在研究。
珀金反应[编辑]
(重定向自Perkin反应)
RXNO:0000003
(这是什么?)
Perkin反应(珀金反应、浦尔金反应)
芳香醛与酸酐在碱性催化剂存在下,发生类似羟醛缩合反应得到β-芳基-α,β-不饱和羧酸。
通常使用与酸酐对应的羧酸盐作催化剂。
例如,苯甲醛与乙酸酐在乙酸钠催化下在170~180°C 沸腾加热5小时,得到肉桂酸。
反应由英国化学家威廉·珀金(William Perkin)发现。
[1][2]这个反应常用于合成肉桂酸及其同系物。
综述:[3][4][5]
目录
[隐藏]
∙ 1 反应机理
∙ 2 底物要求
o 2.1 羰基化合物
o 2.2 羧酸
∙ 3 参见
∙ 4 参考资料
反应机理[编辑]
羧酸盐的负离子作为质子接受体,与酸酐作用,产生羧酸,同时生成一个羧酸酐的α-负离子,该负离子与醛发生亲核加成产生烷氧负离子,然后向分子内的羰基进攻,关环,从另一侧开环,得到羧酸根负离子,与酸酐反应产生混酐,这个混酐发生E2消除,失去质子及酰氧基,产生一个不饱和的酸酐,它受亲核试剂进攻发生加成-消除,再经酸化,最后得到芳基不饱和羧酸,主要是反式羧酸。
[6]
注:Ac = 乙酰基 CH3C(O)- ,Ar = 芳基
底物要求[编辑]
羰基化合物[编辑]
Perkin 反应一般只局限于芳香醛类。
某些杂环醛,如呋喃甲醛[7]能发生反应产生呋喃丙烯酸,这个产物是医治血吸虫病药物呋喃丙胺的原料。
取代基对Perkin 反应的影响与取代基的类型和取代位置有关。
硝基和卤素等吸电子基团,无论在苯环任何位置都对反应有促进作用,但在邻位时作用大于间位,间位大于对位。
当甲氧基位于醛基对位时,对反应产率和速度都有不利的影响;但当甲氧基位于邻位时,稍对反应有利。
醛基的间位或对位有羟基的底物能取得较满意的结果。
邻位有羟基的水杨醛与乙酸酐在乙酸钠作用下,一步就得到香豆素,它是顺式香豆酸的内酯:
Perkin反应一般是产生含有反式双键的羧酸,产物中两个较大的基团处于反型。
上述反应也会产生少量的反式香豆酸(邻羟基肉桂酸),但反式香豆酸不能生成内酯。
也可得到反式的酚基氧-乙酰化衍生物。
芳香二醛,如邻苯二甲醛、间苯二甲醛、对苯二甲醛,均可发生Perkin 反应转变为相应的苯二丙烯酸。
脂肪族亦能进行Perkin 反应,但反应进行不顺利,产率极低。
[8]这是因为脂肪醛活性低和副产物的影响,而较高级的同系物从戊醛开始又增加了链长所引起的空间阻碍。
[9]
芳基烷基酮和二芳基酮只能同具有强活泼亚甲基的化合物如苯乙酸发生反应。
羧酸[编辑]
Perkin 反应实际上只局限于乙酸和一取代乙酸。
具有一直链烷基取代基的乙酸可得较满意的结果。
苯乙酸和其他芳基乙酸中具有活泼的亚甲基,因此很容易与芳醛发生Perkin 反应,产物是α-芳基肉桂酸。
丙二酸也可以在极温和的条件下发生反应。
