图像类离子浓度大小比较
第10讲 离子浓度大小比较的方法技巧

答案 D
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
课前诊断自测
课堂精准突破
6.(2017·课标全国Ⅱ,12)改变 0.1 mol·L-1 二元弱酸 H2A 溶液的 pH,溶液中的 H2A、 HA-、A2-的物质的量分数 δ(X)随 pH 的变化如图所示[已知 δ(X)= c(H2A)+c(c(HXA)-)+c(A2-)]。
室温下pH=7不一定是终点:强碱与强酸反应时,终点是pH=7;强碱与弱 酸(强酸与弱碱)反应时,终点不是pH=7(强碱与弱酸反应终点是pH>7,强 酸与弱碱反应终点是pH<7)
课前诊断自测
课堂精准突破
2.滴定曲线上的特殊点的分析 示例:常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图。
常温下,CaSO4在水中的沉淀溶解平衡曲 线[Ksp=9×10-6]
课前诊断自测
课堂精准突破
(2)直线型(pM-pR曲线) pM为阳离子浓度的负对数,pR为阴离子浓度的负对数
①直线 AB 上的点:c(M2+)=c(R2-); ②溶度积:CaSO4>CaCO3>MnCO3; ③X 点对 CaCO3 要析出沉淀,对 CaSO4 是 不饱和溶液,能继续溶解 CaSO4; ④Y 点:c(SO24-)>c(Ca2+),二者的浓度积 等遇 10-5;Z 点:c(CO23-)<c(Mn2+),二者的浓度积等与 10-10.6。
课前诊断自测
课堂精准突破
3.平衡常数的定量分析 (1)根据多元弱酸“共轭酸碱对”判断电离常数(Ka)与水解常数(Kh)大小
课前诊断自测
2024-2025学年高二化学选择性必修1(配苏教版)教学课件微专题3离子浓度大小比较图像

A.该滴定过程应该选择石蕊溶液作指
示剂
B.W点到X点发生的主要反应的离子
方程式为H2A+2OH- ══ A2-+2H2O
C.Y点对应的溶液中
c(Na+)+c(H+)=3c(A2-)
D.反应H2A+A2K=1.0×107.4
2HA-的平衡常数
解析 石蕊不能用作酸碱中和滴定的指示剂,A 项错误。X 点对应的溶液中溶
过量情况。
(2)滴定过程中的定量关系:①电荷守恒关系在任何时候均存在;②元素质
量守恒可以根据加入酸的物质的量和加入碱的物质的量进行确定,但不一
定为等量关系。
视角2多元弱酸的滴定曲线
3.298 K时,向20.0 mL 0.10 mol·L-1 H2A溶液中滴加0.10 mol·L-1 NaOH溶液,
错误。H2A
+
(H
)·
(HA
)
+
HA +H , Ka1= (H ) ,由于
2
c(HA-)=c(H2A),故 Ka1=c(H+)= 1.0×10-2.3;HA-
W 点对应的溶液中
2+
(H
)·
(A
)
2+
A +H ,Ka2= (HA-) ,由于
点对应的溶液中 c(HA-)=c(A2-),故 Ka2=c(H+)=1.0×10-9.7;H2A+A2平衡常数
应的离子方程式:
HC2O-4 +OHC2O24 +H2O
pH 由 11 到 14 发生反应
的离子方程式:
HPO2+OH
离子浓度大小比较
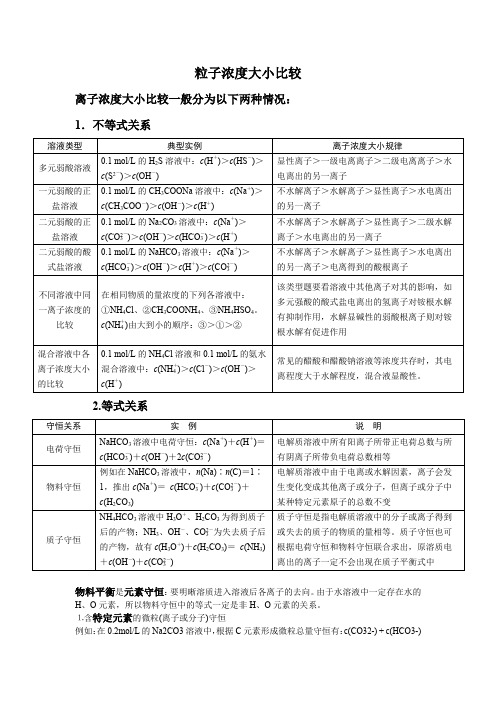
粒子浓度大小比较离子浓度大小比较一般分为以下两种情况:1.不等式关系2.等式关系物料平衡是元素守恒:要明晰溶质进入溶液后各离子的去向。
由于水溶液中一定存在水的H、O元素,所以物料守恒中的等式一定是非H、O元素的关系。
⒈含特定元素的微粒(离子或分子)守恒例如:在0.2mol/L的Na2CO3溶液中,根据C元素形成微粒总量守恒有:c(CO32-) + c(HCO3-)+ c(H2CO3) = 0.2mol/L。
⒉不同元素间形成的特定微粒比守恒例如:在Na2CO3 溶液中,根据Na与C形成微粒的关系有:c(Na+) = 2[c(CO32- ) + c(HCO3- ) + c(H2CO3 )]分析:上述Na2CO3 溶液中,C原子守恒,n(Na) : n(C)恒为2:13.混合溶液中弱电解质及其对应离子总量守恒例如:相同浓度的HAc溶液与NaAc溶液等体积混合后,混合溶液中有:2c(Na+ )=c(Ac-)+c(HAc)分析:上述混合溶液中,虽存在Ac-的水解和HAc的电离,但也仅是Ac-和HAc两种微粒间的转化,其总量不变。
质子守恒规律:水电离的特征是c(H)=c(OH-),只不过有些会水解的盐会导致氢离子、氢氧根可能会有不同的去向,我们需要把它们的去向全部找出来。
例如:NaHCO3溶液,初始H+ 来源于HCO3- 和H2O的电离,c初(H+) = c(CO32- ) + c(OH- );伴随着的水解的发生,一部分H+转化到H2CO3中,因此,c初(H+) = c现(H+) + c(H2CO3 ),从而得出,溶液中离子浓度的关系如下:c(CO32- ) + c(OH- ) = c(H+) +c(H2CO3 )对同一溶液来说:质子守恒=电荷守恒-物料平衡快速书写质子守恒的方法第一步:确定溶液的酸碱性,溶液显酸性,把氢离子浓度写在左边,反之则把氢氧根离子浓度写在左边。
第二步:根据溶液能电离出的离子和溶液中存在的离子,来补全等式右边。
水溶液中离子平衡的两类特殊图像

[答案] C
[例 2] (2017·全国卷Ⅰ)常温下,将 NaOH 溶液滴加到已
二酸(H2X)混合溶液的 pH 与离子浓度变化的关系如图所示。下
列叙述错误的是
()
A.Ka2(H2X)的数量级为 10-6 B.曲线 N 表示 pH 与 lgccHHX2X-的变化关系 C.NaHX 溶液中 c(H+)>c(OH-) D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-) =c(H+)
答案:C
2.常温时,Ca(OH)2 和 CaWO4(钨酸钙)的沉 淀溶解平衡曲线如图所示。下列分析不正
确的是
()
A.常温时 Ksp[Ca(OH)2]>Ksp(CaWO4) B.a 点:无 Ca(OH)2 沉淀,有 CaWO4
沉淀
C.加热饱和 Ca(OH)2 溶液有白色沉淀生成 D.常温时这两种饱和溶液中 c(Ca2+)相等
cHX- lg cH2X
生成物与反应 物离子浓度比
lgccHHX2X-越大,反应 向正反应方向进行
的常用对数
的程度越大
对数图像
V lgV0
稀释后与稀释 前体积比的常
lgVV0越大,稀释程度
用对数
越大
AG= cH+ lgcOH-
氢离子与氢氧 AG 越大,酸性越强,
根离子浓度比 中性时,ccOHH+-=1,
Ca(OH)2 溶液有白色沉淀生成,C 项正确;设饱和氢氧化钙溶液中钙离子 浓度为 x,则氢氧根离子浓度为 2x,x·(2x)2=1.0×10-7,解得 x≈2.9×10 -3mol·L-1,设饱和钨酸钙溶液中钙离子浓度为 y,钨酸根离子浓度也为 y, 则 y2=1.0×10-10,y=1.0×10-5mol·L-1,x>y,D 项不正确。
高考化学复习:溶液中粒子浓度变化图像分析

返回
分布系数曲线
返回
要点梳理
1.透析分布曲线,锁定思维方向
一元弱酸 (以CH3COOH为例)
二元酸(以草酸H2C2O4为例)
δ0
为
CH3COOH
分
布
系
数
,
δ1
为
δ0为H2C2O4分布系数、δ1为HC2O
-
4
分布系
CH3COO-分布系数
数、δ2为C2O 24-分布系数
随着pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。根据
例1 室温下,将1.00 mol/L盐酸滴入20.00 mL 1.00 mol/L的氨水中,溶液pH和 温度随加入盐酸体积的变化曲线如图所示。 下列有关说法中不正确的是 A. a点溶液中离子浓度大小关系:c(NH+4 )>c(Cl-)>c(OH-)>c(H+) B.b点溶液中离子浓度大小关系:c(NH+4 )=c(Cl-)>c(H+)=c(OH-) C.c点溶液中离子浓度大小关系:c(NH+4 )+c(H+)=c(Cl-)+c(OH-)
(3)想原理:涉及电离平衡常数,写出平衡常数表达式,在识图像、想原理的
基础上,将图像与原理结合起来思考。
(4)用公式:运用对数计算公式分析。
返回
核心突破
例3 常温下,向二元弱酸H2Y溶液中滴加NaOH溶液,所得混合溶液的pH与离 子浓度变化的关系如图所示:
回答下列问题:
(1)向二元弱酸H2Y中滴加NaOH溶液, 依次反应的离子方程式为__H__2Y__+__O_H__-_=_=_=_H__2O__+__H_Y__-_、__H__Y_-_+__O__H_-__=_=_=___
分布系数可以书写一定pH时所发生反应的离子方程式
离子浓度大小比较综合图像归纳

离子图像综合讲解1.PH-氢氧化钠体积2.POH-氢氧化钠体积3.溶液导电性- 氢氧化钠体积4.由水电离出来的氢离子浓度- 氢氧化钠体积5.溶液的温度- 氢氧化钠体积6.醋酸根/醋酸- 氢离子浓度7.溶液中醋酸分子醋酸根离子随PH值的变化曲线某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )A.M点所示溶液导电能力强于Q点B.N点所示溶液中c(CH3COO-)﹥c(Na+)C.M点和N点所示溶液中水的电离程度相同D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积二元弱酸1.常温下,用0.10mol/LKOH溶液滴定10.00mL0.10mol/LH2C2O4(二元弱酸)溶液所得的滴定曲线如下图(混合溶液的体积可看成混合前溶液的体积之和)所示。
下列说法正确的是A点①所示溶液中:c(H+)/c(OH-)=1012B点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)C点③所示溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-)D点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10mol/L2.20℃,二元弱酸H2C2O4的Ka1=5×10﹣2,Ka2=5×10﹣5.该温度下配制一组c(H2C2O4)+c(HC2O4)+c(C2O4)=0.100mol•L﹣1的H2C2O4和NaOH混合液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。
下列指定溶液中微粒的物质的量浓度关系不正确的是()A.c(Na+)=0.100mol•L﹣1的溶液中:c(H+)+c(H2C2O4)=c(OH﹣)+c(C2O42﹣)B.pH=2.5的溶液中:c(H2C2O4)+c(C2O42﹣)>c(HC2O4﹣)C.a点的值为5﹣lg5D.pH=7的溶液中:c(Na+)>2c(C2O42﹣)3.常温下,向20mL 0.2mol•L﹣1 H2A溶液中滴加0.2mol•L﹣1 NaOH溶液,有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是()A.在P点时,c(H2A)+c(HA﹣)+c(A2﹣)+c(OH﹣)=c(Na+)+c(H+)B.当V(NaOH)=20mL时,c(OH﹣)=c(H+)+c(HA﹣)+2c(H2A)C.当V(NaOH)=30mL时,3c(Na+)=2[c(HA﹣)+c(A2﹣)+c(H2A)]D.当V(NaOH)=40mL时,c(Na+)>c(A2﹣)>c(HA﹣)>c(H2A)>c(OH﹣)>c (H+)4.室温下,向H2C2O4溶液中滴加NaOH溶液,若pc=﹣lg c,则所得溶液中pc(H2C2O4)、pc(HC2O4﹣)、pc(C2O42﹣)与溶液pH的关系如右图所示。
高二化学酸碱中和图像分析、盐类水解、离子浓度大小比较练习题(附答案)

高二化学酸碱中和图像分析、盐类水解、离子浓度大小比较练习题一、单选题1.常温下,用0.10mol·L-1的NaOH溶液滴定20.00mL浓度为0.10mol·L-1的HX溶液所得滴定曲线如下图(忽略溶液体积变化)。
下列说法正确的是( )A.常温下K(HX)≈1×10-12B.a点所示的溶液中:c(Na+)>c(X-)>c(OH-)=c(H+)C.c点所示的溶液中:c(Na+)+c(HX)+c(X-)=0.10mol·L-1D.相同条件下,X-的水解能力弱于HX的电离能力2.在t ℃时AgBr在水中的沉淀溶解平衡曲线如图所示。
已知t ℃时AgCl的K sp=4×10-10,下列说法正确的是( )A.加入NaBr固体,AgBr的溶解度减小,K sp也减小B.在AgBr饱和溶液中加入固体NaBr,可使溶液中c点变到b点C.图中a点对应的是有AgBr沉淀生成D.在t ℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)的平衡常数K≈8163.25℃时,用0.100mol·L-1盐酸滴定25.00mL0.100mol·L-1氨水的滴定曲线如图所示。
下列说法正确的是()A.可用酚酞作指示剂B.25℃时,NH3·H2O的1gK b=-4.8C.0.100ml·L -1氨水用水稀释时,()()()+4+32c NH c H c NH O H ⋅⋅ 不断减小D.当滴入的盐酸为12.50mL 时溶液中:c (Cl -)>c (NH 3·H 2O )>c (+4NH )4.室温下,取20mL 0.1 -1mol L ⋅某二元酸2H A ,滴加0.2 -1mol L ⋅ NaOH 溶液。
已知:+--+2-2H A=H HA HA H A +,+。
下列说法不正确...的是( ) A .0.1 -1mol L ⋅2H A 溶液中有()()()+-2-c H c OH c A --=0.1 -1mol L ⋅B .当滴加至中性时,溶液中()()()+-2-c Na c HA 2c A =+,用去NaOH 溶液的体积小于10 mL C .当用去NaOH 溶液体积10mL 时,溶液的pH 7<,此时溶液中有()()()2-+-c A c H c OH =- D .当用去NaOH 溶液体积20mL 时,此时溶液中有()()()+-2-c Na 2c HA 2c A =+ 5.已知0.1mol·L -1的二元酸H 2A 溶液的pH=4,则下列说法中正确的是( ) A.在Na 2A 、NaHA 两溶液中,离子种类相同B.在溶质物质的量相等的Na 2A 、NaHA 两溶液中,阴离子总数相等C.在NaHA 溶液中一定有:c(Na +)+c(H +)=c(HA -)+c(OH -)+2c(A 2-)+c(H 2A)D.在Na 2A 溶液中一定有:c(Na +)>c(A 2-)>c(H +)>c(OH -)6.常温下,用0.1000 mol/L NaOH 溶液滴定20.00 mL 0.1000 mol/L HCOOH 溶液,滴 定 曲 线 如 图。
溶液中的离子浓度大小比较、图像问题专项练习题(附答案)

溶液中的离子浓度大小比较、图像问题专项练习题一、单选题1.室温条件下,用0.100 mol/L-1的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L-1,滴定曲线如图所示。
下列叙述正确的是( )A.电离常数K a(HX)的数量级为10-12B.HX的电离程度大于X-的水解程度C.pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)D.P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)2.氢氧熔融碳酸盐燃料电池是一种高温电池(600~700 ℃),具有效率高、噪音低、无污染、燃料多样、余热利用价值高等优点。
氢氧熔融碳酸盐燃料电池的工作原理如图所示。
下列有关该电池的说法正确的是( )A.电池工作时,熔融碳酸盐只起到导电的作用B. 该电池可利用工厂中排出的CO2,减少温室气体的排放CO =CO2+H2OC. 负极反应式为H2-2e-+23D.电池工作时,外电路中流过0.2 mol电子,消耗3.2 g O23.常温下,用0.10mol·L-1的NaOH溶液滴定20.00mL浓度为0.10mol·L-1的HX溶液所得滴定曲线如下图(忽略溶液体积变化)。
下列说法正确的是( )A.常温下K (HX)≈1×10-12B.a 点所示的溶液中:c(Na +)>c (X -)>c (OH -)=c (H +)C.c 点所示的溶液中:c (Na +)+c (HX)+c (X -)=0.10mol·L -1D.相同条件下,X -的水解能力弱于HX 的电离能力4.在t ℃时AgBr 在水中的沉淀溶解平衡曲线如图所示。
已知t ℃时AgCl 的K sp =4×10-10,下列说法正确的是( )A .加入NaBr 固体,AgBr 的溶解度减小,K sp 也减小B .在AgBr 饱和溶液中加入固体NaBr ,可使溶液中c 点变到b 点C .图中a 点对应的是有AgBr 沉淀生成D .在t ℃时,AgCl(s)+Br -(aq)AgBr(s)+Cl -(aq)的平衡常数K≈8165.25℃时,在20mL 0.1mol·L -1一元弱酸HA 溶液中滴加0.1mol ·L -1NaOH 溶液,溶液中(A )lg (HA)c c -与pH 关系如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
图像类离子浓度大小比较一、选择题1.常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入LNaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。
下列说法错误的是A.图中曲线①表示NaOH溶液滴定盐酸时的pH变化B.酸溶液的体积均为10 mLC.a点:c(CH3COOH)>c(CH3COO-)D.a点:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)2.室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。
下列有关说法正确的是A.a点由水电离出的c(H+)=1.0×10-14mol/LB.b点时c(NH4+)+c(NH3·H2O)=c(Cl-)C.c点时消耗的盐酸体积:V(HCl)<20.00mLD.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热3.用·L-1的NaOH溶液滴定·L-1的H2C2O4(草酸)溶液的滴定曲线如图所示。
下列说法不正确的是()A.草酸是弱酸B.X点:c(H2C2O4)+c(HC2O4-)=c(Na+)-c(C2O42-)C.Y点:c(H2C2O4)+c(HC2O4-)=c(OH-)-c(H+)D.滴定过程中始终存在:c(OH-)+2c(C2O42-)+ c(HC2O4-)= c(Na+)+ c(H+)4.常温下,相同pH的氢氧化钠和醋酸钠溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如下图所示,则下列叙述正确的是A.b、c两点溶液的导电能力相同B.a、b、c三点溶液中水的电离程度a>c>bC.c点溶液中c(H+)=c(OH-)+c(CH3COOH)D.用等浓度的盐酸分别与等体积的b,c处溶液恰好完全反应,消耗盐酸体积V b=V c 5.常温下,向20 mL某浓度的盐酸中逐滴加入 mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示。
下列叙述正确的是A.盐酸的物质的量浓度为l mol/LB.在①、②之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)C.在点②所示溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+),且V<20D.在点③所示溶液中:由水电离出的c(OH-)>l0-7mol/L6.亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白。
亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。
经测定,25℃时各组分含量随pH变化情况如图所示(Cl -没有画出)。
则下列分析不正确的是()A.亚氯酸钠在碱性条件下较稳定B.25℃时,HClO2的电离平衡常数的数值K a=10-6C.使用该漂白剂的最佳pH为3D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)7.常温下,用•L-1HCl溶液滴定浓度为•L-1Na2CO3溶液,所得滴定曲线如图所示。
下列微粒浓度大小关系正确的是A .当V=0时:c(H +)+c(HCO 3-)+c(H 2CO 3)=c(OH -)B .当V=5时:c(CO 32-)+c(HCO 3-)+c(H 2CO 3)=2c(Cl -)C .当V=10时:c(Na +)>c(HCO 3-)>c(CO 32-)>c(H 2CO 3)D .当V=a 时:c(Na +)=c(Cl -)>c(H +)=c(OH -)8.H 2C 2O 4水溶液中H 2C 2O 4、HC 2O 4-和 C 2O 42-三种形态的粒子的分布分数δ随溶液pH 变化的关系如图所示[已知Ksp(CaC 2O 4)=×10-9].下列说法正确的是( )A .曲线①代表的粒子是HC 2O 4-B . mol •L -1 NaHC 2O 4溶液中:c(C 2O 42-)>c(H 2C 2O 4)C .pH=5时,溶液中主要含碳物种浓度大小关系为:c(C 2O 42-)>c(H 2C 2O 4)>c(HC 2O 4-)D .一定温度下,往CaC 2O 4饱和溶液中加入少量CaCl 2固体,c(C 2O 42-)将减小,c(Ca2+)不变9.室温下,将•L ﹣1盐酸滴入 •L ﹣1氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是:A .a 点由水电离出的c (H +)=×10﹣14mol •L ﹣1B .b 点:c (NH 4+)+c (NH 3•H 2O )=c (Cl ﹣)C .c 点:c (Cl ﹣)=c (NH 4+)D .d 点后,溶液温度略下降的主要原因是NH 3•H 2O 电离吸热 10.298 K 时,在 mL mol 1L -⋅氨水中滴入 mol 1L -⋅的盐酸,溶液的pH 与所加盐酸的体积关系如图所示。
已知 mol 1L -⋅氨水的电离度为%,下列有关叙述正确的是A .该滴定过程应该选择酚酞作为指示剂B .M 点对应的盐酸体积为 mLC .M 点处的溶液中c(NH 4+)=c(Cl -)=c(H +)=c(OH -)D .N 点处的溶液中pH <1211.常温下,将CO 2通入2LpH=12的KOH 溶液中,溶液中水电离的OH -离子浓度(φ)与通入的CO 2的体积(V)的关系如下图所示。
下列叙述不正确的是A .a 点溶液中:水电离出的c(H +)=1×10-12mol/LB .b 点溶液中:c(H +)=1×10-7mol/LC .c 点溶液中:c(K +)=2[c(CO 32-)+c(HCO 3-)+c(H 2CO 3)]D .d 点溶液中:c(K +)=2c(CO 32-)+c(HCO 3-)12.298K 时,在氨水中滴入•L -1的盐酸,溶液的pH 与所加盐酸的体积关系如图所示。
已知•L -1氨水的电离度为%,下列有关叙述正确的是( )A .该滴定过程应该选择酚酞作为指示剂B .M 点对应的盐酸体积为C .M 点处的溶液中c(NH 4+)=c(Cl -)=c(H +)=c(OH -)D .N 点处的溶液中pH <1213.40℃时,在氨-水体系中不断通入CO 2,各种离子的变化趋势如图所示.下列说法不正确的是( )A .在pH=时,c(NH 4+)>c(HCO 3-)>c(NH 2COO -)>c(CO 32-)B .不同pH 的溶液中存在关系:c(NH 4+)+c(H +)=2c(CO 32-)+c(HCO 3-)+c(NH 2COO -)+c(OH -)C .随着CO 2的通入,32())•(c OH c NH H O 不断增大 D .在溶液pH 不断降低的过程中,有含NH 2COO -的中间产物生成14.体积为1ml 、浓度均为0.10mol/L 的XOH 和X 2CO 3溶液分别加水稀释至体积为V ,pH 随lgV 的变化情况如图所示,下列叙述中正确的是( )A.XOH是弱碱B.pH=10的两种溶液中的c(X+):XOH大于X2CO3C.已知H2CO3的电离平衡常数K a1远远大于K a2,则K a2约为1.0×10-10.2D.当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小15.25℃下,向LH2A溶液中滴加LNaOH 溶液,有关粒子物质的量的变化如图所示。
下列有关说法正确的是( )A.H2A 电离方程式 H2A=2H++A2-B.V[NaOH(aq)]=20mL 时,溶液显碱性C.已知25℃时 K2(H2A)=× ,则V[NaOH(aq)]=VmL 时,pH=D.V[NaOH(aq)]=20mL时,溶液中存在关系:(HA-)+C(A2-)+C(H2A)=L16.电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。
右图是某同学用•L-1KOH溶液分别滴定体积均为20mL、浓度均为•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是A.曲线①代表 mol•L-1 KOH溶液滴定CH3COOH溶液的滴定曲线B.在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═ mol•L-1C.在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)D.在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+)17.常温下,用•L-1HCl溶液滴定浓度为•L-1Na2CO3溶液,所得滴定曲线如图所示。
下列微粒浓度大小关系正确的是A.当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)B.当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)C.当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)D.当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)18.在常温下,0 mol·L-1 Na2CO3溶液25 mL用0 mol·L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是()A.a点:c(CO32-)=c(HCO3-)>c(OH-)B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)D.d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-)19.向I.的NH4HCO3溶液中逐渐加入LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数)。
根据图象,下列说法不正确的是()A.开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2OB.当pH大于以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应C.pH=时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-)D.滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO320.常温下,向10ml mol·L-1的HR溶液中逐滴滴入·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。
下列分析不正确的是A.a~b点导电能力增强,说明HR为弱酸B.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)C.b点溶液pH=5,此时酸碱恰好中和D.b~c任意点溶液均有c(H+)·c(OH-)=K w=×10-1421.常温下,用•L-1NaOH溶液分别滴定浓度均为•L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。
