最新反应工程第二篇课件-(天大)ppt课件
化学反应工程课件—第二章1(反应速率)

意
算结果均是如此),对于复杂反应Φ ≠ x
¾ 收率也有单程和全程之分(循环物料系统)
¾ 无论是收率还是选择性,还有其它的定义(结果不
一样,但说明同样的问题)
¾ 转化率x只能说明总的结果, Φ 说明在转化的反
应物中生成目的产物的比例。
选择性S
S
=
生成产物P的量 生成产物S的量
得率
Xp
=
生成产物P的量 反应物的起始量
式中:n0,n分别为物
系的起始总摩尔数和反
δK
= n − n0 nK 0 − nK
= n − n0 nK 0 xK
= (n − n0 ) n0 yK 0 xK
n = n0(1+δK yK0xK )
yK
=
nK n
=
yK 0
n0 n
(1 −
xK
)
应后的总摩尔数; nK0 、nK为某反应物(关 键组分)的起始摩尔数
则反应的选择性为: S = 1.504 = 75.24% 1.999
S = Y = 10.3 = 75.24% x 13.33
由此可见,乙烯转化率和环氧乙烷收率都很低,实 际生产中是将反应器出来的气体用水吸收以除去环 氧乙烷,用碱吸收除去二氧化碳,余下的气体用循 环压缩机压缩后与新鲜乙烯和氧相混合,送入反应 器中继续反应,这样便构成了一个循环反应过程。
100 − x / 2
100 − x / 2
解得: x = 1.504mol
y = 0.989mol
乙烯的转化量为 :1.504 + 0.989 / 2 = 1.999mol
2009-5-3
23
所以,乙烯的转化率为: 1.999 /15 = 13.33%
反应工程第二章2四川大学化学反应工程.ppt

• 反应物能同时分别进行两个或 两个以上的反应
CH3CH=CH2 + O2 = CH3CH-CH2 O
•
矿物冶金中,常用酸浸取矿物, 但矿物总是有很多伴生杂质。
CH3CH=CH2 + O2 = CH3CO-CH3 CH3CH=CH2 + O2 = CH3CH2-
CHO
•
硫酸浸取磷矿,磷矿中的钙、 镁杂质也与硫酸同时发生反应,
1 ln
1 xA
CA C A0
1
xA
exp[(k1
k2)t]
• 对副产物S亦有:
CS
CS0
s a2
k2 k1 k2
(C A0
CA)
S rP
p a1
k1CA
p
k1
rA (k1 k2 )CA a1 k1 k2
YP
CP CP0 CA0
p a1
k1 k1 k2
xA
主、副反应反应级数相 同时,其CA~t 的变化 规律与一 级不可逆反 应一致;反应收率和选 择性与组分的浓度无关 仅是T的函数。
E 100
E1
K 2 e R 11001000 e R 11000
K1 K2
➢ AP, AS
rA
dCA dT
rA,1 rA,2
k1CA
k2CA
rP
dCP dT
k1CA
rS
dCS dT
k2CA
1.主、副反应的反应级数相同的不可逆平行反应
例: a1A k1 pP (主反应) (1) a2A k2 sS (副反应) (2)
• 为简化讨论,假定主,副反应均为一级不可逆反应,其 速率方程分别为:
α>β时:
最新反应工程第二篇课件-(天大)课件ppt

2.5 反应速率方程的变换与积分
反应过程中经常伴随着反应体积的变化, 对此体系浓度的变化对反应速率的影响如何处理?
2.5 反应速率方程的变换与积分
2.5 反应速率方程的变换与积分
2.7 多相催化反应动力学
反应速率由R脱附净速率决定 其他各步达到平衡 活性位分率归一性
k(pApBpR/KP)
1KApAKBP BKRKPpApB
2.7 多相催化反应动力学
2.7 多相催化反应动力学
2.7 多相催化反应动力学
2.8 动力学参数的确定
吸附平衡常数(吸附热和指前因子) 反应速率常数(活化能和指前因子) 反应因子
解:
2.2 反应速率方程
理想气体
例题2.1
图解法
2.2 反应速率方程
温度
影
浓度
响 因 素
压力
溶剂 固定 速率方程或动力学方程
催化剂
定量描述反应速率和温度 及浓度的关系式
反应速率方程的确定方法
1 基元反应
质量作用定律
vA AvB BvR R
rA k cAAcBB
2 非基元反应
反应速率方程的确定方法
例如对于反应
反应速率方程的确定方法
机理1:
机理2:
机理
速率方程
? 机理
速率方程
机理未明反应 反应速率方程的确定方法
3、反应机理未知 幂函数形速率方程
可逆反应
正逆反应速率常数及反应级数之间的关系?
机理未明可逆反应 反应速率方程的确定方法
对于反应
反应工程_天大_李绍芬
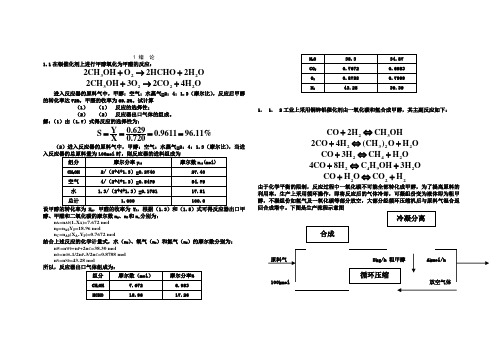
1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进A P 醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P=18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol1. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图Bkg/h 粗甲醇原料气和冷凝分离后的气体组成如下:(mol)组分原料气冷凝分离后的气体CO 26.82 15.49H268.25 69.78CO2 1.46 0.82CH40.55 3.62N2 2.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
化工原理完整(天大版)PPT课件

Principles of Chemical Engineering
使用教材: 姚玉英主编,化工原理,天津大学出版社,1999 参考教材: 陈敏恒主编,化工原理,化学工业出版社,2002 蒋维钧主编,化工原理,清华大学出版社,1993
可编辑课件
版权所有,未经授权禁止复制或建立镜像。谢谢!
返回 1 2021/4/25
0 绪论 1 流体流动
5 蒸馏 6 吸收
2 流体输送机械
3 非均相物系的分 离和固体流态化
4 传热
7 蒸馏和吸收塔设备 8 液-液萃取 9 干燥
可编辑课件
返回 2 2021/4/25
0 绪论
0.1 化工生产与单元操作 0.2 单位制与单位换算 0.3 物料衡算与能量衡算
可编辑课件
返回 3 2021/4/25
解:首先根据题意画出过程的物料流程图
可编辑课件
返回 16 2021/4/25
F=1000 20%
W, 0.0%
蒸发器 422K
S 50%
冷却结晶器 311K
R, 37.5%
P 1-0.04
解题思路:题求三个量,如何列物料衡算式。
首先考虑划定适宜的物衡范围以利于解题。
1.求KNO3结晶产品量P
按虚线框作为物料衡算范围,只涉及两个未知量。
0 绪论
0.1 化工原理课程的性质和基本内容 1. 化工生产过程
原料预处理
物理过程 单元操作
化学反应
化学反应过程 反应器
产物后处理
物理过程 单元操作
可编辑课件
返回 4 2021/4/25
可编辑课件
返回 5 2021/4/25
可编辑课件
返回 6 2021/4/25
化学反应工程第二章精品文档22页

第二章气-固相催化反应宏观动力学概述在化工生产中,有许多重要的反应都是气-固相催化反应。
从上述反应可以得出气-固相催化反应的特点。
1.反应特点1)反应物和产物均为气体;2)使用固体催化剂,具有惊人的内表面;3)反应区在催化剂颗粒内表面。
2.反应步骤反应区在颗粒内部,整个反应过程是由物理过程和化学反应过程组成的,反应分5步进行。
1)反应物从气相主体扩散到颗粒外表面——外扩散;2)反应物从颗粒外表面扩散进入颗粒内部的微孔道——内扩散;3)反应物在孔道的内表面进行化学反应,反应分三步串联而成:反应物在活性位上被吸附;活性吸附态组分进行化学反应;吸附态产物的脱附4)反应产物从内表面上扩散到颗粒外表面;5)反应产物从颗粒外表面扩散到气相主体。
第1、5步称为外扩散过程,第2、4步称为内扩散过程,第3步称为本征动力学过程。
在颗粒内表面上发生的内扩散和本征动力学是同时进行的,相互交织在一起,因此称为扩散-反应过程。
3.宏观动力学气-固相催化反应速率,是反应物和反应产物在气相主体、固体颗粒外表面和内表面上进行物理过程和化学过程速率的“总和”,称之为总体速率。
气-固相催化反应动力学包含了物理过程和化学反应过程,称之为宏观动力学,其速率称为总体速率。
4.本章主要内容讨论气-固相催化反应宏观动力学的基本理论,主要内容有以下几方面。
1)催化剂颗粒内气体的扩散;2)催化剂颗粒内扩散-反应过程的关联方法——内扩散有效因子;3)宏观动力学方程,或称之为总体速率方程的建立。
第一节气-固相催化反应的宏观过程2-1 气-固相催化反应过程中反应组分的浓度分布设某反应的关键组分为A;催化剂为球形,关径R p;颗粒内活性组分均匀分布;颗粒外表面有滞流边界层;A在气相主体、颗粒外表面、内表面的浓度分别为C Ag 、C As、C Ac;平衡浓度为C A*。
1.外扩散过程扩散推动力:C Ag -C As C A 是直线分布 2. 扩散-反应过程C A 为内扩散过程和反应过程的表观浓度,是一条曲线。
天津大学反应工程课件1 (2)

(NO)2+O2→ 2NO2 )
NO3 + NO → 2NO2
r = kc NO2 cO2
虽然机理不同,导出的动力学方程相同,且与质量作用定律形式相同。 虽然机理不同,导出的动力学方程相同,且与质量作用定律形式相同。 说明动力学实验数据与速率方程相符合,仅是证明机理正确的必要条件, 说明动力学实验数据与速率方程相符合,仅是证明机理正确的必要条件, 而不是充分条件。机理判断需证明中间化合物的存在。 而不是充分条件。机理判断需证明中间化合物的存在。
第二章 反应动力学基础
本章内容
化学反应速率 反应速率方程 温度对反应速率的影响 复合反应 反应速率方程的变换与积分 多相催化与吸附 多相催化反应动力学 建立速率方程的步骤
2.1 化学反应速率
1. 定义: 定义:
单位时间、单位体积反应物系中某一反应组分的反应量。 单位时间、单位体积反应物系中某一反应组分的反应量。
→ → →
g(X A ) = ←← ← E A exp(− E/ RTop ) f ( X A )
Te为反应体系中 ← 实际组成对应的 RTe E 1 + ← → ℓn → 平衡温度, 平衡温度,为转 E− E E 化率XA的函数 的函数, 化率 的函数, 因此, 因此, Top是XA的 函数。 函数。 因此,存在一个最佳反应温度,此温度下的反应速率最大。 因此,存在一个最佳反应温度,此温度下的反应速率最大。
2.3 温度对反应速率的影响
k = A exp( − E / RT )
CA (mol/d m3)
-rA (mol/dm3 *s)
Reaction Order zero 1st 2nd
Rate Law -rA = k -rA = kCA -rA = kCA2
化工原理完整(天大版)PPT课件

.
返回 16 2020/5/23
F=1000 20%
W, 0.0%
蒸发器 422K
S 50%
冷却结晶器 311K
R, 37.5%
P 1-0.04
解题思路:题求三个量,如何列物料衡算式。
首先考虑划定适宜的物衡范围以利于解题。
1.求KNO3结晶产品量P
按虚线框作为物料衡算范围,只涉及两个未知量。
GI=GO+GA .
返回 17 2020/5/23
KNO3 组分的物料衡算: F20% = W 0% + P (100 - 4) % 1000 20% = 0 + P 96 % 则:P = 208.3 kg/h
2.水分蒸发量W (物衡范围同1.) 总物料衡算式: F = W + P 则:W = F-P = 1000-208.3 = 791.7 kg/h
.
返回 12 2020/5/23
0.3 物料衡算与能量衡算
☆ 稳定操作
以单位时间为基准, 如 : h , min , s 。 参数=f(x,y,z)
非稳定操作
以每批生产周期所用 的时间为基准。参数 =f(x,y,z,)
=0
=
uA恒定
.
uB 返回 13
2020/5/23
dy
dz
三维
微分衡算(非稳态)
.
返回 15 2020/5/23
例1(清华版,P6):稳态时的总物料衡算及组分物料衡算
生产KNO3的过程中,质量分率为0.2的KNO3水溶液, 以 F = 1000 kg/h 的流量送入蒸发器,在422K下蒸发 出部分水得到50%的浓KNO3溶液。然后送入冷却结晶器, 在311K下结晶,得到含水0.04 的KNO3结晶和含KNO3 0.375的饱和溶液。前者作为产品取出, 后者循环回到 蒸发器。过程为稳定操作,试计算KNO3结晶产品量P、 水分蒸发量W和循环的饱和溶液量R。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.2 反应速率方程
理想气体
例题2.1
图解法
2.2 反应速率方程
温度
影
浓度
响 因 素
压力
溶剂 固定 速率方程或动力学方程
催化剂
定量描述反应速率和温度 及浓度的关系式
反应速率方程的确定方法
1 基元反应
质量作用定律
vA AvB BvR R
rA k cAAcBB
2 非基元反应
反应速率方程的确定方法
例如对于反应
反应速率方程的确定方法
机理1:
机理2:
机理
速率方程
? 机理
速率方程
机理未明反应 反应速率方程的确定方法
3、反应机理未知 幂函数形速率方程
可逆反应
正逆反应速率常数及反应级数之间的关系?
机理未明可逆反应 反应速率方程的确定方法
对于反应
机理未明反应 反应速率方程的确定方法
根据热力学分析,反应达到平衡时:
2.7 多相催化反应动力学
反应速率由R脱附净速率决定 其他各步达到平衡 活性位分率归一性
k(pApBpR/KP)
1KApAKBP BKRKPpApB
2.7 多相催化反应动力学
2.7 多相催化反应动力学
2.7 多相催化反应动力学
2.8 动力学参数的确定
吸附平衡常数(吸附热和指前因子) 反应速率常数(活化能和指前因子) 反应因子
2.5 反应速率方程的变换与积分
2.5 反应速率方程的变换与积分
*根据上述两式就可以对方程进行积分,得出转化率随时间的变化
普遍化的浓度、分压、摩尔分率表达式(变容系统)
2.5 反应速率方程的变换与积分
例如:针对气相反应
A+B=P
1/11
2.5 反应速率方程的变换与积分
例题2.5
rBf(XB)
气相反应 理想气体
正逆反应活化能的关系
等压反应Van’t Hoff 方程
可逆反应
Relationship?
正逆反应活化能的关系
温度对可逆反应速率的影响
可逆反应
温度对可逆反应速温度低 最佳温度 温度高
可逆放热反应的最佳反应温度
=0
反应达到平衡时
可逆放热反应的最佳反应温度
可逆放热反应的最佳反应温度确定实例
求可逆放热反应
在不同反应条件下 的最佳反应温度
已知:
可逆放热反应的最佳反应温度确定实例
解: (1) 混合气的组成为:
可逆放热反应的最佳反应温度确定实例
(2) (3)
2.4 复合反应
反应中任何一个反应都不可能由其他反应经过线性组合而得到
例如:
(2)-(1)=(3) 独立反应数为2
反应速率方程的确定方法
例如针对于此反应机理 化学计量系数为 2
反应速率方程的确定方法
实验测得不同时刻醋酸转化量如下表
反应速率方程的确定方法
解: 因为丁醇大大过量,因此在此反应条件下可不考虑 丁醇浓度的影响,同时不考虑逆反应,则可假设:
CA CAoekt
图解法
参数拟合法 图解法 参数拟合法
2.3 温度对反应速率的影响
2.6 多相催化与吸附
十分 重要
2.6 多相催化与吸附
单分子吸附
2.6 多相催化与吸附
双分子吸附
多分子吸附
2.6 多相催化与吸附
解离吸附
平衡时
2.6 多相催化与吸附
(考虑到吸附表面吸附的不均匀性的模型)
qEaEd
2.6 多相催化与吸附
pA0 ,
A0
另外一种吸附等温式:
A可能大于 1
2.7 多相催化反应动力学
2.5 反应速率方程的变换与积分
解:
rBf(XB)
2.5 反应速率方程的变换与积分
独立反应数为M =
2.5 反应速率方程的变换与积分
2.6 多相催化与吸附
催化剂的作用:改变化学反应的速度(提高主反应速率、 改善反应选择性) 例如:
2.6 多相催化与吸附
反应物的吸附 多相催化反应 表面反应
产物的脱附 例如多相催化反应
1. 例如:反应
2.7 多相催化反应动力学
2.
速率控制 步骤并非 一成不变
其他各步近似认为达到平衡
2.7 多相催化反应动力学
反应速率由表面反应速率决定 其他各步达到平衡 活性位分率归一性
2.7 多相催化反应动力学
其中:
2.7 多相催化反应动力学
反应速率由A吸附净速率决定 其他各步达到平衡 活性位分率归一性
(1)+(3)=(2)
复合反应体系独立方程数的确定方法
复合反应的基本类型
各个反应独立进行,互相不影响 但变容反应过程 速率会受一定影响
A的反应速率 P的瞬时选择性:
复合反应的基本类型
CA S CA S
浓度高有利于反应级数大的反应
S与温度T无关 TS TS
温度升高有利于活化能大的反应
复合反应的基本类型
一定要注明反应速率是按哪一个组分计算的
例题2.1
在350度等温恒容下纯丁二烯进行二聚反应,测得反 应系统总压 p 与反应时间 t 的关系如下:
t/min 0 6 12 26 38 60 p/kPa 66.7 62.3 58.9 53.5 50.4 46.7 试求时间为26min时的反应速率。
反应工程第二篇课件(天大)
化学反应动力学
2.1 化学反应速率此只式是并在非间反歇应反速应率系定统义中式的,
表达方式
定义:单位时间,单位体积反应物系中某一反应组分 的反应量。
AABB RR
rAV 1ddAn ,trBV 1d dBn ,trRV 1ddRnt
1. 反应速率恒为正值 2. 按不同组分计算的反应速率数值上不等,因此
瞬时选择性
综合选择性
综合收率
XA
Y S0XA SdXA
0
复合反应的基本类型
例如: 2 N O O 2 2 N 2 O N 2 O 4
连串反应中 各组分浓度 随时间变化
2.4.3 反应网络
实际的反应体系中既有连串反应,又有平行反应, 往往构成一个网络,因此称之为反应网络 例如:萘氧化反应
反应体系的简化方法主要取决于反应物系的特性 针对于反应组分十分复杂的物系,一般是将性质相近的 物质合并为一种虚拟物质进行对待:例如催化裂化反应:
2.5 反应速率方程的变换与积分
反应过程中经常伴随着反应体积的变化, 对此体系浓度的变化对反应速率的影响如何处理?
2.5 反应速率方程的变换与积分
2.5 反应速率方程的变换与积分
2.8 动力学参数的确定
2.8 动力学参数的确定
例题:2-9 , 2-10
2.8 建立速率方程的步骤
(1)设想各种反应机理,导出不同的速率方程 (2)进行反应动力学实验,测定所需的动力学数据 (3)根据实验数据对可能的速率方程进行筛选
和参数估值,确定合适的速率方程
