气体吸收
第4章气体吸收

25
单相中物质的分子扩散
什么是分子扩散?在一相内部有浓度差存在时, 由于分子无规则的热运动引起的物质传递,简 称扩散。扩散的快慢用扩散通量表示
扩散通量—在单位时间内单位截面积上扩散传 递的物质量;kmol/m2 s ,用 J表示。
33
4.2.3 填料吸收塔的计算
4.2.3.1 吸收塔的物料衡算 4.2.3.2 吸收剂用量 4.2.3.3 填料层高度的计算 4.2.3.4 吸收塔的操作调节
4.3 吸收塔理论板层数的计算
34
4.2.3 填料吸收塔的计算 4.2.3.1 吸收塔的物料衡算
全塔物料衡算(逆流吸收)
Gy 1 +Lx 2 =Gy 2+ Lx 1
13
五、解吸(脱吸)
解吸:将溶质从溶剂中释放出来的操作 常用的解吸方法:升温、减压、吹气,升温和吹气通
常同时进行。 与吸收的比较
1)设备通用 2)传质理论相同。但因为传质方向不同,推动力的表 现形式改变 3)当用吹气解吸时,与吸收中最小液气比对应,存在 最小气体用量问题。
14
六、吸收剂的选择
成氨生产的氮氢混合气中的CO2和CO的净化;在接触法生 产硫酸中二氧化硫的干燥等。 ②分离气体混合物 用以得到目的产物或回收其中一些组分, 如石油裂解气的油吸收,将C2以上的组分与甲烷、氢分开; 用N-甲基吡咯烷酮作溶剂,将天然气部分氧化所得裂解 气中的乙炔分离出来;焦炉气的油吸收以回收苯等。
12
工业生产中的吸收过程
体中一个或几个组分便溶解于液体中 形成溶液,而不溶解的组分则留在气 相中,从而实现其分离。
尾气V1 吸收剂 L0
吸收依据是混合气体中各组分在同一 溶剂中溶解度的不同。
气体吸收

2 以液膜传质分系数表示吸收速率方程式
NA
DL c总 Z L cBm
ci c (ci c) k L (ci c) 1 kL
N A kL (ci c )
kL——以浓度差为推动力的液膜传质分系数,ms-1;
N A k x ( xi x)
kx——以摩尔分数差为推动力的液膜传质分系数,molm-2s-1;
溶质的平衡分压 p与其在液相中的摩尔分率 x之间存在着如下的 关系:
p*=E· x
式中: p*---------溶质在气相中的平衡分压, Pa; x----------溶质在液相中的摩尔分数 E----------享利系数, Pa
上式表示溶液的组成低于一定数值时溶质的平衡分压与它
在溶液中的摩尔分率成正比。对于理想溶液,亨利常数即为纯 溶质的饱和蒸汽压。亨利常数E值较大表示溶解度较小。一般 E值随温度的升高而增大,常压下压力对E值影响不大。
m
y
m
某吸收过程,气相传质分系数,液相传质分系数, 由此可知方该过程为( )。 (A)液膜控制;(B)气膜控制; (C)气液双膜控制;(D)判断依据不足
积上被吸收的溶质量。表明吸收速率与吸收推动力之间
关系的数学式称为吸收速率方程。 1 以气膜传质分系数表示的吸收速率方程式
NA
Dp总 RTZG pB ,m
p pi ( p pi ) kG ( p pi ) 1 kG
N A kG ( p pi )
kG——以分压差为推动力的气膜传质分系数,molm-2s-1Pa-1;
浓度的差值来表示。
(1) 以(p-p*)表示总推动力 液膜吸收速率方程
N A kL (ci c)
代入
化工原理之气体吸收

化工原理之气体吸收气体吸收是化工过程中常用的一种物理操作,它指的是将气体从气相吸收到液相中。
气体吸收广泛应用于环境工程、化工工艺、能源工程等领域,例如废气处理、石油炼制、烟气脱硫等。
一、气体吸收的基本原理气体吸收的基本原理是气体和液体之间的质量传递过程。
气体吸收的过程中,气体溶质分子通过气相和液相之间的传质界面传递到溶液中,从而实现气体从气相到液相的转移。
气体吸收的速度由以下几个因素决定:1.液相溶剂的性质:液相溶剂的挥发性、表面张力、黏度和溶解度等性质都会影响气体吸收的速度。
通常情况下,挥发性较强的溶剂对气体的吸收速率较快。
2.溶剂和气体溶质之间的亲和力:溶剂和气体溶质之间的亲和力越强,气体吸收速度越快。
3.传质界面的面积和传质界面的厚度:传质界面的面积越大,气体吸收速度越快;传质界面的厚度越薄,气体吸收速度越快。
4.溶解度:气体的溶解度越高,气体吸收速度越快。
5.气体浓度梯度:气体浓度梯度越大,气体吸收速度越快。
二、气体吸收的设备常见的气体吸收设备包括吸收塔、吸收柱和吸附塔等。
1.吸收塔:吸收塔是最常用的气体吸收设备之一,它主要由一个塔体和填料层组成。
气体通过底部进入吸收塔,液体从塔顶滴入塔体中。
在填料层的作用下,气体和液体之间的接触面积增加,从而促进气体的传质。
通过提供充分的接触时间和表面积,吸收塔可以实现高效的气体吸收。
2.吸收柱:吸收柱通常用于含有反应过程的气体吸收。
与吸收塔类似,吸收柱也包含一个塔体和填料层。
区别在于,吸收柱还包括一个液相反应器,用于在吸收气体的同时进行反应。
3.吸附塔:吸附塔是另一种常用的气体吸收设备,主要用于吸附分离等工艺中。
吸附过程通过吸附剂将目标气体吸附在其表面上实现。
吸附塔通常由多个吸附层和吸附剂床组成,气体从底部进入吸附塔,经过吸附剂床后,被吸附物质从气相转移到固相中,从而实现气体吸附。
三、气体吸收的应用气体吸收在化工工艺中有着广泛的应用。
1.废气处理:气体吸收是一种有效的废气处理方法,可用于去除废气中的有害污染物,如二氧化硫、氮氧化物等。
化工原理-5章气体吸收

液两相的浓度呈连续变化。如填
溶剂
料塔。
溶剂
规整填料
散装填料
塑料丝网波纹填料 塑料鲍尔环填料
级式接触:气、液两相逐级接 触传质,两相的组成呈阶跃变 化。 如板式塔。
气体
气体
a 微分接触
b 级式接触
图9-2 填料塔和板式塔
5.1.3 吸收操作的分类
物理吸收:吸收过程溶质与溶剂不发生显著的化学反应。如用水 吸收二氧化碳、用水吸收乙醇或丙醇蒸汽、用洗油吸收芳烃等。
硫回收
低温 甲 醇洗
甲醇 醋酸
CO分离
醋酐
低温甲醇洗装置
原气料体器气热I/交合换成 新醇鲜储甲槽 锅冷炉却给器水
原料气 冷却器
补充泵
洗氨器 原料气 体/热合交成换气器
原料气 /交废换气器热
地下 废液罐
地下 吸收器 废液泵
II
C02 甲 醇 级 间冷却器
H进2料S-冷吸却收器器
合成气 原料气
原 凝物料 气 冷
yA 1 yA
KmolA/ KmolB
在计算比质量分数或比摩尔分数的数值时, 通常以在操作中不转移到另一相的组分作为 B组分。在吸收中,B组分是指吸收剂或惰 性气,A组分是指吸收质.
2.质量浓度与物质的量浓度
质量浓度是指单位体积混合物内所含物质的质量。对于A组分,有
A
mA V
kg / m3
对于气体混合物,在压强不太高、温度不太低的情况下,可视为理
EM s 83.318
第八章 吸收
三、吸收平衡线
表明吸收过程中气、液相平衡关系的图线称吸收平衡线。在吸收操作 中,通常用图来表示。
吸收平衡线
YA
1
mX A (1 m) X
气体吸收
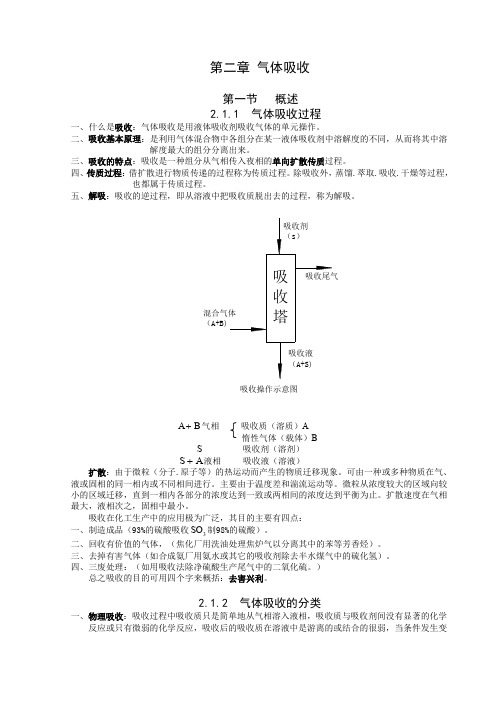
第二章气体吸收第一节概述2.1.1 气体吸收过程一、什么是吸收:气体吸收是用液体吸收剂吸收气体的单元操作。
二、吸收基本原理:是利用气体混合物中各组分在某一液体吸收剂中溶解度的不同,从而将其中溶解度最大的组分分离出来。
三、吸收的特点:吸收是一种组分从气相传入夜相的单向扩散传质过程。
四、传质过程:借扩散进行物质传递的过程称为传质过程。
除吸收外,蒸馏.萃取.吸收.干燥等过程,也都属于传质过程。
五、S吸收剂(溶剂)S+液相吸收液(溶液)A扩散:由于微粒(分子.原子等)的热运动而产生的物质迁移现象。
可由一种或多种物质在气、液或固相的同一相内或不同相间进行。
主要由于温度差和湍流运动等。
微粒从浓度较大的区域向较小的区域迁移,直到一相内各部分的浓度达到一致或两相间的浓度达到平衡为止。
扩散速度在气相最大,液相次之,固相中最小。
吸收在化工生产中的应用极为广泛,其目的主要有四点:SO制98%的硫酸)。
一、制造成品(93%的硫酸吸收3二、回收有价值的气体,(焦化厂用洗油处理焦炉气以分离其中的苯等芳香烃)。
三、去掉有害气体(如合成氨厂用氨水或其它的吸收剂除去半水煤气中的硫化氢)。
四、三废处理:(如用吸收法除净硫酸生产尾气中的二氧化硫。
)总之吸收的目的可用四个字来概括:去害兴利。
2.1.2 气体吸收的分类一、物理吸收:吸收过程中吸收质只是简单地从气相溶入液相,吸收质与吸收剂间没有显著的化学反应或只有微弱的化学反应,吸收后的吸收质在溶液中是游离的或结合的很弱,当条件发生变化时,吸收质很容易从溶剂中解吸出来。
如用水吸收二氧化碳。
物理吸收是一个物理化学过程,吸收的极限取决于操作条件下吸收质在吸收剂中的溶解度、吸收速率则取决于吸收质从气相主体传递入液相主体的扩散速率。
物理吸收都是可逆的一般热效应较小。
二、化学吸收:吸收过程中吸收质与吸收剂之间发生显著的化学反应。
例如NaOH 吸收2CO 。
化学吸收时,吸收平衡主要取决于当时条件下吸收反应的化学平衡,吸收速率则取决于吸收质的扩散速率和化学发应速率,因为化学吸收降低了吸收质的浓度故吸收速率一般比同样条件下没有化学反应的物理吸收速率大。
化工原理 第五章 气体吸收

Y
*
mX 1 (1 m) X
当溶液浓度很低时,上式右端分母约等于1,于是上式可简化为:
Y*=mX
20
三、 相平衡关系在吸收中的应用
(一)判断过程进行的方向
* pA pA * pA pA * pA pA
A由气相向液相传质,吸收过程 平衡状态
A由液相向气相传质,解吸过程
*或x* >x或 c * y
dc A —组分A在扩散方向z上的浓度梯度(kmol/m3)/m; dz
DAB——组分A在B组分中的扩散系数,m2/s。
负号:表示扩散方向与浓度梯度方向相反,扩散沿 着浓度降低的方向进行
28
理想气体:
pA cA RT
dc A 1 dp A = dz RT dz
DAB dpA JA RT dz
25
吸收过程: (1)A由气相主体到相界面,气相内传递; (2)A在相界面上溶解,溶解过程; (3)A自相界面到液相主体,液相内传递。
单相内传递方式:分子扩散;对流扩散 。
26
一、 分子扩散与菲克定律
分子扩散:在静止或滞流流体内部,若某一组分存 在浓度差,则因分子无规则的热运动使
该组分由浓度较高处传递至浓度较低处,
物系一定, E T 2)E大的,溶解度小,难溶气体 E小的,溶解度大,易溶气体
3)E的来源:实验测得;查手册
对于理想溶液,亨利常数即为纯溶质的饱和蒸汽压。亨利常数E值较大表示溶解度 较小。一般E值随温度的升高而增大,常压下压力对E值影响不大。
16
(二)亨利定律其它形式
cA 1)p H
体主体浓度线相交于一点E,则厚度zG为E到相界
面的垂直距离。
(二)气相传质速率方程
气体吸收

5.1 概述
2、传质
气体吸收是传质分离过程。 前面提到的传质分离过程中,
重点是要讲述平衡分离过程, 是组分在两相间的分配不同 (平衡)来实现分离。 气体吸收过程包含有组分从一 相到另一相的转移。 过程的推动力为:浓度差C
二. 物理吸收和化学吸收
物理吸收 定义: 溶质气体溶于液相中不发生显著化学 反应的吸收过程,称之为~ 例如: CO2 + H2O= H2 CO3 HCl(g)+H2O = HCl(L) 丙酮(g)+H2O=丙酮(L) 化学吸收 定义: 液相中有某种组分,能够与溶质气体 (溶解于L)进行化学反应的吸收过程,促进 了吸收过程的进行速率; 例如:Na2 CO3 (K2CO3) +CO2 + H2O = Na2HCO3 ( KHCO3 )
X1、X2——分别为吸收塔的塔底和塔顶的液相比摩尔分率; φA——混合气体中溶质A被吸收的百分率,称为吸收率或回收率
现取塔内任一截面m-n与塔底(图中的虚线范围)作溶质
的物料衡算, 即:
V(Y1 - Y) = L(X1 - X)
L L Y X (Y1 X 1 ) V V
同理,可得
L L Y X (Y2 X 2 ) V V
NA=ky(y-yi) ky=PkG NA=kX(xi -X) kX=CkL
NA=Ky(y-ye) Ky=PKG Ky=1/(1/ky+m/kX) 气膜控制时Ky=ky
液膜
NA=kL(Ci-C)
NA=KG(P-Pe)
KG=1/(1/kG+1/HkL)
气相
气膜控制 KG=kG NA=KL(Ce -C)
一、亨利定律
5.2
气液相平衡
当总压不高(<5×105Pa)时,在一定温度下,稀溶液上方 溶质的平衡分压与其在液相中的浓度之间存在着如下的关系:
气体吸收名词解释

气体吸收名词解释
气体吸收是指气体被其他物质吸收并进入其中的过程。
在化学和物理领域中,气体吸收经常涉及到气体溶解、吸附和反应等过程。
气体溶解是指气体分子在液体中被吸收并与溶剂分子相互作用的过程。
气体溶解可以通过增加溶剂和气体之间的接触面积、提高溶剂的温度或压力来增加。
溶解度通常用溶解度曲线来描述,它表示了在不同温度和压力下溶剂能够溶解的气体的最大量。
气体吸附是指气体吸附剂表面上的分子吸引和捕获气体分子的过程。
吸附可以分为物理吸附和化学吸附两种类型。
物理吸附是指气体分子在吸附剂表面上通过分子间力相互作用被吸附的过程,其吸附速度较快,吸附强度较弱。
化学吸附是指气体分子在吸附剂表面上发生化学反应并形成化学键的过程,其吸附速度较慢,吸附强度较强。
气体吸收还可以是指气体在化学反应中被反应物所吸收的过程。
这种吸收通常是一个反应物与气体发生化学反应,并在反应中形成产物的过程。
气体吸收在许多工业领域中被广泛应用,如空气污染控制、气体分离和催化反应等。
总之,气体吸收涉及到气体在液体或固体中被吸收的过程,可以通过溶解、吸附或化学反应来实现。
该过程在科学研究和工业生产中具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
起因:浓度差
6.1.2 原理
2 为达到吸收分离气体混合物的目的, 如何分离?其分离的依据使什么?
人为地造成两相,故为相际传质。
气液两相、液 液相、汽液两 相 溶解度、相 对挥发度、 尺寸等不同
物理化学性质差异:
2 吸收术语
吸收剂:吸收过程中所 用的溶剂;(S) B A 溶质:混合气体中能显 A B 著被吸收剂吸收的组 分 ;(A) A B A 惰性组分:不能被吸收 剂吸收的组分;(B) B A A 富液 :含有较高溶质 A 浓度的吸收剂; 贫液:从富液中将溶 质分离出来后得到的吸 收剂。
当塔高无限高,吸收剂用量很大 y 2 也不会无限减小
* y2,min y2 mx2
习题
1对低浓度溶质的气液平衡系统,当总压 降低时,亨利系数E将( ),相平衡 常数m将( ),溶解度常数H将( ) 2亨利定律表达式p*=Ex,若某气体在水中 的E很小,说明该气体为( )
思考题: 1. 温度和压力对吸收过程的平衡关系有何影 响? 2. 亨利定律为何具有不同的表达形式? 3. 摩尔比与摩尔分数有何不同,它们之间的 关系如何?
3 吸收工业过程小结
选择合适的溶剂 选择合适的设备 选择合适的溶剂再生方法
–加热,因温度升高,溶解度降低;
–减压,因压力降低,溶解度降低; –惰性气体与溶液逆流接触,一般采
用过热蒸汽,一方面由于较高温度, 另一方面由于惰性气体可以降低溶 质气体的分压,从而带出溶质气体。
6.1.4 溶剂的选择原则
6.1.3 传质设备
1 塔设备 填料塔(packed tower),微分接触式 板式塔(tray tower),阶跃式
2 吸收过程流程
脱苯煤气 冷凝器 粗苯 冷却器 吸收塔 补充新 鲜洗油 换热器 水
解吸塔
含苯煤气 富油 贫油 过热蒸汽
采用吸收剂再生的连续吸收流程
完整流程:吸 收与解吸
S
A S
S
A S S
3 小结
气体吸收是传质分离过程。 气体吸收过程包含有组分从气相到液 相的转移。 平衡分离过程,是组分在两相间的分 配不同(平衡)来实现分离。 过程的推动力为:浓度差C
6.1.3 传质设备
氨气(浓度低)+空气
密闭容器能否用 作工业吸收设备?
密闭 容器
水(溶剂)
尽可能提供气、 液两相有足够大 的接触面积。 氨气(浓度高)+空气(惰性气体) 尽可能使气、 液两相的传质推 (溶质,被吸收组分) 动力大(逆流)
第六章
气体吸收
引言
均相混合物分离特点:
根据混合物中各组分间某种物理化学性质差异 而进行的。依靠物质的分子、涡流传递特性来实 现混合物中各组分的分离。 人为地造成两相,故为相际传质。
吸收------溶解度的不同 eg: 水+Hcl ; 水+甲醛---福尔马林;合成氨工业----NH3+水 精馏---主要依据沸点差异 eg:酿酒工业---乙醇+水; 膜分离------主要依靠筛分作用,尺寸差异 ; 吸附分离------主要依靠筛分作用,尺寸差异 ; 也有络合作用
§6.3 分子扩散 (传质分离过程的动力学)
6.3.1.引言 1 分类
传质分离过程 过程的动力学
过程的机理 过程的速率
过程的热力学
过程的方向 过程的极限
2.物质在相间的传递步骤
B B S A B A B B A S S 溶解 气相内的物质传递 两相界面 液相内的物质传递 S S S S S S
A
△= x2* -x1 =0
△= x1 -x3*
2 、推动力可以有两种表示方法:
吸收过程: (yA-yA*)——气相组成浓度差 (xA*-xA)——液相组成浓度差 两者△越大,过程速率也就越快
解析过程:
( yA* - yA )——气相组成浓度差 (xA - xA*)——液相组成浓度差
两者△越大,过程速率也就越快
6.1.5 物理吸收和化学吸收
物理吸收
本章仅介绍物理 吸收
– 定义: 溶质气体溶于液相中不发生显著化学 反应的吸收过程,称之为~ – 例如: CO2 + H2O= H2 CO3 ; HCl(g)+H2O= HCl(L)
化学吸收
– 定义: 液相中有某种组分,能够与溶质气体 (溶解于L)进行化学反应的吸收过程,促 进了吸收过程的进行速率; – 例如:Na2 CO3 (K2CO3) +CO2 + H2O = Na2HCO3 ( KHCO3)
Ag/100gH2O 0.02 0.05 0.10 0.20 0.30 0.50 1.0
p* mmHg
0.5
1.2
3.2
8.5
14.1 26.0 59.
a 64 x a 64 100 / 18
p* y* P
y
a=0.02g SO2/ 100gH2O 带入 得 x=5.6*10-5 P=1atm, p*=0.5 y*=6.58*10-4 P=2atm, p*=0.5 y*=3.29*10-4 故总压升高有利于吸收 x
SO2 g/100gH2O
p* mmHg
图线 关系式-----如:Henry定律
(2) 溶解度曲线
T↓→溶解度↑,p↑→ 溶解度↑的规律。 ∴低T、高p有利于吸收。
3 例题
在总压为1atm和2atm下,据20℃SO2-水的气液平衡数 据绘出以摩尔分数表示气液平衡的曲线. 解:据<化工数据手册>查20℃ SO2-水的气液平衡数据
P*A=CA/H
(2)
溶解度系数, kmol/m3.atm
y*A=mxA
相平衡常数
(3)
3. Henry定律中E、H、m间关系
1)确定依据 根据组成之间关系及道尔顿分压定律, 即可确定E、H、m之间的关系。 2)确定过程
p*A=ExA
p*A=CA /C*M X A =P y A
* * =EC /P pyAA=ExA /CM A
§6.1 概述
6.1.1 定义
气体溶解于液体的过程,称之为气
体吸收。 气体吸收在工业及环保中的应用
回收产品
应用
气体净化
制备某种气体的溶液
6.1.2 原理
1 气体吸收本质:质量传递,简称传质
可在一相内, 或两相之间
B A A B A A B A B A B B A B
B
A
在混和物系中, 当某组分存在浓 度梯度时,该组 分将由高浓度区 向低浓度区进行 迁移的过程.
溶质A在气相中 的平衡分压
P*A=ExA
(1)
xA ---溶质A在液相中的摩尔分数。
3) 亨利系数特性
亨利系数的值决定于物系的特性及体系 的温度。 E随着温度T升高而升高 E的大小反映了气相组分在该溶剂中溶解 度的大小。 E越大,溶解度越小。
p E1
E2
x1
x2
x
2.亨利定律的不同表示方法
溶质A在溶液中的摩尔浓度 kmol/m3
吸收剂对溶质应有较大的溶解度,以提高吸 收速率,减少吸收剂的用量; 吸收剂对溶质应有良好的选择性,即对于混 合气中待吸收组分的溶解度要大,对其余组 分的溶解度要小; 同时为了便于吸收剂的再生回用,其溶解度 应随操作条件的改变有显著的差异; 溶剂的挥发性要小,即蒸气压低,以减少溶 剂的损失量; 溶剂的粘度要低,这样有利于气、液接触, 提高吸收速率,也便于输送; 无毒;难燃;腐蚀性小;易得价廉;易于再 生利用;不污染环境。
3、确定过程的极限
1)所谓过程的极限是指两相经充分接触后,各 自组成变化的最大可能性。这和两相的量比有 关,也和两相的接触方式(逆、并)有关。
y2
x2
y2>y2*
x2
y1
塔高
x1<x1*
吸收剂用量
y1
x1
吸收剂用量
y2
x1
塔高
当塔无限高吸收剂用量很少
x1 不会无限增大, y * x1,m ax x1 1 m
2、气液平衡关系的表达及测定
P,T一定 A 溶质分子
B 惰性组分
X*=f(t,P,y)
T一定,则:
X*=f(p)
溶解度定义:(平衡溶解 度)气液两相处于平衡 状态时,溶质在液相中 的浓度X* 溶质在气相中的分压
溶解度曲线
(1)气液平衡关系的表示方法
列表
0.02 0.05 0.10 0.20 0.30 0.50 1.0 0.5 1.2 3.2 8.5 14.1 26.0 59.
本章讨论浓度差 引起的质量传递
6.3.2分子扩散速率方程----Fick定律
1 费克(Fick)定律: 对于两组分物系, 某种组分的扩散通量(JA)与该组分方 向上的浓度梯度成正比
J A DAB
dCA dZ
单位时间内通过单 位截面积的量
kmol/(s.m2)
组分A在介质B中的 扩散系数,单位为: 浓度梯度,单位为: m2/s kmol/(m3.m)
4、溶质浓度的表示方法
分压 P 摩尔分率
Gas Phase
y Liquid Phase
–溶质A与溶剂S质量比 x’,单位为:g A/1000g s –体积摩尔浓度 C-kmol/m3 –摩尔分率 x-mol/mol
5、不同溶质浓度间的关系
X’ g A/1000g s C-kmol/m3 x-mol/mol
如何相互换算?
x=( x’/MA)/(x’/MA +1000/ MS ) C=( x’/MA)/(x’ +1000)/ C= x/[x MA + (1-x) MS ] /
当x很低时,ρ ρs 若为水溶液
Cm= s / Ms =1000 /18=55.6
