全国高中化学竞赛晶体结构专项训练
高中化学晶体的结构与性质专项训练专题复习附解析
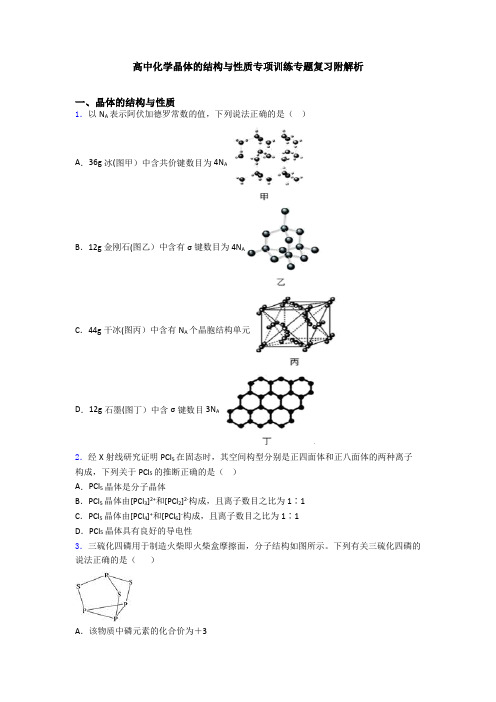
高中化学晶体的结构与性质专项训练专题复习附解析一、晶体的结构与性质1.以N A表示阿伏加德罗常数的值,下列说法正确的是()A.36g冰(图甲)中含共价键数目为4N AB.12g金刚石(图乙)中含有σ键数目为4N AC.44g干冰(图丙)中含有N A个晶胞结构单元D.12g石墨(图丁)中含σ键数目3N A2.经X射线研究证明PCl5在固态时,其空间构型分别是正四面体和正八面体的两种离子构成,下列关于PCl5的推断正确的是()A.PCl5晶体是分子晶体B.PCl5晶体由[PCl3]2+和[PCl2]2-构成,且离子数目之比为1∶1C.PCl5晶体由[PCl4]+和[PCl6]-构成,且离子数目之比为1∶1D.PCl5晶体具有良好的导电性3.三硫化四磷用于制造火柴即火柴盒摩擦面,分子结构如图所示。
下列有关三硫化四磷的说法正确的是()A.该物质中磷元素的化合价为+3B.22 g P4S3含硫原子数目约为1.806×1023C.该物质分子结构中S、P最外层电子数均不为8D.该物质分子中全是极性共价键4.对下列图形解释的说法错误的是()A.晶体金红石的晶胞如图1所示,推知化学式为TiO2(注:氧原子分别位于晶胞的上下底面和内部)B.配合物(如图2)分子中含有分子内氢键C.某手性分子如图3:可通过酯化反应让其失去手性D.可以表示氯化钠晶体,是氯化钠的晶胞5.下列性质中,能充分说明某晶体一定是离子晶体的是A.具有较高的熔点,硬度大B.固态不导电,水溶液能导电C.晶体中存在金属阳离子,熔点较高D.固态不导电,熔融状态能导电6.下列说法不正确的是()A.由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两种晶体中离子的配位数不相等B.CaF2晶体中,Ca2+的配位数为8,F-的配位数为4,配位数不相等主要是由于F-、Ca2+所带电荷(绝对值)不相等C.MgO的熔点比MgCl2的高主要是因为MgO的晶格能比MgCl2大D.MCO3中M2+半径越大,MCO3晶体的晶格能越大7.下列叙述正确的是A.离子晶体中,只存在离子健,不可能存在其它化学键B.可燃冰中甲烷分子与水分子之间存在氢键C.Na 2O2、NaHSO4晶体中的阴、阳离子个数比均为12D.晶体熔点:金刚石>食盐>冰>干冰8.元素ⅹ位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子。
全国高中化学竞赛教练员习题答案晶体结构

五、晶 体 结 构1. 因为立方晶系中,六个面都是等价的,若有底心立方晶胞存在,则必有面心立方晶胞存在,故立方晶系中不存在底心立方晶胞。
不带电荷的分子或原子(金属)之间的相互作用力小,若原子(非金属)以共价键连接,简单立方中的两个原子之间距离又太大,不利于共价键形成,所以不带电荷的分子或原子往往采取六方或立方最紧密堆积或立方体心密堆积结构。
由于六方最紧密堆积结构与立方紧密堆积的空间利用率相同,所以它们具有相同的密度。
在这两种紧密堆积中,原子的配位数为12。
2. Cu 为面心立方晶体,1个晶胞中Cu 原子个数=8×(18) + 6×(12)= 4(1)(2) =1.119 Å 3. ∵Fe 原子半径是相同的,在α型中,Fe3A 2M N a ααρ=g ,在γ型中, Fe γ3A γ4M N a ρ=g 在α型中,43r a α=,∴43a rα=;在γ型中,42r a γ=,∴22a r γ=∴Fe 3A (43)N rαρ=g ,Fe γ3A (22)N r ρ=g∴ 33γ(22)360.918682(43)r r αρρ===4. (1)(2) 原子堆积系数(100)=2222(4141)0.78544(22)r a r ππ⨯+=== 原子堆积系数(110)=22(414212)0.5554242r a π⨯+⨯== 原子堆积系数(111)= 22(316312)30.90696(12)(2)sin60r a ππ⨯+⨯==⨯o 23A 324A 463.548.936,8.97110(3.165)10m N V N ρ-⨯===⨯⨯⨯ 解得=Cu 42,24r a r a =∴=5. (1 ) MgO 与MnO 的d M —O 相差很大,这说明O 2–围成的正八面体空隙小,而Mg 2+、Mn 2+的半径差别大,导致d MnO >d MgO ;而S 2–和Se 2–半径大,围成的正八面体空隙既大于 ,又大于 ,所以d MgS ~d MnS ,d MgSe =d MnSe ,相当于Mg 2+和Mn 2+在S 2–和Se 2–围成的正八面体空隙中“扰动”。
全国高中化学竞赛晶体结构专项训练

全国高中化学竞赛专项训练—晶体结构提示:【初赛真题】选自98-08全国化学初赛试题,09暂无word版,望各选手自己收集整理【波波模拟】选自06-07胡波老师原创模拟题【冲刺模拟】选自2008化学岛第22届全国中学生化学竞赛(省级赛区)初赛模拟题冲刺【决赛真题】仅提供较简单的题目说明:1.本专项练习适用于2010年第24届全国初赛省级赛区;2.本资料为个人收集整理,均不为原创题;3.资料为个人所有,将不对外提供word版。
以图片形式向外出售;4.专项训练将于2010.1-2010.9由麦菊薇化学会陆续整理提供;5.培训教练应根据考情讲解重点;6.应试选手应仔细对阅参考答案及解析;7.欢迎提供更好资源及错误修改;警示:打击盗版,望各位培训教练及广大选手自重!若发现盗版,本资料将不予更新,并对盗版者处以严厉惩罚。
—麦菊薇化学会至上2010.01.25【初赛要求】晶胞。
原子坐标。
晶格能。
晶胞中原子数或分子数的计算及化学式的关系。
分子晶体、原子晶体、离子晶体和金属晶体。
配位数。
晶体的堆积与填隙模型。
常见的晶体结构类型,如NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、硒、冰、干冰、尿素、金红石、钙钛矿、钾、镁、铜等。
点阵的基本概念。
【初赛真题】第一题:(08第3题10分)X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。
该晶体的六方晶胞的参数:a=363.63pm,c=1766.63pm;p=2.53g·cm-3。
1.以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层型结构的堆积方式。
(5分)2.计算一个六方晶胞中“MgCl2”的单元数。
(3分)3.假定将该晶体中所有八面体空隙皆填满Mg 2+离子,将是哪种晶体结构类型?(2分)第二题:(07第5题5分)1963年在格陵兰峡湾发现一种水合碳酸钙矿物。
1998-2008年高中化学竞赛(初赛)有关晶体结构的试题及答案解析
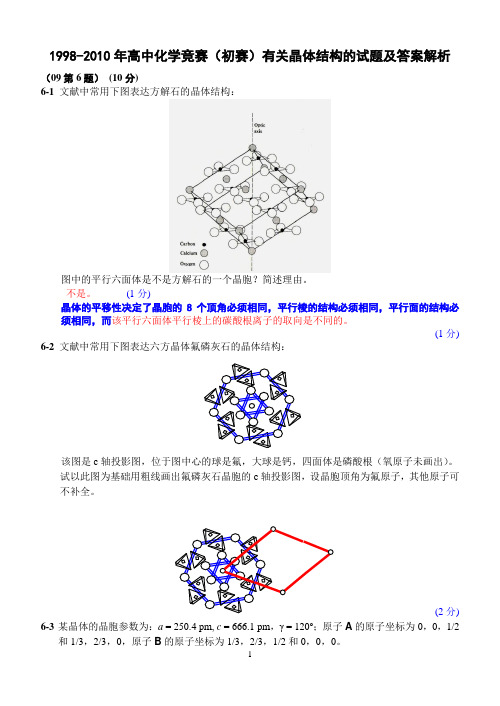
1998-2010年高中化学竞赛(初赛)有关晶体结构的试题及答案解析(09第6题)(10分)6-1 文献中常用下图表达方解石的晶体结构:图中的平行六面体是不是方解石的一个晶胞?简述理由。
不是。
(1分)晶体的平移性决定了晶胞的8个顶角必须相同,平行棱的结构必须相同,平行面的结构必须相同,而该平行六面体平行棱上的碳酸根离子的取向是不同的。
(1分) 6-2 文献中常用下图表达六方晶体氟磷灰石的晶体结构:Array该图是c轴投影图,位于图中心的球是氟,大球是钙,四面体是磷酸根(氧原子未画出)。
试以此图为基础用粗线画出氟磷灰石晶胞的c轴投影图,设晶胞顶角为氟原子,其他原子可不补全。
(2分) 6-3某晶体的晶胞参数为:a = 250.4 pm, c = 666.1 pm,γ = 120o;原子A的原子坐标为0,0,1/2和1/3,2/3,0,原子B的原子坐标为1/3,2/3,1/2和0,0,0。
(1) 试画出该晶体的晶胞透视图(设晶胞底面即ab 面垂直于纸面,A 原子用“○”表示,B原子用“●”表示)。
或(2分)(2) 计算上述晶体中A 和d (AB )。
d (AB) = 250.4 pm ⨯ 0.5 ÷ cos30o = 144.6 pm只要有计算过程,得出正确的核间距(2分)(3) 共价晶体的导热是共价键的振动传递的。
实验证实,该晶体垂直于c 轴的导热性比平行于c 轴的导热性高20倍。
用上述计算结果说明该晶体的结构与导热性的关系。
因为该晶体的c = 666.1 pm, 是AB 最短核间距的4.6倍,其间不可能有共价键,只有范德华力,该晶体属层状晶体,难以通过由共价键振动传热。
(2分)(10第3题) ( 7分) 早在19世纪人们就用金属硼化物和碳反应得到了碳化硼。
它是迄今已知的除金刚石和氮化硼外最硬的固体。
1930年确定了它的理想化学式。
左下图是2007年发表的一篇研究论文给出的碳化硼晶胞简图。
【化学奥赛】晶体结构习题new!
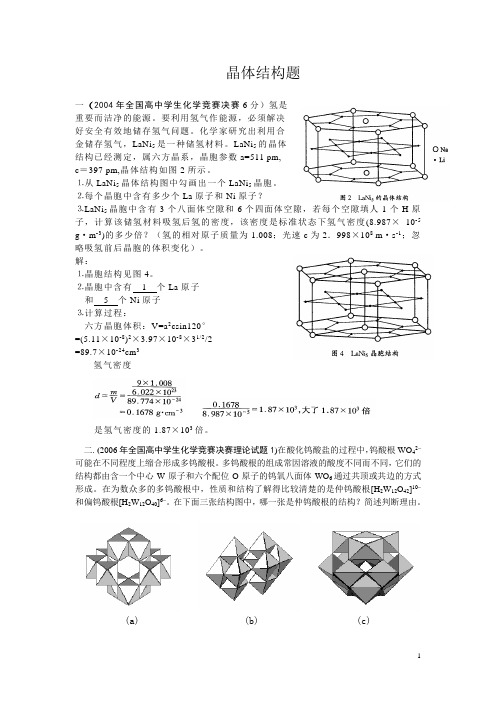
晶体结构题一(2004年全国高中学生化学竞赛决赛6分)氢是重要而洁净的能源。
要利用氢气作能源,必须解决好安全有效地储存氢气问题。
化学家研究出利用合金储存氢气,LaNi5是一种储氢材料。
LaNi5的晶体结构已经测定,属六方晶系,晶胞参数a=511 pm,c=397 pm,晶体结构如图2所示。
⒈从LaNi5晶体结构图中勾画出一个LaNi5晶胞。
⒉每个晶胞中含有多少个La原子和Ni原子?⒊LaNi5晶胞中含有3个八面体空隙和6个四面体空隙,若每个空隙填人1个H原子,计算该储氢材料吸氢后氢的密度,该密度是标准状态下氢气密度(8.987×10-5 g·m-3)的多少倍?(氢的相对原子质量为1.008;光速c为2.998×108 m·s-1;忽略吸氢前后晶胞的体积变化)。
解:⒈晶胞结构见图4。
⒉晶胞中含有1个La原子和5个Ni原子⒊计算过程:六方晶胞体积:V=a2csin120°=(5.11×10-8)2×3.97×10-8×31/2/2=89.7×10-24cm3氢气密度是氢气密度的1.87×103倍。
二. (2006年全国高中学生化学竞赛决赛理论试题1)在酸化钨酸盐的过程中,钨酸根WO42-可能在不同程度上缩合形成多钨酸根。
多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含一个中心W原子和六个配位O原子的钨氧八面体WO6通过共顶或共边的方式形成。
在为数众多的多钨酸根中,性质和结构了解得比较清楚的是仲钨酸根[H2W12O42]10-和偏钨酸根[H2W12O40]6-。
在下面三张结构图中,哪一张是仲钨酸根的结构?简述判断理由。
(a) (b) (c)解:提示:考察八面体的投影图,可以得到更清楚地认识。
三.(2006年全国高中学生化学竞赛决赛理论试题4)轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,它的生产以白云石(主要成分是碳酸镁钙)为原料。
届高中化学竞赛专题辅导(三)晶体结构及答案

高中化学竞赛专题辅导(三)晶体结构一.(9分)下图所示为HgCl2和不同浓度NH3-NH4Cl反应得到的两种含汞的化合物A和B的微观结构重复单元图。
1.写出A、B的化学式和B的生成反应方程式;2.晶体A中,NH3、Cl的堆积方式是否相同,为什么?3.晶体A中Hg占据什么典型位置,占有率是多少?4.指出B中阴阳离子组成特点;5.比较A和B在水溶液中溶解性的大小。
二.(14分)钛酸锶是电子工业的重要原料,与BaTO3相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具有优良稳定性。
因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。
制备高纯、超细、均匀SrTiO3的方法研究日益受到重视。
我国研究者以偏钛酸为原料常压水热法合成纳米钛酸锶,粒子呈球形,粒径分布较均匀,平均22nm。
已知SrTiO3立方晶胞参数a=390.5pm。
1.写出水热法合成纳米钛酸锶的反应方程式;2.SrTiO3晶体的结构可看作由Sr2+和O2-在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由O2-构成,另一种由Sr2+和O2-一起构成,Ti4+只填充在O2-构成的八面体空隙中。
(1)画出该SrTiO3的一个晶胞(Ti4+用小球,O2-用大○球,Sr2+用大球)(2)容纳Ti4+的空隙占据所有八面体空隙的几分之几?(3)解释为什么Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙?(4)通过计算说明和O2-进行立方密堆积的是Sr2+而不是Ti4+的理由(已知O2-半径为140pm)3.计算22nm(直径)粒子的质量,并估算组成原子个数。
三.(10分)NH4Cl为CsCl型结构,晶胞中包含1个NH4+和1个Cl-,晶胞参数a=387pm。
把等物质的量的NH4Cl和HgCl2在密封管中一起加热时,生成NH4HgCl3晶体,晶胞参数a=b=419pm、c=794pm(结构如右图)。
晶体结构考试(含答案)

高中化学竞赛专题考试——晶体结构1.008Zr Nb Mo T cRu Rh Pd Ag Cd In S n S b T e I Hf T a W Re OsIr Pt Au Hg T l Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl S i P Cl S K Ca S c T i V Cr Mn Fe Co Ni Cu Zn G a G e As S e BrRb Cs Fr S r Ba RaY LaLu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn相对原子质量Rf Db Sg Bh Hs Mt一 选择题(每题有一个或者两个正确选项,每题2分,共20分。
)1、下列各组物质汽化或熔化时,所克服的微粒间的作用力,属于同种类型的是( ) A .碘和干冰的升华 B .二氧化硅和生石灰的熔化 C .氯化钠晶体和铁的熔化 D .冰的融化和烧碱的熔化2、在结构中,表示成SiO 4,则该结构式的通式为 ( )A. (Si 2O 5)n 2n-B. (SiO 3)n 2n-C. (Si 6O 17)n 10n-D. (Si 6O 19)n 14n-3、某钾(·)的石墨嵌入化合物沿c 轴的投影图如图,该化合物的化学式为 ( ) A.KC 12 B. KC 10 C. KC 8 D. KC 64、下面二维平面晶体所表示的化学式为AX 3的是 ( )A B C D5.下面图像是从NaCl 或CsCl 晶体结构图中分割出来的部分结构图,试判断属于NaCl 晶体结构的是① ② ③ ④A 图①B 图②C 图③D 图④6 非整数比化合物Fe 0.95O 具有NaCl 型晶体结构,由于n (Fe )∶n (O )<1∶1,所以晶体存在缺陷。
全国高中生化学竞赛试题2 晶体结构(答案)

晶体结构答案第1题(6分)所有原子都是Mg (得3分)所有原子都是O (得3分)画更多原子者仍应有正确几何关系。
第2题(5分)2-1MgB 2(2分)(注:给出最简式才得分)2-2或a =b ≠c ,c 轴向上(3分)(注:任何能准确表达出Mg :B =1:2的晶胞都得满分,但所取晶胞应满足晶胞是晶体微观空间基本平移单位的定义,例如晶胞的顶角应完全相同等。
)第3题(10分)3-1①12②2③钠(各1分,共3分)3-2晶胞体积V =[2×(116pm +167pm)]3=181×106pm 3离子体积v =4×43π(116pm)3+4×43π(167pm)3=104×106pm 3v /V =57.5%(1分)(有效数字错误扣1分,V 和v 的计算结果可取4位,其中最后1位为保留数字,不扣分。
)3-3表面原子为8(顶角)+6(面心)+12(棱中心)=26总原子数为8(顶角)+6(面心)+12(棱中心)+1(体心)=27表面原子占总原子数26/27×100%=96%(1分)注:26和27均为整数值,比值26/27是循环小数0.962,取多少位小数需根据实际应用而定,本题未明确应用场合,无论应试者给出多少位数字都应按正确结果论。
3-4计算分两个步骤:步骤一:计算表面原子数。
可用n =2、3的晶胞聚合体建立模型,得出计算公式,用以计算n =10。
例如,计算公式为:[8]+[(n -1)×12]+[n ×12]+[(n -1)2×6]+[n 2×6]+[(n -1)×n ×2×6]顶角棱上棱交点棱上棱心面上棱交点面上面心面上棱心n =10,表面原子总数为2402(2分)步骤二:计算晶胞聚合体总原子数n 3×8+[8]×7/8+[(n -1)×12]×3/4+[n ×12]×3/4+[(n -1)2×6]/2+[n 2×6]/2+[(n -1)×n ×2×6]/2=8000+7+81+90+243+300+540=9261(2分)表面原子占总原子数的百分数:(2402/9261)×100%=26%(1分)(注:本题计算较复杂(还有更简单的计算方法),若应试者用其他方法估算得出的数值在26%左右2个百分点以内可得3分,3个百分点以内可得2分,其估算公式可不同于标准答案,但其运算应无误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全国高中化学竞赛专项训练—晶体结构提示:【初赛真题】选自98-08全国化学初赛试题,09暂无word版,望各选手自己收集整理【波波模拟】选自06-07胡波老师原创模拟题【冲刺模拟】选自2008化学岛第22届全国中学生化学竞赛(省级赛区)初赛模拟题冲刺【决赛真题】仅提供较简单的题目说明:1.本专项练习适用于2010年第24届全国初赛省级赛区;2.本资料为个人收集整理,均不为原创题;3.资料为个人所有,将不对外提供word版。
以图片形式向外出售;4.专项训练将于2010.1-2010.9由麦菊薇化学会陆续整理提供;5.培训教练应根据考情讲解重点;6.应试选手应仔细对阅参考答案及解析;7.欢迎提供更好资源及错误修改;警示:打击盗版,望各位培训教练及广大选手自重!若发现盗版,本资料将不予更新,并对盗版者处以严厉惩罚。
—麦菊薇化学会至上2010.01.25【初赛要求】晶胞。
原子坐标。
晶格能。
晶胞中原子数或分子数的计算及化学式的关系。
分子晶体、原子晶体、离子晶体和金属晶体。
配位数。
晶体的堆积与填隙模型。
常见的晶体结构类型,如NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、硒、冰、干冰、尿素、金红石、钙钛矿、钾、镁、铜等。
点阵的基本概念。
【初赛真题】第一题:(08第3题10分)X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。
该晶体的六方晶胞的参数:a=363.63pm,c=1766.63pm;p=2.53g·cm-3。
1.以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层型结构的堆积方式。
(5分)2.计算一个六方晶胞中“MgCl2”的单元数。
(3分)3.假定将该晶体中所有八面体空隙皆填满Mg 2+离子,将是哪种晶体结构类型?(2分)第二题:(07第5题5分)1963年在格陵兰峡湾发现一种水合碳酸钙矿物。
它形成于冷的海水中,温度达到8o C 即分解为方解石和水。
1994年的文献指出:该矿物晶体中的Ca 2+离子被氧原子包围,其中2个氧原子来自同一个碳酸根离子,其余6个氧原子来自6个水分子。
它的单斜晶胞的参数为:a =887pm,b =823pm,c =1102pm,β=110.2°,密度d =1.83g cm −3,Z =4。
1.通过计算得出这种晶体的化学式。
(1.5分)2.研究了这种晶体在加压下受热膨胀体积增大的情形,并与冰及钙离子配位数也是8的二水合石膏晶体作了对比,结果如下图所示(纵坐标为相对体积):为什么选取冰和二水合石膏作对比?实验结果说明什么?(2分)3.这种晶体属于哪种类型的晶体?简述理由。
(0.5分)第三题:(07第8题9分)由烷基镁热分解制得镁的氢化物。
实验测定,该氢化物中氢的质量分数为7.6%,氢的密度为0.101g cm −3,镁和氢的核间距为194.8pm 。
已知氢原子的共价半径为37pm ,Mg 2+的离子半径为72pm 。
1写出该氢化物中氢的存在形式,并简述理由。
(2分)2将上述氢化物与金属镍在一定条件下用球磨机研磨,可制得化学式为Mg 2NiH 4的化合物。
X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被镍原子占据,所有镁原子的配位数都相等。
推断镁原子在Mg 2NiH 4晶胞中的位置【写出推理过程】。
(3分)水合碳酸钙矿物冰3实验测定,上述Mg2NiH4晶体的晶胞参数为646.5pm,计算该晶体中镁和镍的核间距。
已知镁和镍的原子半径分别为159.9pm和124.6pm。
(2分)4若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,计算Mg2NiH4的储氢能力【假定氢可全部放出;液氢的密度为0.0708g cm−3】。
(2分)第四题:(06第8题9分)超硬材料氮化铂是近年来的一个研究热点。
它是在高温、超高压条件下合成的(50GPa、2000K)。
由于相对于铂,氮原子的电子太少,衍射强度太弱,单靠X-射线衍射实验难以确定氮化铂晶体中氮原子数和原子坐标,2004年以来,先后提出过氮化铂的晶体结构有闪锌矿型、岩盐型(NaCl)和萤石型,2006年4月11日又有人认为氮化铂的晶胞如下图所示(图中的白球表示氮原子,为便于观察,该图省略了一些氮原子)。
结构分析证实,氮是四配位的,而铂是六配位的;Pt—N键长均为209.6pm,N—N键长均为142.0pm(对比:N2分子的键长为110.0pm)。
备用图1氮化铂的上述四种立方晶体在结构上有什么共同点?(2分)2分别给出上述四种氮化铂结构的化学式。
(2分)3试在图上挑选一个氮原子,不添加原子,用粗线画出所选氮原子的配位多面体。
(3分)4请在本题的附图上添加六个氮原子(添加的氮请尽可能靠前)。
(2分)第五题:(06第11题11分)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。
磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。
1.写出合成磷化硼的化学反应方程式。
(1分)2.分别画出三溴化硼分子和三溴化磷分子的结构。
(2分)3.磷化硼晶体中磷原子作立方最密堆积,硼原子填入四面体空隙中。
画出磷化硼的正当晶胞示意图。
(2分)4.已知磷化硼的晶胞参数a=478pm,计算晶体中硼原子和磷原子的核间距(d B-P)。
(2分)5.画出磷化硼正当晶胞沿着体对角线方向的投影(用实线圆圈表示P原子的投影,用虚线圆圈表示B原子的投影)。
(4分)第六题:(05第8题12分)LiCl和KCl同属NaCl型晶体,其熔点分别为614℃和776℃。
Li+、K+和Cl-的半径分别为76pm、133pm和181pm。
在电解熔盐LiCl以制取金属锂的生产工艺中,加入适量的KCl晶体,可使电解槽温度下降至400℃,从而使生产条件得以改善。
1.简要说明加入熔点高的KCl反而使电解温度大大下降的原因;(2分)2.有人认为,LiCl和KCl可形成固溶体(并画出了“固溶体的晶胞”)。
但实验表明,液相LiCl和KCl能以任意比例混溶而它们的固相完全不混溶(即不能生成固溶体!)。
请解释在固相中完全不混溶的主要原因。
(2分)3.写出计算LiCl和KCl两种晶体密度之比的表达式(须包含离子半径的符号);(2分)4.在KCl晶体中,K+离子占据由Cl-离子围成的八面体空隙,计算相距最近的八面体空隙中心之间的距离。
(2分)5.实验证明,即使产生了阳离子空位,KCl晶体在室温下也不导电。
请通过计算加以说明。
(4分)第七题:(04第2题4分)2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol(N2的键能为942kJ/mol),晶体结构如图所示。
在这种晶体中,每个氮原子的配位数为;按键型分类时,属于晶体。
这种固体的可能潜在应用是,这是因为:。
第八题:(04第6题6分)最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。
鉴于这三种元素都是常见元素,从而引起广泛关注。
该晶体的结构可看作由镁原子和镍原子在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由镍原子构成,另一种由镍原子和镁原子一起构成,两种八面体的数量比是1︰3,碳原子只填充在镍原子构成的八面体空隙中。
1.画出该新型超导材料的一个晶胞(碳原子用小球,镍原子用大○球,镁原子用大球)。
(5分)2.写出该新型超导材料的化学式。
(1分)第九题:(03第4题8分)在30℃以下,将过氧化氢加到硼酸和氢氧化钠的混合溶液中,析出一种无色晶体X。
组成分析证实,该晶体的质量组成为Na14.90%,B7.03%,H5.24%。
加热X,得无色晶体Y。
Y含Na23.0%,是一种温和的氧化剂,常温下在干燥空气里稳定,但在潮湿热空气中分解放氧,广泛用作洗涤剂、牙膏、织物漂白剂和美发产品,也用于有机合成。
结构分析证实X和Y的晶体中有同一种阴离子Z2-,该离子中硼原子的化学环境相同,而氧原子却有两种成健方式。
1.写出X、Y的最简式,给出推理过程。
(3分)X的最简式:Y的最简式:推理过程:2.用最恰当的视角画出Z2-离子的立体结构(原子用元素符号表示,共价键用短线表示)。
(5分)第十题:(03第6题12分)2003年3月日本筑波材料科学国家实验室一个研究小组发现首例带结晶水的晶体在5K下呈现超导性。
据报道,该晶体的化学式为Na0.35CoO2·1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构;在以“CoO2”为最简式表示的二维结构中,钴原子和氧原子呈周期性排列,钴原子被4个氧原子包围,Co -O键等长。
1.钴原子的平均氧化态为。
(1分)2.以●代表氧原子,以●代表钴原子,画出CoO2层的结构,用粗线画出两种二维晶胞。
可资参考的范例是:石墨的二维晶胞是右图中用粗线围拢的平行四边形。
(9分)3.据报道,该晶体是以Na0.7CoO2为起始物,先跟溴反应,然后用水洗涤而得到的。
写出起始物和溴的反应方程式。
(2分)第十一题:(03第9题6分)钒是我国丰产元素,储量占全球11%,居第四位。
在光纤通讯系统中,光纤将信息导入离光源1km外的用户就需用5片钒酸钇晶体(钇是第39号元素)。
我国福州是全球钒酸钇晶体主要供应地,每年出口几十万片钒酸钇晶体,年创汇近千万美元(1999年)。
钒酸钇是四方晶体,晶胞参数a=712pm,c=629pm,密度d=4.22g/cm3,含钒25%,求钒酸钇的化学式以及在一个晶胞中有几个原子。
给出计算过程。
钒酸钛的化学式:一个晶胞中的原子数:计算过程:第十二题:(01第5题5分)今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。
在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,图5-1是该晶体微观空间中取出的部分原子沿C轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。
1由图5-1可确定硼化镁的化学式为:。
(2分)2在图5-l右边的方框里画出硼化镁的一个晶胞的透视图,标出该晶胞内面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球,硼原子用小黑球表示)。
(3分)图5-1硼化镁的晶体结构示意图第十三题:(01第11题10分)研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。
设氯化钠晶体中钠离子跟离它最近的氯离子之间的距离为d,以钠离子为中心,则:1第二层离子有个,离中心离子的距离为d,它们是离子。
