(完整版)物理化学第九章模拟试卷C
(精校版)物理化学第九章模拟试卷C

完整word版,物理化学第九章模拟试卷C编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(完整word版,物理化学第九章模拟试卷C)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为完整word版,物理化学第九章模拟试卷C的全部内容。
物理化学第九章模拟试卷C一、选择题(共10题 20分)1。
极谱分析中加入大量惰性电解质的目的是: ()(A) 增加溶液电导(B) 固定离子强度(C) 消除迁移电流 (D)上述几种都是2。
用铜电极电解 0.1mol·kg—1的 CuCl2水溶液,阳极上的反应为( ) (A) 2Cl—─→ Cl2+ 2e- (B) Cu ─→ Cu2++ 2e—(C) Cu ─→ Cu++ e- (D) 2OH-─→ H2O + 12O2+ 2e-3。
极谱分析仪所用的测量阴极属于下列哪一种? ( ) (A)浓差极化电极(B)电化学极化电极 (C)难极化电极(D)理想可逆电极4. 电解金属盐的水溶液时, 在阴极上:()(A) 还原电势愈正的粒子愈容易析出(B)还原电势与其超电势之代数和愈正的粒子愈容易析出(C) 还原电势愈负的粒子愈容易析出(D)还原电势与其超电势之和愈负的粒子愈容易析出5. 电解时,在阳极上首先发生氧化作用而放电的是: ( )(A) 标准还原电势最大者(B) 标准还原电势最小者(C) 考虑极化后,实际上的不可逆还原电势最大者(D) 考虑极化后,实际上的不可逆还原电势最小者6。
298 K、0。
1 mol·dm—3的 HCl 溶液中,氢电极的热力学电势为 -0。
06 V,电解此溶液时,氢在铜电极上的析出电势f H2为:()(A) 大于—0.06 V (B)等于—0.06 V (C) 小于—0.06 V (D) 不能判定7。
人教版高二物理选修3-3第九章 固体、液体和物态变化期末复习模拟测试(带解析)

绝密★启用前2019-2020学年第二学期人教版物理选修3-3第九章固体、液体和物态变化期末复习模拟测试本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间150分钟。
分卷I一、单选题(共10小题,每小题4.0分,共40分)1.已知50 ℃时饱和水汽压是92.5 mmHg,则在以下两种变化中:①如果温度不变,汽的体积缩小到原来一半;②体积不变,汽的温度升高到100°C其饱和水汽压变化是()A.不变,不变B.变大,不变C.不变,变大D.变大,变大2.在晶体中,原子(或分子、离子)都是按照各自的规律排列的,具有空间上的周期性.晶体的这种微观结构可用来解释()A.单晶体具有规则的几何形状,非晶体没有B.晶体能溶于水,非晶体不能C.晶体的导电性比非晶体强D.晶体的机械强度不如非晶体3.下列说法正确的是()A.空气的绝对湿度跟水的饱和汽压的百分比,叫做空气的相对湿度B.人们的有些病症与空气的相对湿度有关C.干湿泡湿度计上,两温度计的示数的差值越大,说明空气越潮湿D.只要气温不高,人们就一定不会感到闷热4.液体与固体具有的相同特点是()A.都具有确定的形状B.体积都不易被压缩C.物质分子的位置都确定D.物质分子都在固定位置附近振动5.下列关于汽化热的说法中正确的是()A.汽化热不会随温度的变化而变化B.不同物质的汽化热不同,同一物质的汽化热相同C.汽化热不仅与物质的种类有关,还与温度、压强有关D.汽化热只与物质的种类有关,与温度、压强无关6.关于晶体和非晶体,下列说法中正确的是()A.可以根据各向异性或各向同性来鉴别晶体和非晶体B.一块均匀薄片,沿各个方向对它施加拉力,发现其强度一样,则此薄片一定是非晶体C.一个固体球,如果沿其各条直径方向的导电性能不同,则该球体一定是单晶体D.一块晶体,若其各个方向的导热性能相同,则这块晶体一定是多晶体7.有关蒸发和沸腾说法正确的是()A.蒸发和沸腾都是发生在液面的汽化现象B.提高液体的温度可减缓液体的蒸发C.要提高液面沸点必须减少液面的气压D.蒸发可以在任何情况下进行8.高压锅又叫压力锅,用它可以将被蒸煮的食物加热到100 ℃以上,所以食物容易被煮熟,且高压锅煮食物比普通锅煮食物省时间、省燃料,尤其做出的米饭香软可口,很受人们欢迎.下表是AS22-5-80高压锅的铭牌,对此下列解释正确的是()A.食品受到的压强大而易熟B.高压锅保温性能好,热量损失少而易熟C.锅内温度能达到100 ℃以上,食品因高温而易熟D.高压锅的密封性好,减少水的蒸发而易熟9.吉尼斯大全中,记述了一个人赤着脚在650 ℃的燃烧着的一长堆木炭上步行约7.5米的“世界之最”纪录.下面说法正确的是()A.这个表演者一定在脚下事先抹上了一种高级绝热防护剂B.这个表演者一定是跳跃式地走过去的,这样做接触时间短,炭火来不及灼伤脚C.这个表演者一定是用汗脚踩在炭火上一步步轻轻地走过去的D.这个表演者一定是轻轻地踮着脚走过去的,这样做接触面积小,即使灼伤也不厉害10.晶体在熔化过程中,吸收热量的作用是()A.增加晶体的温度B.克服分子间引力,增加分子势能C.克服分子间引力,使分子动能增加D.既增加分子动能,也增加分子势能二、多选题(共4小题,每小题5.0分,共20分)11.(多选)液体表面具有收缩趋势的原因是 ()A.液体可以流动B.液体表面层的分子势能小于液体内部分子势能C.液体表面层的分子势能大于液体内部分子势能D.液体表面层的分子势能有减小的趋势12.(多选)某日白天的气温是20 ℃,空气中水蒸气的压强是1.1×103Pa;夜间,空气中水蒸气的压强不变,气温降到10 ℃,白天水的饱和汽压为2.3×103Pa,夜间水的饱和汽压为1.2×103Pa,则我们感觉到的潮湿与干爽情况是()A.夜间干爽B.白天潮湿C.白天干爽D.夜间潮湿13.(多选)关于晶体、液晶、液体,下列说法正确的是()A.晶体和液晶的性质是完全相同的B.液晶就是液体,具有液体的所有性质C.液晶是介于晶体与液体之间的一种中间态D.液晶具有液体的流动性,具有晶体的各向异性14.(多选)在相对湿度相同的情况下,比较可得()A.冬天的绝对湿度大B.夏天的绝对湿度大C.冬天的绝对湿度小D.夏天的绝对湿度小分卷II三、计算题(共4小题,每小题10.0分,共40分)15.测得室温为20 ℃时,空气的绝对湿度p=0.799 kPa.求此时空气的相对湿度是多少?(20 ℃时水的饱和汽压p s=2.34 kPa)16.在“l”形铁丝框架上有一可以自由滑动的细铁丝ab,如图所示.铁丝长L=20 cm,框上布着液膜.使液膜表面积增加ΔS=200 cm2,需要做多少功?(液体表面单位长度上的表面张力α=72×10-3N/m,摩擦可以不计)17.冬季某天,日间气温6 ℃时的相对湿度是65%,如果夜间最低气温是-3 ℃,那么,空气中的水蒸气会不会成为饱和汽?为什么?(设绝对湿度不变,6 ℃时水蒸气的饱和汽压p s1=9.34×102Pa,-3 ℃时水蒸气的饱和汽压为p s2=5.68×102Pa)18.把0.5千克处于熔点的液态铅倒入1千克22 ℃的水中,铅在水中凝固过程中,水温升高并有一部分水变成100 ℃的水蒸气.如果最终铅和余下水的温度都是27 ℃,那么变成水蒸气的水有多少?(铅的熔点是327 ℃,熔化热λ=2.5×104焦/千克,比热c=125焦/千克·℃;100 ℃水的汽化热L=2.25×106焦/千克).答案1.【答案】C2.【答案】A【解析】单晶体内的原子按一定规律排列,因此具有规则的几何外形,在物理性质上有各向异性,A正确;这种微观结构不能解释晶体能溶于水、晶体的导电性、机械强度,也不能解释非晶体的各向同性.3.【答案】B【解析】选项A中的饱和汽压应改为“同一温度”下的饱和汽压(因为不同温度下的饱和汽压的值不等),A错误;选项B中所述的情况,就是相对湿度对人的生活造成影响的一个例子,B正确;两温度计示数差值越大,说明湿泡温度计上的水蒸发得越快,空气越干燥,C错误;若空气相对湿度大,尽管气温不高人们也会感到闷热,D错误。
物理化学第九章模拟试卷C

物理化学第九章模拟试卷C1物理化学第九章模拟试卷C班级 姓名 分数一、选择题 ( 共10题 20分 ) 1. 2 分已知:(1) Cu │Cu 2+(a 2)‖Cu 2+(a 1)│Cu 电动势为 E 1(2) (2) Pt │Cu 2+(a 2),Cu +(a ')‖Cu 2+(a 1),Cu +(a ')│Pt 电动势为 E 2,则: ( )(A) E 1= 12E 2 (B) E 1= 2 E 2 (C) E 1= E 2 (D) E 1≥ E 22. 2 分298 K 时,已知 φ∃ (Fe 3+,Fe 2+)=0.77 V , φ∃ (Sn 4+,Sn 2+)=0.15 V , 当这两个电极组成自发电池时, E ∃为: ( ) (A) 1.39 V (B) 0.62 V (C) 0.92 V (D) 1.07 V3. 2 分某电池电动势与温度的关系为: E /V = 1.01845 - 4.05×10-5 (t /℃ - 20) - 9.5×10-7(t /℃ - 20)2298 K 时,电池可逆放电 ,则: ( ) (A) Q > 0 (B) Q < 0 (C) Q = 0 (D) 不能确定4. 2 分在电极─溶液界面处形成双电层,其中扩散层的厚度 δ 与溶液中相关离子浓度m 的 大小关系是: ( ) (A) m 增大,δ 增大 (B) m 增大,δ 变小 (C) 两者无关 (D) 两者关系不确定5. 2 分已知E 1∃(Fe 3+|Fe) = - 0.036 V , E 2∃(Fe 3+|Fe 2+) = 0.771 V , 则E 3∃(Fe 2+|Fe)值为:( ) (A) - 0.807 V (B) - 0.4395 V (C) - 0.879 V (D) 0.807 V6. 2 分有两个电池,电动势分别为E 1和E 2: H 2(p ∃)│KOH(0.1 mol ·kg -1)│O 2(p ∃) E 1H 2(p ∃)│H 2SO 4(0.0l mol ·kg -1)│O 2(p ∃) E 2比较其电动势大小: ( ) (A) E 1< E 2 (B) E 1> E 2 (C) E 1= E 2(D) 不能确定物理化学第九章模拟试卷C7. 2 分下列电池不属于浓差电池的是:()(A) (A) Tl(Hg)(a1)|Tl+(aq)|Tl(Hg)(a2)(B) (B) Na(Hg)(a)|NaCl(m1)|| NaCl(m2)|Na(Hg)(a)(C) (C) Na(Hg)(a)| NaCl(m1)|AgCl(s)|Ag(s)—Ag(s)|AgCl(s)| NaCl(m2)|Na(Hg)(a)(D) (D) Ag(s)|AgCl(s)|NaCl(aq)|Na(Hg)(a)|NaCl(CH3CN溶液)|Na(s)8. 2 分298 K时, 电池反应为Zn(s)+Ni2+(a1=1)=Zn2+(a2)+Ni(s) 的电池的电动势为0.54 V, 已知φ∃ (Zn2+,Zn)=-0.763 V, φ∃ (Ni2+,Ni)=-0.250 V, 则Zn2+的活度a2为:( )(A) 0.08 (B) 0.06(C) 0.12 (D) 0.049. 2 分某电池在等温、等压、可逆情况下放电,其热效应为Q R,则: ( )(A) Q R=0 (B) Q R=∆H(C) Q R=T∆S(D) Q R=∆U*. 2 分298 K 时,在下列电池Pt│H2(p∃)│H+(a=1)‖CuSO4(0.01 mol·kg-1)┃Cu(s)右边溶液中加入0.1 mol·kg-1 Na2SO4溶液时(不考虑稀释效应), 则电池的电动势将:( )(A) 上升(B) 下降(C) 基本不变(D) 无法判断二、填空题( 共9题18分)11. 2 分下列两个反应:Pb(Hg) ─→Pb2+(a) + 2e-+ Hg(l)Pb ─→Pb2+(a) + 2e-其电极电势公式分别为及,这两个反应相应的φ及φ∃是否相同?12. 2 分将反应Cl-(a1)→Cl-(a2)设计成电池的表示式为:__________________________________________。
2019高中物理 第九章 固体、液体的物态变化章末质量评估 新人教版选修3-3

第九章固体、液体的物态变化章末质量评估(三)(时间:90分钟满分:100分)一、单项选择题(本大题共10小题,每小题3分,共30分.在每小题给出的四个选项中,只有一个选项符合题目要求)1. 在严寒的冬季,小明到滑雪场滑雪,恰逢有一块空地正在进行人工造雪.他发现造雪机在工作过程中,不断地将水吸入,并持续地从造雪机的前方喷出“白雾”,而在“白雾“下方,已经沉积了厚厚的一层“白雪”,如图所示.对于造雪机在造雪过程中,水这种物质发生的最主要的物态变化,下列说法中正确的是()A.凝华B.凝固C.升华D.液化解析:造雪机工作时把液态水变为固态的雪,故水发生了凝固现象.答案:B2.下面说法正确的是( )A.鸭子从池塘中出来,羽毛并不湿——毛细现象B.细玻璃棒尖端放在火焰上烧熔后尖端变成球形——表面张力C.粉笔能吸干纸上的墨水——浸润现象D.布做的雨伞,虽然纱线间有空隙,却不漏雨水——毛细现象解析:A是不浸润现象,B是表面张力,C是毛细现象,D是不浸润现象.答案:B3.某球形固体物质,其各向导热性能相同,则该物体( )A.一定是非晶体B.可能具有确定的熔点C.一定是单晶体,因为它有规则的几何外形D.一定不是单晶体,因为它具有各向同性的物理性质解析:导热性能各向相同的物体可能是非晶体,也可能是多晶体,因此,A选项错误;多晶体具有确定的熔点,因此B选项正确;物体外形是否规则不是判断是否是单晶体的依据,应该说,单晶体具有规则的几何外形是“天生”的,而多晶体和非晶体也可以有规则的几何外形,当然这只能是“后天”人为加工的,因此C选项错误;单晶体也不一定各个物理特性都具有各向异性,故D选项错误.答案:B4.关于饱和汽,说法不正确的是( )A.在稳定情况下,密闭容器中如有某种液体存在,其中该液体的蒸汽一定是饱和的B.密闭容器中有未饱和的水蒸气,向容器内注入足够量的空气,加大气压可使水汽饱和C.随着液体的不断蒸发,当液化和汽化速率相等时,液体和蒸汽达到的一种平衡状态叫动态平衡D.对于某种液体来说,在温度升高时,由于单位时间内从液面汽化的分子数增多,所以其蒸汽饱和所需要的压强增大解析:在饱和状态下,液化和汽化达到动态平衡,即达到稳定状态,所以A、C正确;液体的饱和汽压与其温度有关,即温度升高,饱和汽压增大,所以D正确;饱和汽压是指液体蒸汽的分气压,与其他气体的压强无关,所以B错误.答案:B5.某实验小组想测试两种材料的导电性能,他们将这两种材料加工成厚度均匀、横截面为正方形的几何体,分别如图甲、乙所示,经测试发现,材料甲沿ab、cd两个方向的电阻相等,材料乙沿ef方向的电阻大于沿gh 方向的电阻,关于这两种材料,下列说法中正确的是( )A.材料甲一定是晶体B.材料甲一定是非晶体C.材料乙一定是单晶体D.材料乙一定是多晶体解析:测试发现,材料甲沿ab、cd两个方向的电阻相等,材料乙沿ef方向的电阻大于沿gh方向的电阻,说明了甲具有各向同性,而乙具有各向异性,单晶体的物理性质是各向异性的,所以乙一定是单晶体,而多晶体和非晶体是各向同性的,材料甲可能是多晶体,也可能不是晶体.故只有选项C正确.答案:C6.在吉尼斯大全中,记述了一个人创造了赤着脚在650 ℃的燃烧着的一长堆木炭上步行了约7.5 m的“世界之最”纪录.关于他创下的这个奇迹,下面说法正确的是( )A.这个表演者一定在脚下事先抹上了一种高级绝热防护剂B.这个表演者一定是跳跃式地走过去的,这样做接触时间短,炭火来不及灼伤脚C.这个表演者一定是用汗脚踩在炭火上一步步轻松地走过去的D.这个表演者一定是轻轻地踮着脚走过去的,这样做接触面积小,即使灼伤也不厉害解析:当赤着的脚踩上炭火时,灼热的炭火使脚底的汗水迅速汽化,立即在脚底下形成一个很薄的蒸气层.由于气体是热的不良导体,在一段短暂的时间内,对脚板将起到绝热防护作用,行走中脚上流出的汗水部分地补偿了汽化所需的水分.而跳跃或踮着脚走均不能提供足够的汗水,且容易使脚陷进炭火,从而使保护层失效.故应选C.答案:C7.下列说法中正确的是( )A.一定质量的理想气体在体积不变的情况下,压强p与摄氏温度t成正比B.竹筏漂浮在水面上,是液体表面张力作用的结果C.同种物质可能以晶体或非晶体两种形态出现D.液晶是一种特殊物质,它既具有液体的流动性,又像某些晶体具有光学各向同性解析:根据查理定律可知,一定质量的理想气体在体积不变的情况下,压强p与热力学温度K成正比,故A 错误;竹筏漂浮在水面上,是受到浮力作用的结果,故B错误;同种物质可能以晶体或非晶体两种形态出现,故C正确;液晶是一种特殊物质,它既具有液体的流动性,又像某些晶体具有光学各向异性,故D错误.答案:C8.下列说法不正确的是( )A.浸润液体在细管里能上升B.不浸润液体在细管里能下降C.在建筑房屋时,在砌砖的地基上要铺一层油毡或涂过沥青的厚纸,这是为了增加毛细现象使地下水容易上升D.农田里如果要保存地下的水分,就要把地面的土壤锄松,以减少毛细现象的发生解析:毛细现象和液体的浸润、不浸润相联系.浸润液体在细管中能上升,不浸润液体在细管中下降,故A、B正确.建筑房屋的时候,在砌砖的地基上铺一层油毡或涂过沥青的厚纸,防止地下的水分沿着夯实的地基以及砖墙的毛细管上升,以使房屋保持干燥.土壤里有很多毛细管,地下的水分可以沿着它们上升到地面.如果要保存地下的水分,就要把地面的土壤锄松,破坏这些土壤里的毛细管.相反,如果想把地下的水分引上来,就不仅要保持土壤里的毛细管,而且还要使它们变得更细,这时就要用磙子压紧土壤,所以C错、D对.答案:C9.液体的饱和汽压随温度的升高而增大()A.其规律遵循查理定律B.是因为饱和汽的质量随温度的升高而增大C.是因为饱和汽的体积随温度的升高而增大D.是因为饱和汽密度和蒸汽分子的平均速率都随温度的升高而增大解析:液体的饱和汽压与温度有关,液体的饱和汽压随温度的升高而增大,与体积、质量无关,故A、B、C 错误,D正确.答案:D10.100 ℃的水蒸气和等质量0 ℃的冰混合后达到热平衡时为(已知水的汽化热L=2.26×106 J/kg,冰的熔化热λ=3.34×105 J/kg)( )A.0 ℃的冰水混合物B.0 ℃的水C.高于0 ℃的水D.100 ℃的水、汽混合物解析:设水蒸气和冰的质量均为m kg,混合后若水蒸气完全液化成100 ℃的水,放出的热量Q1=Lm=2.26×106m.冰完全熔化成0 ℃的水需吸收的热量Q2=λm=3.34×105m,0 ℃的水温度上升至100 ℃需要吸收的热量Q3=cmΔt=4.2×103m×(100-0)=4.2×105m,因为Q1>Q2+Q3,可见水蒸气并未完全液化,所以两者混合后达到热平衡时为100 ℃的水、汽混合物.答案:D二、多项选择题(本大题共4小题,每小题4分,共16分.在每小题给出的四个选项中,有多个选项符合题目要求)11.人类对物质属性的认识是从宏观到微观不断深入的过程.以下说法正确的是( )A.液体的分子势能与体积有关B.晶体的物理性质都是各向异性的C.温度升高,每个分子的动能都增大D.露珠呈球状是由于液体表面张力的作用解析:液体体积与分子间相对位置相联系,从宏观上看,分子势能与体积有关,A正确.多晶体表现各向同性,B错误.温度升高,分子平均速率增大,遵循统计规律,C错误.露珠表面张力使其表面积收缩到最小,呈球状,D正确.答案:AD12.在云母薄片和玻璃片上分层涂一别很薄的石蜡,然后用烧热的钢针去接触云母薄片及玻璃片的反面,石蜡熔化,如图所示,那么( )A.熔化的石蜡呈圆形的是玻璃片B.熔化的石蜡呈圆形的是云母片C.实验说明玻璃片有各向同性,可能是非晶体D.实验说明云母有各向同性,是晶体解析:云母片在导热这一物理性质上具有各向异性,而玻璃片则是各向同性.答案:AC13.关于饱和汽和相对湿度,下列说法正确的是()A.饱和汽压跟热力学温度成正比B.温度一定时,饱和汽的密度为一定值,温度升高,饱和汽的密度增大C.空气的相对湿度定义为水的饱和汽压与相同温度时空气中所含水蒸气的压强之比D.空气的相对湿度越大,空气中水蒸气的压强越接近饱和汽压解析:饱和汽压是物质的一个重要性质,它的大小取决于物质的本性和温度;故一定温度下饱和汽的分子数密度是一定值,相同温度下不同液体的饱和汽压一般是不同的;但饱和汽压不是与热力学温度成正比,故A错误、B正确;相对湿度是指水蒸气的实际压强与该温度下水蒸气的饱和压强之比,故C错误;根据相对湿度的特点可知,空气的相对湿度越大,空气中水蒸气的压强越接近饱和汽压,故D正确.答案:BD14.如图是两种不同物质的熔化曲线,根据曲线判断下列说法正确的是( )A.a是晶体B.b是晶体C.a是非晶体D.b是非晶体解析:晶体在熔化过程中不断吸热,但温度却保持不变(熔点对应的温度),而非晶体没有确定的熔点,加热过程,非晶体先变软,然后温度不断升高,则a是晶体,b是非晶体。
物理化学模拟试题及答案(10套)

物理化学模拟试题(1)(试卷共4页,答题时间120分钟)一、选择题(每小题 20 分,共 2 分。
请将答案填在下面的表格内)1、盐碱地的农作物长势不良,甚至枯萎,主要原因是 ( ) A. 盐碱地的土壤有毒 B. 使农作物肥料不足C. 很少下雨的原因D. 渗透压的存在使农作物水分倒流2、已知Cu 的相对原子质量为64,用0.5法拉第电量可从CuSO 4溶液中沉淀出Cu ( )。
A. 16gB. 32gC. 64gD. 128g3、在298K 、无限稀释的水溶液中,摩尔电导率最大的是 ( )A. 31La 3+B. 21Mg 2+ C. NH 4+ D. H +4、273 K ,10标准大气压下,液态水和固态水(即冰)的化学势分别为μ(l) 和μ(s),两者达到平衡时,其关系为( )A μ(l) >μ(s)B μ(l) = μ(s)C μ(l) < μ(s)D 不能确定5、在温度、压力恒定条件下,设A(l)和B(l)混合形成理想溶液,则有:( )A. 0,0,0,0<∆>∆=∆=∆m mix m mix m mix m mix G S H VB. 0,0,0,0=∆=∆>∆<∆m mix m mix m mix m mix G S H VC. 0,0,0,0<∆<∆>∆>∆m mix m mix m mix m mix G S H VD. 0,0,0,0=∆<∆<∆<∆m mix m mix mix m mix G S H V6、在302K 时,A →B 过程△H=-102kJ ,△S=-330 J·K -1,可判断该过程: A.自发 B.非自发 C.平衡 D.无法判断7、对反应CH 4 (g) + 2O 2 (g) = CO 2 (g) + 2H 2O (g),若压力增大1倍,则将发生:A.平衡向右移动B.平衡向左移动C.不改变平衡D.反应进行到底 8、如果其它条件系统,沉淀在电池阴极的物质的量正比于:A. 阴极表面积B. 通过电池的电荷量C. 溶液中电解质浓度D. 电极间距离 9、下列函数中为强度性质的是:( )A SB (∂G /∂p )TC (∂U /∂V )TD C V 10、理想气体经可逆与不可逆两种绝热过程:( ) A 可以从同一始态出发达到同一终态 B 从同一始态出发,不可能达到同一终态 C 不能断定A 、B 中哪一种正确D 可以达到同一终态,视绝热膨胀还是绝热压缩而定二、填空题(每小题 2 分,共 20 分)1、对于一个U 、V 、N 一定的系统,任何一种分布都必须满足的两个条件是和2、25℃时某KCl 溶液中,如果K +迁移数为0.490,则Cl -迁移数为____。
物理化学实验模拟试卷C

物理化学实验模拟试卷C班级姓名分数一、选择题( 共10题20分)1. 2 分开启气体钢瓶的操作顺序是:( ) (1) 顺时针旋紧减压器旋杆; (2) 反时针旋松减压旋杆;(3) 观测低压表读数;(4) 观测高压表读数;(5) 开启高压气阀(A) 5─4─3─1 (B) 2─5─4─1─3(C) 1─5─4─2─3 (D) 2─5─12. 2 分在测定H2O2在KI水溶液中均相催化分解速率常数时, 加入(1) H2O2, (2) KI溶液的方法是:( )(A) (1), (2)同时一起加入(B) 先(1), 后(2)(C) 先(2), 后(1) (D) 不必注意加入的方法3. 2 分在双液系气液平衡实验中, 常选择测定物系的折光率来测定物系的组成。
下列哪种选择的根据是不对的? ( )(A) 测定折光率操作简单(B) 对任何双液系都能适用(C) 测定所需的试样量少(D) 测量所需时间少, 速度快4. 2 分已知环己烷、醋酸、萘、樟脑的摩尔凝固点降低常数K f 分别为6.5, 16.60, 80.25及173, 今有一未知物能在上述四种溶剂中溶解, 欲测定该化合物之摩尔质量, 最适宜的溶剂是:( )(A) 萘(B) 樟脑(C) 环己烷(D) 醋酸5. 2 分饱和标准电池在20℃时电动势为:( )(A) 1.01845 V(B) 1.01800 V(C) 1.01832 V(D) 1.01865 V6. 2 分使用分光光度计测量吸光度D,为了使测得的D更精确,则应:( )(A) 在最大吸收波长进行测定(B) 用比较厚的比色皿(C) 用合适浓度范围的测定液(D) 选择合适的波长,比色皿及溶液浓度,使D值落在0 ~ 0.8 区间内7. 2 分用对消法测量可逆电池的电动势时,如发现检流计光标总是朝一侧移动,而调不到指零位置,与此现象无关的因素是:( )(A) 工作电源电压不足(B) 工作电源电极接反(C) 测量线路接触不良(D) 检流计灵敏度较低8. 2 分在差热分析中, 都需选择符合一定条件的参比物, 对参比物的要求中哪一点应该除外? ( )(A) 在整个实验温度范围是热稳定的(B) 其导热系数与比热尽可能与试样接近(C) 其颗粒度与装填时的松紧度尽量与试样一致(D) 使用前不能在实验温度下预灼烧9. 2 分具有永久磁矩μm的物质是:( )(A) 反磁性物质(B) 顺磁性物质(C) 铁磁性物质(D) 共价络合物*. 2 分在氧弹实验中, 若测得∆c H m=-5140.7 kJ·mol-1, ∆│∆H│最大=25.47 kJ·mol-1,则实验结果的正确表示应为: ( )(A) ∆c H m= -5140.7 kJ·mol-1(B) ∆c H m= -5140.7±25.47 kJ·mol-1(C) ∆c H m= -(5.1407±0.02547)×103 kJ·mol-1(D) ∆c H m= -5140.7±25.5 kJ·mol-1二、填空题( 共9题18分)11. 2 分具有何种特性的电解质可用来作盐桥,常用作盐桥的电解质有______ 和________ 等。
(完整word版)《物理化学》高等教育出版(第五版)第九章

第九章电解质溶液练习题一、判断题:1.溶液是电中性的,正、负离子所带总电量相等,则正、负离子离子的迁移数也相等。
2.离子迁移数与离子速率成正比,某正离子的运动速率一定时,其迁移数也一定。
3.离子的摩尔电导率与其价态有关系。
4.电解质溶液中各离子迁移数之和为1。
5.电解池通过l F电量时,可以使1mol物质电解。
6.因离子在电场作用下可以定向移动,所以测定电解质溶液的电导率时要用直流电桥。
7.无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
8.电解质的无限稀摩尔电导率Λ∞m可以由Λm作图外推到c1/2 = 0得到。
下列关系式是否正确:(1) Λ∞,1<Λ∞,2<Λ∞,3<Λ∞,4(2)κ1=κ2=κ3=κ4(3)Λ∞,1=Λ∞,2=Λ∞,3=Λ∞,4(4)Λm,1=Λm,2=Λm,3=Λm,410.德拜—休克尔公式适用于强电解质。
11.对于BaCl2溶液,以下等式成立:(1) a = γb/b0;(2) a = a+·a - ; (3) γ± = γ+·γ - 2;(4) b = b+·b-;(5) b±3 = b+·b-2; (6) b± = 4b3。
12.若a(CaF2) = 0.5,则a(Ca2+) = 0.5 ,a(F-) = 1。
二、单选题:1.下列溶液中哪个溶液的摩尔电导最大:(A) 0.1M KCl水溶液;(B) 0.001M HCl水溶液;(C) 0.001M KOH水溶液;(D) 0.001M KCl水溶液。
2.对于混合电解质溶液,下列表征导电性的量中哪个不具有加和性:(A) 电导;(B) 电导率;(C) 摩尔电导率;(D) 极限摩尔电导。
3.在一定温度和较小的浓度情况下,增大强电解质溶液的浓度,则溶液的电导率κ与摩尔电导Λm变化为:(A) κ增大,Λm增大;(B) κ增大,Λm减少;(C) κ减少,Λm增大;(D) κ减少,Λm减少。
《物理化学(第五版)》第九章复习题答案
复习题
8.有哪些求算标准电动势EΘ的方法?在公式E zF ln K 中,EΘ是否是电池反应达平衡时的电动势?KΘ是否是
zE F K exp RT
a
复习题
(8).醋酸的解离平衡常数。 电池:Pt|H2(pΘ)|HAc(mHAc),Ac-(mAc-),Cl-(aCl)|AgCl(s)|Ag(s) 净反应:AgCl(s)+H2(pΘ)→H+(aH+)+Cl-(aCl-) +Ag(s
1.可逆电极有哪些主要类型?每种类型试举一例,并写 出该电极的还原反应。对于气体电极和氧化还原电极 在书写电极表示式时应注意什么问题? 答:可逆电极有三种类型: (1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s) (2)金属难溶盐和金属难溶氧化物电极 如: Ag(s)|AgCl(s)|Cl-(m) AgCl(s)+ e- = Ag(s)+Cl-(m) (3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2) 对于气体电极和氧化还原电极,在书写时要标明电极 反应所依附的惰性金属。
RT a H aCl E E ln zF a 1 2 H2 E RT ln m zF m
复习题
(6)Ag2O(s)的标准摩尔生成焓ΔfHmΘ 和分解压。 电池:Ag(s)+Ag2O(s)|OH-(aOH-)|O2(pΘ )|Pt 净反应:Ag2O(s)→1/2O2(pΘ )+2Ag(s) E r H m zE F zFT T p
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学第九章模拟试卷C一、选择题( 共10题20分)1. 极谱分析中加入大量惰性电解质的目的是:( )(A) 增加溶液电导(B) 固定离子强度(C) 消除迁移电流(D) 上述几种都是2. 用铜电极电解0.1mol·kg-1的CuCl2水溶液,阳极上的反应为( )(A) 2Cl- ─→Cl2+ 2e-(B) Cu ─→Cu2++ 2e-(C) Cu ─→Cu++ e-(D) 2OH-─→H2O + 12O2+ 2e-3. 极谱分析仪所用的测量阴极属于下列哪一种?( )(A) 浓差极化电极(B) 电化学极化电极(C) 难极化电极(D) 理想可逆电极4. 电解金属盐的水溶液时, 在阴极上:( )(A) 还原电势愈正的粒子愈容易析出(B) 还原电势与其超电势之代数和愈正的粒子愈容易析出(C) 还原电势愈负的粒子愈容易析出(D) 还原电势与其超电势之和愈负的粒子愈容易析出5. 电解时, 在阳极上首先发生氧化作用而放电的是:( )(A) 标准还原电势最大者(B) 标准还原电势最小者(C) 考虑极化后,实际上的不可逆还原电势最大者(D) 考虑极化后,实际上的不可逆还原电势最小者6. 298 K、0.1 mol·dm-3的HCl 溶液中,氢电极的热力学电势为-0.06 V,电解此溶液时,氢在铜电极上的析出电势φH2为:( )(A) 大于-0.06 V (B) 等于-0.06 V (C) 小于-0.06 V (D) 不能判定7. 电池在恒温、恒压及可逆情况下放电, 则其与环境的热交换为( )(A) ∆r H(B) T∆r S(C) 一定为零(D) 与∆r H与T∆r S均无关8. 电解混合电解液时,有一种电解质可以首先析出,它的分解电压等于下列差值中的哪一个?式中φ平,φ阴和φ阳分别代表电极的可逆电极电势和阴、阳极的实际析出电势。
( )(A) φ平,阳-φ平,阴(B) φ阳+ φ阴(C) φ阳(最小)-φ阴(最大)(D) φ阳(最大)-φ阴(最小)9. 以石墨为阳极,电解0.01 mol·kg-1 NaCl 溶液,在阳极上首先析出:( )(A) Cl2(B) O2(C) Cl2与O2混合气体(D) 无气体析出已知:φ∃ (Cl2/Cl-)= 1.36 V , η(Cl2)= 0 V ,φ∃ (O2/OH-)= 0.401V , η(O2) = 0.8 V 。
*. 298K,101.325 kPa 下,以1 A 的电流电解CuSO4溶液,析出0.1 mol 铜,需时间大约是:( )(A) 20.2 h (B) 5.4 h (C) 2.7 h (D) 1.5 h二、填空题( 共9题18分)11. 将一Pb 酸蓄电池在10.0 A 电流下充电1.5 h,则PbSO4分解的质量为。
(已知M(PbSO4)= 303 g·mol-1)12.在锌电极上,H2的超电势为0.75 V,电解一含Zn2+的浓度为1×10-5 mol·kg-1的溶液,为了不使H2(g)析出,问溶液的pH 值应控制在______。
已知25℃时,φ∃(Zn2+/Zn)= -0.763 V 。
13. 电极表面反应速率r与电流密度j之间应满足_______________关系。
14. 电池Pb(s)│H2SO4(m)│PbO2(s),作为原电池时,负极是,正极是;作为电解池时,阳极是,阴极是。
15. 电池放电时,随电流密度增加阳极电位变________,阴极电位变________,正极变________ ,负极变_____。
16. 采用三电极装置研究超电势时, 一般采用鲁金毛细管, 其作用为________________, 采用搅拌其作用为_______________________________。
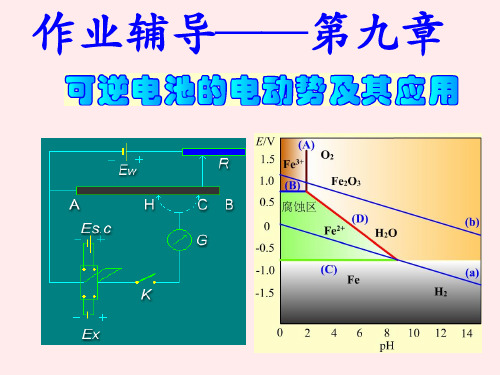
17. 铜板上有一些铁的铆钉, 长期暴露在潮湿的空气中, 在__________部位特别容易生锈。
18. 已知φ∃ (Fe2+/Fe)= -0.440 V, φ∃ (Cu2+/Cu) = 0.337 V,在25℃, p∃时,以Pt 为阴极,石墨为阳极,电解含有FeCl2(0.01 mol·kg-1)和CuCl2(0.02 mol·kg-1)的水溶液,若电解过程不断搅拌溶液,且超电势可忽略不计,则最先析出的金属是______。
19. 已知电极(1)Pt│H2, H+, (2)Pt│Fe3+, Fe2+, 和(3)Pb│H2, H+的交换电流密度j e分别为:(1) 0.79 mA·cm-2; (2) 2.5 mA·cm-2; (3) 5.0×10-12 A·cm-2。
当它们在298 K处于平衡态时, 每秒有多少电子或质子通过双电层被输送?(1) _____________cm-2·s-1;(2) _____________cm-2·s-1;(3) _____________cm-2·s-1。
三、计算题( 共5题40分)20. 298 K 时,用铂电极电解1 mol·dm-3的H2SO4(不考虑活度系数):(1) 计算理论分解电压(2) 若两电极面积均为1cm2,电解液电阻为100 Ω,H2和O2的超电势η(V)与电流密度j (A·cm-2) 的关系分别为ηH2= 0.472 + 0.118 lg jηO2= 1.062 + 0.118 lg j问当通过的电流为1 mA 时,外加电压为若干?已知:φ∃ (O2,H2O,H+) = 1.229 V 。
21. 金属的腐蚀是氧化作用,金属作原电池的阳极,在不同的pH 条件下,水溶液中可能有下列几种还原作用:酸性条件:2H3O+ + 2e-=2H2O + H2(p∃) O2(p∃) + 4H+ + 4e-→2H2O碱性条件:O2(p∃) + 2H2O + 4e-→4OH-所谓金属腐蚀是指金属表面附近能形成离子浓度至少为1×10-6 mol·kg-1。
现有如下6 种金属:Au,Ag,Cu,Fe,Pb 和Al,试问哪些金属在下列pH 条件下会被腐蚀:(甲)强酸性溶液pH = 1 (乙)强碱性溶液pH = 14(丙)微酸性溶液pH = 6 (丁)微碱性溶液pH = 8 设所有活度系数均为1。
已知φ∃ (Al3+/Al)= -1.66 V, φ∃ (Cu2+/Cu)= 0.337 V, φ∃ (Fe2+/Fe)= -0.440 V ,φ∃ (Pb2+/Pb)= -0.126 V, φ∃ (Au+/Au)= 1.50 V。
.22. 298 K时, 用Pt阳极Cu阴极电解0.10 mol·dm-3 CuSO4溶液, 电极的面积为50 cm2, 电流保持在0.040 A, 并采取措施, 使浓差极化极小。
若电解槽中含1dm3溶液, 试问至少电解多少时间后, H2才会析出?此时剩余Cu2+的浓度为多少? 设活度系数均为1。
已知氢在铜上之η=a+blg j, a=0.80 V, b=0.115 V, φ∃ (Cu2+/ Cu) =0.337 V。
23. 求在Fe 电极上, 自1mol·kg-1KOH 水溶液中,每小时电解出氢100 mg·cm-2时应维持的电势(氢标)。
(已知:a = -0.76 V,b = -0.11V)24. 若氢在Cd、Hg 电极上的超电势,在所讨论电流密度范围内服从塔菲尔公式η= a + blg j. 对于这两个电极, 其b 值都为0.118 V,但两电极的a 值不同。
氢在这些电极上析出时的传递系数α均为0.5。
电极反应得失电子数均为1。
氢在Cd 和Hg 上的交换电流j。
分别是1×10-7A·m-2和6×10-9 A·m-2。
求在298 K时,两电极通过相同的电流密度情况下,氢在Hg、Cd 两电极上的超电势的差值。
四、问答题( 共3题20分)25. (1) 试导出同一电极反应在不同的超电势时, 反应速率(即电流密度j)之比的表达式;(2) 25℃时,1 mol·dm-3的KOH溶液用镀铂黑的铂电极电解,使它在阳极上产生O2, 当超电势为0.4V时, 电流密度j=10-3 A·cm-2, 若超电势为0.6 V, j为多少? (设对称因子或传递系数β=0.5)26. 298 K 时, 某钢铁容器内盛pH = 4.0 的溶液,试通过计算说明此时钢铁容器是否会被腐蚀?假定容器内Fe2+浓度超过10-6 mol·dm-3时,则认为容器已被腐蚀。
已知:φ∃ (Fe2+/Fe) = -0.4402 V,H2在铁上析出时的超电势为0.40 V。
27. 试述电极过程产生超电势的原因。
参考答案一、选择题( 共10题20分)1. (C)2. (B)3. (A)4. (B)5. (D)6. (C)7. (B)8. (C)9. (A) *. (B)二、填空题( 共9题18分)11. PbO2+ Pb + 2H2SO4=2PbSO4+ 2H2O(10 A×1.5×3600 s)/(96500 C·mol-1 )×1/2×303 g·mol-1 = 84.8g12. 若φ(Zn2+/Zn) > φ(H+/H2) 时,则Zn 析出,而H2不能析出,即-0.763 - 0.05917/2×lg (1/10-5) > (-0.0591pH - 0.75) pH > 2.7213. j = nFr14. Pb│H2SO4(m) PbO2│H2SO4(m) Pb│H2SO4(m) PbO2│H2SO4(m)15. 正,负,负,正16.降低电阻超电势; 降低浓差超电势. 17.铆钉18. φ(Fe2+/Fe) = φ∃+ RT/2F×ln 0.01 = -0.4992 Vφ(Cu2+/Cu) = φ∃+ RT/2F×ln 0.02 = 0.2868 V 最先析出的是Cu19.电子的电流密度是j e/e, 因每个电子携带电量大小为e, 则:(1)4.94×1015 cm-2·s-1 (2) 1.56×1016 cm-2·s-1 (3) 3.12×107 cm-2·s-1三、计算题( 共5题40分)20. E理论=E = E∃= φ∃ (H+,H2O/O2) - φ∃ (H+/H2)= 1.229 VE外加=E理论+ IR + η++ η- = 2.155 V21. 若金属氧化与析氢或吸氧反应组成的原电池的E > 0,则金属发生腐蚀氧化反应:φ(M n+/M) = φ∃ (M n+/M) + RT/F×ln 1/a(M n+)= φ∃ (M n+/M) - 0.354/z(1) φ(Al3+/Al) = -1.78 V φ(Cu2+/Cu) = 0.160 Vφ(Fe2+/Fe) = -0.617 V φ(Ag+/Ag) = 0.445 Vφ(Pb2+/Pb) = -0.303 V φ(Au3+/Au) = 1.38 V2pH = 1,若析H2腐蚀,Al ,Fe ,Pb 被腐蚀,吸氧腐蚀则除Au 外均被腐蚀pH = 8,Al , Fe , Pb 被腐蚀pH = 14,Al,Fe,被腐蚀22.电解反应Cu2++H2O ──→Cu +12O2+2H+φ(Cu2+/Cu)=φ(H+/H2)0.337+(0.05915/2)lgα (Cu2+) =0.05915lg[2×(0.10-α (Cu2+))]-[a+b lg(I/A)]解得[Cu2+]=1.6×10-28 mol·dm-3电解需时:t=Q/I=nF/I=2×0.10×96500/0.040=4.83×105 s =134 h23. j = Q/t = 2.68 A·cm -2η(H2│Fe) = a + b lg j = -0.81 V φ = φ(H+/H2) + η = -1.64 V24. ηm = - 2.303RT/αzF×lg j°(m) + 2.303RT/αzF×lg jη(Hg) - η(Cd)= 2.303RT/αzF×lg j°(Cd)/j°(Hg)= 0.333 V四、问答题( 共3题20分)25. (1) 据Tafel公式η= a+blg j可得:(η2-η1)=blg(r2/r1) 即r2/r1=10exp[(η2-η1)/b](2) b = 2.303RT/βF = 0.12 V因为r2/r1 =10exp(0.2/0.12) =46 所以r2=46×10-3 A·cm226. φ(H+/H2) = (- 0.05916 pH - 0.40)V = -0.6366 Vφ(Fe2+/Fe) = -0.6177 Vφ(Fe2+/Fe) > φ(H+/H2),Fe2+易还原为Fe,H2被氧化为H+,故容器不被腐蚀。
