大学化学基础-刘静-第九章滴定分析法概论
合集下载
第九章 滴定分析法

2 2 3 3 2 3
湖 3 南 农 业 大 学 应 用 化 学 系
K a3 3.2 1012 107
不能被滴定
第九章 滴定分析方法
无 机 (2) 多元碱的滴定 及 多元碱的滴定与多元酸的滴定相似,滴定判据中的 Ka 分 析 换成 Kb 即可。 化 学 湖 南 农 业 大 学 应 用 化 学 系
例题2 Na 2CO3 的滴定
2 CO3 +H 2O=HCO3 +OH HCO3 +H 2O=H 2CO3 +OH
K b 1.8 104 1 K b2 2.38 108
第九章 滴定分析方法
无 机 及 分 析 化 学 湖 南 农 业 大 学 应 用 化 学 系
第九章 滴定分析方法
无 机 4 应用示例 及 分 (1) 混合碱的测定(双指示剂法) 析 a. Na2CO3 与 NaHCO3 混合碱的测定 化 学 HCl标液滴定 湖 南 Na2CO3 + NaHCO3 农 V1 0 业 大 酚酞终点 NaHCO3 NaHCO3 学 V1 V2-V1 应 用 甲基橙终点 H2O + CO2 化 学 系
20.00 19.98 pK a lg 0.1000 7.74 19.98
第九章 滴定分析方法
无 机 及 分 析 化 学
3 理论终点时 溶液为0.05mol L -1 NaAc c(OH- ) K b c(Ac ) mol L-1 5.6 1010 0.050 00 mol L-1 5.34 106 pH 14 pOH 8.72
湖 南 4 理论终点后 当加入VNaOH 20.02mL Er 0.1% 农 业 pH 9.70 大 学 可见,该滴定的滴定突跃范围 7.74~9.70,选择酚酞、 应 用 百里酚酞作指示剂 化 学 系
湖 3 南 农 业 大 学 应 用 化 学 系
K a3 3.2 1012 107
不能被滴定
第九章 滴定分析方法
无 机 (2) 多元碱的滴定 及 多元碱的滴定与多元酸的滴定相似,滴定判据中的 Ka 分 析 换成 Kb 即可。 化 学 湖 南 农 业 大 学 应 用 化 学 系
例题2 Na 2CO3 的滴定
2 CO3 +H 2O=HCO3 +OH HCO3 +H 2O=H 2CO3 +OH
K b 1.8 104 1 K b2 2.38 108
第九章 滴定分析方法
无 机 及 分 析 化 学 湖 南 农 业 大 学 应 用 化 学 系
第九章 滴定分析方法
无 机 4 应用示例 及 分 (1) 混合碱的测定(双指示剂法) 析 a. Na2CO3 与 NaHCO3 混合碱的测定 化 学 HCl标液滴定 湖 南 Na2CO3 + NaHCO3 农 V1 0 业 大 酚酞终点 NaHCO3 NaHCO3 学 V1 V2-V1 应 用 甲基橙终点 H2O + CO2 化 学 系
20.00 19.98 pK a lg 0.1000 7.74 19.98
第九章 滴定分析方法
无 机 及 分 析 化 学
3 理论终点时 溶液为0.05mol L -1 NaAc c(OH- ) K b c(Ac ) mol L-1 5.6 1010 0.050 00 mol L-1 5.34 106 pH 14 pOH 8.72
湖 南 4 理论终点后 当加入VNaOH 20.02mL Er 0.1% 农 业 pH 9.70 大 学 可见,该滴定的滴定突跃范围 7.74~9.70,选择酚酞、 应 用 百里酚酞作指示剂 化 学 系
大学化学基础——刘静——第九章_滴定分析法概论

计量点之间的差别。
精选课件ppt
4
1.滴定方法介绍及分类
滴定分析法特点
• 简便、快速,适于常量分析(含量>1%) • 准确度高(相对误差 0.2%) • 应用广泛
精选课件ppt
5
1.滴定方法介绍及分类
按被测物与标准溶液的反应类型,可将滴定分 析法分为四类:
按反应类型分类
酸碱滴定法:酸碱中和反应; 配位滴定法:配位反应; 氧化还原滴定法:氧化还原反应; 沉淀滴定法:沉淀反应。
精选课件ppt
14
间接滴定法
例:Ca2+ 的测定
Ca2+
CaC2O4沉淀
H2SO4
KMnO4标液
C2O42-
间接测定
精选课件ppt
15
4.基准物及标准溶液的配制
4.1 概念 ➢ 标准溶液:浓度准确已知的溶液
➢ 基准物质:能用于直接配制或标定标准溶 液的物质
精选课件ppt
16
4.基准物及标准溶液的配制
4.2 对基准物质的要求:
a.试剂的组成与化学式完全相符 b.具有较大的摩尔质量 c.纯度高(含量≥99.9%) d.性质稳定
精选课件ppt
17
4.基准物及标准溶液的配制
4.3 标准溶液的配制方法
(1)直接配制法: 基准物质 称量 溶解 定量转移至 容量瓶 稀释至刻度 根据称量的质量 和体积计算标准溶液的准确浓度
注意:要“准确”地称取、转移。
精选课件ppt
18
4.基准物及标准溶液的配制
(2)间接配制法
标定法:利用基准物质确定溶液准确浓度。
比较法:用一种已知浓度的标液来确定另 一种溶液的浓度方法。
精选课件ppt
精选课件ppt
4
1.滴定方法介绍及分类
滴定分析法特点
• 简便、快速,适于常量分析(含量>1%) • 准确度高(相对误差 0.2%) • 应用广泛
精选课件ppt
5
1.滴定方法介绍及分类
按被测物与标准溶液的反应类型,可将滴定分 析法分为四类:
按反应类型分类
酸碱滴定法:酸碱中和反应; 配位滴定法:配位反应; 氧化还原滴定法:氧化还原反应; 沉淀滴定法:沉淀反应。
精选课件ppt
14
间接滴定法
例:Ca2+ 的测定
Ca2+
CaC2O4沉淀
H2SO4
KMnO4标液
C2O42-
间接测定
精选课件ppt
15
4.基准物及标准溶液的配制
4.1 概念 ➢ 标准溶液:浓度准确已知的溶液
➢ 基准物质:能用于直接配制或标定标准溶 液的物质
精选课件ppt
16
4.基准物及标准溶液的配制
4.2 对基准物质的要求:
a.试剂的组成与化学式完全相符 b.具有较大的摩尔质量 c.纯度高(含量≥99.9%) d.性质稳定
精选课件ppt
17
4.基准物及标准溶液的配制
4.3 标准溶液的配制方法
(1)直接配制法: 基准物质 称量 溶解 定量转移至 容量瓶 稀释至刻度 根据称量的质量 和体积计算标准溶液的准确浓度
注意:要“准确”地称取、转移。
精选课件ppt
18
4.基准物及标准溶液的配制
(2)间接配制法
标定法:利用基准物质确定溶液准确浓度。
比较法:用一种已知浓度的标液来确定另 一种溶液的浓度方法。
精选课件ppt
大学分析化学经典课件04-滴定分析概论

A%
TT A VT S
100%
0.0056 10 CaO% 100% 93.33% 0.06000
26
第四节
一、基本概念
滴定分析中的化学平衡
分析浓度是平衡体系中各种存在型体的平衡浓
度之和,以符号c表示,即该物质总的浓度。
平衡浓度是指平衡状态时溶液中溶质的各种型
体的浓度,用[ ]表示,溶质各型体浓度之和必等 于总浓度。
返滴定法(剩余滴定法) 置换滴定法 其他间接滴定法
5
返滴定法(剩余滴定法) 先准确加入过量标准溶液,使与试液中的待 测物质或固体试样进行反应,待反应完成以 后,再用另一种标准溶液滴定剩余的标准溶 液的方法 适用:反应较慢或难溶于水的固体试样
6
例1:Al3+ +定过量EDTA标液
剩余EDTA Zn2+标液
例6:测定药用Na2CO3的含量,称取试样0.1230 g,溶 解后用浓度为0.1006mol/L的HCl标准溶液滴定, 终点时消耗该HCl标液23.50 mL,求试样中Na2CO3 的百分含量。 解:
nNa2CO3 nHCl 1 2
a CT VT M A A% 100% t S 1000
概述
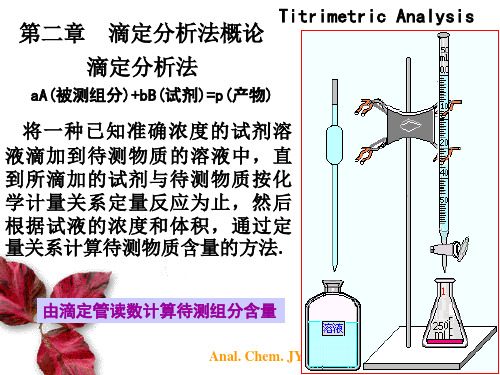
将一种已知准确浓度的试剂溶液-标准 溶液滴加到待测物质的溶液中,直到 所滴加的试剂与待测物质按化学计量 关系定量反应为止,然后根据标准溶 液的浓度和体积,通过定量关系计算 待测物质含量的方法。
2
基本术语:
滴定:将滴定剂通过滴定管滴入待测液中的过程
滴定剂:浓度准确已知的试样溶液
指示剂:滴定分析中能发生颜色改变而指示 终点的试剂 滴定终点(ep):滴定分析中指示剂发生颜色 改变的那一点(实际) 化学计量点(sp):滴定剂与待测溶液按化学计量 关系反应完全的那一点(理论)
定量分析基础—滴定分析法概述(基础化学课件)

滴定液的配制
基准物质应具备的条件 ①试剂的组成与化学式相符合; ②试剂的纯度高,一般要求纯度在99.9%以上; ③试剂的性质稳定; ④具有较大的摩尔质量。
盐酸和氢氧化钠 能否作为基准 物质,为什么?
常用的基准物质有:K2Cr2O7、AgNO3、Na2CO3、KHC8H4O4 、 Na2B4O7·10H2O、Zn等。
TT / A
a t
CT M A
103
例:用0.1000mol/L盐酸滴定液测定氧化钙含量,计算每
1mL0.1000mol/L盐酸滴定液相当于被测物质氧化钙的质量
(THCl/CaO) 2HCl + CaO = CaCl2 + H2O
练习:已知某HCl对CaO的滴定度为0.005608g/mL,求该HCI溶液 的物质的量浓度。(0.2000mol/L)
基本概念
减小终点误差的方法 (1)选择正确的指示剂 (2)半滴加入 (3)控制指示剂用量
滴定分析的主要方法
酸碱滴定法 以质子传递反应为基础的滴定分析法。 沉淀滴定法 以沉淀反应为基础的滴定分析法(银量法)。
Ag+ + X- = AgX↓ 式中: X- 代表Cl- 、Br-、I- 及SCN- 等离子。 氧化还原滴定法 以氧化还原反应为基础的滴定分析方法。 2MnO4- + 5C2O42-+ 16H+ = 2Mn2+ + 10CO2↑ + 8H2O 配位滴定法 以配位反应为基础的滴定分析方法
滴定分析的主要方式--置换滴定法
置换滴定法:先用适当的试剂与被测物质反应,使之定量置换出 一种能被直接滴定的物质,然后再用滴定液滴定置换出来的物质 的方法。 适用:没有定量关系或者伴有副反应的反应。 例:用Na2S2O3滴定K2Cr2O7,将得到S4O62-和SO42- 的混合物, 只能用碘量法测定K2Cr2O7:
滴定分析概论

标准溶液的配制有直接法和标定法
直接配制法:直接用容量瓶配制,定容。 步骤:
(1)称取一定质量的基准物质。
( 2 )用溶剂溶解后定容至一定体 积。 ( 3 )由基准物质的质量及配制的 溶液体积计算确定其准确浓度。
标定法:间接配制法
步骤: (1)配制溶液 配制成近似所需浓度的溶液。 (2)标定 用基准物质或另一种已知准确浓度的标 准溶液来滴定。
返滴定(涉及到两个反应)
例:配位滴定法测定Al3+ 。 在待测的Al3+溶液中先加入准确体积且过量的 EDTA标 准溶液,加热反应完全后,再用 Zn2+ 标准溶液,滴定 过量的EDTA标准溶液。 反应1: Al3+ + Y4-(准确、过量) = AlY 反应2: Zn2+ + Y4- = ZnY
置换滴定(涉及到多个反应)
6 c( K 2Cr2O7 ) V ( K 2Cr2O7 ) M ( Fe ) w( Fe ) 1 m( s ) 33.45 6 0.01500 55.85 1000 0.5000
0.3363
1 c( K 2Cr2O7 ) 6c( K 2Cr2O7 ) 0.01500 6 0.09000 mol / l 6
0.3363
n(I2 ) = 1/2 n(S2O32-)
( 3) K2Cr2O7与 Na2S2O3之间物质的量的关系为: n(Cr2O7 2- ) = 1/3 n(I2 ) = 1/6 n(S2O32-)
间接滴定(涉及到多个反应)
例:氧化还原法测钙 Ca2+ CaC2O4 ↓ 滴定 过滤
洗涤
酸解
C2O42
2 2MnO4 5C2O4 16H 2Mn2 10CO2 8H2O
2-滴定分析法概论0
n m/M m C (取4位有效数字) V V M V
Anal. Chem. JYPC
2.间接配制法: (1)配制溶液(粗配) 步骤:
配制成近似于所需浓度的溶液。 (2)标定——通过滴定来确定溶液浓度的过程 用基准物质(标定法)或另一种已知浓度的标准溶液 (比较法)来滴定。 (3)确定浓度 由基准物质的量(体积、浓度),计算溶液浓度。
解:
法一: 浓盐酸中: 1L mHCl V 1.19 1000 1190 g m 1190 nHCl 12mol M 36.5
由cV c V
' '
cHCl (浓) 12mol/L
c 'V ' 0.1 500 V 4.2mL c 12
Anal. Chem. JYPC
Anal. Chem. JYPC
一、基准物质 1.对基准物质的要求 试剂的组成与化学式相符,包括结晶水 纯度高,性质稳定 具有较大的摩尔质量 试剂参加滴定反应时,定量进行,无副反应 2.常用的基准物(P23表2-1)
无水Na2CO3、Na2B4O7· 2O 10H KHC8H4O4、H2C2O4· 2O 10H CaCO3、Zn、ZnO K2Cr2O7、Na2C2O4 、H2C2O4· 2O 2H NaCl Anal. Chem. JYPC
Cr2O72-+14H++6Fe2+ =2Cr3++6Fe3+ + H2O 适用:不能与滴定剂起化学反应的物质
Anal. Chem. JYPC
Cr2O72-
§2.2 溶液浓度的表示方法 一、物质量的浓度:
B—基本单元
单位体积溶液所含B物质的物质的量
分析化学第9讲滴定分析法概论3

解:以邻苯二甲酸氢钾(KHP)为基准物质,其滴 定反应为:
KHP + NaOH = KNaP + H2O
即
nKHP nNaOH
mKHP (cV )NaOH MKHP
V=20 mKHP=0.10 mol·L-1 2010-3L204.22 g.mol-1=0.40g
V=25 mKHP=0.10 mol·L-1 2510-3L204.22 g.mol-1=0.50g
例. 写出Na(NH4)HPO4 溶液的质子条件式
[H+]+[
H
2
PO
- 4
]+2[H3PO4]
=[
NH3]+[
PO
3- 4
]+[
OH–]
注意:①质子参考水准,是溶液中大量存在并参与质子
1. 分析浓度:
·指单位体积的溶液中含有某种溶质的物质的量。 ·包括:已离解的溶质的浓度和未离解溶质的浓度。 ·单位:mol·L-1 ·表示:c
2.平衡浓度
• 指平衡状态时,溶液中溶质存在的各种型体的实 际浓度称为平衡浓度。
• 单位:mol·L-1 • 表示:[ ] • 例如:[HAc]
3. 分析浓度与平衡浓度的关系
三、溶液中化学平衡的处理方法
1. 质量平衡(Mass balance) 在平衡状态下某一组分的分析浓度等于该组分各种型 体的平衡浓度之和。 用质量平衡式(Mass balance equation)表示
例如, c mol/L Na2CO3溶液的质量平衡式为: [Na+] = 2c
[H2CO3]+
[HCO
③ 通过控制溶液的酸度可得到所需的型体。
HAc、Ac-分布系数与溶液pH值的关系曲线
滴定分析法概论

aA
(被测物)
+
(滴定液)
tT
=
(生成物) (生成物)
cC
+ dD
n A : nT a : t
nA : CTVT a : t
全国高职高专 “十二五”规划教材
Analytical Chemistry
分析化学
2.1.1 滴定反应的基本术语
指示剂:滴定过程中,加入被测溶液中,利用
它的颜色变化指示实验终点到达的辅助试剂。
tT + aA = cC + dD
a nT t 2.3.2 滴定分析计算公式应用 nA =
1.有关配制滴定液的计算 例2-2 准确称取基准物质K2Cr2O7 2.9418g,用适量的溶剂溶 解后,定量转移到500.00mL容量瓶中并稀释至刻度,计算溶液 物质的量浓度是多少?
CK 2C r 2O 7 = m K 2Cr 2O 7 / M K 2Cr 2O 7 VK 2Cr 2O 7 = 2.9418 / 294.18 -1 = 0.02000mol L 500.0 10- 3
全国高职高专 “十二五”规划教材
Analytical Chemistry
分析化学
《分析化学》
电子配套课件
全国高职高专 “十二五”规划教材
Analytical Chemistry
分析化学
第2章
2.1 概述 2.2 标准溶液
滴定分析法概论
2.3 滴定分析的计算 2.4 小结
2.5 能力检测
全国高职高专 “十二五”规划教材
2MnO4 5C2O42- +16H+ = 2Mn 2+ +10CO2 +8H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
滴定分析法概论
Titration Introduction
实用文档
滴定分析法概论
1.滴定方法介绍及分类 2.滴定分析反应的条件 3.滴定方式分类 4.基准物及标准溶液的配制 5.滴定分析的计算(略)
实用文档
1.滴定方法介绍及分类
滴定分析法
标准溶液(B) 被测溶液(A)
将被测物配制成溶液置于锥 形瓶中,用滴定管将已知浓度的 试剂(滴定剂或标准溶液)逐渐 加入,直到二者完全反应为止。 按所消耗的滴定剂用量,确定被 滴定物的含量。
比较法:用一种已知浓度的标液来确定另 一种溶液的浓度方法。
实用文档
Na2S2O3+K2Cr2O7
无定量关系
K2Cr2O7 +过量KI I2
S4O62-+SO42-
定量生成
Na2S2O3标液
淀粉指示剂
实用文档
➢ 间接滴定法
通过另外的化学反应,以滴定法定量进行 ✓适用:不能与滴定剂起化学反应的物质
实用文档
间接滴定法
例:Ca2+ 的测定
Ca2+
CaC2O4沉淀
H2SO4
KMnO4标液
间接测定
实用文档
C2O42-
4.基准物及标准溶液的配制
4.1 概念 ➢ 标准溶液:浓度准确已知的溶液 ➢ 基准物质:能用于直接配制或标定标准溶
液的物质
实用文档
4.基准物及标准溶液的配制
4.2 对基准物质的要求:
a.试剂的组成与化学式完全相符 b.具有较大的摩尔质量 c.纯度高(含量≥99.9%) d.性质稳定
返滴定
实用文档
返滴定法
例2:固体CaCO3 的测定 固体CaCO3 + 定量过量HCl标液
液 滴定
剩余HCl标液 NaOH标
返
实用文档
➢置换滴定法
先用适当试剂与待测物质反应, 定量置换出另一种物质 ,再用标准溶液去 滴定该物质的方法。 ✓适用:无明确定量关系的反应
实用文档
置换滴定法
例:Na2S2O3溶液浓度的标定
沉淀滴定法:沉淀反应。
实用文档
2.滴定分析反应的条件
➢ 反应必须具有确定的化学计量关系 ➢ 反应定量地完成(≧99.9%) ➢ 反应速度要快 ➢ 无副反应 ➢ 能用比较简便的方法确定滴定终点
实用文档
3.滴定方式分类
3.1 直接滴定法:标液直接滴定待测物(基本) 3.2 返滴定法(剩余滴定法) 3.3 置换滴定法 3.4 间接滴定法
实用文档
4.基准物及标准溶液的配制
4.3 标准溶液的配制方法
(1)直接配制法: 基准物质 称量 溶解 定量转移至
容量瓶 稀释至刻度 根据称量的质量 和体积计算标准溶液的准确浓度
注意:要“准确”地称、转移。
实用文档
4.基准物及标准溶液的配制
(2)间接配制法 标定法:利用基准物质确定溶液准确浓度。
实用文档
1.滴定方法介绍及分类
滴定分析基本术语
• 滴定(Titration):滴加标准溶液的操作过程。 • 化学计量点(Stoichiometric point):滴加标准溶液与待测组分恰好
完全反应之点。 • 指示剂(Indicator):滴定分析中能发生颜色改变而指示终点的试剂。 • 终点(End point):指示剂变色之点。 • 终点误差(Error of end point) :实际分析操作中指示剂变色点与
化学计量点之间的差别。
实用文档
1.滴定方法介绍及分类
滴定分析法特点
• 简便、快速,适于常量分析(含量>1%) • 准确度高(相对误差 0.2%) • 应用广泛
实用文档
1.滴定方法介绍及分类
按被测物与标准溶液的反应类型,可将滴定 分析法分为四类:
反应; 按反应类型分类
还原反应;
酸碱滴定法:酸碱中和 配位滴定法:配位反应; 氧化还原滴定法:氧化
实用文档
➢返滴定法(剩余滴定法)
先准确加入过量标准溶液,使与试液中的 待测 物质或固体试样进行反应,待反应完成以后,再用 另一种标准溶液滴定剩余的标准溶液的方法。 ✓ 适用:反应较慢或难溶于水的固体试样
实用文档
返滴定法 例1:Al3+的测定 Al3+ + 定量过量EDTA标液 剩余EDTA Zn2+标液,EBT
Titration Introduction
实用文档
滴定分析法概论
1.滴定方法介绍及分类 2.滴定分析反应的条件 3.滴定方式分类 4.基准物及标准溶液的配制 5.滴定分析的计算(略)
实用文档
1.滴定方法介绍及分类
滴定分析法
标准溶液(B) 被测溶液(A)
将被测物配制成溶液置于锥 形瓶中,用滴定管将已知浓度的 试剂(滴定剂或标准溶液)逐渐 加入,直到二者完全反应为止。 按所消耗的滴定剂用量,确定被 滴定物的含量。
比较法:用一种已知浓度的标液来确定另 一种溶液的浓度方法。
实用文档
Na2S2O3+K2Cr2O7
无定量关系
K2Cr2O7 +过量KI I2
S4O62-+SO42-
定量生成
Na2S2O3标液
淀粉指示剂
实用文档
➢ 间接滴定法
通过另外的化学反应,以滴定法定量进行 ✓适用:不能与滴定剂起化学反应的物质
实用文档
间接滴定法
例:Ca2+ 的测定
Ca2+
CaC2O4沉淀
H2SO4
KMnO4标液
间接测定
实用文档
C2O42-
4.基准物及标准溶液的配制
4.1 概念 ➢ 标准溶液:浓度准确已知的溶液 ➢ 基准物质:能用于直接配制或标定标准溶
液的物质
实用文档
4.基准物及标准溶液的配制
4.2 对基准物质的要求:
a.试剂的组成与化学式完全相符 b.具有较大的摩尔质量 c.纯度高(含量≥99.9%) d.性质稳定
返滴定
实用文档
返滴定法
例2:固体CaCO3 的测定 固体CaCO3 + 定量过量HCl标液
液 滴定
剩余HCl标液 NaOH标
返
实用文档
➢置换滴定法
先用适当试剂与待测物质反应, 定量置换出另一种物质 ,再用标准溶液去 滴定该物质的方法。 ✓适用:无明确定量关系的反应
实用文档
置换滴定法
例:Na2S2O3溶液浓度的标定
沉淀滴定法:沉淀反应。
实用文档
2.滴定分析反应的条件
➢ 反应必须具有确定的化学计量关系 ➢ 反应定量地完成(≧99.9%) ➢ 反应速度要快 ➢ 无副反应 ➢ 能用比较简便的方法确定滴定终点
实用文档
3.滴定方式分类
3.1 直接滴定法:标液直接滴定待测物(基本) 3.2 返滴定法(剩余滴定法) 3.3 置换滴定法 3.4 间接滴定法
实用文档
4.基准物及标准溶液的配制
4.3 标准溶液的配制方法
(1)直接配制法: 基准物质 称量 溶解 定量转移至
容量瓶 稀释至刻度 根据称量的质量 和体积计算标准溶液的准确浓度
注意:要“准确”地称、转移。
实用文档
4.基准物及标准溶液的配制
(2)间接配制法 标定法:利用基准物质确定溶液准确浓度。
实用文档
1.滴定方法介绍及分类
滴定分析基本术语
• 滴定(Titration):滴加标准溶液的操作过程。 • 化学计量点(Stoichiometric point):滴加标准溶液与待测组分恰好
完全反应之点。 • 指示剂(Indicator):滴定分析中能发生颜色改变而指示终点的试剂。 • 终点(End point):指示剂变色之点。 • 终点误差(Error of end point) :实际分析操作中指示剂变色点与
化学计量点之间的差别。
实用文档
1.滴定方法介绍及分类
滴定分析法特点
• 简便、快速,适于常量分析(含量>1%) • 准确度高(相对误差 0.2%) • 应用广泛
实用文档
1.滴定方法介绍及分类
按被测物与标准溶液的反应类型,可将滴定 分析法分为四类:
反应; 按反应类型分类
还原反应;
酸碱滴定法:酸碱中和 配位滴定法:配位反应; 氧化还原滴定法:氧化
实用文档
➢返滴定法(剩余滴定法)
先准确加入过量标准溶液,使与试液中的 待测 物质或固体试样进行反应,待反应完成以后,再用 另一种标准溶液滴定剩余的标准溶液的方法。 ✓ 适用:反应较慢或难溶于水的固体试样
实用文档
返滴定法 例1:Al3+的测定 Al3+ + 定量过量EDTA标液 剩余EDTA Zn2+标液,EBT
