《金属及其化合物》化学方程式总结
第三章金属及其化合物 3.1.2铝与氢氧化钠溶液的反应、物质的量在化学方程式计算中的应用含解析

第2课时铝与氢氧化钠溶液的反应物质的量在化学方程式计算中的应用1.铝与盐酸的反应现象:铝片逐渐溶解,试管中产生无色气泡;点燃的木条放在试管口时发出爆鸣声.化学方程式:2Al+6HCl===2AlCl3+3H2↑离子方程式:2Al+6H+===2Al3++3H2↑2.铝与氢氧化钠溶液的反应现象:铝片逐渐溶解,试管中产生无色气泡;点燃的木条放在试管口时发出爆鸣声。
化学方程式:2Al+2NaOH+2H2O错误!2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O===2AlO-,2+3H2↑铝既能与盐酸反应,又能与NaOH溶液反应,都产生氢气(或H2)。
H2+Cl2错误!2HCl错误! 1 ∶ 1 ∶2错误! 1 ∶ 1 ∶2错误!错误!∶错误!∶错误!物质的量之比1 mol ∶ 1 mol ∶2 mol错误!1体积∶1体积∶2体积(1)结论:化学方程式中的化学计量数之比等于其物质的量之比,等于微粒个数之比,等于气体的体积之比.(2)应注意的问题①任何一种反应物,只有实际参加反应的纯物质的量才能根据化学方程式计算,过量部分不参与化学方程式的计算。
②化学方程式的书写要正确。
③列比例式时要符合“左右量相当,上下单位同”的原则.4.物质的量与各物理量之间的关系(1)图示关系:(2)计算公式:①n=mM;②n=错误!;③n=错误!;④n=c·V(溶液)(时间20分钟,满分30分)知识点一铝与氢氧化钠溶液的反应1.下列金属既能与稀盐酸反应,又能与NaOH溶液反应的是()A.Mg B.AlC.Fe D.Cu答案:B解析:Al既能与稀盐酸反应,又能与NaOH溶液反应;Mg、Fe只能与稀盐酸反应;Cu既不与稀盐酸反应,也不与NaOH溶液反应.2.下列关于铝与氢氧化钠溶液反应的说法错误的是( )A.铝失去电子,作还原剂B.产生的气体是氢气C.NaOH与H2O作氧化剂D.溶液中铝元素的存在形式是AlO错误!答案:C解析:反应中铝失去电子,铝元素由0价升高到+3价,故铝是还原剂,A项正确;铝与氢氧化钠溶液反应生成NaAlO2和H2,B项正确;铝与氢氧化钠溶液的反应中,水作氧化剂,C项错误;溶液中铝元素以AlO错误!的形式存在,D项正确。
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
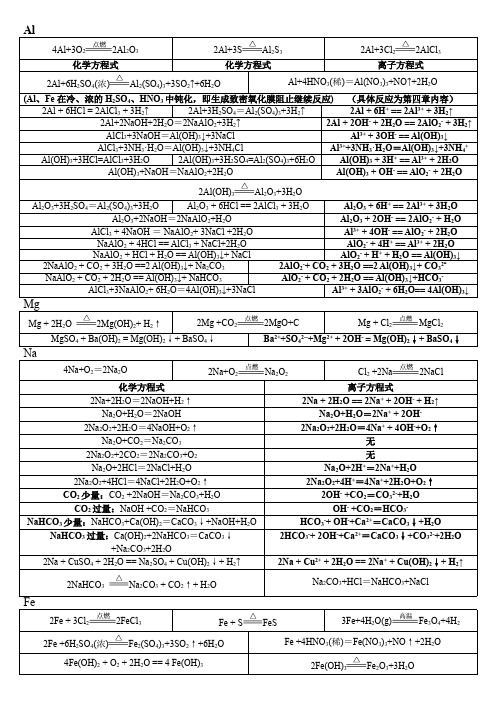
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
铁及其化合物的化学方程式和离子方程式答案

铁及其化合物的化学方程式和离子方程式答案铁及其化合物的化学方程式和离子方程式总结铁是一种常见的金属元素,它在不同条件下可以与氧气、氯气、硫、水蒸气等反应。
其中,铁在氧气中燃烧的化学方程式为3Fe+2O2→2Fe3O4,而在氯气中燃烧的方程式为2Fe+3Cl2→2FeCl3.此外,常温条件下铁锈的形成是由4Fe+3O2+2H2O→2Fe2O3·H2O引起的。
氧化亚铁是铁的一种氧化物,它也可以与一氧化碳、铝粉等物质发生反应。
例如,氧化亚铁在空气中加热会发生6FeO +O2→2Fe3O4的反应,而与一氧化碳高温反应的方程式为FeO+CO→Fe+CO2.此外,氧化亚铁与铝粉在高温下反应的方程式为3FeO+2Al→Al2O3+3Fe。
铁和硫的共热反应的方程式为Fe+S→FeS,而铁和水蒸气在高温条件下反应的方程式为3Fe+4H2O→Fe3O4+4H2.铁还可以与稀硫酸、浓硫酸、稀硝酸、浓硝酸等酸性物质反应,生成不同的产物和离子。
例如,铁与稀硫酸反应的方程式为Fe+H2SO4→FeSO4+H2↑,而少量的铁与浓硝酸共热的方程式为Fe+6HNO3(浓)→Fe(NO3)3+3NO2↑+3H2O。
需要注意的是,有些段落中出现了格式错误和明显有问题的内容,需要删除或修改。
例如,第10段中的化学方程式和离子方程式之间的符号错误,需要进行修改。
铁的化学性质1.氢氧化亚铁与浓硫酸反应,生成二价铁离子和二氧化硫气体,反应式为:2Fe(OH)2 + 4H2SO4 → Fe2+ + 2H2O +4SO2↑。
2.氢氧化亚铁与浓硝酸反应,生成二价铁离子和一氧化氮气体,反应式为:Fe(OH)2 + 4HNO3 → Fe2+ + 2NO↑ + 3H2O。
3.氢氧化亚铁与稀硝酸反应,生成二价铁离子和一氧化氮气体,反应式为:3Fe(OH)2 + 10HNO3 → 3Fe2+ + 2NO↑ +8H2O。
4.氢氧化亚铁在空气中被氧化,生成三价铁离子和水,反应式为:4Fe(OH)2 + O2 + 2H2O → 4Fe3+ + 4OH^-。
专题06 金属及其化合物(讲)(学生版)

8.Na-K合金常温下呈液态,是原子反应堆的导热剂。
9.铝是活泼金属,但铝抗腐蚀性相当强,因为铝表面生成一层致密的氧化物薄膜。由于Al2O3的熔点高于Al的熔点,故在酒精灯上加热铝箔直至熔化,发现熔化的铝并不滴落。
10.铝热反应不仅仅是单质铝与Fe2O3反应,还包含制取其他难熔金属的反应,由于铝热剂是混合物,故铝热反应不能用于工业上冶炼铁。注意铝热反应是中学化学中唯一一类金属单质与金属氧化物在高温条件下的置换反应。
11.并不是Al与所有金属氧化物均能组成铝热剂,该金属氧化物对应的金属活泼性应比铝弱。
12.Al2O3、Al(OH)3与NaOH溶液的反应常用于物质的分离提纯。Al(OH)3不溶于氨水,所以实验室常用铝盐和氨水来制备Al(OH)3。
核心素养
宏观辨识与微观探析科学态度与社会责任
高频考点一金属单质的性质
1.常见金属的主要性质
(1)钠及其化合物
①等物质的量的金属钠被氧化成Na2O和Na2O2时转移的电子数相同。
②钠与酸反应时,先与酸反应,酸不足再与水反应。
③钠与盐的溶液反应:钠不能置换出溶液中的金属,钠直接与水反应,反应后的碱再与溶液中的其他物质反应。
和水的反应
与冷水剧
烈反应
与沸水缓
慢反应
高温与水
蒸气反应
—
不跟水反应
生成碱和氢气
生成氧化
物和氢气
和酸的
反应
剧烈反应
反应逐渐减缓
—
不能置换稀酸中的氢
与非氧化性酸反应放出H2;与浓硫酸、浓硝酸及稀硝酸反应,不放出H2,一般产物为:盐+水+成酸元素的低价化合物
高中必修金属和非金属化学方程式总结

高中必修金属和非金属化学方程式总结LELE was finally revised on the morning of December 16, 2020金属及其化合物一、钠和钠的化合物1、钠与水反应:2Na+2H 2O =2NaOH+H 2↑2Na+2H 2O =2Na ++2OH -+H 2↑2、钠与氧气反应:①常温反应4Na+O 2=2Na 2O②点燃或加热2Na+O 2=Na 2O 23、钠与盐酸等酸反应:2Na+2HCl=2NaCl+H 2↑2Na+2H +=2Na ++H 2↑4、钠与氯气的反应:2Na+Cl 22NaCl5、钠与硫的反应:22S6、钠与碱溶液的反应实际上是与钠跟水的反应7、钠与盐溶液的反应①NaCl 溶液:实际上与水反应,反应的化学方程式:2Na+2H 2O =2NaOH+H 2↑②CuSO4溶液:2Na+CuSO 4+2H 2O=Cu(OH)2↓+H 2↑+Na 2SO 4 ③NaHSO 4溶液:2Na+2NaHSO 4=2Na 2SO 4+H 2↑④通常钠不能从盐溶液中置换出金属:若盐为熔融状态,钠可以置换出较不活泼的金属,如:4Na+TiCl44NaCl+Ti8、金属钠露置在空气中的变化过程4Na+O2=2Na2ONa2O+H2O=2NaOH2NaOH+CO2=Na2CO3+H2O9、氧化钠和水的反应:Na2O+H2O=2NaOH10、氧化钠和盐酸的反应:Na2O+2HCl=2NaCl+H2O11、氧化钠和二氧化碳的反应:Na2O+CO2=Na2CO312、过氧化钠和水的反应:2Na2O2+2H2O=4NaOH+O2↑13、过氧化钠和二氧化碳的反应:2Na2O2+2CO2=2Na2CO3+O214、过氧化钠和盐酸的反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑15、氧化钠和过氧化钠转化:2Na2O+O22O216、碳酸钠和盐酸反应:①Na2CO3+HCl=NaHCO3+NaCl②Na2CO3+2HCl=2NaCl+H2O+CO2↑17、碳酸钠和氢氧化钙反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH18、碳酸钠和可溶性盐反应:Na2CO3+CaCl2=CaCO3↓+2NaCl Na2CO3+BaCl2=BaCO3↓+2NaCl19、碳酸氢钠和盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑20、碳酸氢钠和氢氧化钠、氢氧化钙反应:NaOH=Na2CO3+H2O2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O21、碳酸氢钠和盐反应:NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑22、碳酸氢钠受热分解:2NaHCO323+H2O+CO2↑23、碳酸氢钠和碳酸钠转化:Na 2CO 3+H 2O+CO 2=2NaHCO 32NaHCO 3=Na 2CO 3+H 2O+CO 2↑ NaHCO 3+NaOH =Na 2CO 3+H 2O24、碳酸氢钠制法:NH3+NaCl+H 2O+CO 2=NaHCO 3↓+NH4Cl 二、铝和铝的化合物1、铝与氧气反应:4Al+3O 22O32、铝与盐酸等酸的反应:2Al+6HCl =2AlCl3+3H 23、铝与氢氧化钠溶液的反应:2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑4、氧化铝和盐酸反应:Al 2O 3+6HCl=2AlCl 3+3H 2O5、氧化铝和氢氧化钠反应:Al 2O 3+2NaOH =2NaAlO 2+H 2O 6、氢氧化铝制备:Al 3++3NH3H 2O =Al (OH )3↓+3NH4+7、氢氧化铝和酸的反应:Al (OH )3+3HCl =AlCl 3+3H 2O8、氢氧化铝和氢氧化钠的反应:Al (OH )3+NaOH =NaAlO 2+2H 2O氢氧化铝不稳定性:2Al (OH )323+3H 2O 三、铁和铁的化合物1、铁与氧气反应:2342、铁与水蒸气反应:3Fe+4H 2O (g )342↑ 3、铁与盐酸等酸反应:Fe+2HCl =FeCl 2+H 2↑4、铁的氧化物分别与酸反应:FeO+2H +=Fe 2++H 2OFe 2O 3+6H +=2Fe 3++3H 2OFe 3O 4+8H +=Fe 2++2Fe 3++4H 2O5、铁的氧化物与还原剂反应:Fe x O y +yCOFe+yCO 26、铁的氢氧化物与盐酸等酸反应:Fe (OH )2+2HCl =FeCl2+2H 2O Fe (OH )3+3HCl =FeCl 3+3H 2O7、铁的氢氧化物制备:FeSO 4+2NaOH =Fe (OH )2↓+Na 2SO 4FeCl 3+3NaOH =Fe (OH )3↓+3NaCl8、转化:4Fe (OH )2+O 2+2H 2O =4Fe (OH )39、受热分解:2Fe (OH )3Fe 2O 3+3H 2O10、Fe 3+的检验:Fe 3++3SCN -=Fe(SCN)3(血红色)11、氧化性:2Fe 3++Fe =3Fe 2+2Fe 3++Cu =2Fe 2++Cu 2+12、还原性:2Fe 2++Cl2=2Fe 3++2Cl -四、硅及其化合物1、硅与氧气、氟、氯气、碳反应:2=SiO 2Si+2F 2=SiF 4Si+2Cl 2=SiCl 4Si+C =SiC2、硅与氢氟酸、氢氧化钠反应:Si+4HF =SiF 4↑+2H 2↑Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑3、二氧化硅与氢氟酸反应:SiO 2+4HF =SiF 4↑+2H 2O4、二氧化硅与碱性氧化物反应:SiO 2+CaOCaSiO 35、二氧化硅与碱反应:SiO 2+2=Na 2SiO 3+H2O6、二氧化硅与碳反应:SiO 2↑7、碳酸钙反应: SiO 2+Na 2CO 323+CO 2↑SiO 2+CaCO 3CaSiO 3+CO 2↑8、硅酸和氢氧化钠反应:H 2SiO 3+2NaOH =Na 2SiO 3+2H 2O9、硅酸受热分解:H 2SiO 32+H 2O10、硅酸钠与酸反应:Na 2SiO 3+2HCl =2NaCl+H 2SiO 3(胶体)Na 2SiO 3+H 2O+CO 2=H 2SiO 3(胶体)+Na 2CO 3 Na 2SiO 3+2H 2O+2CO 2=H 2SiO 3(胶体)+2NaHCO 3 五、氯1、氯气与金属反应:Cl 2+2Na 2+Cu =23Cl 2+2Fe =2FeCl 32、氯气与非金属反应:Cl 223、氯气、氟与水的反应:Cl2+H2O=HCl+HClO2HClO=2HCl+O2↑2F2+2H2O=4H F+O24、氯气与碱反应:Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O5、漂白液、漂白粉、漂白精长期露置空气中会发生反应:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO2NaClO+H2O+CO2=Na2CO3+2HClO2↑6、氯离子检验:先在被检验液中加稀硝酸酸化,再加硝酸银溶液,如产生白色沉淀可判断原溶液中含氯离子Ag++Cl-=AgCl↓7、卤素单质间置换:Cl2+2Br-=2Cl-+Br2Cl2+2I-=2Cl-+I2Br2+2I-=2Br-+I2六、硫和氮1、二氧化硫和水反应:SO2+H2O=H2SO32、二氧化硫和氧化钙反应:SO2+CaO=CaSO33、二氧化硫和氢氧化钠反应:SO2(少)+2NaOH=Na2SO3+H2OSO2(过)+NaOH=NaHSO34、二氧化硫和盐反应SO2(少)+2NaHCO3=Na2SO3+H2O+2CO2SO2(过)+NaHCO3=NaHSO3+CO25、二氧化硫和硫化氢反应:SO2+2H2S=3S↓+2H2O6、二氧化硫和卤素单质水溶液反应:SO2+X2+2H2O=H2SO4+2HX(X=Cl、Br、I,F除外)7、二氧化硫能被氧气氧化:2SO238SO3+H2O=H2SO4SO3+CaO=CaSO4SO3+NaOH=Na2SO49、氮气和氧气反应:N2+O2=2NO10、一氧化氮与氧气反应:2NO+O2=2NO211、二氧化氮与水反应:3NO2+H2O=3HNO3+NO12、氮的氧化物溶于水的有关计算:3NO2+H2O=3HNO3+NO 2NO+O2=2NO24NO2+O2+2H2O=4HNO34NO+3O2+2H2O=4HNO3七、氨硝酸硫酸1、氨:N2+3H2=2NH3(反应条件是高温高压和催化剂)2、氨与水的反应NH3+H2O=NH3H2O(可逆)3、氨水不稳定:NH3H2O=↑+H2O4、氨与HCl等酸的反应NH3+HCl=NH4Cl2NH3+H2SO4=(NH4)2SO4NH3+HNO3=NH4NO3NH3+H2O+CO2=NH4HCO3 5铵盐受热分解:NH4Cl3↑+HCl↑NH4HCO3=NH3↑+H2O↑+CO2↑6氨的催化氧化:4NH3+5O24NO+6H2O(条件是催化剂和加热)7氨的制法:2NH4Cl+Ca(OH)2=l2+2NH3↑+2H2O。
元素(金属、非金属)及其化合物化学方程式

金属及其化合物1、钠放置在空气中 4Na + O2 = 2Na2O2、钠在空气中燃烧(黄色的火焰)2Na + O2 Na2O2(淡黄色固体)3、铝箔被氧气氧化 4Al + 3O2 △2O34、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2NaOH + H2↑【2Na + 2H2O = 2Na+ + 2OH - + H2 ↑】5、高温下铁与水反应 3Fe + 4H2O(g) 高温Fe3O4 + 4H26、铝片与稀盐酸反应 2Al + 6HCl = 2AlCl3 + 3H2↑【2Al + 6H+ = 2Al3+ +3H2↑】7、铝与氢氧化钠溶液反应(实际是钠和水反应) 2Al + 2NaOH + 2H2O = 2NaAlO2(偏铝酸钠) + 3H2↑【2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑】8、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O = 4NaOH + O2↑【2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑】9、过氧化钠可用在呼吸面具和潜水艇中作为【供氧剂】,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O210、苏打(纯碱)与盐酸反应 Na2CO3 +2HCl=2NaCl+H2O +CO2↑【 CO32- + 2H+ = H2O + CO2↑】11、小苏打(碳酸氢钠)溶液与盐酸反应 NaHCO3 + HCl= NaCl+H2O +CO2↑【HCO3- + H+ = H2O + CO2↑】12、小苏打受热分解 2NaHCO3△Na2CO3 + H2O +CO2 ↑13、小苏打和氢氧化钠溶液溶液反应NaHCO3+NaOH= Na2CO3 + H2O 【HCO3-+ OH - = H2O + CO32- 】14、氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH ===2NaAlO2 +H2O 【Al2O3 + 2OH - === 2AlO2- + H2O】15、氧化铝溶于硫酸Al2O3+ 3H2SO4==Al2(SO4)3+3H2O 【Al2O3 +6H+ = 2Al3+ +3H2O】16、硫酸铝溶液中滴加过量氨水Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4【Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+】17、氢氧化铝中加盐酸 Al(OH)3 + 3HCl = AlCl3 + 3H2O 【Al(OH)3 + 3H+ = Al3+ + 3H2O】18、Al(OH)3与NaOH溶液反应: Al(OH)3 + NaOH NaAlO2 +2H2O【Al(OH)3 + OH - = AlO2- +2H2O】19、氢氧化铝受热分解 2Al(OH)3△Al2O3+3H2O20、铁与盐酸反应 Fe + 2HCl = FeCl2 + H2↑【Fe + 2H+ = Fe2+ + H2↑】21、氧化铁溶于盐酸中 Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O 【Fe 2O 3 + 6H + = 2Fe 3++ 3H 2O 】 22、氧化亚铁溶于盐酸中 FeO + 2HCl = FeCl 2 + H 2O 【FeO + 2H += Fe 2++ H 2O 】 23、氯化铁溶液中滴入氢氧化钠溶液 FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl【Fe 3++ 3OH - = Fe(OH)3 ↓(红褐色沉淀)】 24、硫酸亚铁溶液中滴加氢氧化钠溶液Fe SO 4+ 2NaOH = Fe(OH)2↓+ Na 2SO 4 【Fe 2++ 2OH - = Fe(OH)2 ↓(白色沉淀)】25、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色,最后变为红褐色沉淀) 4Fe(OH)2 + O 2 +2H 2O = 4Fe(OH)3 26、氢氧化铁受热分解 2Fe(OH)3△Fe 2O 3+3H 2O27、氯化亚铁溶液中通入氯气 2FeCl 2 + Cl 2 = 2FeCl 3 【2Fe 2++ Cl 2 = 2Fe 3++ 2Cl - 】 28、氯化铁溶液中加入铁粉2FeCl 3 + Fe =3FeCl 2 【2Fe 3++ Fe =3Fe 2+】非金属及其化合物1、硅及其化合物的转化关系※ ①SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)※ ②SiO 2+2NaOH = Na 2SiO 3+H 2O( SiO 2+2OH -= SiO 32-+H 2O )※ ③Na 2SiO 3+2HCl = H 2SiO 3(胶体)+2NaCl ( SiO 32-+2H += H 2SiO 3(胶体))④ SiO 2+CaO 高温 CaSiO 32、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3②Cu +Cl 2 点燃CuCl 2③2FeCl 3+Cu = 2FeCl 2+CuCl 2(2Fe 3++Cu = 2Fe 2++Cu 2+)④H 2+Cl 2 2HCl ※⑤MnO 2+4HCl(浓)△MnCl 2+Cl 2↑+2H 2O(MnO 2+4H ++2Cl -△Mn 2++Cl 2↑+2H 2O) ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑(不稳定性)(Cl 2+H 2O = H ++Cl -+HclO) (2HClO 2H ++2Cl -+O 2↑)※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O (工业制漂白粉) Ca(ClO)2+CO 2+H 2O = CaCO 3↓+2HClO(漂白原理)3、硫及其化合物的转化关系Na 2SiO 3 SiF 4 SiO 2 H 2SiO 3CaSiO 3 ① ② ③④ CuCl 2 HClO HCl Cl 2 FeCl 3 NaClO Ca(ClO)2 ① ② ③④ ⑤ ⑥ ⑦ ⑧ ⑨点燃或光照 光照光照①S +O 2 点燃 SO 2 ※②SO 2+O 2 催化剂 加热 2SO 3③SO 3+H 2O = H 2SO 4(工业制硫酸) ④SO 2+H 2O H 2SO 3⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O(SO 2+Ca 2++2OH -=CaSO 3↓+H 2O )⑥SO 3+CaO = CaSO 4 或 SO 3+Ca(OH)2 = CaSO 4+H 2O※⑦Cu+2H 2SO 4(浓) △ CuSO 4+SO 2↑+2H 2O ※⑧C +2H 2SO 4(浓) △CO 2↑+2SO 2↑+2H 2O4、氮及其化合物的转化关系※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2 ※③3NO 2+H 2O = 2HNO 3+NO ( 3NO 2+H 2O =2H ++2NO 3-+NO)※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O (Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O)※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂高温高压 2NH 3 (3Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O ) (工业制氨气)⑦NH 3+HCl = NH 4Cl NH 4HCO 3 △NH 3↑+H 2O+CO 2↑(铵盐受热易分解)⑧NH 4Cl△NH 3↑+HCl ↑(水溶液中)( NH 3+H += NH 4+) ⑧NH 4Cl +NaOH △ NaCl+NH 3↑+H 2O (NH 4++OH-△NH 3↑+H 2O) ※⑧2NH 4Cl +2Ca(OH)2 △ CaCl 2+2NH 3↑+2H 2O⑨4NH 3+5O 2 催化剂△ 4NO +6H 2OSO 42 3 CaSO 3 4① ⑨ ⑧⑦ ⑥ ④ ③ N 2 NH 3 NH 4Cl NO 3② ③高温或放电。
高三化学金属及其化合物化学方程式大全

高三化学金属及其化合物化学方程式大全在高三化学的学习中,金属及其化合物的化学方程式是非常重要的知识点。
熟练掌握这些方程式,对于理解化学反应的本质、解决化学问题以及在考试中取得好成绩都具有关键作用。
下面我们就来一起梳理一下常见的金属及其化合物的化学方程式。
一、钠及其化合物1、钠与氧气反应常温下:4Na + O₂= 2Na₂O加热时:2Na + O₂= Na₂O₂2、钠与水反应2Na + 2H₂O = 2NaOH + H₂↑3、钠与盐酸反应2Na + 2HCl = 2NaCl + H₂↑4、钠在空气中燃烧2Na + Cl₂= 2NaCl5、氧化钠与水反应Na₂O + H₂O = 2NaOH6、过氧化钠与水反应2Na₂O₂+ 2H₂O = 4NaOH + O₂↑7、过氧化钠与二氧化碳反应2Na₂O₂+ 2CO₂= 2Na₂CO₃+ O₂8、碳酸钠与盐酸反应Na₂CO₃+ 2HCl = 2NaCl + H₂O + CO₂↑9、碳酸氢钠与盐酸反应NaHCO₃+ HCl = NaCl + H₂O + CO₂↑10、碳酸氢钠受热分解2NaHCO₃= Na₂CO₃+ H₂O + CO₂↑11、碳酸钠溶液中通入二氧化碳Na₂CO₃+ H₂O + CO₂= 2NaHCO₃二、铝及其化合物1、铝与氧气反应4Al + 3O₂= 2Al₂O₃2、铝与盐酸反应2Al + 6HCl = 2AlCl₃+ 3H₂↑3、铝与氢氧化钠溶液反应2Al + 2NaOH + 2H₂O = 2NaAlO₂+ 3H₂↑4、氧化铝与盐酸反应Al₂O₃+ 6HCl = 2AlCl₃+ 3H₂O5、氧化铝与氢氧化钠溶液反应Al₂O₃+ 2NaOH = 2NaAlO₂+ H₂O6、氢氧化铝与盐酸反应Al(OH)₃+ 3HCl = AlCl₃+ 3H₂O7、氢氧化铝与氢氧化钠溶液反应Al(OH)₃+ NaOH = NaAlO₂+ 2H₂O8、实验室制取氢氧化铝AlCl₃+ 3NH₃·H₂O = Al(OH)₃↓ + 3NH₄Cl9、偏铝酸钠溶液中通入二氧化碳(少量)2NaAlO₂+ CO₂+ 3H₂O = 2Al(OH)₃↓ + Na₂CO₃偏铝酸钠溶液中通入二氧化碳(过量)NaAlO₂+ CO₂+ 2H₂O = Al(OH)₃↓ + NaHCO₃三、铁及其化合物1、铁与氧气反应3Fe + 2O₂= Fe₃O₄2、铁与盐酸反应Fe + 2HCl = FeCl₂+ H₂↑3、铁与硫酸铜溶液反应Fe + CuSO₄= FeSO₄+ Cu4、氧化亚铁与盐酸反应FeO + 2HCl = FeCl₂+ H₂O5、氧化铁与盐酸反应Fe₂O₃+ 6HCl = 2FeCl₃+ 3H₂O6、四氧化三铁与盐酸反应Fe₃O₄+ 8HCl = FeCl₂+ 2FeCl₃+ 4H₂O 7、氯化亚铁溶液中通入氯气2FeCl₂+ Cl₂= 2FeCl₃8、氯化铁溶液中加入铁粉2FeCl₃+ Fe = 3FeCl₂9、氯化铁溶液中加入铜粉2FeCl₃+ Cu = 2FeCl₂+ CuCl₂10、氢氧化亚铁在空气中被氧化4Fe(OH)₂+ O₂+ 2H₂O = 4Fe(OH)₃11、氢氧化铁受热分解2Fe(OH)₃= Fe₂O₃+ 3H₂O四、铜及其化合物1、铜在空气中加热2Cu + O₂= 2CuO2、铜与硝酸反应(浓硝酸)Cu + 4HNO₃(浓) = Cu(NO₃)₂+ 2NO₂↑ + 2H₂O (稀硝酸)3Cu + 8HNO₃(稀) = 3Cu(NO₃)₂+2NO↑ + 4H₂O 3、氧化铜与盐酸反应CuO + 2HCl = CuCl₂+ H₂O4、氢氧化铜受热分解Cu(OH)₂= CuO + H₂O5、硫酸铜溶液与氢氧化钠溶液反应CuSO₄+ 2NaOH = Cu(OH)₂↓ + Na₂SO₄掌握这些金属及其化合物的化学方程式,不仅需要死记硬背,更要理解反应的本质和规律。
金属及其化合物化学方程式汇总

.必修一金属及其化合物化学方程式一、金属钠及其化合物1、钠在空气中(1)钠块在空气中变暗:2Na +O2=Na2O(白色固体)(钠长时间露置在空气中最终变为碳酸钠)(2)在空气中加热4Na+2O2 =2Na2O2(淡黄色固体)现象:钠融化成小球,然后剧烈燃烧,产生黄色火焰,生成淡黄色固体(3)2Na2O+O2=2Na2O22、钠与水反应(浮、熔、游、响、红)2Na +2H2O =2NaOH +H2↑2Na +2H2O =2Na++2OH-+H2↑3、钠与盐溶液反应(先水后盐)(1)与氯化钠溶液:本质上就是与水反应(2)与硫酸铜溶液:2Na +2H2O =2NaOH +H2↑2NaOH + CuSO4 ==Cu(OH)2↓+ Na2SO4总:2Na +2H2O + CuSO4=Cu(OH)2↓+ Na2SO4+H2↑2Na +2H2O+ Cu2+ =Cu(OH)2↓+H2↑+ 2Na+(3)与氯化铁溶液:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na+ +3H2↑4、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O =4NaOH +O2 ↑2Na2O2+2H2O =4Na++4OH -+O2↑现象:产生大量气泡,带火星的木条复燃,试管外壁发热,滴加酚酞后溶液变红(振荡后褪色)碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH Na2O +H2O =2Na++2OH -5、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+2CO2=2Na2CO3+O2碱性氧化物Na2O与二氧化碳的反应Na2O+CO2===Na2CO36、过氧化钠与盐酸的反应2Na2O2+4HCl =4NaCl +2H2O+O2 ↑2Na2O2+4H+=4Na++2H2O+O2↑碱性氧化物Na2O与盐酸的反应Na2O +2HCl =2NaCl +H2O Na2O +2H+=2Na++H2O7、氢氧化钠(1)与酸性氧化物反应a向NaOH中通入少量CO2:2NaOH+ CO2 (少量)== Na2CO3 + H2OOH -+CO2 (少量)= CO32-+H2Ob 继续向该溶液中通入CO2:Na2CO3+H2O +CO2=2NaHCO3CO32-+H2O +CO2=2HCO3-c向NaOH中通入过量CO2:NaOH+ CO2(过量)== NaHCO3a+bOH -+CO2 (过量)= HCO3-d向Ca(OH)2中通入少量CO2:CO2+Ca(OH)2(过量)===CaCO3↓+H2OCa2++ 2OH -+CO2 (少量)= CaCO3↓+H2Oe继续向该溶液中通入CO2:CaCO3+H2O +CO2=Ca(HCO3)2CaCO3+H2O +CO2=Ca2++ 2HCO3-f向Ca(OH)2中通入过量CO2:2CO2(过量)+Ca(OH)2===Ca(HCO3)2 d+eOH -+CO2 (过量)= HCO3-CaCl2不与CO2反应:因为一般情况下弱酸不能制强酸8、苏打(纯碱)与盐酸反应(根据滴加顺序不同,现象不同,所以可以鉴别盐酸和碳酸氢钠)①向盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O+CO2↑CO32-+2H+=H2O +CO2↑现象:立即有气泡产生②纯碱溶液中滴加盐酸,至过量△△.Na2CO3+HCl =NaHCO3+NaCl CO32-+H+ =HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑现象:先无明显现象,然后有气泡产生9、碳酸氢钠和盐酸反应(无论是向碳酸氢钠中滴加稀盐酸还是向盐酸中滴加碳酸氢钠,现象均为:立即有气泡产生)NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑10、碳酸钠与Ca(OH)2反应:Na2CO3+Ca(OH)2 = 2NaOH+CaCO3↓CO32-+Ca2+ = CaCO3↓11、碳酸氢钠与碱反应(1)与NaOH反应:NaHCO3 + NaOH== Na2CO3 + H2OHCO3-+OH -=H2O +CO32-(2)与Ca(OH)2反应Ca(OH)2 + NaHCO3(少)==CaCO3↓+ H2O+ NaOHCa2+ +OH -+HCO3-(少)==CaCO3↓+ H2OCa(OH)2 + 2NaHCO3(多)== CaCO3↓ + 2H2O+Na2CO3Ca2+ +2OH -+2HCO3-(多)== CaCO3↓ + 2H2O+CO32-12、碳酸钠与某些盐反应Na2CO3+CaCl 2== CaCO3↓+2NaCl CO32-+Ca2+ = CaCO3↓NaHCO3+CaCl 2== 不反应(可用于鉴别碳酸钠和碳酸氢钠)13、小苏打受热分解2NaHCO3=Na2CO3+H2O +CO2↑14、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH -=H2O +CO32-(若是溶液中反应有离子方程式)二、铝及其化合物1、与非金属4Al + 3O2 = 2Al2O32Al+3Cl2 == 2AlCl32Al + 3S == Al2S32、铝片与稀盐酸反应2Al +6HCl =2AlCl3 +3H2↑2Al +6H+=2Al3++3H2↑3 、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2+3H2↑2Al +2OH-+2H2O =2AlO2-+3H2↑4、与盐溶液反应:置换出较不活泼的金属单质2Al+3CuSO4 ==Al2(SO4 )3+3Cu 2Al+3Cu2+ = 2Al3++3Cu5、与水不反应:6、Al2O3(两性氧化物)(1)与强酸反应Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+ = 2Al3++3H2O(2)与强碱反应Al2O3+2NaOH = 2NaAlO2+H2O Al2O3+2OH-=2AlO2-+H2O7. Al(OH)3(两性氢氧化物)(1)Al(OH)3的制备:可溶性铝盐和氨水Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+(2)与强酸反应Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O (3)与强碱反应Al(OH)3+NaOH =NaAlO2+2 H2O Al(OH)3+OH-=AlO2-+2 H2O (4)加热分解2Al(OH)3△Al2O3 + 3H2O8、Al3+(1)少量强碱:AlCl3+3NaOH===Al(OH)3↓+3N aCl Al3++3OH-=Al(OH)3↓(2)过量强碱:AlCl3+4NaOH===NaAlO2 +3NaCl+2 H2OAl3++4OH-=AlO2-+2 H2O9、AlO2-(1)少量HCl:NaAlO2 +HCl+H2O=NaCl+Al(OH)3↓AlO2-+H++H2O=Al(OH)3↓(2)继续向该溶液中加入盐酸:Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O△点燃△.(3)过量HCl:NaAlO2+4HCl=NaCl+AlCl3+2H2O AlO2-+4H+=Al3++2 H2O(4)通入少量CO2CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(5)通入过量CO2CO2+NaAlO2+2H2O=Al(OH)3↓+Na HCO3 (工业制取氢氧化铝)CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-10、KA1(SO4)2 (净水剂)(1)使硫酸根恰好沉淀完全: KA1(SO4)2+2Ba(OH)2==2BaSO4↓+KAlO2Al3++4OH-+2Ba2++2SO42-==2BaSO4↓+AlO2-(2)使铝离子恰好沉淀完全: 2KA1(SO4)2+3Ba(OH)2==2Al(OH)3↓+3BaSO4↓+K2SO42Al3++ 3 SO42- + 6OH—+ 3Ba2+==3Ba SO4↓+ 2Al(OH)3↓(3)净水原理:Al3++3H2O=== Al(OH)3(胶体)+3 H+11、相互滴加顺序不同而现象不同的几组反应:(可用于鉴别)①:AlCl3+ NaOH ②:NaAlO2 + HCl ③:Na2CO3+ HCl (NaHSO4)三、铁及铁的化合物1、铁的冶炼: 3CO+ Fe2O3== 2Fe+ 3CO22、与非金属:(1)2Fe + 3Cl2 === 2FeCl3(2)3 Fe + 2O2=== Fe3O4(3)Fe + S === FeS3、与水蒸气:3 Fe + 4 H2O(g) ====Fe3O4+ 4 H24、与非氧化性酸:Fe + 2 HCl === FeCl2+ H2↑Fe + 2 H+ == Fe2++ H2↑5、与盐:Fe + CuSO4 == FeSO4+Cu Fe + Cu2+===Fe2+ + Cu6、与碱不反应:7、铁的氧化物FeO(黑色)、Fe2O3(红棕色,俗名铁红)、Fe3O4(磁性氧化铁,黑色晶体)(1)FeO + 2 HCl === FeCl2 + H2O(非氧化性酸,不变价;遇HNO3变价,下同)FeO + 2 H+ == Fe2+ + H2O(2)Fe2O3 + 6HCl ===2 FeCl3 + 3 H2OFe2O3 + 6 H+ ===2 Fe3+ + 3 H2O(3)Fe3O4+ 8 HCl ===2 FeCl3 + FeCl2 + 4 H2OFe3O4+ 8 H+ === 2 Fe3+ +Fe2+ + 4 H2O用途:作油漆的颜料,炼铁的原料8、铁的氢氧化物(Fe(OH)2,Fe(OH)3)(1)制备:A:FeSO4 + 2 NaOH = Fe(OH)2↓+ Na 2SO4Fe2+ + 2 OH—= Fe(OH)2↓B:3NH3 .H2O + FeCl3 ==== Fe(OH)3↓+ 3 NH4CIFe3+ + 3NH3 .H2O =Fe(OH)3↓+ 3 NH4+(2)氢氧化亚铁不稳定性:4 Fe(OH)2 + O2 + 2 H2O= 4 Fe(OH)3(3)氢氧化铁不稳定性:2Fe(OH)3 ==== Fe2O3 + 3H2O(4)与酸:Fe(OH)3+ 3HCl ====FeCl3+ 3 H2O Fe(OH)3+ 3 H+ === Fe3+ + 3 H2O Fe(OH)2+ 2 HCl ==== FeCI2+ 2 H2O(非氧化性酸,不变价;遇HNO3变价)Fe(OH)2 + 2 H+ == Fe2+ + 2H2O9、Fe2+盐(还原性离子,易被氧化,保存需加少量Fe粉及相应酸)(1)与氯气:2FeCl2 + Cl2 = 2 FeCl3 2Fe2+ + Cl2 === 2Fe3+ + 2 CI—(2)FeSO4溶液和H2O2:2Fe2+ + H2O2 + 2H+== 2Fe3+ + 2H2O(3)FeSO4溶液和酸性KMnO4溶液:5 Fe2+ + MnO4—+8 H+=== Mn 2++ 4H2O+ 5Fe3+(4)FeSO4溶液在空气中变质:4Fe2+ + O2 + 4 H+=== 4Fe3+ + 2H2O10、Fe3+盐(氧化性离子,易被还原. 易水解,保存需加少量相应酸抑制水解.)(1) 2 FeCl3 + Fe =3 FeCl22Fe3+ + Fe === 3 Fe2+(2)2 FeCl3+ Cu === 2FeCl2+ CuCl22Fe3+ + Cu ==2Fe2++ Cu2+(3)Fe3+的检验:FeCl3 + 3 KSCN == 3 KCI+ Fe(SCN)3Fe3+ + 3SCN— === Fe(SCN)3(4)用途:净水剂Fe3+ +3 H2O=== Fe(OH)3(胶体)+ 3 H+高温点燃点燃△高温△.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属及其化合物化学方程式
1、钠放置在空气中4Na + O2 = 2Na2O
2、钠在空气中燃烧(黄色的火焰)2Na + O2Na2O2(淡黄色固体)
4Li + O2△2Li2O
3、铝箔被氧气氧化4Al + 3O2 △2Al2O3
4、钠与水反应(浮、熔、游、响、红)
2Na + 2H2O = 2NaOH + H2↑
【2Na + 2H2O = 2Na+ + 2OH - + H2 ↑】
5、高温下铁与水反应3Fe + 4H2O(g) 高温Fe3O4 + 4H2
6、铝片与稀盐酸反应
2Al + 6HCl = 2AlCl3 + 3H2↑【2Al + 6H+ = 2Al3+ +3H2↑】
7、铝与氢氧化钠溶液反应
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
【2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑】
8、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)
2Na2O2 + 2H2O = 4NaOH + O2↑
【2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑】
9、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
10、苏打(纯碱)与盐酸反应Na2CO3 +2HCl=2NaCl+H2O +CO2↑
【CO32- + 2H+ = H2O + CO2↑】
11、小苏打溶液与盐酸反应NaHCO3 + HCl= NaCl+H2O +CO2↑
【HCO3- + H+ = H2O + CO2↑】
12、小苏打受热分解2NaHCO3△Na2CO3 + H2O +CO2 ↑
13、氢氧化钠溶液和碳酸氢钠溶液反应
NaHCO3+NaOH= Na2CO3 + H2O
【HCO3-+ OH - = H2O + CO32- 】
14、氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH ===2NaAlO2 +H2O
【Al2O3 + 2OH - === 2AlO2- + H2O】
15、氧化铝溶于硫酸Al2O3+ 3H2SO4==Al2(SO4)3+3H2O
【Al2O3 +6H+ = 2Al3+ +3H2O】
16、硫酸铝溶液中滴加过量氨水
Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4
【Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+】
17、氢氧化铝中加盐酸Al(OH)3 + 3HCl = AlCl3 + 3H2O
【Al(OH)3 + 3H+ = Al3+ + 3H2O】
18、Al(OH)3与NaOH溶液反应:
Al(OH)3 + NaOH NaAlO2 +2H2O
【Al(OH)3 + OH- = AlO2- +2H2O】
19、氢氧化铝受热分解2Al(OH)3△2O3+3H2O
20、铁与盐酸反应Fe + 2HCl = FeCl2 + H2↑
【Fe + 2H+ = Fe2+ + H2↑】
21、氧化铁溶于盐酸中Fe2O3 + 6HCl = 2FeCl3 + 3H2O
【Fe2O3 + 6H+ = 2Fe3+ + 3H2O】
22、氧化亚铁溶于盐酸中FeO + 2HCl = FeCl2 + H2O
【FeO + 2H+ = Fe2+ + H2O】
23、氯化铁溶液中滴入氢氧化钠溶液(红褐色沉淀)
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
【Fe3+ + 3OH - = Fe(OH)3↓(红褐色沉淀)】
24、硫酸亚铁溶液中滴加氢氧化钠溶液
Fe SO4+ 2NaOH = Fe(OH)2↓+ Na2SO4
【Fe2+ + 2OH - = Fe(OH)2↓(白色沉淀)】
25、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色,最后变为红褐色沉淀)4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3
26、氢氧化铁受热分解2Fe(OH)3△Fe2O3+3H2O
27、氯化亚铁溶液中通入氯气2FeCl2 + Cl2 = 2FeCl3
【2Fe2+ + Cl2 = 2Fe3+ + 2Cl-】
28、氯化铁溶液中加入铁粉
2FeCl3 + Fe =3FeCl2
【2Fe3+ + Fe =3Fe2+】。
