分子与原子的关系
原子离子 分子关系

原子离子分子关系原子、离子和分子是物质的基本组成部分,它们之间存在着密切的关系。
本文将从不同角度探讨原子、离子和分子之间的关系。
一、原子原子是物质的最小单位,由质子、中子和电子组成。
原子的质子和中子位于原子核中,而电子则绕着原子核运动。
原子的种类由其原子核中质子的数量决定,称为元素。
不同元素的原子具有不同的性质。
二、离子离子是带电的原子或原子团。
当原子失去或获得一个或多个电子时,就会形成正离子或负离子。
正离子带有正电荷,因为它失去了一个或多个电子,而负离子带有负电荷,因为它获得了一个或多个电子。
离子的形成通常是由于原子与其他原子发生化学反应。
三、分子分子是由两个或多个原子通过化学键结合而成的粒子。
分子可以由相同的原子组成,称为单质分子,例如氧气(O2)和氮气(N2)。
分子也可以由不同的原子组成,称为化合物分子,例如水(H2O)和二氧化碳(CO2)。
分子的形成是通过共用电子对来实现的,原子之间共享电子以形成稳定的化学键。
原子、离子和分子之间的关系密切相连。
离子是原子失去或获得电子后形成的,而分子是由原子通过共用电子对结合而成的。
离子和分子都是化学反应的产物,它们之间的形成与化学键的形成密切相关。
在化学反应中,原子可以通过失去或获得电子来形成离子,进而与其他原子结合形成分子。
化学键的形成是通过电子的共用或转移来实现的。
不同的原子之间可以通过共价键或离子键结合,形成不同类型的分子。
例如,氯原子可以通过获得一个电子形成氯离子(Cl-),而钠原子可以通过失去一个电子形成钠离子(Na+)。
当氯离子和钠离子相遇时,它们之间会发生离子键的形成,形成氯化钠(NaCl)分子。
在这个过程中,氯离子和钠离子通过电荷吸引力结合在一起。
总结起来,原子、离子和分子是物质的基本组成部分。
原子是构成物质的最小单位,离子是原子失去或获得电子形成的带电粒子,分子是由原子通过化学键结合而成的粒子。
它们之间的关系密切相连,通过化学反应和化学键的形成相互转化。
分子与原子的联系与区别

分子与原子的联系与区别1. 什么是原子?1.1 原子的定义原子就像是物质的基本构件,简单说,它是构成一切东西的“小砖块”。
想象一下,一个可口的汉堡,原子就是每一块面包、每一片生菜的最小单位。
每个原子都有一个中心叫原子核,里面有质子和中子,外面则围绕着电子,像行星围绕着太阳一样。
1.2 原子的种类原子有很多种,每种都有不同的特性。
比如,氧原子和氢原子,听起来是不是像两个朋友?它们可以结合在一起,形成水,这是我们生活中最离不开的东西。
所以,原子之间的“友谊”非常重要!2. 分子是什么?2.1 分子的定义分子可以看作是由两个或多个原子组成的“小团队”。
就像是一个乐队,多个乐器齐奏出美妙的音乐。
分子的构成可以非常简单,比如氧气(O₂)是由两个氧原子组成的;也可以非常复杂,比如蛋白质,它是由成千上万的原子组成的复杂结构。
2.2 分子的种类分子也有很多种类,像我们身边的空气、食物,甚至是我们的身体,都是由分子构成的。
不同的分子可以带来不同的味道和感觉,想想你吃的冰淇淋和热辣的咖喱,都是分子在里面起作用哦。
3. 原子与分子的联系3.1 分子是由原子组成的原子和分子的关系就像是单个乐手与整个乐队之间的关系。
没有原子,就没有分子;而分子则是由多个原子组合而成的。
所以,如果你了解了原子,理解分子也就不难了。
3.2 共同构成万物这些原子和分子一起构成了我们身边的一切。
无论是石头、树木,还是人类,都是由它们组合而成的。
有时候,想象它们在宇宙中翩翩起舞,就觉得生活充满了诗意。
4. 原子与分子的区别4.1 规模大小原子是基本单位,而分子是由多个原子组成的。
因此,分子的规模往往要比单个原子大得多。
你可以想象,原子就像是沙滩上的沙粒,而分子就像是一个个装满沙子的沙堡。
4.2 性质不同原子的性质主要由它的电子构成决定,而分子的性质则取决于原子的组合方式。
比如,同样都是由氧和氢构成的水(H₂O)和过氧化氢(H₂O₂),它们的性质完全不同,一个能喝,另一个则是漂白剂!这就像两个看似相似的人,性格却天差地别。
分子和原子在化学变化中的根本区别

分子和原子在化学变化中的根本区别好吧,今天我们来聊聊分子和原子在化学变化中的那些事儿。
说起来,这两个家伙在化学界就像是好莱坞的明星,名声在外,但其实它们的关系可复杂得多呢。
咱们得明白什么是原子。
简单来说,原子就是构成一切物质的基本单位,像是万物的“砖块”。
你想想,咱们身边的桌子、椅子,甚至那块冰淇淋,都是由原子组成的。
原子就像小小的珠子,聚在一起,能形成更大的结构。
再说说分子,分子是由两个或两个以上的原子通过化学键结合而成的。
这就像是把几个小珠子串在一起,变成了一串美丽的项链。
比如说,水分子就是由两个氢原子和一个氧原子组成的。
水就是生活中必不可少的东西,咱们离不开它,没水的话,感觉就像干了井一样,啥都不行。
分子和原子这两者的区别就像是单身汉和已婚人士,一个是独来独往的,一个是成对成双的。
那么在化学变化中,原子和分子又有什么不同呢?嘿,化学变化可不是小打小闹的事儿。
想象一下,咱们在厨房里做菜,做着做着,原材料一变,变成了美味的佳肴。
这里面就涉及到原子和分子的重新排列。
原子在变化中其实是没变的,换句话说,原子从来没有离开过它的“家”,它们只是换了个位置而已。
这就像是搬家,原来住在这儿的家具,搬完后都在新家里了,但家具的本身并没有消失。
而分子可就热闹多了。
分子在化学反应中可以形成新的分子。
比如说,水分子遇到其他化学物质,它们可能会分开,重新组合,变成新的东西。
这就像是参加派对,每个人都在寻找合适的搭档,找到合适的后,便会组成新的组合。
嘿,有时候甚至会变成一盘色拉,各种材料混在一起,真是让人眼花缭乱。
这样一来,化学反应就变得生动有趣了。
有趣的是,分子的变化往往伴随着能量的释放或者吸收。
比如说,燃烧就是一个经典的例子。
你把木头放进火里,原子在那儿“嬉戏”,分子也在忙着拆分和组合。
结果就是,咱们得到了热量和光。
这就像是开了一场盛大的派对,大家都在尽情享受,热情四溢。
相比之下,原子在这场派对上则显得有些安静,它们就像是派对的幕后支持者,始终在那儿默默工作,确保一切正常。
分子与原子及原子的结构

分子与原子及原子的结构分子和原子是构成物质的基本单位,它们之间存在着密切的关系。
在讨论分子和原子之前,首先要了解原子的结构。
原子是物质的基本粒子,由三种亚原子粒子组成,分别是质子、中子和电子。
质子和中子聚集在原子的中心,形成了原子核,而电子绕着原子核旋转。
质子具有正电荷,中子是中性的,而电子具有负电荷。
原子内部的质子数目和电子数目是相等的,因此原子整体呈现出电中性。
质子和中子的质量比较大,约为1.67×10^-27千克,而电子的质量相对较小,约为9.11×10^-31千克。
原子的大小通常以原子半径来衡量,原子半径的大小与原子核外层电子的分布有关。
电子在不同的电子壳层中运动,每个壳层都有其特定的能级。
原子外层的电子接近原子核,原子半径较小,而原子外层电子远离原子核,原子半径较大。
原子分为不同的元素,元素由具有相同质子数的原子组成。
质子数也叫做元素的原子序数,用符号Z表示,它决定了元素的化学属性。
例如,氢元素的原子序数为1,氧元素的原子序数为8当两个原子通过化学键结合在一起时,形成了分子。
分子是由两个或更多个原子通过共用电子形成的化学结构。
分子内部的原子通过化学键连接在一起,而分子之间的相互作用通过各种相互作用力实现。
分子可以是由相同元素的原子组成的,如氧气(O₂)或氮气(N₂),也可以是由不同元素的原子组成的,如水(H₂O)或二氧化碳(CO₂)。
分子的结构可以通过分子式来表示。
分子式是用元素符号和下标表示分子中原子的数量,例如,水的分子式为H₂O,表示一个氧原子和两个氢原子。
分子的结构也可以通过分子模型来表示。
分子模型是通过球和棒等形状的模型来展示分子内原子的位置和相互之间的连接关系。
总之,原子是物质的基本单位,由质子、中子和电子组成。
原子通过形成化学键而结合在一起,形成了分子。
分子可以由相同元素的原子组成,也可以由不同元素的原子组成。
通过了解原子的结构和分子的形成,我们可以更好地理解物质的构成和性质。
原子和分子的概念和相互作用

原子和分子的概念和相互作用一、原子的概念原子是物质的基本单位,由原子核和核外电子组成。
原子核位于原子的中心,由质子和中子组成,质子带正电,中子不带电。
核外电子绕原子核高速运动,电子带负电。
原子核和核外电子之间的电磁力相互作用保持着原子的稳定性。
二、分子的概念分子是由两个或两个以上原子通过化学键连接在一起构成的稳定粒子。
分子是保持物质化学性质的最小粒子。
分子中的原子之间通过共享或转移电子形成化学键,包括共价键、离子键和金属键等。
三、原子的相互作用1.电磁相互作用:原子核中的质子带正电,核外电子带负电,它们之间存在电磁相互作用。
在原子内部,正电荷的质子与负电荷的电子之间相互吸引,使原子保持稳定。
2.强相互作用:原子核中的质子之间存在一种很强的相互作用力,称为强相互作用。
这种力使得质子能够聚集在一起,形成原子核。
3.弱相互作用:原子核中的中子与质子之间存在一种较弱的相互作用力,称为弱相互作用。
这种力在某些核反应中起作用,如β衰变。
四、分子的相互作用1.范德华力:分子之间的瞬时偶极矩引起的吸引力,是一种较弱的相互作用力。
范德华力存在于所有分子之间,包括非极性分子和极性分子。
2.氢键:分子之间的一种特殊类型的静电作用力,发生在带有部分正电荷的氢原子与带有部分负电荷的氮、氧或氟原子之间。
氢键比范德华力强,对物质的物理性质有显著影响。
3.离子键:由正负电荷的离子之间的吸引力形成的化学键。
离子键通常存在于离子化合物中,如氯化钠(NaCl)。
4.共价键:原子之间通过共享电子形成的化学键。
共价键可以是单键、双键或三键,如水分子(H2O)中的氧氢键。
5.金属键:金属原子之间的一种特殊类型的相互作用力,金属原子失去部分外层电子,形成金属离子和自由电子。
金属离子与自由电子之间的吸引力形成金属键,使金属具有独特的物理性质。
五、原子和分子的相互作用对物质性质的影响1.熔点:分子间相互作用力越强,物质的熔点越高。
如离子晶体(如食盐)的熔点高于分子晶体(如冰)。
分子原子离子关系图

分子原子离子关系图简介分子、原子和离子是化学中的重要概念,它们代表了物质构成的基本单位。
分子由两个或多个原子通过化学键连接而成,而原子是构成物质的最小单位,离子是带电的原子或分子。
分子、原子和离子之间存在着特定的关系,理解这些关系对于理解化学反应和物质的性质至关重要。
本文将介绍分子、原子和离子的关系,并通过图表展示它们之间的联系。
分子分子是由两个或多个原子通过化学键连接形成的。
分子是化学反应的基本单位,物质的性质往往由分子的组成和结构决定。
不同的原子组合和连接方式可以形成各种不同的分子。
例如,水分子由两个氢原子和一个氧原子通过共价键连接而成,化学式为H2O。
原子原子是构成物质的最小单位。
每种元素都由特定的原子组成,具有自己独特的物理和化学性质。
原子由带正电荷的质子、不带电荷的中性子和带负电荷的电子组成。
质子和中性子位于原子核中,而电子则围绕原子核轨道运动。
原子的电子结构决定了原子的化学性质。
离子离子是带电的原子或分子。
当一个原子失去或获得一个或多个电子时,它将带有正电荷或负电荷,从而形成一个离子。
失去一个或多个电子的原子称为阳离子,带正电荷;获得一个或多个电子的原子称为阴离子,带负电荷。
离子通过电荷的吸引力与其他离子或原子相互作用,形成了离子键或离子化合物。
关系图下面是一个示例的分子、原子和离子之间的关系图:+---------++---- | 分子 | ----+| +---------+ || |分解 | | 结合| |v v+---------+ +-------------+----| 原子 | -----+----- | 离子 |-------+---------+ | +-------------+|合并 | 释放|v+------------+| 化学反应 |+------------+上图展示了分子、原子和离子之间的转化关系。
化学反应通常涉及原子和离子之间的重新组合。
例如,在化学反应中,分子可以发生分解,将分子中的原子释放出来。
分子与原子之间的关联

分子与原子之间的关联分子与原子之间的关联导语:分子和原子是化学领域中最基本的概念,它们之间存在紧密的关联。
本文将从深度和广度的角度,探讨分子与原子之间的关系,帮助读者全面理解这一概念。
一、分子和原子的基本概念1. 原子的定义和性质原子是物质中最基本的单位,由带正电荷的质子、带负电荷的电子和中性的中子组成。
原子的性质取决于其原子序数、质子数、电子数等特征。
2. 分子的定义和性质分子是由两个或多个原子通过化学键结合而成的稳定结构体。
分子可以是同种元素的原子组成的,也可以是不同元素的原子组成的。
分子的性质由其成员原子的性质和结构决定。
二、分子与原子的互相影响1. 化学键的形成与断裂分子中的原子通过化学键结合在一起,形成稳定的分子结构。
不同类型的化学键,如共价键、离子键和金属键,影响着分子的性质和化学反应。
而化学反应中的键的断裂又会导致分子结构的改变。
2. 原子的电子构型与分子的稳定性原子的电子配置决定了分子的稳定性。
原子可以通过共享、获得或失去电子,以满足稳定的八个外层电子。
氢原子通过与另一个氢原子共享电子形成氢分子,增强了稳定性。
三、分子与原子的性质与功能1. 分子的形状与多样性分子的形状对其性质和功能起着重要的影响。
分子的形状可以决定分子间的相互作用、极性、溶解度等特征。
不同形状的分子具有不同的化学和生物活性。
2. 分子之间的相互作用分子之间存在着各种相互作用,如分子间力、氢键等。
这些相互作用可以影响分子的聚集形态、溶解性质和化学反应进程。
分子间的相互作用也对生物分子的折叠和物质的相态变化起着重要作用。
3. 分子在生命中的作用分子在生命的各个层面中发挥着重要作用。
生物大分子,如DNA、蛋白质等由分子组成,它们通过分子间的相互作用、结构特性和功能属性,参与了生物体内的生命活动。
分子生物学的发展,深化了我们对生命分子的认识。
四、总结与回顾本文通过深入探讨了分子与原子之间的关联。
首先介绍了分子和原子的基本概念,然后分析了它们之间的相互影响,包括化学键的形成与断裂、原子的电子构型与分子的稳定性等。
初中化学易错辨析 分子和原子
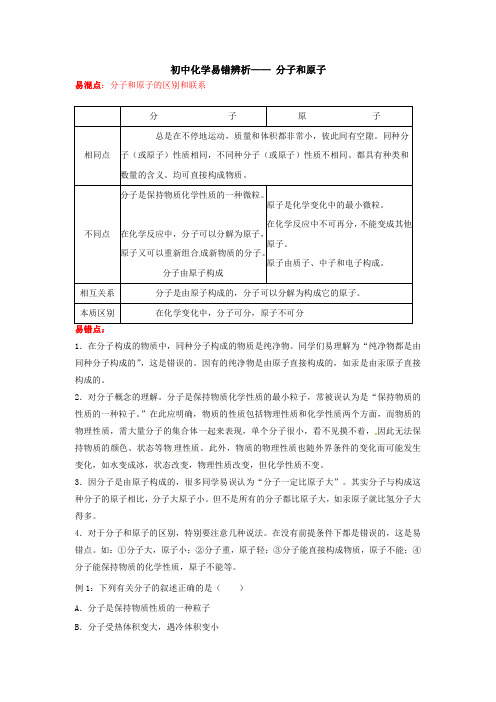
初中化学易错辨析——分子和原子易混点:分子和原子的区别和联系易错点:1.在分子构成的物质中,同种分子构成的物质是纯净物。
同学们易理解为“纯净物都是由同种分子构成的”,这是错误的。
因有的纯净物是由原子直接构成的,如汞是由汞原子直接构成的。
2.对分子概念的理解。
分子是保持物质化学性质的最小粒子,常被误认为是“保持物质的性质的一种粒子。
”在此应明确,物质的性质包括物理性质和化学性质两个方面,而物质的物理性质,需大量分子的集合体一起来表现,单个分子很小,看不见摸不着,因此无法保持物质的颜色、状态等物理性质。
此外,物质的物理性质也随外界条件的变化而可能发生变化,如水变成冰,状态改变,物理性质改变,但化学性质不变。
3.因分子是由原子构成的,很多同学易误认为“分子一定比原子大”。
其实分子与构成这种分子的原子相比,分子大原子小。
但不是所有的分子都比原子大,如汞原子就比氢分子大得多。
4.对于分子和原子的区别,特别要注意几种说法。
在没有前提条件下都是错误的,这是易错点。
如:①分子大,原子小;②分子重,原子轻;③分子能直接构成物质,原子不能;④分子能保持物质的化学性质,原子不能等。
例1:下列有关分子的叙述正确的是()A.分子是保持物质性质的一种粒子B.分子受热体积变大,遇冷体积变小分子原子相同点总是在不停地运动,质量和体积都非常小,彼此间有空隙。
同种分子(或原子)性质相同,不同种分子(或原子)性质不相同。
都具有种类和数量的含义。
均可直接构成物质。
不同点分子是保持物质化学性质的一种微粒。
在化学反应中,分子可以分解为原子,原子又可以重新组合成新物质的分子。
分子由原子构成原子是化学变化中的最小微粒。
在化学反应中不可再分,不能变成其他原子。
原子由质子、中子和电子构成。
相互关系分子是由原子构成的,分子可以分解为构成它的原子。
本质区别在化学变化中,分子可分,原子不可分C.分子是构成物质的唯一粒子D.分子是不断运动的错因会诊错选A是对分子的概念不理解;错选B是对分子的基本性质没有掌握;错选C是不知道分子只是构成物质的一种粒子,除分子外,构成物质的粒子还有原子、离子等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子与原子的关系:
元素与原子的关系:
原子与离子的关系: 例1:已知六种微粒结构示意图分别为:
(1)A 、B 、C 、D 、E 、F
共表示 种元素;(2)表示原子的微粒是 (填序号);(3)表示离子的微粒是 (填序号)。
审题与思路:元素是具有同相同核电荷数的一类原子的总称。
在题所示的六种微粒中,(A )与(B )核电荷都是+8,(E )与(F )核电荷都是+12,所以这六种微粒结构代表核电荷为+8、+10、+11、+12四种元素。
原子的核电荷数与核外电子总数相等;阳离子的核电荷数比核外电子总数大,阴离子的核外电子总数小,即离子的核电荷数与核外电子总数不相等。
解答:(1)四(2)A、C、F (3)B 、D、E
总结:对于微粒洁构成示意图的含义,我们要深刻理解,要判断是原子、阳离子还阴离子,主要依据是质子数与核外电子数是否相等。
2.下图为四种粒子的结构示意图,请用对应的序号
..填空:
(1)属于同种元素的粒子是;
(2)具有相对稳定结构的粒子是;
(3)某元素R形成碱的化学式为R(OH)3,则R元素对应的原子结构示意图可能是。
