药物合成反应 第二章 烃化反应
药物合成反应-3烃化反应

第二章 烃化反应
(Hydrocarbylation Reaction,Alkylation)
一、概念
《药物合成反应》
用烃基取代有机物分子中的氢原子,包括某些 官能团或碳架上的氢原子,均称为烃化反应。
引入的烃基包括: 饱和的、不饱和的烃基 脂肪的、芳香的烃基 含有各种取代基的烃基 举例 NaOH
O CH2OCOC17H33
O
O
/KOH /H2 O
CH2OCOC17H33 O(CH2CH2O)p H
HO OH
OH (75.5%)
H(OCH2CH2)mO (13 )
(m、n、p均约为20)
O(CH2CH2O)nH
四、烯烃为烃化剂
《药物合成反应》
醇可与烯烃双键进行加成反应生成醚, 也可理解为烯对醇的O-烃化。但对烯烃双 键旁没有吸电子基团存在时,反应不易进 行。只有当双键的α-位有羰基、氰基、酯 基、羧基等存在时,才较易发生烃化反应。 例如醇在碱存在下对丙烯腈的加成反应。
HOOC NH
HX
CuSO4/NaOH,pH5~6
F3C NH2
HOOC Cl
Cu/无水K2CO3 HCl
F3C
HOOC NH
pH4
二、酯类为烃化剂
《药物合成反应》
1.硫酸酯为烃化剂
OH COOCH3 S O NH O
(CH3)2SO4/NaOH 25 ,10h
OH COOCH3 S O N CH3 O
ห้องสมุดไป่ตู้
七、溶剂对烃化位置有较大影响:
《药物合成反应》
酚类在DMSO、DMF、醚类、醇类中烃化时,主要 得酚醚(O-烃化产物),而在水、酚或三氟乙醇中 烃化时,则主要得到C-烃化产物。
药合试题库及答案
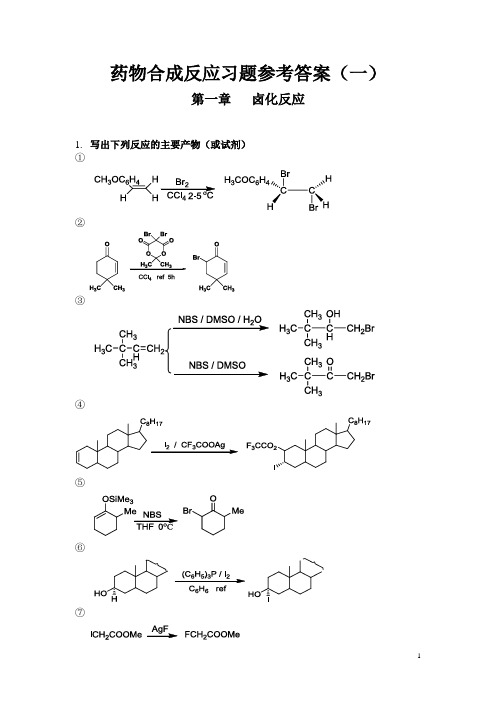
药物合成反应习题参考答案(一)第一章卤化反应1.写出下列反应的主要产物(或试剂)①②③④⑤⑥⑦⑧⑨⑩2.写出下列反应的可能产物①②③④3.写出下列反应的主要试剂及条件①②③④第二章烃化反应1. 完成下列反应①③④⑤⑥⑦⑧OH3C LDA / CH3OCH2CH2OCH3-40~0 o C, 酮过量O-Li⊕ H3C2.完成下列反应过程①②③④第三章 酰化反应1.完成下列反应①OCH 3OCH 3H 3CO +CH 3COClAlCl 3OCH 3OCH 3H 3COCOCH 3②C O 2NH OH C NHCOCHCl 2HCH 2OH +CH 3(CH 2)16COClC 6H 6C O 2N H OH C NHCOCHCl 2HCH 2OCO(CH 2)16CH 3Py③ClCH 2CONH+N SOCOOH CH 2S H 2N N NNNCH 3DCC THFN SOCOOHCH 2S N N NNCH 3SCO 2H NOCH 3ClCH 2CONHS CONH NOCH 3④CH 3CH 3(CH 2)5COClAlCl 3ClCH 2CH 2Cl, 0 o CCH 3CH 3O⑤OCH 3H 3CO H 3COH 3CO OCH 3H 3CO H 3COH 3COCHODMF/POCl 3⑥+C 6H 5N CHOPOCl 390-95 oCCHOCH 3CH 3CO C H 2C O OC 2H 5+HO140 oC 4~5hrCH 3CO C H 2C O O2.完成下列合成路线①OH OC 2H 5DMFPOCl 3OC 2H 5COClNaOH/C 2H 5BrOC 2H 5CHOOC 2H 5CONH SOH 2NCH 3CH 3CO 2NaSOCH 3CH 3CO 2Na② 以苯和丁二酸酐为起始原料合成四氢萘O OOOOH O AlCl 3Zn-Hg HCl (gas)OHO OPPAHCl (gas)Zn-Hg第四章 缩合反应1. 改错(只能改动一处)①Ph 3PCHCH 3+CHOHCH 3H HCH 3HXCH 3CH 2CH 2CCH 3O+CH 3COOC 2H 5C 3H 7H 3CCCHCOOC 2H 5XCH 3CH 2CH 2COCH 2COCH 3C 2H 5ONa③CHO+ClCH 2CO 2C 2H 5Zn +C 6H 6(C 2H 5)2OH CCHCOOC 2H 5BrCH 2CO 2C 2H 5x2. 完成下列反应式①O+NO 2CHO OH /H 2OCH 3OCH 3O 2N②OOCHCH 3H 3CHC Ph 3P=CHCH 3> 2mol③O+CH 2O (excess)Ca(OH)2H 2OOCH 2OH CH 2OHHOH 2C HOH 2C④C 6H 5CHOC H CCOOH C 2H 5C 3H 7CO 2K(C 3H 7CO)2O⑤OClCH 2CO 2CH 3CH 3ONaH 2OOH-H+OCO 2CH 3OCO 2CHO+C 6H 5CH 2CNC 6H 5H C CNC OC 2H 5O(CO 2C 2H 5)2C 2H 5ONaor C 2H 5OCO 2C 2H 5⑦(C 6H 5)3P C H 2C HCH 2OCH 2CH 2CHO CH 3C 6H 6BrNaNH 2Ph 3P=CH-CH=CH 2O CH 2CH 2CH=CH-CH=CH 2CH 3⑧H 3COOCH 3CO 2CH 3BrCH 2CO 2CH 3ZnC 6H 6(C 2H 5)2O,ref.CH 3CO 2H H 2O+H 3COCHCO 2CH 3CH 3CO 2CH 33. 完成下列合成过程 ①CCOOC 2H 5C 2H 5COOC 2H 5CH 3CH 3CH 2BrCH 2CNCH 2CO 2C 2H 5CH(CO 2C 2H 5)2C 2H 5Br/C 2H 5ONaC(CO 2C 2H 5)2C 2H 5C 2H 5ONaOC 2H 5OOC 2H 5NBSKCN1. H +/H 2O2. C 2H 5OH H 2SO 4CH 3CH 3H 2C CH 3C HCHOCH 3CH 3CH 3CHOCH 3CH 2CH(CH 3)CHOCH 3CH 3CH 3CHO H 2, Pd/CCH 3CH 2CHO NaOHCrO 2Cl 24. 填写下列各部分产物(1)H 3CCHOCH 3H 3CCHOH 3C CH 2OH H 3CCH H 3C CH 2OH OHCO 2H AB O H 3C H 3C OHOC NH 2CH 2CH 2CO 2CH 2PhCH 3H 3C CH 2OHCHCONHCH 2CH 2CO 2CH 2PhOH DH 3OCH 3H 3C CH 2OHCHCONHCH 2CH 2CO 2H OH E+ PhCH 2OHHCHO OH(2)OCOCH 3(C 2H 5)2N CH 2CH 2COCH 3CH 3CH 3ONa CH 3OH C 6H 6KOH CH 3OH/H 2O, ref.H 3O +O COCH 3COCH 3OCOCH 3Zn/BrCH 2CO 2EtH 3O +HBr KCNSOCl 2AlCl 3OHCEtO 2CCH=CHOHO 2COHLAHCN(4)N HMeCO 2EtMeHCOOH, HClor DMF/POCl 3CH 2(CO 2H)2PiperidineN HMeCO 2EtMeOHCN HMe CO 2EtMeHO 2C-HC=HC第五章 重排反应1.完成下列反应式 (1)OHOHdilute H 2SO 4O(2)CONH 2H OH HO H H OH HOH CH 2OHNaOCl / H 2OCHO HO H H OH H OH CH 2OH(3)NC 2H 5CH 3CH 2OCH 3C 6H 5Li Et 2ON C 2H 5CH 2CH 3OCH 3N ClC 6H 5Libenzene, heatN(5)N CH 2N(CH 3)3CH 3NaNH 2 / NH 3N CH 3CH 3CH 2N (CH 3)2(6)CH 3CH 3OH OH H +- H 2OCH 3OCH 3(7)OCH 3CONH 2NaOCl, NaOHOCH 3OCH 3NH 2OCH 3(8)NC EtOOC180 o CNC EtOOC(9)OOCH 3CH 3CH 3PhNEt 2reflux 2hOHOCH 3(10)CH 3NaNO 2 / H +HOCH 2NH 2CH 3OHOCH 3C(OEt)3142-147o C, 8daysCO 2C 2H 5(12)1. HCl-HOAc-Ac 2O2. H 3O +MeCO 2MeMeC CHMe 2MeN HOMeCO 2MeMeCHMe 2NH 22.完成下列合成过程 (1)OCHOO COOH OHOCNOOOONaOH H 3O(2)OCH 2OH +CH 3OC 2H 5OCH 3CHO OOCH 3OCH 3CHO ClaisenCopeOCH 3CHOH 2, Pd-C(3)CH 3C 2H 5OCH 3OCH 3+H 3CO 2COHCH 3ClaisenRearrangement2,4-O 2NC 6H 5OHTol OC 2H 5CO 2CH 3CH 3CO 2CH 3C 2H 5OCH 3CO2CH3C2H5OHCH3CH3C2H5OCH3OCH3CO2CH3C2H5CH3C2H5OHNaBH4MeOHNaBH4MeOHCO2CH3CH3C2H5OC2H5CO2CH3C2H5CH3C2H5OClaisen第六章氧化反应1.完成下列反应式①CH3NO2CrO3/Ac2OH2SO4CHONO2②CH3COOHNa2Cr2O7, H2O③CH3CH3CH3COClAlCl3CH 3COOHCH3CH3CH3COCH3 1. Br2,NaOH2. H+④HO OHMnO2CHCl3,25°CRHO OR⑤OAcOKMnO4BaOHKIO4//H2O/K2CO3/35°COOAcOOH⑥CH3NO2 OCH3CrO2Cl2CS225°CCHONO2OCH3⑦HO CH2OH(C5H5N)2CrO3CH2Cl225°CHO CHO ⑧0.5 M SeO2C2H5OH, ref.OH⑨H3CO HOOHH3PO4RTDMSO-DCCH3COOO⑩C OCH 3C OCH 3ORO ROH 2O 2, NaOH⑾H 3C H 3CH HHHClCOOOH(C 2H 5)2O 25°C H 3CH 3CHHHHO⑿HCOCH 3C 6H 5COOOHCHCl 325°CHOCOCH 32. 试以化学式表示实现下列变化的各步反应①CHOAg 2O1.SOCl 22.NH 3RCO 3Haq NaOHC 2H 5CHO C 2H 5COOH C 2H 5CONH 2C 2H 5CONH 2O②HO(CH 2)6CH 3H 3CSO 2ClOHC(CH 2)5CH 3H 3CSO 2O(CH 2)6CH 3DMSO③OH1.H 2SO 42.KMnO 4CHOCHO CHOOH OHPb(OAc)4aqNaOH④OH Bu-tO Bu-tOOBu-t1. CrO 3-H 2SO 4-H 2O2.SeO 21. KOH2. HCl,第七章 还原反应1、完成下列反应 ①H 3CCHO0.25M NaBH 4H 3CCH 2OH②NO 2NH 2NH 2H 2O Pd-C /C 2H 5OHNH 2③OOH0.25M NaBH 4④CO(CH 2)2CH 2Br OCH 3OCH 3Zn-Hg.HClCH 2(CH 2)2CH 2BrOCH 3OCH 3⑤H3CCH 3CH 3H B 2H 6THF,25°CNaOHH 2OH 3CCH 3CH 3H2BHH 3CCH 3HOH CH 3H⑥OCH 3CH 3COClOCH 3CH 3CHOPd-BaSO 4/H 2⑦2PhCH 2C HCH 2+Pd/C2PhCH 2CH 2CH 3⑧OH 2 / (Ph 3P)3RhClO⑨OOPhH 2 / Pd-CAcOH , HClO 4HOOPh⑩N H 3COCNC HCH 2Al(OCH(CH 3)2)3(CH 3)2CHOHONH 3COCHN C HCH 2HO2. 改错①COOHCOOEtLAHCH 2OHCOOEtCH 2OHCH 2OH②CH 3C O COOEtZn-Hg HClCH 3CH 2COOEtCH 3CCHOOEtOH③C CH 3O C H 3C H C H 3C CH 3CH 3C CH 3OHC H 3C H C H 3C CH 3CH 3H C CH 3H C H 3C H C H 3C CH 3CH 3OH LAH3. 完成下列合成题①试由环己醇,氯乙酸,乙醇合成C 10OOH-H 2O1. O 32. Pd/C, H 2ZnCl 2/ HCl Cl(CH 2)6ClClCH 2COOHNaCNOH -C 2H 5OHCH 2(COOC 2H 5)2CH 2(COOC 2H 5)2+Cl(CH 2)6Cl C 2H 5ONa(COOC 2H 5)2CH(CH 2)6CH(COOC 2H 5)21. NaOH, H 2O 2. EtOH, H +C 2H 5OOC(CH 2)8COOC 2H 5Na, NH 3PhCH 3(CH 2)2OHO(CH 2)2O②试由O OCH 3合成O。
《药物合成反应》闻韧主编第二章烃化反应-知识点总结

#2.10打卡# 李骅轩完成学习目标烃化反应定义:用烃基取代有机分子中的某些功能基上的氢原子得到烃化产物的反应都称为烃化反应。
烃基:饱和、不饱和、脂肪、芳香分类1)按被烃化物不同C-OH(醇或酚羟基)变为-OR醚;C-N(NH3) 变为伯、仲、叔胺;C-C2)按烃化剂的种类分类卤代烷:RX 最常用;硫酸酯、磺酸酯;醇;烯烃;环氧烃:发生羟乙基化;CH2N2:很好的重氮化试剂3)按反应历程分类:SN1 SN2 亲电取代一醇的O-烃化1 卤代烷为烃化剂2 磺酸酯3 环氧乙烷类作烃化剂4 烯烃作为烃化剂5 醇作为烃化剂6 其它烃化剂二酚的O-烃化1 烃化剂2 多元酚的选择性烃化一醇的O-烃化1 卤代烷为烃化剂在碱的条件下与卤代烷生成醚:SN1伯卤代烷RCH2X按SN2历程;随着与X相连的C的取代基数目的增加越趋向SN1。
影响因素 a RX的影响ii)活性:RI>RBr>RCl>RFb 醇的影响苯海拉明合成可采用的两种方法。
可以看到,由于醇羟基氢原子的活性不同,进行烃化反应时所需的条件也不同。
前一反应醇的活性低,要先制成醇钠;而二苯甲醇中,由于苯基的吸电子效应,羟基中氢原子的活性增大,在反应中加入氢氧化钠作除酸剂即可。
显然后一反应优于前一反应,因此苯海拉明的合成采用了后一种方式c催化剂的影响催化剂:醇钠、Na、NaH、NaOH、KOH有机碱:六甲基磷酰胺(HMPA)、N,N-二甲基苯胺(DMA)有些有旋光活性的醇,如果加金属钠制成醇钠,再与卤代烃反应,产物比较复杂,如用氢化钠,则可立体专一性地得到相应的甲醚。
d溶剂影响溶剂: 过量醇(既是反应物又是溶剂)非质子溶剂:苯、甲苯(Tol)、二甲苯(xylene)、DMF、DMSO无水条件下质子性溶剂:有助于R-CH2X 解离,但是与RO-易发生溶剂化,因此通常不用质子性溶剂。
副反应消除反应2 磺酸酯为烃化剂:主要指芳磺酸酯,引入较大的烃基3环氧乙烷类作烃化剂:反应机理:a 酸催化R为供电子基或苯,在a处断裂R'为吸电子基得b处断裂产物b 碱催化SN2 双分子亲核取代,开环单一,立体位阻原因为主,反应发生在取代较少的碳原子上。
药物合成反应(全)

O
O
C2H5 C2H5
NH ONa
HCl
C2H5
NH
C2H5
NH O
NH
O
O
盐酸普鲁卡因(ProcaineHydrochloride)的合成
➢ 盐酸普鲁卡因为局部麻醉药,作用强,毒性低 ➢ 临床上主要用于浸润、脊椎及传导麻醉 ➢ 化学名为对氨基苯甲酸2-二乙胺基乙酯盐酸盐 ➢ 化学结构式为:
H2N
化学选择性 化学选择性
区域选择性
化学选择性
我国抗癌药物紫杉醇合成成功
文章来源: 健康报
第四军医大学化学教研室张生勇教授课题组经过9年攻关, 在国内首次利用手性催化技术合成出抗癌药物紫杉醇。
紫杉醇和多烯紫杉醇是高效、低毒、广谱的抗癌药,广 泛用于治疗乳腺癌、卵巢癌、子宫癌等妇科肿瘤,对于某些 晚期肿瘤也有明显疗效。
Br2 CH3 COOH
P
O BrCH2 C-Br
X
溴乙酰溴
Br2 PCl3
BrCH2COOH
NH3 NH2-CH2COOH
第三节 醇、醚的卤素置换反应
一、醇的卤素置换反应
1 与HX反应 HI﹥HBr﹥HCl﹥HF 叔﹥仲﹥伯
2 与氯化亚砜、氯化砜的反应
S O2Cl
o C2O H H P y
o C2C H l
1S,2S (+)
仅1R,2R(-)型有抗菌活性, 临床使用
合成路线如下
O2N
Br2 , C6H5Cl COCH3
O2N
COCH2Br (CH2)6N4 , C6H5Cl O2N
COCH2Br(CH2)6N4
C2H5OH HCl , H2O O2N
(CH3CO)2O COCH2NH2 . HCl CH3COONa O2N
药物合成反应》课程教学大纲

[教学目的及要求]
[了解]
1. 了解卤化反应的定义。
2. 卤素对烯烃的加成。
3. 卤代反应新试剂。
[熟悉]
1. 药物合成反应课程教授内容
2. 熟悉其它官能团化合物的卤置换反应
[掌握]
1.不饱和烃卤加成反应的立体化学及常用的卤化剂。
2.烃类、羰基化合物的卤取代反应的特点、反应类型及立体化学。
3.醇、酚、醚及羧酸的卤置换反应中常用的卤化剂、反应条件及应用特点。
[教学内容]
卤化反应:
1.不饱和烃的卤加成反应
2. 烃类的卤取代反应
3. 羰基化合物的卤取代反应
4. 醇、酚和醚的卤置换反应
5. 羧酸的卤置换反应
6. 其他官能团化合物的卤置换反应
[教学重点]
2. 氮原子上的酰化反应
3. 碳原子上的酰化反应
4. 有机金属化合物在C-酰化中的应用
[教学重点]
1.酰化反应的机理及常用酰化剂类型。
2.醇、酚羟基及氨基保护中常用的保护基以及在药物合成中保护基对选择性反应的重要性。
[教学难点]
1. 反应条件对酰化反应的影响
0.5
第七节
胺的氧化反应
0.3
第八节
其他氧化发应
0.2
第七章
还原反应
6 Βιβλιοθήκη 第一节 还原反应机理
1.5
第二节
不饱和烃的还原
1.5
第三节
羰基的还原反应。
1.0
第四节
羧酸及其衍生物的还原反应
[教学目的及要求]
1.了解烃化反应的定义、类型及其在药物合成中的重要性。
药物合成反应(全) PPT

H2N
COOCH2CH2N(C2H5)2 . HCl
二氢吡啶钙离子拮抗剂的合成
➢ 具有很强的扩血管作用,适用于冠脉痉挛、高血压、 心肌梗死等症。
➢ 本品化学名为1,4-二氢-2,6-二甲基-4-2-硝基苯基)-吡
啶-3,5-二羧酸二乙酯
NO2
➢ 化学结构式为:
CH 3CH 2OOC
COOCH 2CH 3
药物合成反应(全) PPT
药物合成反应教学内容
绪论 第1章 卤化反应 第2章 烃化反应 第3章 缩合反应 第4章 氧化反应 第5章 还原反应 第6章 重排反应 第7章 官能团保护反应 第8章 药物合成反应路线设计
Chapter 1 概论
水杨酰苯胺(Salicylanilide)的合成
➢ 水杨酸类解热镇痛药 ➢ 用于发热、头痛、神经痛、关节痛及活动性风湿症 ➢ 作用较阿司匹林强,副作用小 ➢ 化学名为邻羟基苯甲酰苯胺 ➢ 化学结构式为:
巴比妥(Barbital)的合成
➢ 巴比妥为长时间作用的催眠药。 ➢ 主要用于神经过度兴奋、狂躁或忧虑引起的失眠。 ➢ 学名为5,5-二乙基巴比妥酸,化学结构式为:
O
C2H 5 C2H 5
O
NH O
NH
合成路线如下
H2C
COOC2H5
COOC2H5+C2H5Br
C2H5ONa
C2H5 C2H5
C
CONH
OH
合成路线如下:
OH
OH
COOH
+
PCl3
OH COO
OH COO
NH2
+
CONH OH
苯妥英钠(PHenytoin Sodium)的合成
药物合成反应 第二章 卤化反应

醇羟基的置 换反应
一、卤素对不饱烃的加成反应
烯烃和炔烃中的双键和叁键,存在有不稳定的π键, 它们容易被亲电试剂进攻而发生断裂,进而发生加成反应 。药物原料分子中大多含有双键,利用药物原料分子中的 双键与亲电型卤化剂的加成是药物原料分子卤化的常用方 法,加成后得到相应的邻二卤化物。炔烃类含叁键的化合 物,在与卤素的加成中,叁键的反应活性比双键小得多, 应用远没有烯烃广泛。在药物合成技术中主要学习双键的 有关反应。
(三)常用卤化试剂
类别
分子式 Cl2
特
点
应用范围
常 见 卤 化 试 剂
Br2 HCl HBr HClO HBrO
活性高,易进行 ,但需注意反应的特 殊条件。
与不饱和键加成 • 在芳环上、芳环侧链上和羰 基α 位上取代
价廉易得,应用 广泛,反应条件要控 制。
不稳定,需新制 ;条件温和,但有副 产物。
CH2
CH2 + Cl2 + H2O
60
ClCH2CH2OH + HCl
用次溴酸合成氯霉素中间体(9):
H CH CH CH2OH
Br2/H2O
Br C CH2OH
C
OH H (9)
又如用N-卤化酰胺合成α–卤代醇:
O H C C + RC N Br
H2O
Br C C OH
三、卤素与芳香烃的反应பைடு நூலகம்
CCl4 60
杂环中的五员环(呋喃、吡咯、噻吩等),环中碳的 电子密度比苯大,均为多电子杂环,亲电取代活性大于苯 ,卤代要容易进行些; 六员杂环(吡啶、吡喃、吡嗪等),环中碳的电子密 度比苯小,均为缺电子杂环,使位碳上的电子密度减小, 亲电取代活性小于苯,卤代要难进行些。
第二章 烃化反应(药物合成)

N CHMe H2/Raney Ni
NHCH2Me (88%)
• (6)芳胺的N-芳烃化
U11mann反应
COOH + Cl CuSO4/NaOH,PH=5-6
• 6. 碱性越弱越易离去,卤素、磺酸酯、硫酸酯 都是好的离去基团; • 7. 离去能力越强越利于SN1; • 8. 极性溶剂利于SN1,不利于SN2; • 9. 亲核性越强越利于SN2;亲核性-碱性 • (1)同周期的元素形成的负离子,碱性和亲 核性一致,随电负性增大而减, NH2->HO->F• (2)亲核原子相同时,碱性和亲核性一致, RO->HO->ArO->RCOO->ROH>H2O; • (3)同一族中,碱性随体积增加而减小,亲 核性则相反;
MeONa + ClCH2COOMe MeOH/Ph=8~9 64~66 C,3h
0
MeOCH2COOMe + NaCl
(88.4%)
• • • • •
(3)影响因素 ①卤代烃的结构 如果活性不够,可加入适当的KI; 芳香卤化物-邻对位有吸电子基团存在; ②反应溶剂
• 醚类、极性非质子溶剂
Cl EtOH / NaOH
Raney Ni
PhCHO + NH3
PhCH2NH2 + (PhCH2)2NH (90%) ( 7%)
• (6)重排制胺 Curtius Rearrangement
Example
Schmidt Rearrangement
Lossen rearrangement.
ห้องสมุดไป่ตู้
Example
二、亲电取代反应
• Friedel-Crafts反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Hydrocarbylation Reaction , Alkylation
教学目的
1.了解O-、N-烃化在保护反应的地位和应用, 有机金属化合物在C-烃化中的应用;
2.掌握C、N、O原子上的烃化反应,包括 反应机理、影响因素、常用的烃化剂、重 要的人名反应;
3.重点掌握C、N、O原子上烃化反应的反 应机理,相转移催化烃化反应的原理。
5碳以上的脂肪醛与过量氨还原烃化可主要得伯胺
脂肪酮的立体位阻大小决定了收率高低:
仲胺的制备:
控制反 应的投
料比
叔胺的制备
Or EtBr
几 种 方 法 ?
常用作 甲基化
盐酸利多卡因(Lidocaine Hydrochloride)
盐酸氯丙嗪
氟哌啶醇(Haloperidol)
芳香胺的N-烃化
3、重氮甲烷
缺点:重氮甲烷及制备的中间体均有毒。 羟基的酸性愈大,质子愈易发生转移,反
应愈易进行。
比较酚与羧 酸的酸性
4、醇
酚与醇在DCC存在下发生缩合反应可生成 酚醚。伯醇收率较好,仲、叔醇收率偏低
5、烷氧膦盐
伯及仲醇与三苯基膦及偶氮二羧酸酯反应。
6、烯烃
酚与异丁烯在酸催化下进行烃化反应,可 得叔丁醚,可作为酚羟基的保护。
混合物
芳香胺的N-芳基化-Ullmann反应:
后二者均为非甾体抗炎药
杂环胺的N-烃化:
黄嘌呤
注意选择性
抗组胺
曲吡那敏 咖啡因
可可碱
COOH C2H5OH
Cl
H2SO4
OH C
Cl
SOCl2
CO2C2H5 C6H5MgBr
Cl
OMgBr C
Cl
H2O H2SO4
Cl C
Cl
N
N N
N
H
C
Cl
克霉唑
难点
1、烃化反应的反应机理、影响因素; 2、相转移催化烃化反应的原理及其应用; 3、选择适当的烃化剂进行选择性烃化; 4、醛、酮通过烯胺进行C-烃化反应的区
域选择性。
用烃基取代有机分子中的氢原子,均称 为烃化反应。
引入的烃基包括饱和的、不饱和、脂肪 的、芳香的以及各种取代的烃基。
被烃化的有:醇、酚、胺及活性亚甲基、 芳烃等。
氧、氮、碳原子上的烃化反应。
常用的烃化剂:卤代烃及硫酸酯类。芳 磺酸酯、醇、醚、烯烃以至甲醛、甲酸、 重氮甲烷等。
第一节:氮原子上的烃化反应
卤代烃与氨或伯、仲胺进行烃化反应是合成 胺类的主要方法之一。
比羟基更容易进行烃化反应。I>Br>>Cl>>F
伯胺
伯胺
仲胺
叔胺 季铵盐
一、伯胺得到伯胺。
重点
1、氨及脂肪胺的N-烃化(包括Gabril反应、 Delepine反应等)
2、醇的O-烃化(以卤代烃、芳磺酸酯、环氧乙烷 等为烃化剂)
3、多元酚的选择性烃化 4、醇、酚羟基的保护—成醚反应以及脱保护的方
法 5、 芳烃的烃化∶Friedel-Crafts反应 6、 活泼亚甲基化合物的C-烃化反应 7、 相转移烃化反应: O-、N-、C-烃化
why?
在中性或弱碱性条件下,也可发生 单分子的亲核取代反应。
V=k[RX]
??? ??
多卤化物
芳基-烷基混合醚
周效磺胺--150h
2、芳磺酸酯为烃化剂
OTS是很好 的离去基团
3、环氧乙烷为烃化剂
称为羟乙基反应:酸催化属于单分子亲核取代反
应,碱催化属于双分子亲核取代反应。
碱催化
由于位阻关系, RO-进攻取代少的
7、还原烃化
醛、酮在还原剂存在下,与氨或伯胺、仲 胺反应,使氮原子上引入烃基的反应称为 还原烃化反应。
主要特点是没有季铵盐生成。 可使用的还原剂:催化氢化、金属钠和乙
醇、锌粉、负氢化物以及甲酸等。 用甲酸及其铵盐进行的还原烃化叫Leuckart
反应。
伯 胺
仲胺
叔 胺
低级脂肪醛(C<4)与氨还原烃化得混合物:
1、卤代烃
酚羟基易苄基化,将酚置于干燥的丙酮中, 与氯化苄、碘化钾、碳酸钾回流即可。
盐酸普萘洛尔 心得安
2、硫酸酯
硫酸酯的活性大于芳磺酸酯,大于卤代烃。 机理基本相同。 常用的硫酸酯为硫酸二甲酯和二乙酯,故只
能用于甲基化和乙基化,范围小。
盐酸维拉帕米
没食子酸
香兰醛
分子中同时含有酚羟基和醇羟基时,若只 需对醇羟基进行烃化,则应保护酚羟基。
试比较两种 方法的优缺 点。Why??
付克烃化反应 溴化
Williamson
N-烃化
改进的Williason合成
卤代醇在碱性条件下的环化反应即分 子内Williamson反应,是制备环氧乙烷、 环氧丙烷及高级醚的方法。
由于Williamson反应是在强碱条件 下进行的,故不能用叔卤代烃
作为卤化剂。
2、反应中加入氯化铵、硝酸铵或醋酸铵等, 因增加铵离子,有利于反应进行。
3、Gabriel合成法
伯喹
4、Delepin反应
卤代烃与环六亚甲四胺(乌洛托品)反应
氯霉素中间体
5、利用三氟甲磺酸酰化苄胺得N-苄基三氟 甲磺酰胺,在碱性条件下与卤代烃反应,然 后用氢化钠催化消除,水解得伯胺。
6、用两个苯硫基封闭氨中氮,然后与丁基锂 反应得锂盐,再与卤代烃反应,经水解得伯 胺。
一、醇的O-烃化
醚
1、卤代烃为烃化剂
Williamson合成--醇在碱存在下与卤代 烃反应生成醚的反应--是制备混合醚的 有效方法。
卤代烃的结构不同,反应可以是单 分子亲核取代反应SN1,也可以是双 分子取代反应SN2。
通常伯卤代烃发生SN2反应
烷基R相同时,活性顺序为RI > RBr >RCl (KI)
Br
F
Mg
MgBr F 1. ClCH2COCH2Cl, (C2H5O)2O
(C2H5O)2O
F
F
H
N N
N
K2CO3, PEG600, C2H5CO2C2H5
2. CH3COOH, H2O
OH
N N H2C C CH2 N N
N
FN
OH ClH2C C CH2Cl
F
F
F
氟康唑
第二节 氧原子上的烃化反应
碳原子
酸催化
开环方向取 决于电子因
素
注意聚合
4、烯烃为烃化剂:
醇和烯烃加成反应生成醚。也可理解为烯对 醇的O-烃化。
只有当双键上有羰基、氰基、酯基、羧基等 存在时,较易发生烃化反应。
二、酚的O-烃化
由于酚的酸性比醇强,反应更容易进行。 烃化剂:卤代烃、硫酸酯、重氮甲烷、醇、
有机膦卤化物、烯烃、氯甲醚等。
