鲁科版化学必修二课后练习(带答案)教学提纲
2021-2022高一化学鲁科版必修2课后作业:第3章 第2节 第3课时 习题课 Word版含解析
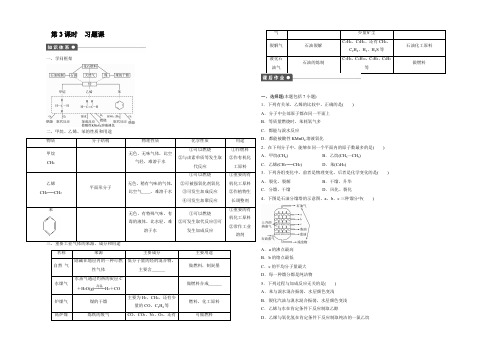
第3课时 习题课一、学问框架二、甲烷、乙烯、苯的性质和用途 物质 分子结构物理性质 化学性质 用途 甲烷 CH 4无色、无味气体,比空气轻,难溶于水①可以燃烧 ②与卤素单质等发生取代反应 ①作燃料 ②作有机化工原料 乙烯 CH 2===CH 2平面形分子无色、稍有气味的气体,比空气____,难溶于水①可以燃烧②可被强氧化剂氧化 ③可发生加成反应 ④可发生加聚反应①重要的有机化工原料②作植物生长调整剂 苯无色、有特殊气味、有毒的液体,比水轻,难溶于水①可以燃烧 ②可发生取代反应③可发生加成反应①重要的有机化工原料②常作工业溶剂三、重要工业气体的来源、成分和用途名称 来源主要成分主要用途 自然 气隐藏在地层内的一种可燃性气体低分子量的烃的混合物,主要含______做燃料,制炭墨水煤气水蒸气通过灼热的炭层C+H 2O(g)=====高温H 2+CO做燃料合成______炉煤气 煤的干馏 主要为H 2、CH 4,还有少量的CO 、C 2H 4等 燃料,化工原料高炉煤炼铁的废气CO 、CO 2、N 2、O 2,还有可做燃料气 少量矿尘裂解气 石油裂解C 2H 4、C 3H 6、还有CH 4、C 2H 6、H 2、H 2S 等 石油化工原料液化石油气石油的炼制 C 3H 8、C 4H 10、C 3H 6、C 4H 8等 做燃料一、选择题(本题包括7小题)1.下列有关苯、乙烯的比较中,正确的是( ) A .分子中全部原子都在同一平面上B .等质量燃烧时,苯耗氧气多C .都能与溴水反应D .都能被酸性KMnO 4溶液氧化2.在下列分子中,能够在同一个平面内的原子数最多的是( ) A .甲烷(CH 4)B .乙烷(CH 3—CH 3)C .乙烯(CH 2===CH 2)D .苯(C 6H 6)3.下列各组变化中,前者是物理变化,后者是化学变化的是( ) A .裂化、裂解 B .干馏、升华 C .分馏、干馏D .风化、裂化4.下图是石油分馏塔的示意图,a 、b 、c 三种馏分中( )A .a 的沸点最高B .b 的熔点最低C .c 的平均分子量最大D .每一种馏分都是纯洁物5.下列过程与加成反应无关的是( ) A .苯与溴水混合振荡,水层颜色变浅 B .裂化汽油与溴水混合振荡,水层颜色变浅 C .乙烯与水在肯定条件下反应制取乙醇D .乙烯与氧化氢在肯定条件下反应制取纯洁的一氯乙烷。
2021-2022高一化学鲁科版必修2课后作业:第2章 第2节 第3课时 习题课 Word版含解析

第3课时习题课一、多角度生疏化学反应限度二、化学反应速率的变化与化学平衡移动的关系化学平衡的实质是__________________,化学平衡移动的实质是旧v正=v逆→____________________→新v′正=v′逆。
由此可知,化学平衡的移动与______________________之间有着必定的联系。
具体的状况如表条件变化后的v正与v逆的关系化学平衡移动的方向旧v正=v逆→________→新v′正=v′逆____反应方向旧v正=v逆→________→新v′正=v′逆____反应方向旧v正=v逆→v正=v逆→新v′正=v′逆____移动说明①化学平衡移动的本质所在是不同程度地转变了v正和v逆。
只有条件转变后v正≠v逆,平衡才发生移动。
②平衡移动的方向是向反应速率占优势的方向移动(即加快反应程度大的或减慢反应程度小的)。
一、选择题(本题包括9小题)1.可逆反应N2(g)+3H2(g)2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。
下列各关系中能说明反应已达到平衡状态的是()A.3v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)2.对于反应2SO2(g)+O2(g)2SO3(g),能增大正反应速率的措施是()A.通入大量O2B.增大容器容积C.移去部分SO2D.降低体系温度3.在密闭容器中进行反应X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在肯定条件下当反应达到平衡时,各物质的浓度有可能是()①Z为0.3 mol·L-1②X2为0.2 mol·L-1③Y2为0.35 mol·L-1④Z为0.4 mol·L-1 A.①②B.①③C.②④D.①④4.将4 mol A气体和2 mol B气体在2 L容器中混合并在肯定条件下发生如下反应2A(g)+B(g)2C(g),若2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是()①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1③2 s时物质A的转化率为70%④2 s时物质B的浓度为0.7 mol·L-1A.①③B.①④C.②③D.③④5.某温度下,在一固定容积的容器中进行如下反应:H2(g)+I2(g)2HI(g),下列状况肯定能说明反应已达到反应限度的是()A.压强不再随时间而转变时B.气体的总质量不再转变时C.混合气体中各组成成分的含量不再转变时D.单位时间内每消耗1 mol I2,同时有2 mol HI生成时6.化学反应H2(g)+I2(g)2HI(g)是一个可逆反应,在持续加热的条件下,向密闭容器中充入2 mol H2和3 mol I2蒸气,充分反应后,该密闭容器内()A.2 mol H2已耗尽B.3 mol I2已耗尽C.HI的物质的量等于4 molD.HI的物质的量少于4 mol7.肯定条件下,对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列推断不合理的是()A.c1∶c2=1∶3B.平衡时,Y和Z的生成速率之比为2∶3C.X、Y的转化率相等△高温、高压催化剂D .c 1的取值范围为0<c 1<0.14 mol·L -18.下列说法可以证明反应N 2+3H 22NH 3已达到化学平衡状态的是( )①1 个NN 键断裂的同时,有3个H—H 键形成 ②1 个NN 键断裂的同时,有3个H—H 键断裂 ③1 个NN 键断裂的同时,有6个N—H 键断裂 ④1 个NN 键断裂的同时,有6个N—H 键形成 A .①③B .①②C .②③D .①④9.已知肯定温度时:2SO 2(g)+O 2(g)2SO 3(g)。
新教材 鲁科版高中化学必修第二册全册各章节课时练习题 含解析

鲁科版必修第二册第一章原子结构元素周期表.............................................................................................. - 2 - 第1节原子结构与元素性质........................................................................................ - 2 - 第1课时原子结构.............................................................................................. - 2 -第2课时原子结构与元素原子得失电子能力.................................................. - 7 - 第2节元素周期律和元素周期表................................................................................ - 12 - 第1课时元素周期律........................................................................................ - 12 -第2课时元素周期表.......................................................................................... - 17 - 第3节元素周期表的应用............................................................................................ - 22 - 第1课时认识同周期元素性质的递变规律.................................................... - 22 -第2课时研究同主族元素的性质.................................................................... - 27 -第3课时预测元素及其化合物的性质............................................................ - 34 - 微项目海带提碘与海水提溴——体验元素性质递变规律的实际应用................. - 41 - 第二章化学键化学反应规律............................................................................................ - 45 - 第1节化学键与物质构成........................................................................................ - 45 - 第2节化学反应与能量转化........................................................................................ - 50 - 第1课时化学反应中能量变化的本质及转化形式........................................ - 50 -第2课时化学反应能量转化的重要应用——化学电池.................................. - 56 - 第3节化学反应的快慢和限度.................................................................................... - 63 - 第1课时化学反应的快慢................................................................................ - 63 -第2课时化学反应的限度................................................................................ - 71 - 微项目研究车用燃料及安全气囊—利用化学反应解决实际问题 ........................ - 78 - 第三章简单的有机化合物.................................................................................................... - 80 - 第1节认识有机化合物................................................................................................ - 80 - 第1课时有机化合物的一般性质与结构特点................................................ - 80 -第2课时有机化合物的官能团同分异构现象............................................ - 86 - 第2节从化石燃料中获取有机化合物........................................................................ - 93 - 第1课时从天然气、石油和煤中获取燃料石油裂解与乙烯 .................... - 93 -第2课时煤的干馏与苯.................................................................................. - 100 -第3课时有机高分子化合物与有机高分子材料.......................................... - 107 - 第3节饮食中的有机化合物...................................................................................... - 113 - 第1课时乙醇.................................................................................................. - 113 -第2课时乙酸.................................................................................................. - 118 -第3课时糖类、油脂和蛋白质...................................................................... - 125 - 微项目自制米酒—领略我国传统酿造工艺的魅力 .............................................. - 130 -第一章原子结构元素周期表第1节原子结构与元素性质第1课时原子结构1.下列有关原子的说法正确的是( )①原子是由核外电子和原子核构成的②原子不能再分③原子在化学变化中不能再分④原子在化学变化中不发生变化⑤原子的质量主要集中在原子核上A.①②③B.①③④C.①②⑤D.①③⑤答案 D解析所有原子都是由原子核和核外电子构成的,①正确;原子是由原子核和核外电子构成的,可以再分,②错误;原子是化学变化中的最小微粒,所以原子在化学变化中不能再分,③正确;原子在化学变化中可以通过得失电子变为离子,④错误;由于电子的质量很小,所以原子的质量主要集中在原子核上,⑤正确。
鲁科版化学必修二课后练习(带答案)

1、据报道,某些花岗岩会产生氡(22286Rn),从而对人体产生伤害。
请回答:(1)该原子的质量数是,质子数是,中子数是。
(2)请补全Rn的原子结构示意图(3)请根据Rn的原子结构预测,氡气的化学性质()A.非常活泼,容易与氧气等非金属单质反应B.比较活泼,能与钠等金属反应C.不太活泼,与氮气性质相似D.很难与其他物质发生反应⑶研究发现,镭能蜕变为22286Rn,故称22286Rn为镭射气;钍能蜕变为22086Rn,故将22086Rn称为钍射气;锕能蜕变为21986Rn,故将21986Rn称为锕射气。
22286Rn、21986Rn是()A.同种元素B.同位素C.同种核素D.同种原子由此可见,决定元素种类,质子数和决定核素种类。
2、请利用原子结构的知识解释下列事实(1)在硫化钠中,钠元素显+1价,硫元素显-2价(2)钠原子和铝原子电子层数相同,但金属钠与氯气的反应要比金属铝与氯气的反应容易而且剧烈。
第二节元素周期律和元素周期表ag jb c f i l me h kd(1)表中所列元素中:属于短周期元素的有________________________________,属于主族元素的有____________________,e元素在周期表中的位置是_________周期,_______族。
(2)下列___________组元素的单质可能都是电的良导体A.b,c,iB.a,g,kC.c,g,lD.d,e,f(3)将元素a,b,c,f,l的原子半径按从小到大的顺序排列:_______________________ (4)i元素属于___________元素,它的最高化合价是____________,最低化合价是_______。
它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用作干燥剂,写出i 的单质与氧气反应的化学方程式:___________________________________________。
2021-2022高一化学鲁科版必修2课后作业:第2章 第3节 第3课时 习题课 Word版含解析

第3课时 习题课一、化学反应的分类1.四大基本反应类型⎩⎪⎨⎪⎧反应分解反应反应复分解反应2.电子转移⎩⎪⎨⎪⎧反应非氧化还原反应3.是否有离子参与⎩⎪⎨⎪⎧ 离子反应反应4.反应进行程度⎩⎪⎨⎪⎧可逆反应 反应5.反应的热效应⎩⎪⎨⎪⎧反应放热反应二、利用化学反应制备物质 1.Cl 2的制法⎩⎪⎨⎪⎧工业制法:2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑试验室制法⎩⎪⎨⎪⎧ 原理:装置:固+液――→△气(圆底烧瓶)收集: 尾气处理:用 吸取2.气体的制备 (1)气体的制备和收集 ①常用的气体发生装置a .固体之间反应且需要加热,用加热KMnO 4制O 2的装置(如NH 3、CH 4等);肯定要用 ________。
b .固体与液体反应且不需要加热,用制H 2的装置(如CO 2等);肯定不用________。
②常用的气体收集方法a .排水法:适用于______或不溶于水且与水不反应的气体,导管稍稍伸进瓶内(CO 、N 2、NO 只能用排水法)。
b .向上排空气法:适用于密度比空气____的气体(CO 2、HCl 只能用向上排空气法)。
c .向下排空气法:适用于密度比空气____的气体。
用排气法时,留意导管应伸入瓶底。
(2)气体的验满①O 2的验满:用带火星的木条放在瓶口。
②CO 2的验满:用燃着的木条放在瓶口。
验证CO 2的方法是用____________。
三、化学能转化为电能——原电池1.原电池的工作原理原电池是利用____________反应将______能转化成____能的装置,利用原电池可以将氧化还原反应中电子的转移变成电子在导线上的定向移动,将氧化反应和还原反应分别在两个电极上进行。
(1)构成原电池的条件:两个活动性不同的______、____________、形成闭合______。
(2)电子的流向:由____极沿导线流向____极;(3)溶液中离子的移动方向:阴离子移向____极,阳离子移向____极;(4)两极反应:负极发生______反应,正极发生______反应。
2020年鲁科版高中化学必修2课后练习(2)(有答案解析)

2020年鲁科版必修2课后练习(2)一、单选题(本大题共2小题,共2.0分)1.物质之间发生化学反应时,一定发生变化的是A. 化学键B. 物质的颜色C. 物质状态D. 原子核2.已知氢气在氯气中燃烧时产生苍白色火焰,在反应过程中,破坏1mol氢气的化学键消耗的能量为,破坏1mol氯气的化学键消耗的能量为,形成1mol氯化氢中的化学键释放的能量为,下列关系式正确的是A. B. C. D.二、填空题(本大题共1小题,共1.0分)3.人们可以从不同的角度、不同的层面来认识物质变化。
请你以为例,谈谈自己对化学变化有哪些认识______。
三、推断题(本大题共1小题,共10.0分)4.已知A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大。
A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。
E元素与D元素同族;E的单质为黄色晶体,易溶于二硫化碳。
请写出元素符号:A______,B______,C______,D______,E______。
画出E的阴离子的结构示意图:______的单质和C的单质在一定条件下反应生成化合物X,该反应的化学方程式为______。
向X 的水溶液中滴入酚酞溶液,会观察到______。
将9gB单质在足量的D单质中燃烧,所得气体通入溶液中,完全吸收后,溶液中大量存在的离子是______。
四、简答题(本大题共4小题,共20.0分)5.1956年,杨振宁和李政道提出在弱相互作用中宇称不守恒,并由吴健雄用放射源进行了实验验证。
次年,杨振宁、李政道两人因此获得诺贝尔物理学奖。
的衰变方程为:。
其中,是反中微子,它的电荷为零,静止质量可认为是零。
下列关于的叙述中,错误的是______。
A.质子数是电子数是质量数是中子数是60在上述衰变方程中,衰变产物Ni的质量数A为______,核电荷数Z为______。
元素的化学性质主要决定于______。
2020年鲁科版高中化学必修第二册课后练习(2)(有答案解析)

2020年鲁科版必修第二册课后练习(2)一、单选题(本大题共3小题,共3.0分)1.X、Y是元素周期表ⅦA族中的两种元素。
下列说法中,能说明X原子的得电子能力比Y强的是A. X原子的电子层数比Y原子的电子层数多B. X的单质的颜色比Y的浅C. X的气态氢化物比Y的气态氢化物稳定D. Y的单质能将X从NaX的溶液中置换出来2.氧化性由弱到强,原子或离子半径由大到小的一组微粒是A. O,Cl,S,PB. ,,,C. Rb,K,Na,LiD. ,,,3.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是X YZ WA. 原子半径:B. 最高价氧化物对应水化物的酸性:C. 四种元素的单质中,W单质的熔、沸点最高D. W的单质能与水反应,生成一种具有漂白性的物质二、双选题(本大题共1小题,共4.0分)4.已知X、Y、Z为三种原子序数相邻的元素,最高价氧化物对应水化物的酸性相对强弱是,下列说法中,不正确的是A. 气态氢化物的稳定性:B. 原子的得电子能力:C. 单质的氧化性:D. 三种元素原子的最外层电子数相等三、推断题(本大题共2小题,共20.0分)5.元素特征X在元素周期表中,原子半径最小Y常温下,可以形成、型的两种气体单质存在Z其原子内层电子层与最外层电子数之比为10:1 W最高化合价为的元素符号是,其原子结构示意图为。
四种元素中,原子半径最大的是______填元素符号。
元素原子的得电子能力______填“强”或“弱”于W,请用原子结构的知识解释其原因:______。
将通入溶液中,没有明显变化,再向其中加入Z元素最高价氧化物对应的水化物,可观察到的现象是______,所发生反应的离子方程式是______。
6.已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大。
A元素的原子形成的离子核外电子数为0,B元素的原子的最外层电子数是内层电子数的2倍,C、D元素在元素周期表中处于相邻的位置,E元素与D元素处于同一主族,E元素的单质为黄色晶体。
鲁科版化学必修二课后练习(带答案)

第一章第一节原子结构1据报道,某些花岗岩会产生氡( 22286Rn),从而对人体产生伤害。
请回答:(1) 该原子的质量数是 ,质子数是 ,中子数是 。
(3)请根据Rn 的原子结构预测,氡气的化学性质( )A •非常活泼,容易与氧气等非金属单质反应B .比较活泼,能与钠等金属反应C •不太活泼,与氮气性质相似D .很难与其他物质发生反应⑶研究发现,镭能蜕变为22286Rn ,故称22286Rn 为镭射气;钍能蜕变为22086Rn ,故将22086Rn 称为钍射气;锕能蜕变为21986Rn ,故将21986Rn 称为锕射气。
22286Rn 、1 2 3 4%Rn 是()A .同种元素B .同位素C .同种核素D .同种原子 由此可见, _____________ 决定元素种类,质子数和 ______________ 决定核素种类。
2、请利用原子结构的知识解释下列事实 (1) 在硫化钠中,钠元素显 +1价,硫元素显-2价(2 )钠原子和铝原子电子层数相同,但金属钠与氯气的反应要比金属铝与氯气的反应容易而且剧烈。
第二节元素周期律和元素周期表agjbcfilmehkd1 表中所列元素中:属于短周期元素的有 ________________________________________ ,属于主 族元素的有 ______________________ , e 元素在周期表中的位置是 __________ 周期, _______ 族。
2 下列 _____________ 组元素的单质可能都是电的良导体 A. b , c , i B.a , g , k C.c , g , l D.d , e , f3 将元素a , b , c , f , l 的原子半径按从小到大的顺序排列: ______________________________4 i 元素属于 _____________ 元素,它的最高化合价是 ______________ ,最低化合价是 _______ 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、据报道,某些花岗岩会产生氡(22286Rn),从而对人体产生伤害。
请回答:(1)该原子的质量数是,质子数是,中子数是。
(2)请补全Rn的原子结构示意图(3)请根据Rn的原子结构预测,氡气的化学性质()A.非常活泼,容易与氧气等非金属单质反应B.比较活泼,能与钠等金属反应C.不太活泼,与氮气性质相似D.很难与其他物质发生反应⑶研究发现,镭能蜕变为22286Rn,故称22286Rn为镭射气;钍能蜕变为22086Rn,故将22086Rn称为钍射气;锕能蜕变为21986Rn,故将21986Rn称为锕射气。
22286Rn、21986Rn是()A.同种元素B.同位素C.同种核素D.同种原子由此可见,决定元素种类,质子数和决定核素种类。
2、请利用原子结构的知识解释下列事实(1)在硫化钠中,钠元素显+1价,硫元素显-2价(2)钠原子和铝原子电子层数相同,但金属钠与氯气的反应要比金属铝与氯气的反应容易而且剧烈。
第二节元素周期律和元素周期表ag jb c f i l me h kd(1)表中所列元素中:属于短周期元素的有________________________________,属于主族元素的有____________________,e元素在周期表中的位置是_________周期,_______族。
(2)下列___________组元素的单质可能都是电的良导体A.b,c,iB.a,g,kC.c,g,lD.d,e,f(3)将元素a,b,c,f,l的原子半径按从小到大的顺序排列:_______________________ (4)i元素属于___________元素,它的最高化合价是____________,最低化合价是_______。
它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用作干燥剂,写出i 的单质与氧气反应的化学方程式:___________________________________________。
2、请你利用元素周期律和元素周期表的有关知识,回答下列问题(1)下列各组元祖性质或原子结构递变情况错误的是()A.Li、Be、B原子最外层电子数依次增多B.P、S、Cl元素最高正化合价依次升高C.N、O、F原子半径依次增大D.Na、K、Rb的电子层数依次增多(2)A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层电子数是最外层电子数的2倍,则A、B元素()A.一定是第二周期元素B.一定是同一主族元素C.可能是低2、3周期元素D.可以互相化合形成化合物第三节元素周期表的应用1、X、Y是元素周期表VIIA族中的两种元素,下列叙述中能说明X的原子得电子能力比Y 强的是()A.X原子的电子层数比Y原子的电子层数多B.X的氢化物的沸点比Y的氢化物的沸点低C.X的气态氢化物比Y的气态氢化物稳定D.Y的单质能将X从NaX的溶液中置换出来2、元素X 的单质的分子是双原子分子X 2,元素X 的单质与金属镁反应时元素X 的原子形成-1价的阴离子。
请回答:(1)元素X 在元素周期表中位于哪一族?(2)写出金属镁与X 的单质反应的化学方程式:________________________________第一章自我评价1、1956年,李政道和杨振宁提出在弱相互作用中宇称不守恒,并由吴健雄用放射源进行了实验验证,1957年李、杨两人为此获得诺贝尔物理学奖。
的衰变方程是,其中是反中微子,它的电荷为零,静止质量可认为是零。
(1)下列关于的叙述中,错误的是( )A.质子数是27B.电子数是27C.质量数是27D.中子数是60(2)元素的化学性质主要取决于( )A.核外电子数B.核内质子数C.核内中子数D.最外层电子数(3)不同种元素的本质区别是( )A.质子数不同B.中子数不同C.电子数不同D.质量数不同2、下列8种化学符号:11H 2 21H 2 146C 63Li 2311Na 147N 73Li 2412Mg (1)表示核素的符号共________种。
(2)互为同位素的是_______________和______________(3)质量数相等,但不能互称为同位素的是_______________和______________(4)中子数相等,但质子数不相等的是_______________和______________。
3、请根据元素周期律和元素周期表回答以下问题(1) 下列叙述中,正确的是( )A.同周期元素中,VIIA 族元素的原子半径最大B.VIA 族元素的原子,其半径越大,越容易得到电子C.室温时,o 族元素的单质都是气体D.元素周期表中从IIIB 到IIB10个纵列的元素都是金属元素 (2)X 、Y 、Z 、W 均为短周期元素,它们在元素周期表中的位置如图所示.若Y 原子的最外层电子数是次外层电子数的2倍,下列说法中正确的是( )A .原子半径:W>Z>Y>XB .最高价氧化物对应的水化物的酸性:Z >W >XC .4种元素的单质中,Z 单质的熔、沸点最高D .W 单质能与水反应,生成一种具有漂白性的物质(3)铊(Tl )位于元素周期表的IIIA 族,有的同学预测:单质铊能与盐酸反应放出氢气,氢氧化铊是两性氢氧化物。
你认为这位同学的预测正确吗?4、已知A 、B 、C 、D 、E 是短周期中的五种非金属元素,它们的原子序数依次增大,元素原子形成的离子核外电子数为零,C 、D 在元素周期表中处于相邻的位置,B 原子的最外层电子数是内层电子数的2倍。
E 元素与D 元素同主族;E 的单质为黄色晶体,易溶于二硫化碳。
(1)请写出元素符号:A___________、B____________、C___________、D____________、E____________ X Y Z W(2)画出E的阴离子的结构示意图_____________________(3)A的单质与C的单质在一定条件下反应生成化合物X,该反应的化学方程式为__________________,向X的水溶液中滴入酚酞溶液,会观察到__________________________。
(4)将9gB单质在足量的D单质中燃烧,所得气体通入1L 1mol·L-1NaOH溶液中,完全吸收后,溶液中大量存在的离子是__________________________。
第二章第一节化学键与化学反应1、物质之间发生化学反应时,一定发生变化的是()A.颜色B.状态C.化学键D.原子核2、下面所列的是一组你熟悉的物质:HCl、CO2、H2O、H2、NaOH、Cl2、NaF、CH4、CaO、MgCl2(1)这些物质中分别存在哪些类型的化学键?(2)请从中找出属于离子化合物和共价化合物的物质(3)对于这些物质,你是否还有其他的分类方法?标准是什么?3、氢气在氯气中燃烧时产生苍白色火焰。
在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molCl2中的化学键消耗的能量为Q2kJ,形成1molHCl中的化学键释放的能量为Q3kJ,下列关系式中,正确的是()A.Q1+Q2>Q3B. Q1+Q2>2Q3C. Q1+Q2<Q3D. Q1+Q2<2Q3第二章第二节化学反应的快慢和限度1、现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:(1)实验过程如图所示,分析判断:________段化学反应速率最快,_______段收集的二氧化碳气体最多。
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是________________A.蒸馏水B.氯化钠固体C.氯化钠溶液D.浓盐酸(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答两种)_______________________________________________________第二章第三节化学反应的利用1、电池在通讯交通及日常生活中有着广泛的应用。
(1)利用电池可将____________能转化为______________能。
(2)下列电池中,不易造成环境污染的是()A.锂离子电池B.锌锰电池C.镍镉电池D.氢氧燃料电池(3)已知甲醇燃料电池每生成1mol的液态水放出286kJ的热量,又知该电池每发1kW·h 电能生成350g水,则该电池的能量转化率为______________。
3、某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图所示:(1)写出该反应的化学方程式__________________。
(2)上述反应中,还原剂是______,1 mol该还原剂被氧化时转移的电子的物质的量是____mol。
(3)实验开始前,某学生对装置进行了气密性检查。
方法是:连接好装置后,用弹簧夹夹住____(填“A”或“B”)处橡胶管,向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察,当观察到分液漏斗中_________________________ 时,表明该装置不漏气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是____(填字母)。
A.氢氧化钠溶液B.碳酸钠浓溶液C.浓H2SO4第二章自我评价1、利用元素周期表,确定下列化合物中化学键的类型:NaF、NO2、CH4、Na2S2、下列哪些反应可以设计成原电池?A.CaCO3+2HCl=CaCl2+CO2↑+H2OB.Zn+CuSO4=Cu+ZnSO4C.2H2+O2=2H2OD.2NaOH+CuSO4=Cu(OH)2↓+Na2SO43、在19世纪后期,人们发现炼铁高炉所排出的高炉气中含有相当数量的CO。
有的工程师认为,这是由于CO和铁矿石的接触时间不够长所造成的,于是在英国耗费了大量资金建造了一座高达的炼铁高炉,以增加CO与铁矿石的接触时间。
可是后来发现,用这座高炉炼铁,所排出的高炉气中的CO含量并没有减少。
请说明其中的原因。
4、某化学反应2A B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的-1实验序号时间浓度温度0 10 20 30 40 50 601 800 1.0 0.80 0.67 0.57 0.50 0.50 0.502 800 1.0 0.60 0.50 0.50 0.50 0.50 0.503 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20根据上述数据,回答下列问题:(1)在实验1.2中,有一个实验使用了催化剂,请你利用表中数据判断是哪个实验(2)请你利用表中数据判断实验1.3在反应进行了多长时间才达到化学平衡状态。
5、请你比较氯气、氢气、氧气和二氧化碳气体的实验室制法。
