第四章多组分系统热力学习题
04 多组分系统热力学 习题课(含答案)
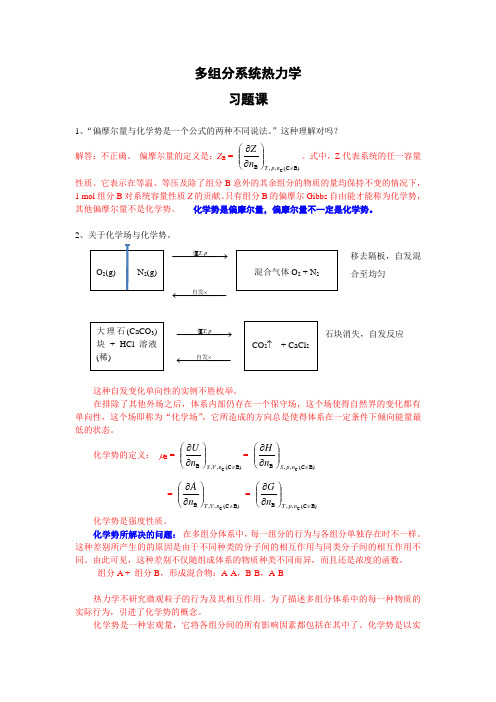
多组分系统热力学习题课1、“偏摩尔量与化学势是一个公式的两种不同说法。
”这种理解对吗? 解答:不正确。
偏摩尔量的定义是:Z B = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n Z 。
式中,Z 代表系统的任一容量性质。
它表示在等温、等压及除了组分B 意外的其余组分的物质的量均保持不变的情况下,1 mol 组分B 对系统容量性质Z 的贡献。
只有组分B 的偏摩尔Gibbs 自由能才能称为化学势,其他偏摩尔量不是化学势。
化学势是偏摩尔量,偏摩尔量不一定是化学势。
2、关于化学场与化学势。
−−−−→−pT,恒 移去隔板,自发混合至均匀−−−−−←⨯自发−−−−→−pT,恒 石块消失,自发反应 −−−−−←⨯自发这种自发变化单向性的实例不胜枚举。
在排除了其他外场之后,体系内部仍存在一个保守场,这个场使得自然界的变化都有单向性,这个场即称为“化学场”,它所造成的方向总是使得体系在一定条件下倾向能量最低的状态。
化学势的定义: μB = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂nV S n U = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np S n H= B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂nV T n A = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n G化学势是强度性质。
化学势所解决的问题: 在多组分体系中,每一组分的行为与各组分单独存在时不一样。
这种差别所产生的的原因是由于不同种类的分子间的相互作用与同类分子间的相互作用不同。
由此可见,这种差别不仅随组成体系的物质种类不同而异,而且还是浓度的函数。
组分A + 组分B ,形成混合物:A-A ,B-B ,A-B热力学不研究微观粒子的行为及其相互作用。
为了描述多组分体系中的每一种物质的实际行为,引进了化学势的概念。
化学势是一种宏观量,它将各组分间的所有影响因素都包括在其中了。
化学势是以实际应用为背景引入的一个概念,有很强的实践性。
化学势的物理意义:μB = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n G = 偏摩尔Gibbs 自由能G B它表示在T 、p 和其他组分的含量不变的条件下,增加1 mol 组分B 对于体系总Gibbs自由能的贡献。
第四章+多组分热力学系统

二、概念题 题号 1 2 3 4 5 6 7 8 选项 C A B C B D B B 题号 9 10 11 12 13 14 15 选项B DC A A C D1. 2 mol A 物质和3 mol B 物质在等温、等压下,混合形成理想液态混合物,该系统中A 和B 的偏摩尔体积分别为1.79×10-5 m 3⋅mol -1,2.15×10-5 m 3⋅mol -1 ,则混合物的总体积为( )。
(A )9.67×10-5 m 3 (B )9.85×10-5 m 3 (C )1.003×10-4 m 3 (D )8.95×10-5 m 3 答:(C )运用偏摩尔量的集合公式(B B A A V n V n V+=)。
2. 下列偏微分中,能称为偏摩尔量的是( )。
(A )()C B C B T p n V n ≠⎛⎞∂⎜⎟∂⎝⎠,,(B )()C B C B S p n H n ≠⎛⎞∂⎜⎟∂⎝⎠,, (C )()CB C B p V nG n ≠⎛⎞∂⎜⎟∂⎝⎠,, (D )()CB C B T H nS n ≠⎛⎞∂⎜⎟∂⎝⎠,,答:(A )偏摩尔量定义。
()C B C B T p n X X n ≠⎛⎞∂=⎜⎟∂⎝⎠,, 3. 下列偏微分中,不是化学势的是( )。
(A )C ,,(C B)B ()S V n Un ≠∂∂ (B )()CB C B T p nH n ≠⎛⎞∂⎜⎟∂⎝⎠,,(C )C ,,(C B)B()T p n G n ≠∂∂ (D )C ,,(C B)B (T V n A n ≠∂∂答:(B )广义的化学式:C C C C B ,,(C B),,(C B),,(C B),,(C B)B B B B()()()()S V n S p n T V n T p n U H A Gn n n n μ≠≠≠≠∂∂∂∂====∂∂∂∂4. 已知373 K 时,液体A 的饱和蒸气压为133.24 kPa ,液体B 的饱和蒸气压为66.62 kPa 。
多组分系统热力学自测题答案

4、在 50.00gCCl4 中溶入 0.5126g 的萘(M=0.1282kg.mol-1),测得沸点升高 0.402K。若在
同量 CCl4 中溶入 0.6216g 未知物,测得沸点升高 0.647K,求该未知物的摩尔质量。
解:
Tb
KbbB
Kb
mB / M B mA
所以Kb
TbM BmA mB
0.402 0.1282 50 0.5126
依据克 - 克方程:ln
p2 p1
Δ
g l
H
m
R
1 T2
1 T1
求得100C时pA 175.288kPa,pB 76.166kPa
对理想液态混合物各组分符合拉乌尔定律:P=pA+pB=pA*xA+pB*xB=pA*xA+pB*(1-xA)
求出气液平衡时液相组成 xA=0.254,xB=0.746 气相组成 yA=pA/p=pA*xA/p=0.439,yB=1-yA=0.561
由已知条件求得混合物总组成 xA=0.371,xB=0.629
依据杠杆规则:nl/ng=(0.629-0.561)/(0.746-0.629) 求得 nl=1.270mol,ng=2.186mol
2、解:依据稀溶液的依数性:⊿Tf =kf bB 求得血浆浓度 bB=0.301mol/kg 血浆渗透压: cBRT bBRT 0.301998.28.314310 774.38kPa
第四章 多组分系统热力学
ห้องสมุดไป่ตู้
一、填空题
1、10.03×10-5 m3 4、= 7、0.045,0.955 10、0.180,0.252 13、170kPa
2、3.95×10-5 m3,1.71×10-5 m3 5、减小 8、35.02kPa 11、373.75K, 2.865×103kPa 14、拉乌尔
合肥工业大学-物理化学习题-第四章、多组分系统热力学合并

A. 增加
00-7-15
B. 减少
C. 不变
D. 不一定
本章完 5
1 在恒温和总体积不变的条件下, 向理想气体混合物中增加一 种新组分, 各气体的分压的变化是 __不__变__( _p_B_=__n_B_R_T_/_V_); 各气体
的化学势的变化是 __不__变__(__B__=__B___+__R_T_l_n_(p_B__/p___).
pB
pB xB
22.13k
Pa
0.0379 /
0.9621/88.10 18.02 0.9621/
88.10
18.56kPa
(2) p = pA + pB =(6.306 + 18.56)kPa = 24.86 kPa
00-8-16
15
例 20℃下HCl溶于苯中达到气液平衡. 液相中每100g苯含有
00-7-15
8
10 在25℃, p下, *H2O(l) ___>__ H2O(溶液) ; 在100℃, 2p下, *H2O(l) __<___ *H2O(g) ; 在-5℃, p下, *H2O(l) __>___ *H2O(s) .
11 0.5mol苯与0.8mol甲苯在300K, p下形成理想液态混合物,
3
10 25℃时, 0.01moll-1糖水的渗透压为1, 0.01moll-1食盐水 的渗透压为2, 则1与2 的关系是 __B___. A. 1 > 2 B. 1 < 2 C. 1 = 2 D. 不能确定
11 在未平衡的多相系统中, 组分B在各相中的物质的量分数都 相等, 则下述说法中正确的是___E_.
拉乌尔定律和亨利 1.87g HCl, 气相中苯的摩尔分数为0.095. 已知苯与HCl的摩尔质 定律 量分别为78.11gmol1与36.46 gmol1. 20℃苯饱和蒸气压为
第4章 多组分系统热力学

第四章多组分体系热力学一、选择题1. 在298K时,A和B两种气体单独溶解在某一溶剂中,均遵守亨利定律,亨利常数分别为kА和k B,且知kА> k B,则当A和B的平衡压力相同时,在一定量的该溶剂中所溶解的关系为( ) (A) A 的量大于 B 的量;(B) A 的量小于 B 的量;(C) A 的量等于 B 的量;(D) A 的量与 B 的量无法比较。
2. 在恒温抽空的玻璃罩中封入二杯液面相同的糖水 (A) 和纯水 (B)。
经历若干时间后,二杯液面的高度将是:( )(A) A 杯高于 B 杯; (B) A 杯等于 B 杯; (C) A 杯低于 B 杯;(D) 视温度而定。
3. 在温度T时,纯液体A的饱和蒸气压为P A*,化学势为μA*,并且已知在P⊖压力下的凝固点为T f*,当A 中溶入少量与A不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为P、μA、T f则( ) (A) P < P,μA*<μA ,T f*< T f(B) P A*> P A ,μA*<μA ,T f*< T f(C) P < P,μA*<μA ,T f*> T f(D) P A*> P A ,μA*>μA , T f*> T f4.已知在 373K 时液体A 的饱和蒸气压为66662Pa,液体B的饱和蒸气压为1.01325×105 Pa,设 A 和 B 构成理想液体混合物,则当A在溶液中的物质的量分数为0.5 时,气相 A 的物质的量分数应为:( )(A) 0.200 (B) 0.300 (C) 0.397 (D) 0.6035. 对于理想液体混合物,下列偏微商小于零的是:(A) [∂(△mix F m)/ ∂T]p(B) [∂(△mix S m)/ ∂T]p(C) [∂ (△mix G m)/T]/ ∂T]p(D) [∂ (△mix G m)/ ∂P]T6. 假设A、B 二组分混合可以形成理想液体混合物,则下列叙述中不正确的是:( )(A)A、B 分子之间的作用力很微弱;(B) A、B 都遵守拉乌尔定律;(C) 液体混合物的蒸气压介于A、B 的蒸气压之间;(D) 可以用重复蒸馏的方法使A、B 完全分离。
第四章 多组分系统热力学练习题及答案1

第四章多组分系统热力学练习1 题及答案.第四章多组分系统热力学练习1题及答案.第四章多组分系统热力学练习题及答案1.20 C下HCl溶于苯中达平衡,气相中HCl的分压为101.325 kPa时,溶液中HCl的摩尔分数为0.0425。
已知20 ?C时苯的饱和蒸气压为10.0 kPa,若20?C 时HCl和苯蒸气总压为101.325 kPa,求100 g笨中溶解多少克HCl。
解:设HCl在苯中的溶解符合Henry定律2.60 ?C时甲醇的饱和蒸气压是84.4 kPa,乙醇的饱和蒸气压是47.0 kPa。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50 %,求60 ?C 时此混合物的平衡蒸气组成,以摩尔分数表示。
解:质量分数与摩尔分数的关系为求得甲醇的摩尔分数为根据Raoult定律3.80 ?C是纯苯的蒸气压为100 kPa,纯甲苯的蒸气压为38.7 kPa。
两液体可形成理想液态混合物。
若有苯-甲苯的气-液平衡混合物,80 ?C时气相中苯的摩尔分数,求液相的组成。
解:根据Raoult定律t时纯AB,两液体能形成理想液态混合物。
已知在温度的饱和蒸气压A4.。
的饱和蒸气压B,纯t下,于气缸中将组成为的A, B(1)在温度混合气体恒温缓慢压缩,求凝结出第一滴微小液滴时系统的总压及该液滴的组成(以摩尔分数表示)为多少?t下开始沸腾,,温度两液体混合,并使此混合物在100 kPa2)若将A, B(求该液态混合物的组成及沸腾时饱和蒸气的组成(摩尔分数)。
解:1. 由于形成理想液态混合物,每个组分均符合Raoult定律; 2. 凝结出第t一滴微小液滴时气相组成不变。
因此在温度t 100 kPa,温度下开始沸腾,要求混合物在5. 已知101.325kPa下,纯苯(A)的正常沸点和摩尔蒸发焓分别为353.3K和?1,纯甲苯(B)的正常沸点和摩尔30762J·mol蒸发焓分别为383.7K和?1。
第四章、多组分系统热力学

第四章,多组分系统热力学一、选择题1. 在 298K 时,A 和 B 两种气体单独在某一溶剂中溶解,遵守亨利定律,亨利常数分别为 kA 和 KB,且知 KA>KB,则当 A 和 B 压力(平衡时的)相同时,在一定量的该溶剂中所溶解的关系为 ( ) B (A) A 的量大于 B 的量 (B) A 的量小于 B 的量(C) A 的量等于 B 的量 (D) A 的量与 B 的量无法比较2. 在 400K 时,液体 A 的蒸气压为 4×104Pa,液体 B 的蒸气压为 6×104Pa,两者组成理想液体混合物,平衡时,溶液中 A 的物质的量分数为 0.6,则气相中 B 的物质的量分数为: ( ) B(A) 0.60 (B) 0.50 (C) 0.40 (D) 0.313. 已知挥发性纯溶质 A 液体的蒸气压为 67 Pa,纯溶剂 B 的蒸气压为 26665Pa,该溶质在此溶剂的饱和溶液的物质的量分数为 0.02,则此饱和溶液(假设为理想液体混合物)的蒸气压为:( ) C(A) 600 Pa (B) 26198 Pa (C) 26133 Pa (D) 599 Pa4. 已知 373.2K 时,液体 A 的饱和蒸气压为 133.32 kPa,另一液体 B 可与 A构成理想液体混合物。
当 A 在溶液中的物质的量分数为 0.5 时,A 在气相中的物质量分数为 2/3 时,则在 373.2K时,液体 B 的饱和蒸气压应为: ( ) A(A) 66.66 kPa (B) 88.88 kPa (C) 133.32 kPa (D) 266.64 kPa5. 已知 373K 时液体 A 的饱和蒸气压为 133.24kPa,液体 B 的饱和蒸气压为66.62kPa。
设 A 和 B形成理想溶液,当 A 在溶液中的摩尔分数为 0.5 时,在气相中 A 的摩尔分数为: ( ) D(A) 1 (B) 1/2 (C) 1/3 (D) 2/36. 关于亨利系数,下列说法中正确的是: ( ) D(A) 其值与温度、浓度和压力有关(B) 其值与温度、溶剂性质和浓度有关(C) 其值与温度、溶质性质和浓度有关(D) 其值与温度、溶质和溶剂性质及浓度的标度有关7. 已知 373K 时,液体 A 的饱和蒸气压为 5×104 Pa,液体 B 的饱和蒸气压为 105Pa,A 和 B构成理想液体混合物,当 A 在溶液中的物质的量分数为 0.5时,气相中 B 的物质的量分数为:( ) A(A) 1/1.5 (B) 1/2 (C) 1/2.5 (D) 1/38.2molA物质和3molB物质在等温、等压下,混合形成理想液态混合物,该系统中A和B的偏摩尔体积分别为1.79×10-5m3×mol-1,2.15×10-5m3×mol-1,则混合物的总体积为:() C(A)9.67×10-5m3 (B)9.85×10-5m3(C)1.003×10-4m3 (D)8.95×10-5m39.298K,标准压力下,苯和甲苯形成理想液态混合物。
第四章--多组分系统热力学习题

第四章多组分系统热力学选择题1. 在和101325Pa•下水的化学势与水蒸气化学位的关系为(A) μ(水)=μ(汽) (B) μ(水)<μ(汽)(C) μ(水)>μ(汽) (D) 无法确定答案:A。
两相平衡,化学势相等。
2.下列哪种现象不属于稀溶液的依数性(A) 凝固点降低(B)沸点升高(C) 渗透压(D)蒸气压升高^答案:D。
稀溶液的依数性之一为蒸气压下降。
3.98K时,A、B两种气体在水中的亨利常数分别为k1和k2,且k1>k2,则当P1=P2时,A、B在水中的溶解量C1 和C2 的关系为(A) C1>C2 (B) C1<C2 (C) C1=C2 (D) 不能确定答案:B4.将非挥发性溶质溶于溶剂中形成稀溶液时,将引起(A) 沸点升高(B) 熔点升高(C) 蒸气压升高(D) 都不对答案:A。
稀溶液的依数性包括沸点升高、凝固点下降、蒸气压下降和渗透压。
5. 涉及纯物质标准状态的下列说法中不正确的是(A) 纯理想气体的标准状态就是标准压力P(100KPa)下的状态(B) 纯液体物质的标准状态就是标准压力P(100KPa)下的纯液体—(C) 纯固体物质的标准状态就是标准压力P(100KPa)下的纯固体(D) 不同的物质在相同温度下都处于标准状态时,它们的同一热力学函数值都应相同答案:D6. 稀溶液的依数性包括蒸汽压下降、沸点升高、凝固点降低和渗透压,下面的陈述都与它们有关,其中正确的是(A) 只有溶质不挥发的稀溶液才有这些依数性(B) 所有依数性都与溶液中溶质的浓度成正比(C) 所有依数性都与溶剂的性质无关(D) 所有依数性都与溶质的性质有关答案:B7. 关于亨利系数, 下面的说法中正确的是!(A) 其值与温度、浓度和压力有关(B) 其值只与温度、溶质性质和浓度标度有关(C) 其值与溶剂性质、温度和浓度大小有关(D) 其值与温度、溶剂和溶质的性质及浓度标度等因素都有关答案:D8. 定义偏摩尔量时规定的条件是(A) 等温等压 (B) 等熵等压(C) 等温, 溶液浓度不变 (D) 等温等压, 溶液浓度不变答案:D9. 关于偏摩尔量, 下面的说法中正确的是~(A) 偏摩尔量的绝对值都可求算(B) 系统的容量性质才有偏摩尔量(C) 同一系统的各个偏摩尔量之间彼此无关(D) 没有热力学过程就没有偏摩尔量答案:B10. 关于偏摩尔量, 下面的叙述中不正确的是(A) 偏摩尔量是状态函数, 其值与物质的数量无关(B) 系统的强度性质无偏摩尔量(C) 纯物质的偏摩尔量等于它的摩尔量(D) 偏摩尔量的数值只能为整数或零-答案:D11. 影响沸点升高常数和凝固点降低常数值的主要因素是(A) 溶剂本性 (B) 温度和压力 (C )溶质本性(D) 温度和溶剂本性答案:A 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pA p xA
pB k x,B xB
返回
2012-5-27
每
周
一
题
(1)
【证明】对于恒温恒压下的二组分(A + B)溶液
x A du
A
x B du B 0
因为: u B u B R T ln p B / p
du B R T d ln p B
上一内容 下一内容 回主目录 返回
2012-5-27
每
周
一
题
并分析冻梨为什么不用热水浸泡?
答:如果把冻梨放在热水中,等于加强热,这 时,冻梨的皮内就出现大量的气泡。这些气泡
起到了“包暖内衣”的作用,使外部的热量不
能很快的传到内部,冻梨化的也就慢了。并且 加强热使水和冻梨的表面发生一些物理及化学 变化,使原来的物质改变了,冻梨也就变的不 好吃了。
2012-5-27
每
周
一
题
【证明】由多组分单相系统的热力学公式
dG SdT Vdp
B
B
dn B
在等温等压且除组分B之外的其他组分不变 条件下,则:
dG T , p B dn B
移项整理得:
B GB
上一内容 下一内容
G n B
T , p ,nC
* m
p1 p2
V m ( H 2 O , g ) dp
*
*
V
p1 p2
( H 2 O , g ) V m ( H 2 O , l ) dp
p 2 p1 , G 0 , u 4 u 3
上一内容 下一内容 回主目录 返回
2012-5-27
4.2 化学势
解: (1)u1 和u3 的比较
2012-5-27
每
周
一
题
【证明】试由组成可变的均相系统的热力学基本
方程导出化学势的表达式:
B GB
G n B T , p ,nC
【分析】重点理解组成可变的均相系统(多组分 单相系统)的热力学基本方程的表达式 与化学势之间的关系。
上一内容 下一内容 回主目录 返回
得:
xA 1/ 2
2.【解】令A的总组成XA
n g 5 mol ; n l 5 mol
XA n g y A n l x A n g n l yA xA 2 7 12
上一内容
下一内容
回主目录
返回
2012-5-27
每
G H2O( l) (100℃,202.65Kpa)
H2O(l) (100℃,202.65Kpa)
G1 u 3 u1
p2 p1
V ( H 2 O , l ) dp 0
* m
u 3 u1
综合以上讨论:u4 > u3 > u2 = u1
上一内容 下一内容 回主目录 返回
上一内容 下一内容 回主目录 返回
2012-5-27
每
周
一
题
【问题4】自然界中, 有的高大树木可以 长到100m以上(例如 美国的红杉树高达 114m),其能够从地 表供给树冠养料和 水分的主要动力是 什么?
美国红杉树(文化遗产)
上一内容 下一内容 回主目录 返回
2012-5-27
物理化学电子教案—第四章
古巴海岸
上一内容 下一内容 回主目录 返回
2012-5-27
4.2 化学势
例如:比较下列不同状态的水的化学势的大小: (1)100℃,101.325KPa,H2O(l) (2)100℃,101.325KPa,H2O(g) (3)100℃,202.65KPa,H2O(l) (4)100℃,202.65KPa,H2O(g)
上一内容 下一内容 回主目录 返回
2012-5-27
每
周
一
题
【问题2】农田中施肥太浓时植物会被烧死。盐碱 地的农作物长势不良,甚至枯萎,试解释原因? 答:这是由于水份在庄稼体内和土壤中化学势不 等,发生渗透造成的。当土壤中肥料或盐类的浓 度大于在植物中的浓度时,在植物中水的化学势 高,就要通过细胞壁向土壤中渗透,植物就会枯 萎,甚至烧死。
上一内容 下一内容 回主目录 返回
2012-5-27
谢谢!
上一内容
下一内容
回主目录
返回
2012-5-27
周
一
题
【问题1】北方人冬天吃冻梨前,将冻梨放入凉 水中浸泡,过一段时间后冻梨内部解冻了,但 表面结了一层薄冰。试解释原因?并分析为什 么不用热水浸泡?
答:凉水温度比冻梨温度高,使冻梨解冻。冻梨 含有糖分和果酸,故其凝固点低于水的冰点,当 冻梨内部解冻时,要吸收热量,而解冻后的温度 仍略低于水的冰点,所以冻梨内部解冻了而表面 上仍凝结一层薄冰。
u1 u2 u3 u4
上一内容
下一内容
回主目录
返回
2012-5-27
4.2 化学势
解: (1)u1 和u2 的比较
G1 H2O( l) H2O(g) (100℃,101.325Kpa) (100℃,101.325Kpa)
过程为可逆相变过程,所以:
G1 u 2 u1 0 , u1 u 2
同理: du A R T d ln p A 将(2)和(3)代入(1)得
(2) (3)
x A d ln p A x B d ln p B 0
上一内容 下一内容 回主目录 返回
2012-5-27
每
整理得:
周
一
题
(4) (5)
x A d ln p A x B d ln p B
【要点】这是凝固点降低现象,即一定外压下,溶 液的凝固点低于纯溶剂在同样外压下的凝固点.
上一内容 下一内容 回主目录 返回
2012-5-27
每
周
一
题
答:乙年龄最大,丙次之;甲最小。因为溶液 的凝固点是指在一定压力下,溶液相与纯溶剂 相互达到平衡时的温度值。对于封闭体系的溶 液,当有溶剂固相析出时,溶液的浓度会增加, 此时凝固点将进一步下降。所以当一支冰棍凝 结为固体时,含糖量最高的部分凝固点最低。 反之,当其融化时,含糖量最高的部分先融化。 所以先抿此融化者感觉最甜,最后抿者吃到的 已经全部是水了。
上一内容 下一内容 回主目录 返回
2012-5-27
每
周
A
一
题
B
1.【解】由理想液态混合物的性质
p A p x A , pB p xB
p pA pB pB pA pB xA
pA p yA p p p
p xA p p p
A
B
A
B
x y
A
A A
A
B
A
B
x y
A
yA
上一内容 下一内容
p
B
p p
p xA
A A
B
x
2012-5-27
回主目录
返回
每
周
一
5
题
4
y A 2 / 3; p A 1 . 2 10 pa ; p B 6 10 pa
上一内容
下一内容
回主目录
返回
2012-5-27
每
周
一
题
【问题3】甲乙丙三个小孩共吃一支将要融化的冰 棍。三人约定(1)各吃质量的三分之一 ;(2) 只准抿,不准咬;(3)按年龄从小到大的顺序 排先后。结果乙认为这支冰棍中没有糖;甲认 为这支冰棍非常甜;丙觉得他们两人的说法太 绝对化。问此三人中谁的年龄最大?谁次之?
每
周
一
题
答:由生物学的知识,能够从地表供给树冠养料和 水分的动力有 (一)、因外界大气压引起的树干内导管的空吸作 用,但是因为这种原因能够吸起的水柱最大高度为 10.3m: (二)、树干中微导管的毛细作用,则能吸起的水 柱最大高度为30m; (三)、树内体液含盐浓度大,渗透压高。也正是 渗透压使得吸起的水柱达到100m,树木可以长到 100m。
回主目录 返回
2012-5-27
每
周
一
题
由于溶质符合亨利定律,即
pB k x,B xB
ln p B ln k x , B ln x B
ln p B ln x 1 B T
ln p A ln p B ln p A 因为 ln x ln x ln x 1 A T B T A T
上一内容
下一内容
回主目录
返回
2012-5-27
4.2 化学势
解: (2)u3 和u4 的比较
G u 4 u 3 G1 G 2 G 3
G1 0
G u4 u3 G2 G3
p2 p1
V ( H 2 O , l ) dp
* m
上一内容
下一内容
回主目录
返回
2012-5-27
4.2 化学势
解: (1)u3 和u4 的比较
G H2O( l) (100℃,202.65Kpa)
H2O(g) (100℃,202.65Kpa)
G3
G2
G1 H2O( l) H2O(g) (100℃,101.325Kpa) (100℃,101.325Kpa)
