上海交大周丕生土壤学第7章 土壤酸碱性和氧化还原反
第七章 土壤酸碱性和氧化还原反应

第七章 土壤酸碱性和氧化还原反应
第一节 土壤的酸碱性 四、土壤的缓冲性能
1、土壤缓冲性的概念 2、土壤具有缓冲性的原因 1)土壤溶液中弱酸及其盐类的存在; 2)土壤胶体的阳离子交换作用; 3)土壤中两性物质的存在。
第七章 土壤酸碱性和氧化还原反应
第一节 土壤的酸碱性 四、土壤的缓冲性能
1、土壤缓冲性的概念 2、土壤具有缓冲性的原因 3、缓冲容量 缓冲容量:表示缓冲作用的大小。指土壤溶液改变一
2250000×20%×10-7=0.045mol H+/公顷
所以需要中和活性酸量为 4.5-0.045=4.455mol H+/公顷 若以CaO中和:其需要量124.74 克 中和潜性酸: 2250000×(10 /100)×(1- 60/100)=90000 mol H+/公顷 90000×56/2=2520000克=2520公斤/公顷
水田土壤:
排水种植旱作期间:> 500 mv
淹水期间: < 150 mv
水稻适宜生长条件: 200 - 400 mv
影响土壤氧化还原的因素 1.微生物的活动
2.易分解有机的含量
在一定的通气条件下,土壤中的易分解的有机愈 多,耗氧也愈多,其氧化还原电位就较低。
3.土壤中易氧化和还原的无机物的含量 土壤的氧化体和硝酸盐含量高时,可使Eh值下降 得较慢。
潜 性 酸 (1)交换性酸度(soil exchangeable acidity) (2)水解性酸度(soil hydrolytic acidity)
几种土壤中的交换性酸量和水解性酸量的比较
3. 活性酸和潜性酸的关系
活性酸和潜酸的总和,称为土壤总酸度。由于 它通常是用滴定法测定的,故又称之为土壤的滴定酸 度。它是土壤的酸度的容量指标。它与pH值在意义 上是不同的。
土壤酸碱反应和氧化还原反应

过度施用石灰的负面影响
土壤板结,结构变劣; 部分微量元素有效性降低;磷的有效性
也下降。 因此,施用石灰要适量。 影响石灰施用量的因素有:
土壤潜性酸和pH;盐基饱和度;质地; 有机质含量;石灰的种类和施用方法; 作物的要求等;
石灰需要量的估算
石灰需要量= 土壤体积*容重*CEC*(1-盐基饱和度) 单位:千克/公顷
不同作物对土壤酸碱性都有一定的要求, 这是植物长期的自然选择的结果。常见 植物对土壤pH的要求见下表:
植物适宜的pH范围
适应偏碱 性pH7-8
紫苜蓿
适应中到微 碱性pH6.57.5
苹果
适应中到微 适应偏酸性 适应酸性 酸性的pH6-7 的pH5.5-6.5 的pH5-6
蚕豆
水稻
小麦
金花菜 黄花苜蓿 碗豆
包权
人书友圈7.三端同步
土壤酸碱性的分级
强酸性 酸性 中性 碱性 强碱性
pH<5.0 pH5.0-6.5 pH6.5-7.5 pH7.5-8.5 pH>8.5
2、潜性酸
(1)概念与成因 土壤胶粒上吸附的氢离子和铝离子进
入土壤溶液后表现出来的酸度,称为潜 性酸。
在一般矿质土壤中, 由交换性铝离子产 生的酸度, 比由交换性氢离子产生的酸度 重要。红壤的交换性酸度,90%以上是 由交换性铝所引起。
档消耗一个共享文档下载特权。
年VIP
月VIP
连续包月VIP
享受100次共享文档下载特权,一次 发放,全年内有效
赠每的送次VI的发P类共放型的享决特文定权档。有下效载期特为权1自个V月IP,生发效放起数每量月由发您放购一买次,赠 V不 我I送 清 的P生每 零 设效月 。 置起1自 随5每动 时次月续 取共发费 消享放, 。文一前档次往下,我载持的特续账权有号,效-自
土壤酸碱性和氧化还原反应..PPT共49页

1
0
、
倚
南
窗
以
寄
傲
,
审
容
膝
之
易
安
。
1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、有勇气承担命运这才是英雄好汉。——黑塞 4、与肝胆人共事,无字句处读书。——周恩来 5、阅读使人充实,会谈使人敏捷,写作使人精确。——培根
土壤酸碱性和氧化还原反应..
6
、
露凝无游 Nhomakorabea氛
,
天
高
风
景
澈
。
7、翩翩新 来燕,双双入我庐 ,先巢故尚在,相 将还旧居。
8
、
吁
嗟
身
后
名
,
于
我
若
浮
烟
。
9、 陶渊 明( 约 365年 —427年 ),字 元亮, (又 一说名 潜,字 渊明 )号五 柳先生 ,私 谥“靖 节”, 东晋 末期南 朝宋初 期诗 人、文 学家、 辞赋 家、散
文 家 。汉 族 ,东 晋 浔阳 柴桑 人 (今 江西 九江 ) 。曾 做过 几 年小 官, 后辞 官 回家 ,从 此 隐居 ,田 园生 活 是陶 渊明 诗 的主 要题 材, 相 关作 品有 《饮 酒 》 、 《 归 园 田 居 》 、 《 桃花 源 记 》 、 《 五 柳先 生 传 》 、 《 归 去来 兮 辞 》 等 。
土壤学第7章
2、水解性酸度
以弱酸强碱盐溶液(常用pH8.2的 1M NaOAc)浸提土壤,再以标准 碱滴定所测得的酸度。单位 cmol/kg,是容量指标。
CH3COONa + H2O = CH3COOH + NaOH Al--胶粒--H + 4 NaOH = 胶粒--Na4 + Al(OH)3 + H2O NaOAc水解,生成 HOAc和NaOH , HOAc解离度小,多以分子态存在, NaOH解离度大,与土壤作用,生成水和Al(OH)3 沉淀,反应比较 完全,所以水解性酸度大于交换性酸度。
第七章 土壤酸碱性和氧化还原性
130
第一节 土壤酸碱性
1、土壤酸碱性或称土壤反应,表示土壤溶液中游离的H+ 和OH-浓度的相对大小,以pH表示,是土壤的一个重要 属性。 pH = -lg [H+] pH =7 时, [H+ ] = [OH-]
2、土壤酸碱性分级
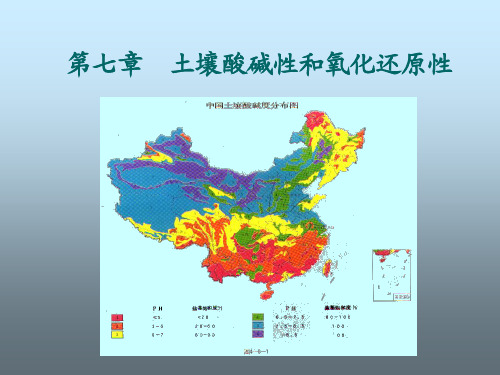
3、我国酸碱性土壤分布 我国土壤pH多在4—9范围内,极个别<3,如泛酸田,或>
碱化土:钠饱和度达5%--15%。
3 碱性土的成因
干旱气候;降水量低于蒸发量 母质; 基性、超基性岩 过量施用石灰; 引灌碱性污水; 海水浸渍。
三、土壤缓冲作用
1、定义 • 狭义:把少量的酸或碱加入到到土壤里,其pH值的变化却不
大,这种对酸碱变化的抵抗能力,叫做土壤的缓冲性能或缓冲 作用。 • 广义:土壤是一个巨大的缓冲体系,对营养元素、污染物质、 氧化还原等同样具有缓冲性,具有抗衡外界环境变化的能力。 2、土壤具有缓冲作用的原因 • 溶液中有弱酸及其盐类
①土壤pH6.5左右时,各种营养元素的有效度都较高,并适宜多数作物的生 长。
环境土壤学课程教学大纲-上海交通大学

《环境土壤学》教学大纲一、课程基本信息课程代码:EV362 课程名称:环境土壤学英文名称:Environmental Soil Science 课程类别:专业选修课学时:32 学分:3.0适用对象:环境科学、环境工程、生态学、地理科学、农业工程等专业本科生考核方式:闭卷考试,平时成绩占总成绩的30%前修课程:无机化学、有机化学、环境化学原理、环境学概论等二、课程简介环境土壤学是一门新兴的土壤学与环境科学交叉融合的综合性学科。
是在近代土壤污染状况日益严重,日益引起世界各国人民关注的情况下应运而生的一门基础理论课程。
该课程主要关注自然因素和人为条件下土壤环境质量恶化的机制、土壤中重要的元素,包括生命必需元素和生命毒性物质的生物、化学性质及其土壤环境行为。
课程内容涉及:土壤质量与生物品质、土壤与水和大气质量的关系;土壤环境质量变化对人体健康、社会经济、生态系统结构和功能的影响;探索调节、恢复和控制土壤环境质量的途径和方法。
通过本课程的学习,使学生正确理解土壤在环境中的作用与地位,掌握土壤基本组成、性质与分类,了解土壤的形成、发展、退化和恢复的过程及机制,熟悉不同类型污染物对土壤生态系统造成的危害,掌握土壤环境质量调控和改善的基本途径和方法。
为培养环境、农业方面的工程人才和科研人才打下坚实的基础。
三、课程性质与要求土壤是环境中的一项基本要素,且土壤决定了环境污染物的归趋,是许多重要元素的源和汇,与大气、水体等介质有着持续不断的物质、能量交换,是重要的环境介质。
对于环境专业学生来说,了解土壤在环境学中的地位与作用,了解土壤中污染物的行为十分重要。
本课程为面向环境科学与工程专业本科三年级的专业基础课程,与2017年最新开设的工程类课程《土壤与地下水污染修复技术》形成姊妹篇,其目的是使学生掌握土壤这种重要的环境介质与污染物之间的关系,为培养专业的治污人才提供足够的科学理论知识储备。
本课程知识点繁多、信息量大,学科交叉融合性极强。
土壤酸碱性和氧化还原反应..

土壤胶粒-Na+CaSO4===土壤胶粒-Ca+NaSO4
(淋洗排出)
3、对碱化土、碱土,可施用石膏、硅酸钙, 以钙将土壤胶体上的钠代换下来,并随水排出, 从而降低土壤的PH,改善土壤理化性状。
桑 6.0-8.0 桦 5.0-6.0 泡桐 6.0-8.0 油桐 6.0-8.0 榆 6.0-8.0 侧柏 6.0-7.5 柽柳 6.0-8.0
四、土壤酸碱性的调节
(一)土壤酸性的调节
土壤酸性主要由胶体吸附的交换性H+和Al3+所控 制,在改良土壤酸性时,不仅要中和活性酸,更重 要的是中和潜在酸,才能从根本上改变酸性的大小。
• 碱化度>30%,含盐量<0.5%和pH >9.0定为碱土
• 碱化度5—10%轻度碱化
•
10—15%中度碱化
•
15—20%强碱化土壤
三、影响土壤碱化的因素
1、气候
碱土都分布在干旱、半干旱和漠境区由 于蒸降比一般为5—10,甚至20以上,明显 的季节性积盐和脱盐频繁交替的特点,是 土壤碱化的重要条件。
十4H20 当溶液中OH-离子增多时,铝离子周围的水分子 中就有一、两个水分子解离出H+,以中和加入的OH离子,生成水。
pH>5时,铝离子形成A1(OH)3沉淀,失去它的 缓冲能力。
三、影响缓冲作用的因素
• 1、土壤无机胶体蒙脱伊利>高岭>含水氧
•
化硅
• 2、土壤质地黏土>壤土 >砂土
• 3、土壤有机质含量高缓冲作用大
CH3COONa+H2O==CH3cooH+NaOH
土壤酸碱反应和氧化还原反应ppt课件

土壤酸碱性的分级
强酸性 酸性 中性 碱性 强碱性
pH<5.0 pH5.0-6.5 pH6.5-7.5 pH7.5-8.5 pH>8.5
2、潜性酸
(1)概念与成因 土壤胶粒上吸附的氢离子和铝离子进
入土壤溶液后表现出来的酸度,称为潜 性酸。
在一般矿质土壤中, 由交换性铝离子产 生的酸度, 比由交换性氢离子产生的酸度 重要。红壤的交换性酸度,90%以上是 由交换性铝所引起。
一些耐盐、耐碱的植物会选择性地富集 盐基离子,其残体分解后会促进土壤碱 性的发展。
4、地形
不同地形部位的盐基淋失和富集状况不 同,土壤pH也有差异。
地形高处的土壤的盐基淋失较强烈,pH 可能较低;
低洼处的土壤多接受盐基的淀积,所以 pH可能较高;
内陆一些闭流区域或集水洼地,由于大 量富集径流水带来的Ca,Mg,K,Na的 重碳酸盐类,pH可能较高。
(2)测定方法
---代换性酸度:用过量的中性盐(如KCl) 溶液与土壤作用,将胶体上吸附的氢离 子和铝离子代换出来。
H+ me/100g, Cmol(+)/kg
---水解性酸度
用弱酸强碱盐(通常用pH8.2的醋酸钠)浸 提的土壤溶液的酸度。
4CH3COONa + 3H2O + H-(S) Al
Na
过度施用石灰的负面影响
土壤板结,结构变劣; 部分微量元素有效性降低;磷的有效性
也下降。 因此,施用石灰要适量。 影响石灰施用量的因素有:
土壤潜性酸和pH;盐基饱和度;质地; 有机质含量;石灰的种类和施用方法; 作物的要求等;
石灰需要量的估算
石灰需要量= 土壤体积*容重*CEC*(1-盐基饱和度) 单位:千克/公顷
第七章 土壤酸碱性及缓冲性能(1学时)

(四)影响作物生长
1. 不同的栽培作物适应不同的PH范围。 2. 有些对酸碱度要求比较严格,如茶树只能生长于 酸性土,而甜菜和紫花苜蓿喜钙而只能生长在中 性至微碱性土壤上。 3. 一般作物对土壤酸碱性的适应范围都较严,如马 铃薯在PH4-8的范围内可以生长,但以PH5左右生 长最好(表6-3),对大多数作物来说,喜欢近中性 的土壤,以PH6.0-7.5为宜。
我国土壤的酸碱性反应,大多数在pH4.5~8.5之间。在地 理分布上有“东南酸西北碱”的规律性。大致可以长江为界 (北纬33),长江以南的土壤为酸性或强酸性,长江以北的 土壤多为中性或碱性。
2、潜性酸度(potential acidity)
潜性酸度是指土壤胶体上吸附的H+、Al3+ 所引起的酸度。
• 土壤胶体上吸附的H+、Al3+所引起的酸度 只有在转移到土壤溶液中,形成溶液中的 H+时,才会显示酸性,故称为潜性酸。 • 土壤潜性酸要比活性酸多得多,相差3-4 个数量级。土壤中潜性酸的大小常用土壤 交换性酸度和水解性酸度表示之。
(1)交换性酸度(exchangeable acidity)
•
土壤细菌和放线菌,如硝化细菌、固氮菌和 纤维分解菌等,均适于中性和微碱性环境,pH< 5.5 的强酸性土壤中,其活性明显下降。 真菌可在所有pH范围内活动,在强酸性土 壤中以真菌占优势。
2、对养分有效性的影响
① 土壤pH6.5时,各种养分的有效性都较高。 ② 在微酸至碱性土壤中,氮、硫、钾的有效性高。 ③ pH6~7土壤中,磷的有效性最高。pH<5时,土壤活性 铁、铝增加,易形成磷酸铁、铝沉淀。pH>7时,易 形成磷酸钙沉淀。 ④ pH6.5~8.5土壤中,有效钙、镁含量高,强酸和强碱性 土中,其含量低。 ⑤ Fe、Mn、Cu、Zn有效性在酸性土中高在pH>7土壤中 明显降低,常出现Fe、Mn供给不足。 ⑥ Mo在酸性土中有效性低,当pH>6时,其有效性增加。 ⑦ B在强酸性土和石灰性土中有效性较低,在pH6~7和 pH>8.5的碱性土中有效性较高,表现较复杂的情况。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
50%
交换性 H+
键连 H 25%
交换性 Al3+ Al(OH)x离子
0% 3 3.5 4 4.5 5 5.5 6 6.5 7 7.5 8
土壤pH
2015年10月31日星期六8时58分18秒 土壤pH与土壤交换性阳离子的关系 专业基础课程
农业与生物学院专业基础课程
活性酸
潜性酸
2015年10月31日星期六8时58分18秒
土壤碱度的指标
1.总碱度 土壤溶液中碳酸根和重碳酸根的总量: 总碱度=CO32- +HCO3- [cmol(+) ·L-1 ]
2.碱化度 (ESP) 土壤胶体吸附的交换性钠占阳离子交换量 的百分率。 碱化度 (%)=交换性钠 /CEC × 100
专业基础课程
2015年10月31日星期六8时58分18秒
(x+3y)K+ + (x+3y)K+ =
土壤 胶粒
+ xH+ + yAl3+
yAl3+
潜性酸
专业基础课程
活性酸
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
土壤碱性的形成
土壤中的碱性物质主要是 Ca 、Mg、Na 的碳酸盐和重碳酸盐以及交换性 Na ,它们通 过水解反应产生OH - 。 1.碳酸钙水解 CaCO3-CO2-H2O 的体系, CaCO3 水解 产生OH - 。 CaCO3 + H2O Ca2+ +HCO3- +OHCO2 + H2O HCO3- + H+ 所以石灰性土壤的 pH 主要受土壤空气 中二氧化碳分压控制。
K H+
土壤 胶粒
K+ +
专业基础课程
OHHOH KCl Cl2015年10月31日星期六8时58分18秒
农业与生物学院专业基础课程
下午8时58分
土壤与植物营养学
Soil Science and Plant Nutrition
丘陵 10% 盆地 19% 山地 33%
主讲:周丕生
高原 26% 平原 12%
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
第七章 土壤酸碱性和氧化还 原反
土壤溶液 中的 H+ 反 映出来的 酸度,能 参与土壤 中的各种 化学反应
盆地 19%
丘陵 10%
高原 26%
吸附在土壤 胶粒表面的 交换性 H+ 离 主讲:周丕生 子和 Al3+ 离子
山地 33% 平原 12%
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
活性酸和潜性酸的关系
xH+
土壤 胶粒
3+ + Al Na
Al(OH)3
Na+ + 4 HAc
ZD
水解性酸度
专业基础课程
2015年10月31日星期六8时58分18秒
中国土壤 pH 图 土壤与植物营养学 / 第一章 土壤酸碱性和氧化还原反应
专业基础课程
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
专业基础课程
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
土壤碱性的形成
2.碳酸钠的水解 碳酸钠、重碳酸钠 ( 俗称苏 打、小苏打) 水解产生强碱性。 Na2CO3 + 2 H2O 2 Na+ + 2 OH- + H2CO3 3.交换性钠的水解
专业基础课程
ZD
Al(OH)3 + 3 H+
交换性酸度
专业基础课程
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
K+
土壤 胶粒
H+ + 4 KCl Al3+
K+ K+
K+
土壤 胶粒
K+ K+
+
Al3+
H+ 4Cl-
K+
K+
Al3+ + 3 H2O
Al(OH)3 + 3 H+
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
土壤酸碱性的指标
土壤酸度的指标
土壤 pH :土壤溶液中 H+ 离子浓度的负 对数。 pH= - log [H+]
pHKCl(1 mol ·L-1 KCl pHH2O (水提 取所得的 pH ) 提取土壤所得的 pH
土壤酸性的形成和类型
5 .酸雨 pH<5.6 的酸性大气化学物质。 6 .吸附性 H+, Al3 +的作用
专业基础课程
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
土壤酸性的形成和类型
7.土壤中铝的活化
当交换氢达到一定限度时,胶体的结 构破坏,晶格中的铝离子成为活性离子, 水解产生氢离子。 Al3+ + H2O → Al( OH)2+ + H+ Al( OH)2+ + H2O → Al(OH)2+ + H+ Al(OH)2+ + H2O → Al(OH)3 + H+ 水解离子的形态则取决与土壤 pH 。
专业基础课程
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
CaCO3 和 MgCO3 的溶解度低,在正常 的CO2偏压下,最高 pH 只能达 pH8.5。 CaCO3+ H2O Ca2+ + HCO3- + OHCO2 + H2O HCO3- + H+ pH=6.03 - 2/3 logpCO2 pCO2 是CO2的分压,在大气CO2浓度 (0.03%) 下,土壤的 pH 为 8.57 CO2 浓度愈 高, pH 愈低。一般 pH 在 6.5~8.5 之间。 这种由石灰性物质引起的弱碱性反应叫 石灰反应,这种土壤叫石灰性土壤。
专业基础课程
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
K+
土壤 胶粒
H+ + 4 KCl
K+
Al3+
土壤 土壤 + H+ + 胶粒 Al K3+ K+ 胶粒 K+ K+ Al3+ 4Cl-
+ K + K
K+
++ HK H
Al3+
Al3+ + 3 H2O
3+ + Al Na
Al(OH)3
Na+ + 4 HAc
ZD
水解性酸度
专业基础课程
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
CH3COONa + H2O CH3COOH + NaOH
H+ 土壤 土壤 胶粒 胶粒 Al3+ + 4AcNa Na+ H+ 土壤 土壤 胶粒 胶粒 Al3+ Na+
)
专业基础课程
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
土壤酸碱性的指标
土壤酸度的指标
土壤交换性酸度和水解性酸度 测定土壤潜性酸时,由于提取剂的不同, 可分为交换性酸和水解性酸度,它们是土 壤酸度的数量指标。
– 交换性酸度:用中性盐提取的酸度。常用1 mol ·L-1 KCl 提取。 – 水解性酸度:用弱酸强碱盐提取的酸度。常 用 pH8.2 NaAc 溶液提取。
土壤胶体的缓冲作用
H+
K+
土壤 胶粒
K+ +
NaOH HCl
H+ Na+ H+
土壤 胶粒
K+ +
专业基础课程
HOH
KCl
2015年10月31日星期六8时58分18秒
H+
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
土壤胶体的缓冲作用
H+
K+
土壤 胶粒
K+ +
NaOH
HCl
H+
+ Na H+
土壤缓冲性的机制
土壤溶液的缓冲作用
弱酸及弱酸盐、弱碱及弱碱盐共存时都具 有缓冲作用。
石灰性土壤主要是CaCO3-H2O-CO2 体系 CaCO3 + H2O =Ca2+ + 2 HCO3pH=6.03 - 2/3 logpCO2 大气中浓度约 0.03% ,所以石灰性土壤 pH 稳定在 8.5 左右。
专业基础课程
2015年10月31日星期六8时58分18秒
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
土壤胶体的缓冲作用
H+
K+
土壤 胶粒
K+ +
NaOH
HCl
H+
+ Na H+
K H+
土壤 胶粒
K+ +
专业基础课程
Hale Waihona Puke OHHOH KCl Cl2015年10月31日星期六8时58分18秒
H+
土壤与植物营养学/ 第一章 土壤酸碱性和氧化还原反应
