有机化学之胺类化合物教学案例
高中化学竞赛《有机化学-胺》教案

第二节 胺一、分类和命名法定义:氨分子中的氢原子被氨基取代后所得到的化合物。
分类:根据氨分子中的一个、二个和三个氢原子被烃基取代分成伯胺(10胺)、仲胺(20胺)和叔胺(30胺)。
相当于氢氧化铵NH 4OH 和卤化铵NH 4X 的四个氢全被烃基取代所成的化合物叫做季铵碱和季铵盐。
NH 3 → R-NH 2 伯胺→ R 2NH 仲胺→ R 3N 叔胺NH 4OH → R 4NOH 季铵碱NH 4X → R 4NX 季铵盐根据氨基所连的烃基不同可分为脂肪胺(R-NH 2)和芳香胺(Ar-NH 2)。
根据氨基的数目又可分成一元胺和多元胺。
应当注意的是:1、伯、仲、叔胺与伯、仲、叔醇的分级依据不同。
胺的分级着眼于氮原子上烃基的数目;醇的分级立足于羟基所连的碳原子的级别。
例如叔丁醇是叔醇而叔丁胺属于伯胺。
叔丁醇 (30醇) 叔丁胺(10胺)2、要掌握氨、胺和铵的用法。
氨是NH 3。
氨分子从形式上去掉一个氢原子,剩余部分叫做氨基-NH 2,(去掉二个氢原子叫亚氨基=NH)。
氨分子中氢原子被烃基取代生成有机化合物的胺。
季铵类的名称用铵,表示它与NH 4的关系。
命名:对于简单的胺,命名时在“胺”字之前加上烃基的名称即可。
仲胺和叔胺中,当烃基相同时,在烃基名称之前加词头“二”或“三”。
例如:CH 3NH 2 甲胺 (CH 3)2NH 二甲胺 (CH 3)3N 三甲胺 C 6H 5NH 2 苯胺 (C 6H 5)2NH 二苯胺 (C 6H 5)3N 三苯胺而仲胺或叔胺分子中烃基不同时,命名时选最复杂的烃基作为母体伯胺,小烃基作为取代 基,并在前面冠以“N”,突出它是连在氮原子上。
例如:CH 3CH 2CH 2N (CH 3)CH 2CH 3 N-甲基-N-乙基丙胺(或甲乙丙胺)C 6H 5CH (CH 3)NHCH 3 N-甲基-1-苯基乙胺C 6H 5N (CH 3)2 N ,N-二甲基苯胺季铵盐和季铵碱,如4个烃基相同时,其命名与卤化铵和氢氧化铵的命名相似,称为卤化四某铵和氢氧化四某铵;若烃基不同时,烃基名称由小到大依次排列。
有机化学课件-16胺

NH2 (CH3CO)2O
NHCOCH3 HNO3
H2SO4
NHCOCH3 △ (1)H3O+ (2)OH-
NH2
NO2
NO2
五、磺酰化:
即磺酰氯的胺解,常用的磺酰氯是对甲苯磺酰氯(TSCl),又 称为Hinsberg(兴斯堡)试剂;
RNH2
通式为: R2NH
R3N
O p-CH3C6H4-S Cl
O CH3 C
Cl
CH3CONHR CH3CONR2
HCl-H2O
R3N
R3N
CH3CONHR 油相 CH3CONR2 水相 (R3NH+Cl-)
油相
NaOH
△
油相
RNH2
H2O
R2NH
水相 NaOH 油相 (R3N)
H2O
(2)保护氨基避免副反应,对于芳香胺,可使亲电反应活性降低, 避免多取代;
例:
NH2
2-甲基-4-氨基戊烷
CH3CH2CHCH3
N(CH2CH3)2
2-二乙氨基丁烷
(三)季铵盐及季铵碱: 类似无机物NH4X或NH4OH的命名
(CH3)4N+Cl- C6H5CH2N+(C2H5)3Cl- (CH3)2N+(C2H5)2OH-
氯化四甲基铵 氯化三乙基苄基铵 氢氧化二甲基二乙基铵
注意:氨、胺及铵在命名时用法不同;
R'' R NH+X-
R NH + HX R' R''
R N + HX
R'
R'
R'
R'' R N + R'''X
大学化学《有机化学-胺》课件

E1cb
(单分子共 轭碱消除)
H CC
L
B: - HB
CC L
LC=C
碳负离子很不稳定。 按这种机制进行的 情况很少。
-OH
H1
H2
CH3CH2-C3H-C2H-C1 H2 +N(CH3)3
四 级 铵 碱 的 E2 消 除(符合霍夫曼规则,动 力学控制的产物。 )
B:
H1
H2
CH3CH2-C3H-C2H-C1 H2
碱
CH3CH2CH2CH2CH=CH2 Hofmann烯烃
L的变化规律 L
I
吸 电 子 能 力 增 强
离 去 能 力 减 弱
Br Cl F
Hofmann烯烃的含量
CH3O-/CH3OH
t-BuO-/t-BuOH
19.3
69.0
27.6
80.0
33.3
87.6
69.9
97.4
+NMe3
96.2
98
L吸电子能力增强,试剂的碱性增强,试剂的体积 增大时, Hofmann烯烃的含量也增大。
铵 (+)酸(-)胺 盐 (-) 酸(-)胺
HCl HCl
有机酸(+) 有机酸(-)
非对映体利用溶解度 等物理性质上的差别 予以分离。
17.4.3 四级铵盐及其相转移催化作用
1 四级铵盐
(1)四级铵盐的制备:由三级胺和卤代烃反应制备。
C6H5CH2Cl + (C2H5)3N
C6H5CH2N+(C2H5)3Cl四级铵盐
10.5 % ~7 %
霍夫曼产物
eg 5.
H3C
+ N(CH3)3
本科五年制 基础 有机化学第12章 胺
N
N
N
N
OH
ONa
无偶联 能力
② 酚或胺:
OH
OH -
偶联慢
NH 2
H+
O-
偶联快
NH 3+
H+ OH-
能偶联
不能偶联
偶联的条件为:低温、弱酸或弱碱。
思考题
重氮盐稳定存在的条件是什么?为什么? 为什么重氮盐被羟基取代要强酸条件,而偶 联反应要弱酸、弱碱?
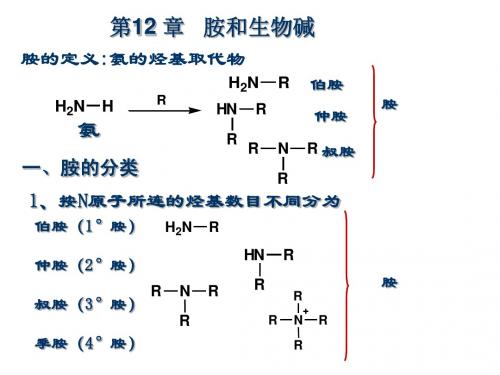
生物碱 (Alkaloid) 一、生物碱的概念及临床应用
胺
脂肪胺 芳香胺 R-NH2 Ar-NH2
3、根据分子中氨基的数目分类
胺 一元胺 多元胺
CH3CH2NH2 H2NCH2CH2NH2
注:芳香胺为N原子 直接连在芳香环上 的胺,如果不是直 接连在芳香环上, 即使有芳香环也不 属于芳香胺。
4、季铵盐和季铵碱
氢氧化铵或铵盐分子中四个氢原子完全被烃基取代而 成的化合物分别称为季铵碱或季铵盐。
MDMA
2-(2-氯苯基)-2-(甲氨基)环己酮 氯胺酮(K粉)
苯丙胺为中枢神经兴奋剂, 是国家严格管制的精神类药品。 甲基苯丙胺俗称“冰毒”, 属于联合国规定的苯丙胺类毒品。 MDMA 属于致幻剂类毒品,是“摇头丸”的主要成分。 氯胺酮俗称K粉。临床上用作麻醉剂或麻醉诱导剂, 有精神 依赖性,其致幻作用是导致被滥用的主要原因。
R R' N H OH2 "R
R R' H OH 2 H OH 2
< <
N
<
H OH 2 R N H OH 2 H OH 2
H OH2 H2O H N H OH2 H OH2
胺类化合物的结构与性质

胺类化合物的结构与性质胺类化合物是一类重要的有机化合物,其分子结构含有一个或多个氨基(-NH2)官能团。
它们在生物化学、药物化学、有机合成等领域中具有广泛的应用。
本文将就胺类化合物的结构和性质展开探讨。
一、胺类化合物的结构胺类化合物的分子结构中,氨基官能团与碳原子以共价键相连。
根据氨基原子的数量和位置,胺类化合物可以进一步分为三类:一级胺、二级胺和三级胺。
一级胺的分子中含有一个氨基原子,如甲胺(CH3NH2)和乙胺(C2H5NH2)。
二级胺的分子中含有两个氨基原子,如乙二胺(C2H4(NH2)2)和丁胺(C4H9NH2)。
三级胺的分子中含有三个氨基原子,如三甲胺((CH3)3N)和三乙胺((C2H5)3N)。
二、胺类化合物的性质1. 水溶性:胺类化合物的水溶性随分子量的增加而增加。
一级胺和二级胺可以与水形成氢键,因此水溶性较好。
而三级胺不具备代表性的氢键结构,其水溶性较差。
2. 碱性:由于氨基的存在,胺类化合物表现出一定的碱性。
一级胺和二级胺在水溶液中可以参与酸碱反应,与弱酸生成盐。
三级胺则不能参与酸碱反应,因为它的三个氨基原子全部被烷基或芳香基取代。
3. 氨基氢的活性:胺类化合物的氨基氢具有较强的活性,可被酸、卤素或氧化剂直接取代或氧化,发生不同类型的化学反应。
三、胺类化合物的应用1. 生物化学:胺类化合物在生物体内起着极其重要的作用。
例如,在蛋白质、核酸和维生素等生物大分子中,都存在着胺基。
它们的氨基功能团是蛋白质折叠和结构稳定性的关键要素。
2. 药物化学:许多药物中含有胺基官能团,这是因为胺基官能团可以改变药物的溶解度、吸收性和生物利用度等性质。
例如,普通的抗组胺药物就是基于胺基官能团设计和制造的。
3. 有机合成:胺类化合物作为有机合成中的重要底物或中间体,广泛应用于各种有机合成反应中。
例如,它们可以通过烷基卤化物与氨气反应制备;也可通过Mannich反应、Gabriel合成等方法进行合成。
高中化学教案氨

教学目标:1. 理解氨的物理性质和化学性质。
2. 掌握氨的制备方法和用途。
3. 能够解决相关氨化学问题。
教学重点和难点:重点:氨的性质和用途。
难点:氨的化学性质和其与其他物质的反应。
教学准备:实验器材:氨水、盐酸、氢氧化钠等。
课本:有关氨的知识点。
图表:相关实验原理和结果图表。
教学过程:一、导入:通过有趣的实例引入氨的概念和作用,激发学生对氨的兴趣。
二、讲解氨的性质:1. 介绍氨的物理性质(无色、刺激性气味、易挥发等)和化学性质(碱性、与酸等物质发生反应)。
2. 展示实验现象,让学生亲自操作观察和体会氨的性质。
三、探讨氨的制备方法:1. 介绍氨的制备方法(氨水和氢氧化铵的反应、氨气与氢氮气的合成等)。
2. 分析不同制备方法的优缺点,并让学生进行讨论。
四、探讨氨的用途:1. 介绍氨在工业生产、医药、化肥等方面的广泛应用。
2. 分析氨的用途对人类生活和环境的影响,让学生思考如何合理利用和管理氨资源。
1. 安排相关实验,让学生进行氨的制备和性质实验。
2. 引导学生观察、记录实验现象并进行分析。
六、总结回顾:对本节课学习内容进行总结,强调氨的重要性和用途,激发学生对化学的兴趣和探究欲望。
板书设计:氨的性质:物理性质、化学性质氨的制备方法:氨水和氢氧化铵的反应、氨气与氢氮气的合成氨的用途:工业生产、医药、化肥等作业布置:1. 思考并写出氨在不同领域的应用情况。
2. 撰写氨的化学性质及与其他物质的反应实验报告。
教学反思:本节课注重通过实验操作,引导学生深入理解氨的性质和用途,培养学生独立思考和解决问题的能力。
同时,激发学生对化学知识的兴趣和探究欲望,使得化学教学更生动有趣。
高中有机化学胺教案

高中有机化学胺教案
主题:有机化学胺
教学目标:
1. 了解胺的基本性质和结构特点
2. 掌握胺的命名方法和分类
3. 理解胺的合成方法及反应特点
4. 能够解决相关胺化合物的化学问题
教学内容:
1. 胺的结构和性质
2. 胺的命名和分类
3. 胺的合成方法
4. 胺的反应特点
教学过程:
一、导入(5分钟)
老师引导学生讨论胺是什么化合物,有什么性质,有什样的应用。
引发学生对于胺的兴趣。
二、讲授(20分钟)
1. 胺的基本结构和性质
2. 胺的命名方法和分类
3. 胺的合成方法及反应特点
三、实验操作(30分钟)
学生进行实验操作,合成不同种类的胺化合物,并观察其化学性质和反应特点。
四、讨论与总结(10分钟)
学生讨论实验结果,总结胺的特性以及合成方法和反应特点。
五、课堂练习(15分钟)
老师布置课后作业,学生进行相关题目的解答和计算。
教学资源:
1. 实验器材和试剂
2. 讲义及教材
3. 课堂练习题
评估方式:
1. 实验报告评分
2. 课后作业成绩
3. 课堂讨论表现【教案结束】。
有机化学之胺类化合物-文档资料

+
C H 3
+ N p h C H 2 5 C H = C H C H 2 2
p h C H C H = C H 2 2
芳香胺
N
H H
N原子在SP3与SP2杂化之间,为不等 性的sp3杂化。其弧对电子与大π键 可以达到某种程度上的共轭,C-N键 具有部分双键的性质。
+ R N H + O H 3
胺的碱性较弱,其盐与氢氧化钠溶液作用时,释放出游离胺。
R NH Cl + N a O H 3
R N H + C l+ H O 2 2
胺的碱性强弱
A、碱性强度:脂肪胺 > 氨 > 芳香胺
C H N H 3 2
PKb
(C H )2 N H 3 3 .2 7 N H 2 1 3 .0
C H C H O C H C H C H C H ) N HC H C H C H C H O H 3 2 2 3 ( 3 2 2 3 2 2 2
o 3 4 . 5 C o 5 6 C o 1 1 7 C
4 炭原子数目相同,沸点 伯胺>仲胺>叔胺.
5 溶解度:低级胺(C6~C7)能溶于水,溶解度略大于相应 的醇。随分子量的增加,溶解度降低,高级胺不溶于水。
C H C H C H C H C H C H C H 3 2 2 2 2 3 N H C H C H 2 3
3-(N-乙氨基)庚烷
ON H C H C C H C C H 3 2 3
3-甲基-2-(N-甲氨基)戊烷
O H N 2 C O C H 2 5
4-亚氨基-2-戊酮
对氨基苯甲酸乙酯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3
N+ ph C2H5 CH2=CHCH2
• 芳香胺
NH H
N原子在SP3与SP2杂化之间,为不等 性的sp3杂化。其弧对电子与大π键 可以达到某种程度上的共轭,C-N键 具有部分双键的性质。
2. 胺的化学性质 1) 碱性 胺和氨相似,具有碱性,能与大多数酸作用成盐。
RN2 H+H C l RN2 H+H O SO 3H
•气态时,仅有烷基的供电子效应,烷基越多,供电子效应越大。 •在水溶液中,碱性的强弱决定于电子效应、溶剂化效应等。 溶剂化效应——铵正离子与水的溶剂化作用(胺的氮原子上的氢与水形成氢 键的作用)。胺的氮原子上的氢越多,溶剂化作用越大,铵正离子越稳定, 胺的碱性越强。
HO H 2
C H 3
C H 3
C H 3N +HO H 2>C H 3 N +HO H 2>C H 3N +HO H 2
3) 烷基化 氨或胺与卤代烃作用
1 胺分子中的氮原子上有弧对电子,可作为亲核试剂与卤 代烃发生SN2反应。
C H 3 C H 2 IN H 3 C H 3 C H 2 N H 3 + I C H 3 C H 2 N H 3 + I - N H 3 C H 3 C H 2 N H 2N H 4 I
C H 3 C H 2 N H 2C H 3 C H 2 I( C H 3 C H 2 ) 2 N H 2 + I - ( C H 3 C H 2 ) 2 N H N H 4 I
HO H 2
HO H 2
C H 3
C、芳香胺的碱性比氨弱,不能用石蕊试纸检验,强弱与芳环上取代基的性 质有关。苯环上连供电子基时,碱性略有增强;连有吸电子基时,碱性则降
低。
C H 3
N H 2 >
N H 2> O 2 N
N H 2
2) 季铵盐与季铵碱 季铵碱碱性与苛性碱相当。
三级胺与卤代烷加热形成四级铵盐即季铵盐。
C H 3 C H 2 C H C H N H C H 3 H 3 C C H 3
3-(N-乙氨基)庚烷
O N H C H 3 C C H 2 C C H 3
3-甲基-2-(N-甲氨基)戊烷
O
H 2 N
C O C 2 H 5
4-亚氨基-2-戊酮
对氨基苯甲酸乙酯
[季铵化合物] 将负离子和取代基的名称放在“铵”字前。某化某铵或某铵某盐
[(CH3)2CH]4N+I-
碘化四异丙铵 • 胺的结构
CH3
CH2CH2OH N+ CH3 OHCH3
氢氧化(2-羟乙基) 三甲铵(俗名胆碱)
脂肪胺:
sp3
N
105.9o
H3C 112.9oH H
R1
N R2
R3
R1
N R2
R3
1.氮原子为SP3杂化,分子呈棱椎状,键角略小于109.5°
2.一对弧对电子占据一个SP3杂化轨道,在棱椎的顶点,压缩了
R'COCl or (R'CO) 2O
NCOCH 3 CH 3
注意
1. 胺的酰化反应比烷基化反应简单,不发生二次酰化. 2. 酸酐(酰氯)常用来为胺的酰基化试剂. 3. 伯、仲胺可以被酰化,叔胺不被酰化,可分离叔胺. 4. 芳胺的酰基化与脂肪胺类似,但前者酰基化的活性低于后者
氨基:-NH2 ; 亚氨基:-NH-, 次氨基: N
命名
[简单胺]
以胺为母体,氮上取代基用N定位。烃基的名称 和数目加胺.
CH2NH
H2NCH2CH2NH2
N-苯基苯甲胺
乙二胺
[较复杂胺] 烃或其它官能团为母体,氨基作取代基。
C H 3 C H 2 C H C H 2 C H 2 C H 2 C H 3 N H C H 2 C H 3
其它三个键, 孤电子对使胺具有亲核性、碱性.
3.如果氮原子连有三个不同基团,理论上似应有手性,存在对映 体.实际上,对简单胺,这样的对映体并未被分离出来.原因 是,这对对映体之间转换的能垒低,可以迅速互相转变.
氮原子上连有四个不同基团的季铵化合物具有旋光性,
CH3
H5C2
N+ ph CH2CH=CH2
总之,反应得到的是混合物,一般用于制备的意义不大。在实 际中,可通过控制反应物的量来控制生成物。
4) 酰化与磺酰化 •酰化:酰基取代胺氮原子上氢的反应。
RNH 2 (Ar)
R'COCl or (R'CO) 2O
RNHCOR'
R 2NH
R'COCl
R 2NCOR'
NHCH 3 CH 3COCl
R 3N (Ar) 3N
RN3 H Cl RN3 HOS 3H O
胺的氮原子上有孤对电子,能结合水中的质子。
R N H 2 + H 2 O
R N H 3 + + O H -
胺的碱性较弱,其盐与氢氧化钠溶液作用时,释放出游离胺。
R N 3 C H + N la O H R N H 2 + C l+ H 2 O
胺的碱性强弱 A、碱性强度:脂肪胺 > 氨 > 芳香胺
2反应中释ห้องสมุดไป่ตู้出的仲胺可继续,作为亲核试剂发生SN2反应, 直至生成季铵盐。
(C H 3 C H 2 )2 N H C H 3 C H 2 I(C H 3 C H 2 )2 N H + I-N H 3 (C H 3 C H 2 )3 NN H 4 I
.................................
R 3N+R 'I
R 3N +RI-
C H 2C l + (C H 3)3N
C H 2N +(C H 3)3C l-
季铵盐易溶于水、熔点高。 季铵盐与氢氧化钠(钾)作用形成平衡体系:
R 4 N + I-+ K O H
R 4 N + O H -+ K I
R 4 N C l A g O H R 4 N O HA g C l
第十四章 胺类化合物
1. 分类、命名、结构与物理性质
N H 3 R N H 2 R 2 N H R 3 N R 4 N + X - R 4 N + O H 氨 1 o 胺 2 o 胺 3 o 胺季 铵 盐 季 铵 碱
季铵化合物:氮原子上连有四个烃基的衍生物
注意: ① 伯、仲、叔胺与伯、仲、叔醇或卤代烃不同. ② 胺、氨、铵的用法 胺:NH3的烃基衍生物 氨:氨基、亚氨基、次氨基 铵:季铵类化合物
CH3NH2 (CH3)2NH (CH3)3N
PKb 3.38
3.27
4.21
NH3 4.76
O2N
NH2 CH3
NH2
13.0
8.92
NH2 9.37
B、脂肪胺 •在气态时碱性: (CH3)3N > (CH3)2NH > CH3NH2 > NH3 •在水溶液中碱性: (CH3)2NH > CH3NH2 > (CH3)3N > NH3 原因:
