溶液的酸碱性导学案
第三节 溶液的酸碱性导学案

第三节溶液的酸碱性导学案一、学习目标:1 、初步学会测定酸碱性的方法2 、会用PH试纸测定溶液的酸碱度。
重难点:1.学会测定酸碱性的方法;2.用pH试纸来表示溶液的酸碱度;二、新课讲授:复习导入:学生复习酸碱的有关知识。
1、酸溶液中都含有______从而使溶液呈现_____性;碱溶液中都含有_____使溶液呈_____性2、石蕊遇酸溶液变____色,遇碱溶液变____色。
无色酚酞试液遇酸溶液_____色,遇碱溶液显___色。
(一)如何测定溶液的酸碱性1.溶液的酸碱性的微观原因:(1)酸(HCl、H2SO4等)的溶液中都含有,表现出性和酸的通性;(2)碱﹝NaOH、Ca(OH)2等﹞的溶液中都含有,表现出性和碱的通性。
2.检验溶液的酸碱性常用的酸碱指示剂有和试液。
3.酸碱指示剂在不同溶液中的变色情况4.用红色、蓝色石蕊试纸来检测溶液的酸碱性:蓝色石蕊试纸遇到酸性溶液变成色;红色石蕊试纸遇到碱性溶液变成色。
(二)怎样判断溶液酸碱性的强弱1.决定溶液酸碱性强弱的微观原因:在一定量的水溶液中,越多,酸性越强;越多,碱性越强。
2.溶液酸碱性强弱的表示方法:化学上通常采用表示,其数值通常在之间。
3.溶液酸碱性强弱与PH值的关系(1)PH<7,溶液呈_________性,PH值越小,酸性越_________;(2)PH>7,溶液呈_________性,PH值越大,碱性越_________;(3)PH=7,溶液呈_________性。
〖实验〗实验探究小结1.溶液PH值的测量方法:(1)通常用测定溶液的PH值。
PH值精确到整数位。
(2)测定方法:①在洁净干燥的玻璃片上放上一片;②用蘸取待测液滴在试纸上;③将试纸显示的颜色与对照,读出对应的PH。
〖讨论〗(1)检验溶液的酸碱性用;测定溶液酸碱性强弱用。
(2)用PH试纸测定它们的PH:白醋、汽水、石灰水、肥皂水、食盐水、蔗糖水;按PH由小到大的顺序将检验的式样排序:思考讨论:甲同学在测定某碱溶液的PH 值时,先把PH 试纸用水湿润再测,他所得的结果准确吗?为什么?如果是酸溶液呢?溶液PH 的测定步骤: (1)一蘸:用玻璃棒蘸取待测液; (2)二滴:将待测液滴到PH 试纸上(3)三看:观察试纸颜色的变化; (4)四比:与标准比色卡对照。
56初三年级化学第一课时溶液的酸碱性(1)导学案

第1节《溶液的酸碱性》(第1课时)导学案【学习目标】1.了解溶液的酸碱性及检验方法;2.实验验证石蕊、酚酞两种酸碱指示剂的变色情况。
【课前预习】1.你知道生活中的酸性物质有哪些?碱性物质呢?如何检验溶液酸碱性?2.将CO2气体通入紫色石蕊试液中,溶液颜色如何变化?为什么呢?【学习过程】1.[活动与探究1]在白色点滴板的空穴里,分别滴入几滴待测液,再各滴加1~2滴紫色石蕊试液,观察并记录紫色石蕊试液的颜色变化情况。
思考:依据实验现象,将上述溶液分为哪几类?小结:(1)使紫色石蕊试液的溶液,呈性;(2)使紫色石蕊试液的溶液,呈性;(3)使紫色石蕊试液的溶液,呈性。
2.[活动与探究2]在白色点滴板的空穴里,分别滴入几滴待测液,再各滴加1~2滴无色酚酞试液,观察并记录试液的颜色变化情况。
小结:(1)无色酚酞试液遇酸性溶液;(2)无色酚酞试液遇中性溶液;(3)无色酚酞试液遇碱性溶液。
【课后练习】1.下列日常所见的溶液中呈酸性的是()A.肥皂水B.石灰水C.雪碧D.蔗糖水2.柠檬汁能使石蕊试液变红色,由此可知柠檬汁()A.显酸性B.显碱性C.显中性D.无法确定3. 某些植物的花汁可作酸碱指示剂。
取三种花汁用稀酸溶液或稀碱溶液检验,颜色如下:试回答下列问题:(1)为试验生活中的食盐水、肥皂水、汽水、石灰水四种物质的酸碱性,我选择花汁是,不选用其他花汁的原因是。
(2)取所选花汁少许分别滴人上述四种物质,请将所显颜色填入下表中:4.张老师上课时做了趣味实验:他选择了一种指示剂(无色酚酞试液或紫色石蕊试液)、稀盐酸、稀NaOH溶液。
他先用玻璃棒蘸取某种指示剂在白纸上写上“化学”,可是学生什么也看不见。
然后用某种物质喷洒在白纸上,出现了红色的“化学”二字。
接着,又向纸上喷洒另一种物质,红字消失。
则他选用的指示剂是,先喷洒的物质是,后喷洒的物质为。
【参考答案】1.C2.A3.(1)大红花万寿菊花的花汁在不同酸碱性的溶液中颜色均相同,所以它不能做指示剂;玫瑰花的花汁不能区分酸性和中性物质(2)4. 无色酚酞试液稀NaOH溶液稀盐酸。
实验活动7溶液酸碱性的检验导学案九年级化学人教版下册

实验活动7 溶液酸碱性的检验(导学案)班级姓名【学习目标】1、了解什么是酸碱指示剂,并检验指示剂与酸碱作用的变色效果。
2、动手自制指示剂,并会用酸碱指示剂。
1、通过探究活动的分工、配合,增强学生的协作意识、合作能力。
2、通过对检测溶液酸碱性的意义分析,提高学生的环保意识。
【实验用品】主要仪器:烧杯、点滴板、胶头滴管、研钵和杵、纱布、喷雾瓶、纸花。
药品:酚酞溶液、石蕊溶液、蒸馏水、酒精、食盐溶液、稀盐酸、白醋、雪碧、氢氧化钠溶液、食用纯碱、紫卷心菜、月季花、胡萝卜。
【学习重难点】重点:用酸碱指示剂检验溶液的酸碱性。
难点:自制酸碱指示剂。
【学习方法】分组学习法实验探究法观察法【学习过程】一、自主导学3、酸碱指示剂与酸碱反应的规律:紫色石蕊试液遇酸;遇碱;遇中性溶液;无色酚酞试液遇碱;遇酸性和中性溶二、合作探究1.自制指示剂的步骤:(1)取植物的花瓣(如月季花)、蔬菜(紫卷心菜、胡萝卜)在研钵中捣烂,加入适量酒精浸泡。
(2)将纱布摊开放在烧杯上,将研钵中捣乱的物质倒在纱布上。
(3)用纱布将浸泡出来的汁液过滤或挤出,就可以得到指示剂。
2.用自制的指示剂检验以下几种溶液的酸碱性,并认真填好实验报告。
实验步骤:(1) 按表中的顺序,用胶头滴管....依次取少量稀盐酸、白醋、雪碧、食盐水、氢氧化钠溶液、纯碱溶液滴加到点滴板...上,(滴取完一种溶液后,应该在蒸馏水中清洗后再滴取其他溶液);(2) 用胶头滴管将自制的指示剂依次加入点滴板上的溶液中,(取完后,切勿将胶头滴管平放或倒置);(3) 观察并记录实验的现象,填写好实验报告单。
(4) 成果展示时,先介绍自制指示剂,然后介绍自制指示剂在不同溶液中的颜色变化,并判断自制的试剂能否作为酸碱指示剂。
使用方法图示:三、交流讨论各小组进行成果展示,展示时每小组选择一名同学上台将小组实验的成果展示给大家,并判断自制的指示剂能否作为酸碱指示剂。
四、实验结论一、酸碱指示剂:能跟酸或碱的溶液起作用而显示不同的颜色的物质。
第二单元第三节溶液的酸碱性学案
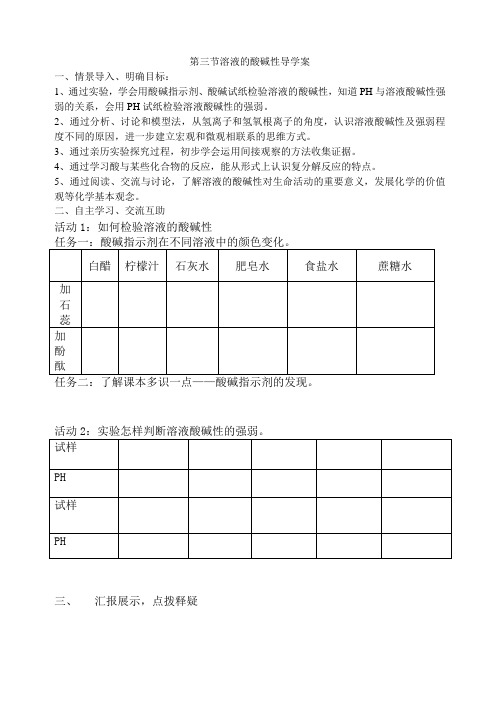
第三节溶液的酸碱性导学案一、情景导入、明确目标:1、通过实验,学会用酸碱指示剂、酸碱试纸检验溶液的酸碱性,知道PH与溶液酸碱性强弱的关系,会用PH试纸检验溶液酸碱性的强弱。
2、通过分析、讨论和模型法,从氢离子和氢氧根离子的角度,认识溶液酸碱性及强弱程度不同的原因,进一步建立宏观和微观相联系的思维方式。
3、通过亲历实验探究过程,初步学会运用间接观察的方法收集证据。
4、通过学习酸与某些化合物的反应,能从形式上认识复分解反应的特点。
5、通过阅读、交流与讨论,了解溶液的酸碱性对生命活动的重要意义,发展化学的价值观等化学基本观念。
二、自主学习、交流互助活动1:如何检验溶液的酸碱性任务二:了解课本多识一点——酸碱指示剂的发现。
三、汇报展示,点拨释疑1、溶液中只要含有较多的氢离子的溶液,就能显示出酸性;只要含有较多氢氧根离子的溶液就能显示出碱性。
有些不属于酸的物质如:硫酸氢钠,其溶液也显酸性。
也有不属于碱的物质,其溶液也显碱性。
2、试纸的使用:3、试纸的种类四、巩固练习,拓展提高1、下列关于盐酸的说法正确的是()A. 浓盐酸敞口放在空气中会形成白烟B.浓盐酸具有腐蚀性C 浓盐酸是一种无色无味的液体 D.浓盐酸敞口放在空气中溶液质量会变大2、盐酸具有所学化学性质,这是因为盐酸中含有大量的()A、氢原子B、氢离子C、氢分子D、氯离子3、不法分子常用金光闪闪的“假金元宝”(铜、锌合金)蒙骗人们,下列鉴别办法中错误的是() A. 加盐酸 B. 测密度 C. 用火烧 D. 看颜色4、下列方程式书写完全正确的是()A.Zn+HCl=ZnCl2+H2↑ B.2Fe+6HCl=2FeCl3+3H2↑C.AgNO3+HCl=AgCl +HNO3D.Fe2O3+ HCl = FeCi3+H2O5、苯甲酸(C6H5COOH)可用作食品防腐剂,其性质与盐酸相似。
下列对苯甲酸性质的推测不合理是( )A.苯甲酸溶液的pH小于7 B.苯甲酸溶液不能使无色酚酞试液变色C.苯甲酸溶液能使紫色石蕊试液变红色 D.苯甲酸溶液的pH大于7五、总结提升、达标检测盐酸、硫酸溶液中含有相同的所以具有相似的化学性质,你能推导出稀硫酸具有哪些化学性质吗?。
第三节溶液的酸碱性导学案(第2课时)+带答案新.doc

第三节溶液的酸碱性导学案(第2课时)【学习目标】: 知识目标:了解酸和碱对生命活动的意义;能力目标:通过学习,提高学生对酸碱在生命活动中意义的认识;情感目标:通过联系生活实际,感受化学与生活的密切关系,增强学习化学的兴趣【重点和难点】:了解酸和碱对生命活动的意义【学习过程】:一、难点回顾1、酸碱指示剂只能测出溶液的酸碱性;pH 试纸不仅能测出溶液的酸碱性,还能测定 出溶液的酸碱性强弱。
用pH 表示溶液的酸碱性强弱。
2、含有H +的溶液一定是酸性溶液,酸溶液一定显酸性,酸性溶液不一定是酸溶液含有OH —的溶液一定是碱性溶液,碱溶液一定显碱性,碱性溶液不一定是碱溶液酸和碱对生命活动的意义二、自主学习、合作探究:学习活动一:阅读课本第41--42页回答下列问题:1、酸和碱与人的生理活动密切相关,人的体液的pH 必须维持在一定的范围内,如果____超出正常范围,就会导致生理功能失调或 产生疾病,甚至死亡。
胃液中的胃酸(主要成分为___)能帮助消化食物,如果胃酸分泌过多,使胃液的pH__(填下降或上升),就会导致胃痛。
剧烈运动时,肌肉里产生的乳酸过多,会感到肌肉酸痛。
2、土壤的酸碱性对植物的生长有重要的意义。
大多数植物适宜在接近_____的土壤中生长,土壤的酸性太强((pH____)或者碱性太强(pH_____),作物就不能正常生长。
学习活动二:阅读课本第41页生活中常见物质的pH 、人体中某些体液的正常PH 范围及第42页表回答下列问题:1、生活中大多数的水果呈_______性,厨房中常用的洗涤剂呈_______性,牙膏呈_____性,卫生间常用的洗涤剂呈_____性,肥皂水显_______性。
2、正常人体的血浆的pH 在_____之间,为____性体质,但是这部分人只占10%左右。
更多人的体液pH 的在7.35以下,处于健康和疾病之间的亚健康状态,医学上成为酸性体质者。
3、人体中pH 最小的分泌物是____________多识一点:通常雨水的pH<7,原因是雨中溶解了空气中的__________,使其自身显酸性,我们我在学!我要学!把pH <5.6的雨水称为__________。
溶液酸碱性与PH 导学案

溶液酸碱性与pH【学习目标】1. 通过阅读课本46页,能够判断溶液酸碱性与溶液中H+浓度和OH-浓度的关系。
2. 通过阅读课本47页,能够正确说出pH的定义及表达式。
3. 通过阅读课本47页,能够规范复述pH的测定方法,及pH试纸使用相关注意事项。
4. 通过教师讲解能正确判断酸碱稀释后溶液pH的变化。
【重点难点】重点:溶液酸碱性的判断方法;pH的简单求算;pH试纸使用方法及注意事项。
难点:稀释溶液及混合溶液pH的变化【导学流程】一.基础感知1.溶液酸碱性结合课本46页及资料卡片完成以下思考(1)pH的计算公式为_______________________,pH可表示的范围为_____________。
(2)下列溶液一定显酸性的是_______________________①能与金属Al反应放出H2的溶液②加紫色石蕊变红的溶液③pH=6的某溶液④ C(H+)>C(OH-)的任意水溶液⑤C(H+)>(3)25℃纯水中,Kw值为;C(H+)= ;pH= ;呈性;100℃纯水中,Kw值为;C(H+)= ;pH= ;呈性;思考:pH=7的溶液一定成中性吗?pH=6的溶液一定呈酸性吗?(4)混合溶液酸碱性判断(填>,=,或<)①pH=3的盐酸和pH=11的氨水等体积混合,pH____7②pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合pH____7③pH=3的醋酸和pH=11的的氢氧化钡溶液等体积混合pH____72.稀释溶液分析(1)室温下,pH=0的硫酸溶液,c(H+)=_________,若该溶液稀释100倍,pH=__________。
(2)pH=5的H2SO4稀释1000倍pH值约为;稀释之后溶液中C(H+):C(SO42-)等于;(清北)(3)常温下,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随的变化如图所示,回答:①碱性MOH____ROH;②ROH的电离程度b___a;③当时,若两溶液同时升高温度,则c(M+)/c(R+)如何变化_____。
《溶液的酸碱性》导学案

《溶液的酸碱性》导学案------------------------------------------作者xxxx------------------------------------------日期xxxx《溶液的酸碱性》导学案学习目标:1、通过自主学习,了解不同的溶液酸碱性的相关知识,以及两种观察方法的不同点。
2、通过教师的点拨,能知道“溶液的酸碱性和酸碱度”之间的关系。
3、通过小组合作,学会用PH试纸测定溶液酸碱度的操作方法。
学习过程:1、知识准备(1)凡是能紫色的石蕊试液_______都是酸性溶液,并且该溶液______使无色酚酞试液变色;(2)凡是能使紫色的石蕊试液__________都是碱性溶液,并且该溶液能使无色酚酞试液变______;(3)不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为_________溶液。
(4)如紫色石蕊试液及无色酚酞等能检验溶液酸碱性的试液,称为酸碱指示剂。
酸碱指示剂能把溶液分为________溶液和_______溶液。
但不能表示溶液酸碱性的强弱程度。
2、自主学习溶液的酸碱性的强弱程度1.酸碱度:_______________________________________________________ 2.___________试纸用来定量的测定溶液的酸碱度。
pH值 1 2 3 4 5 6 7 8 9 10 11 12 13 14酸性增强中性碱性增强溶液的pH值与酸碱性关系pH=7,溶液呈 _______ ;pH<7,溶液呈 _________ ,pH越小,酸性越_________ ;pH>7,溶液呈 ________ ,pH越大,碱性越 _________ 3.pH试纸的使用方法;用 __________ 在pH试纸上,然后把试纸显示的颜色与___________对照,标准比色卡上相同颜色的pH即为该溶液的pH。
【合作探究】【探究活动】二:阅读教材41--42页后讨论:①PH与生命活动的关系,②测定自己唾液的PH,了解自己的健康状况.③说说酸雨是怎样形成的,它有哪些危害.【分层检测】应知应会1.溶液的酸碱度用________表示,测定溶液的酸碱度常用__________,鉴别溶液的酸碱性常用___________。
溶液的酸碱性导学案

课题:溶液的酸碱性【自学评价】1.0.1mol/L盐酸溶液中存在的离子有,其中c(H+)=,c(H+)·c(OH-)=。
2.常用的大小来表示溶液酸碱性的强弱。
酸性越强,批pH越;碱性越强,pH越。
【互动学习】问题一溶液的酸碱性与c(H+)、c(OH-)的关系中性溶液c(H+)c(OH-)酸性溶液c(H+)c(OH-)碱性溶液c(H+)c(OH-)[思考交流]如果t℃时,Kw=1.0×10-12,则t℃时的酸性溶液中c(H+)﹥mol/L问题二溶液的酸碱性与pH的关系1.pH的定义:溶液中H+浓度的即为溶液的pH。
数学表达式:。
2.pH的意义:pH的大小反映了溶液的强弱,溶液的pH越小则酸性越;溶液的PH越大则碱性越。
3.适用范围:对于c(H+)或c(OH-)大于1mol/L的溶液,直接用c(H+)或c(OH-)的大小表示溶液的酸碱性。
因为当C(H+)>1mol/L时,pH为负值,当C(OH-)>1mol/L时,pH>14;用pH来表示反而不方便。
所以用pH来表示溶液的酸碱性时,仅适用于C(H+)或C(OH-)小于等于1mol/L的稀溶液。
故通常pH在之间。
问题三pH的测量⑴定性测定:酸碱指示剂法说明:常用的酸碱指示剂有石蕊、甲基橙、酚酞试液等。
根据它们显示的颜色可大致确定溶液的pH范围。
常用酸碱指示剂的pH变色范围指示剂颜色及变色的pH范围石蕊<5红色5-8紫色>8蓝色甲基橙<3.1红色 3.1-4.4橙色>4.4黄色酚酞<8.2无色8.2-10浅(粉)红色>10红色⑵定量测定测量方法①:用pH试纸来测定溶液的pH。
操作方法:用洁净的干玻璃棒直接蘸取少许待测液,滴在pH试纸上(注意不能将pH试纸先用水沾湿或用湿的玻璃棒,因为这样做,实际上已将溶液稀释,导致所测定的pH不准确)将pH试纸显示的颜色随即(半分钟内)与标准比色卡对照,确定溶液的pH(因为时间长了,试纸所显示的颜色会改变,致使测得的pH不准。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液的酸碱性导学案-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
溶液的酸碱性
一、学习目标:
1、知道溶液的酸碱度——pH,并学会用pH试纸测定溶液的酸碱度。
2、学会自制酸碱指示剂,并用其测定溶液的酸碱性
二、课前预习
1.测定溶液的酸碱性用,测定溶液的酸碱度
用。
2.酸性溶液能使蓝色石蕊试纸变,碱性溶液能使红色石蕊试纸变3.溶液的pH=7,溶液呈性;pH<7,溶液呈性;pH>7,溶液呈
性。
4.溶液的pH与酸碱性强弱的关系:pH越大,,pH越小,
5、使用PH试纸测定溶液的酸碱度的方法。
6、雨水因溶有空气中的而略显酸性。
人们通常把PH小于的降水称为
酸雨。
三、课堂拓展
某同学在使用PH试纸测定溶液的酸碱度时,先用蒸馏水将PH试纸湿润,然后与标准比色卡对照。
该同学做法对吗测得的结果与实际值比较
()
A、偏大
B、偏小
C、不变
D、无法判断
四、课堂测试
1、使酚酞变红的溶液,使紫色石蕊变
()
A.红色 B.蓝色 C.紫色 D.无色
2、有一种溶液,能使无色酚酞试液变红,则该溶液呈_____性, pH________7.
3、下列溶液中pH最小的是
()
A.氨水 B.肥皂水 C.食盐水 D.白醋
4、人体中几种重要体液的正常pH范围如下:①血液 7.35 ~7. 45 ②唾液6.6~7.1③胃液 0.8~1.5 ④胆汁 6.8~7.4 其中酸性最强的是()
A.① B.② C.③ D.④。
