徐州市2019届高三模拟考试化学试题
2019届江苏省徐州市第一中学高三上学期第一次月考化学试题含解析

C. Al Al(OH)3 Al2O3
D. Fe2O3 Fe(OH)3 Fe2(SO4)3(aq)
8.常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、NH4+、I-、CO32-
B. 0.1mol•L-1KNO3溶液中:Na+、Fe2+、Cl-、SO42—
B. 用如图所示方法可保护钢闸门不被腐蚀
C. 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 的值增大
D. 常温下,pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
14.25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8.0。1mol/L的NaHTeO3溶液中,下列粒子的物质的量浓度关系不正确的是
(4)“过滤"得到的滤渣中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=_____。
17.药物阿佐昔芬H主要用于防治骨质疏松症和预防乳腺癌.合成路线如下:
(1)H(阿佐昔芬)中含氧官能团的名称为_____、_____。
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。
①图中仪器A的名称为_______。
②在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:___________。
A. 分子式为C9H8O4
B. 1mol该物质最多能与3molBr2发生取代反应
2019-2020学年江苏省徐州市第一中学新高考化学模拟试卷含解析
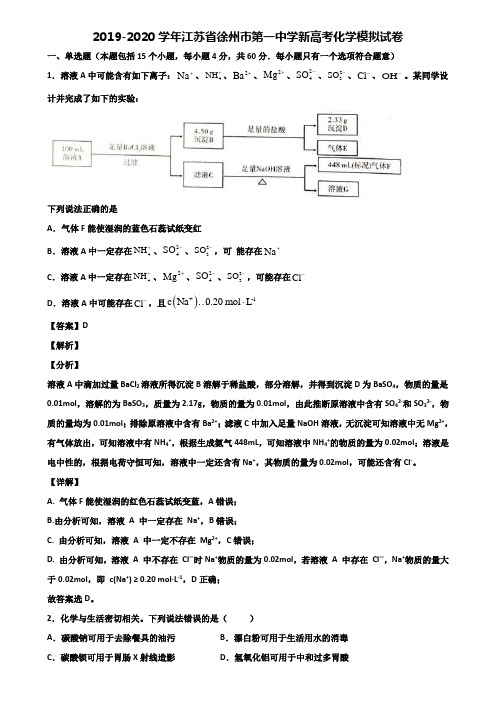
2019-2020学年江苏省徐州市第一中学新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.溶液A 中可能含有如下离子:Na +、4NH +、2Ba+、2Mg +、24SO -、23SO -、Cl -、OH -。
某同学设计并完成了如下的实验:下列说法正确的是A .气体F 能使湿润的蓝色石蕊试纸变红B .溶液A 中一定存在4NH +、24SO -、23SO -,可 能存在Na +C .溶液A 中一定存在4NH +、2Mg +、24SO -、23SO -,可能存在Cl -D .溶液A 中可能存在Cl -,且()+-1c Na 0.20mol L⋅…【答案】D 【解析】 【分析】溶液A 中滴加过量BaCl 2溶液所得沉淀B 溶解于稀盐酸,部分溶解,并得到沉淀D 为BaSO 4,物质的量是0.01mol ,溶解的为BaSO 3,质量为2.17g ,物质的量为0.01mol ,由此推断原溶液中含有SO 42-和SO 32-,物质的量均为0.01mol ;排除原溶液中含有Ba 2+;滤液C 中加入足量NaOH 溶液,无沉淀可知溶液中无Mg 2+,有气体放出,可知溶液中有NH 4+,根据生成氨气448mL ,可知溶液中NH 4+的物质的量为0.02mol ;溶液是电中性的,根据电荷守恒可知,溶液中一定还含有Na +,其物质的量为0.02mol ,可能还含有Cl -。
【详解】A. 气体F 能使湿润的红色石蕊试纸变蓝,A 错误;B.由分析可知,溶液 A 中一定存在 Na +,B 错误;C. 由分析可知,溶液 A 中一定不存在 Mg 2+,C 错误;D. 由分析可知,溶液 A 中不存在 Cl -时Na +物质的量为0.02mol ,若溶液 A 中存在 Cl -,Na +物质的量大于0.02mol ,即 c(Na +) ≥ 0.20 mol·L -1,D 正确; 故答案选D 。
2019届高三化学模拟试卷及参考答案(Word版含答案)

2019届高三化学模拟试卷及参考答案(WORD版本试卷+名师解析答案,建议下载练习)可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cu-64 Ba-137 V-51选择题单项选择题:本题包括10小题,每小题2分, 共计20分。
每小题只有一个....选项符合题意。
1. 2018年是“2025中国制造”启动年,而化学与生活、人类生产、社会可持续发展密切相关,下列有关化学知识的说法错误..的是A.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”B.我国发射“嫦娥三号”卫星所使用的碳纤维,是一种非金属材料C.用聚氯乙烯代替木材,生产快餐盒,以减少木材的使用D.碳纳米管表面积大,可用作新型储氢材料2. 化学科学需要借助化学专用语言描述,下列有关化学用语表示正确的是A.碳铵的化学式: NH4HCO3B. 次氯酸的结构式:H—Cl—OC. 中子数为145、质子数为94的钚(Pu)原子:145 94PuD. S2﹣的结构示意图:3. 下列家庭化学实验不能达到预期目的的是A. 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物B. 用湿润的淀粉-KI 试纸检验 HCl 气体中是否混有 Cl 2C . 向 Ca(ClO)2 溶液中加入硫酸溶液,来证明 S 、Cl 的非金属性强弱D. 将一片铝箔用火灼烧,铝箔熔化但不滴落,证明铝箔表面致密Al 2O 3薄膜的熔点高于Al4. 下列实验装置设计不能..达到目的的是A .实验I :所示装置可制备氨气B .实验II :检验电解饱和食盐水的产物C12C .实验III :制取并观察Fe(OH)2沉淀D .实验IV :吸收SO 25. 短周期主族元素X 、Y 、Z 、W 原子序数依次增大,原子序数之和为42,X 原子的核外电子数等于Y 的最外层电子数,Z 是第IA 元素,W 是同周期非金属性最强的元素。
下列说法正确的是A .单质的还原性:X >ZB .原子半径:r (X)<r (Y)<r (Z)<r (W)C .Y 、Z 组成的化合物中一定含有离子键D .W 的氧化物的水化物一定是强酸6. 下列表示对应化学反应的离子方程式正确的是A .氢氧化铁胶体中加入HI 溶液:Fe(OH)3+3H +═Fe 3++2H 2OB .用氨水溶解氢氧化铜沉淀:Cu 2++4NH 3•H 2O═[Cu (NH 3)4]2++4H 2OC .用稀硝酸除去试管内壁银:3Ag+4H ++NO 3﹣═3Ag ++NO↑+2H 2OD .向NaClO 溶液中通入过量的SO 2:SO 2+NaClO +H 2O=HClO +NaHSO 37. 给定条件下,下列选项中所示的物质间转化均能一步实现的组合是① FeS 2――→O 2/高温SO 2――→H 2O 2H 2SO 4② SiO 2――→HCl (aq )SiCl 4――→H 2/高温Si③ Al ――→NaOH (aq )NaAlO 2(aq)――→蒸发NaAlO 2(s)④ 1 mol·L −1HCl(aq)――→MnO 2/△Cl 2――→石灰乳Ca(ClO)2 ⑤ CuSO 4(aq)――→过量NaOH (aq )Cu(OH)2――→葡萄糖△CuO ⑥ 饱和NaCl 溶液――→NH 3、CO 2NaHCO 3――→△Na 2CO 3A .①③⑤B .①③⑥C .②③④D .①④⑥8. 如图是金属镁和卤素单质(X 2)反应的能量变化示意图。
【高考模拟】2019届江苏省徐州市高三上学期期末考试化学(word版有答案)

2021届江苏省徐州市高三上学期期末测试2021.1本试卷分第I 卷〔选择题〕和第n 卷〔非选择题〕两局部.总分值120分,测试时间100分钟.H —1 C —12 N —14 O —16 Na —23 S —32第I 卷〔选择题共40分〕单项选择题:此题包括 10小题,每题2分,共20分.每题只有一个选项符合题意.1.2021年10月,中国美丽乡村百家范例经验交流会在我省举办.O / \ C. H 2O 的结构式:H H 3.以下有关物质性质与用途具有对应关系的是 A. A1具有良好的导电性,可用于制铝箔C. NaClO 溶液显碱性,可用于杀菌消毒 〔 〕B. Fe 2O 3粉末呈红色,可用于制颜料、油漆D. HNO 3有酸性,可用于洗涤附有银镜的试管4.室温下,以下各组离子在指定溶液中能大量共存的是 〔 〕 A. 0.1 mol • L 1NaHCO 3溶液:<、Al 3+、NO 3、SO 2使蓝色石蕊试纸变红的溶液: Mg 2+、Na+、SO 4 > NO 3 滴加KSCN 溶液显红色的溶液:NH 4、K +、Cl > I 由水电离产生的 c 〔H 〕 = 1 X 10 12 mol - L 1 的溶液:NH 4、Ca 2+、Cl 、AlO 2A. Na 2O 2与CO 2反响生成.2A. C. 2. 秸秆就地露天燃烧 消除农村黑臭水体 用化学用语表示 Na2O+B.生活垃圾资源化利用D.推广使用可降解塑料2HCl===2NaCl + H 2O 中的相关微粒,其中正确的选项是〔 A. 中子数为18的氯原子: 18人 17C1 B. Na 2O 的电子式: 十 八 / 一Na 2 [ O ] 可能用到的相对原子质量:Cl —35.5 K —39 Mn —55卜列做法不应该提倡的是D. Na 卡的结构示意图:磅))B.C.D.5. 卜列关于C12的制备、净化、收集及尾气处理的装置和原理能到达实验目的的是 A. C. 6. Mn(NaJ ICO饱和济海*41甲用装置甲制备Cl 2 B. 用装置丙收集Cl 2D. 乙丙用装置乙除去 Cl 2中的HCl 用装置丁吸收尾气卜列有关物质性质的表达不正确的选项是〔 〕浓盐酸Ml .】{溶油TB.铁片投入到冷的浓硫酸中,发生钝化C.NH4CI溶液中滴加酚酗:溶液,溶液变红D.AlCl 3溶液中参加足量氨水,生成Al(OH) 37.以下指定反响的离子方程式正确的选项是( )A.KC1O 3 溶液和浓盐酸反响:ClO 3 + C「+ 6H + ===Cl2 T + 3H2OB.NaHSO3 溶液和NaClO 溶液混合:HSO3 + ClO ===HClO + SO2C.酸TKMnO 4 溶液和双氧水混合:2MnO 4 + 5H2O2===2Mn2++ 5.2 T + 6OH + 2H2OD. NaHCO3 溶液参加少量的Ca(OH)2 溶液:Ca2+ + 2OH + 2HCO 3 ===CaCO3 + CO2 + 2H2O8.短周期主族元素X、Y、Z、W原子序数依次增大,X位于第IV A族,Y元素原子最外层电子数是次外层的3倍,Z原子半径为同周期中最大, W与Y同主族.以下说法正确的选项是( )A. X、Y只能形成一种化合物B.原子半径:r(X)<r(Y)<r(Z)C.X最高价氧化物的水化物酸性比W的弱D.Y的简单气态氢化物的热稳定性比W的弱9.在给定条件下,以下选项所示的物质间转化均能实现的是( )A. Cu -O^CuO H'SO4-^^ >CuSO4(aq)B. SiO 2NaOH^aq)Na2SiO3(aq)^S?Na2SO3(aq)C. NH3催^O^ NO-H2^HNO3(aq)D. Fe203H C^q,FeCb(aq)-^无水FeCb10.以下说法正确的选项是( )A.甲烷燃烧时,化学能全部转化为热能B.反响3Si(s) + 2N2(g)===Si3N4(S)能自发进行,那么该反响为放热反响C. 1 mol Cl2与足量的NaOH溶液充分反响,转移电子的数目为2X 6.02X 1023D.常温下,pH = 2的醋酸溶液与pH =12的NaOH溶液混合后的溶液呈酸性不定项选择题:此题包括5小题,每题4分,共20分.每题只有一个或两个选项符合题意. 假设正确答案只包括一个选项,多项选择时,该小题得0分;假设正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得总分值,但只要选错一个,该小题就得0分.11.丹参醇可由化合物X在一定条件下反响制得:丹参醇以下有关化合物X、Y和丹参醇的说法正确的选项是( )A. X分子中所有碳原子一定在同一平面上B. X - Y的反响为消去反响C.用FeCl3溶液可鉴别丫和丹参醇D.丹参醇分子中含有2个手性碳原子12.根据以下实验操作和现象所得出的结论正确的选项是( )A,图甲表示2SO 2(g)+ 02(g)'2SO 3;川<0速率与时间关系曲线, 说明t i 时改变的条件是增大体系的压强B.图乙是常温下碳钢浸没在 NaCl 溶液中腐蚀速率与 NaCl 浓度的关系曲线,说明在 NaCl 浓度较高时溶液中.2的浓度减少,正极反响减慢导致腐蚀速率降低C.图丙是金刚石与石墨氧化生成CO 2的能量关系曲线,说明石墨转化为金刚石的反响的小>0D.图丁是常温下AgCl 和Ag 2CrO 4的沉淀溶解平衡曲线,说明阴影区域只有 Ag 2CrO 4沉淀14 .常温常压下,将a mol CO 2气体通入含b mol NaOH 的溶液中,以下对所得溶液的描述正确 的是()A. 2a<b 时,那么一定存在: c(Na +)>c(CO 2 )>c(OH )>c(H +)B. 2a = b 时,那么一定存在: c(OH ) = c(H2CO3) + c(HCO3) + c(H +)-- c (HCO 3) c (H 2CO 3)C. b<2a<2b 时,那么一TE 存在: ℃2-、> 、c ( CO3 ) c ( HCO3 ) + + — 2— —D. a=b 时,那么一定存在: 2c(Na )+c(H ) = c(OH )+3c(CO 3 ) + 2c(HCO 3)+c(H 2CO 3) 15 .在初始温度为 T 时,向三个密闭的容器中按不同方式投入反响物,发生反响: A(g) +3B(g) '2C(g); A H<0 ,测得反响的相关数据如下:容容器类型初始 反响物投入量/mol反响物平衡时C平1 3 1B向蛋白质溶液中分别参加甲醛和 (NH 4)2SO 4饱和溶液,均有固体析出蛋白质均发生了变性C向2 mL 0.5 mol L 1 NaHCO 3溶液中滴加1 mL0.5 mol L11 CaCl 2溶液,产生白色沉淀和气体白色沉淀和气体分别为 CaCO 3和CO 2D向溶有$.2的8202溶液中通入气体 X, 出现白色沉淀气体X 具有强氧化性根据以下图示所得出的结论不正确的选项是T10 15 NaCI 的含忱/%乙2 Q S 6 4 2反向过程丙0 1234 567K 9 DO 11 RT 酗C 〞,8 7 6 5 4 3 2器体积A BC 的平 衡转化 率a的物 质的量 /mol 衡 常数KI 恒温恒容 1 L 1 3 0 a 1(A) 1.2 K In 绝热恒容 1 L 0 0 2 a 2(C) x K 2 m恒温恒压2 L2 6a 3(A)yK 325 a 1(A)< a 3(A)C. K 2>K 3= —第n 卷(非选择题共80分)16 . (12分)以硫酸渣(含Fe 2O 3、SiO 2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:MS . Fe 粉 NH4HCO3 空气I 4 JJ疏酸渣f 酸溶f 复原f 过滤I T 沉铁|f 聿化f 过滤11 f 铁黄I I 滤渣 co 2(1) “酸溶〞中加快溶解的方法为 (写出一种). (2) “复原〞过程中的离子方程式为(3)①“沉铁〞过程中生成 Fe(OH)2的化学方程式为 .②假设用CaCO 3“沉铁〞,那么生成FeCO 3沉淀.当反响完成时,溶液中 c(Ca 2+)/c(Fe 2+) =[ K sp (CaCO 3)=2.8X10 9, K sp (FeCO 3)= 2X 10 11](4) “氧化〞时,用NaNO 2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是(5)焦炭复原硫酸渣炼铁能充分利用铁资源,在 1 225 C 、n(C)/n(O)= 1.2时,焙烧时间与金属 产率的关系如右图, 时间超过15 min 金属产率下降的原因是17. (15分)某研究小组拟以对苯二酚为原料合成染料G .合成路线如下:A. x<1.2, y<2.4B. D. a 1(A) + a 2(C)>1焙烧[ltmimiin100r(1) G 中的含氧官能团名称为 (写出两种). (2) A-B 的反响类型为.⑶E 的分子式为 C i7H 19O 3N,写出E 的结构简式: .(4) C 的一种同分异构体同时满足以下条件,写出该同分异构体的结构简式:①含有苯环,且分子中有一个手性碳原子,能与 FeCl 3溶液发生显色反响;②能发生水解反响,水解产物均有4种不同化学环境的氢且水解产物之一是“氨基酸.⑸:① 苯胺(O )易被氧化:CH a COOH COOH_ 声人, 酸性KMnOi 溶液 有入 浓HNOi 浓声人(5) ------------------ U ----------------------- Z ―A U Z A 」NO2.CH 3 C) COOH O 上 I] , I I] /=\写出以Q 和Crcri 为原料制备的合成路线流程图(无机试剂任用,合成路线流程图例如见此题题干).18. (12分)实验室以食盐为原料制备焦亚硫酸钠 (Na 2s 205)并测定其纯度,流程如下:NH 5 CO2S()s 1I 2(),, I II I饱3।液反响। f 过滤|f 加热f反响』 f …f Na 岛(*jIJr漉液XX:① Na 2SO 3+SO 2===Na 2s 2O 5, 5c 202 +2MnO 4 + 16H + ===10CO 2 T + 2Mn 2+ + 8H 20; ②焦亚硫酸钠与强酸接触放出SO 2,并生成盐.(1)反响I 的化学方程式为 ;流程中X 的化学式为(2) 0.5 mol Na 2s 2O 5溶解于水配成1 L 溶液,该溶液pH = 4.5.OHOHCHjCHjC]3cHOCHjCHa溶液中局部微粒浓度随溶液酸碱性变化如下图, 写出Na 2s 2O 5溶于水时主要反响的离子方程式为.(3)为测定产品的纯度,实验步骤依次如下:步骤1:准确称取20.00 g 产品于反响容器中,参加稍过量的 2 mol L_1的H 2SO 4溶液,蒸储;将 产生的SO 2用200.00 mL 0.500 0 mol L 1酸f I E KMnO 4溶液吸收,完全吸收后,加水稀释得到吸收液 250 mL .步骤2:准确量取25.00 mL 吸收液,用0.100 0 mol 广1的K 2c 2O 4标准溶液滴定,消耗 K 2c 2O 4 标准溶液48.00mL 0计算产品中焦亚硫酸钠(Na 2s 2O 5)的纯度(写出计算过程).19. (15分)实验室用红土馍矿(主要成分为NiS 、FeS CaS 和SiO 2等)为原料制备NiSO 4,6H 2.的流 程如下:稀硫酸 Ni% H2S打斗4 J ।做烧|f|酸浸阮国]f [复原1(过滤]f …f NiSO 」・6凡.浸小渣 )渣3液:① CaF 2难溶于水,NiSO 4易溶于水,不溶于乙醇;② Ni 溶于稀H 2SO 4.(1) “煨烧〞的目的是 .(2) “段烧〞得到的 M2O 3有强氧化性,“酸浸〞时有气体产生且馍被复原为Ni 2+,那么产生的气体为(填化学式),浸出渣的主要成分为 (填化学式).(3) “复原〞后得到的滤渣是单质馍、硫的混合物,请写出通入H 2s 气体时生成单质馍的离子方程式:.(4)检验“沉钙〞完全的操作为 .(5) NiSO 4质量分数随温度变化曲线如图,请补充流程中“过滤〞后得到NiSO 4 • 6H 2O 晶体的实, 6 ,一、一 ,,、…. ,一, _____ … ............ -1 一验万案:将滤渣 ,得到N1SO 4 - 6H 2O 晶体(实验中须使用的试剂有 1 mol L H 2SO 4,乙 醇).20. (14分)SO 2、NO 是大气污染物,NH 4NO 3、〞SO 4等是水体污染物,有效去除这些污染物是 一项重要课题.(1) NO 、SO 2可以先氧化,后用碱吸收.其氧化过程的反响原理如下:1NO(g) +O 3(g)^ ----------- N O 2(g)+O 2(g); AH 1 = — 200.9 kJ mol______ A・—1SO 2(g)+O 3(g)^ ----------- S O 3(g)+O 2(g); AH2=—241.6 kJ mol12SO 2(g) + O 2(g)^ ---------- 2SO 3(g); AH 3 = - 196.6 kJ mol那么反响 2NO 2(g)^=^2NO(g)+O 2(g)的 AH=kJ - mol 1°(2) 土壤中的硫循环如图 1所示,土壤中的黄铁矿(FeS2)在过程I 中会转化成硫酸亚铁和硫酸, 该过程发生的化学方程式为 ;某种反硫化细菌在过程n 中需要 有乳酸参与反响消耗硫酸,生成 H 2s 并伴有热量放出,那么乳酸除在反响中作复原剂外,还存在另 一作用并解释原因: .(3)电解法除去工业废水中的硝酸俊的装置示意图如图2所示,阴极电极反响式 为. (4)向恒容密闭容器中充入 1 mol NO 和2 mol O 3,发生如下反响:NO(g) + O 3(g)'- NO 2(g) + O 2(g); AH <0不同温度下反响相同时间后,体系中 NO 转化率随温度变化曲线如图3.温度低于100 C 时,NO 转化率随温度升高而增大的主要原因是 ;当温度高时,O 3分解生成活性极高的氧原子, NO 转化率随温度升高而降低,可能的原因有:①,②.21. (12分)【选做题】此题包括 A 、B 两小题,请选定其中一小题作答.假设多做,那么按 A 小题评分. A.[物质结构与性质]()N —??—As —() H阿散酸(OH)是一种饲料添加剂,能溶于Na 2CO 3溶液中.常含有H 3AsO 3、NaCl等杂质.O,电源—小,体 藉 祐阴离了MA气口阳离子交换膜言%次鞭膜HNO.-F7溶液节密谣0 0-000 0-8 6 4 2 1(或最:士学O Z(1) As 原子基态核外电子排布式为 .(2) CO £中央原子轨道的杂化类型为 , AsO1的空间构型为 (用文字描 述). (3)与As04一互为等电子体的分子为 (填化学式). (4) C 、N 、0三种元素的第一电离能由小到大的顺序为 .(5) NaCl 晶体在50〜300 GPa 的高压下和Na 或C12反响,可以形成不同的晶体.其中一种晶体 的晶胞如右图,该晶体的化学式为 .(8) 实验化学]实验室以扑热息痛(对乙酰氨基苯酚)为原料,经多步反响制甘素的流程如下:步骤I :非那西汀的合成1 .将含有1.0 g 扑热息痛的药片捣碎,转移至两颈烧瓶中.用滴管参加 8 mL 1 mol L :1 NaOH 的95%乙醇溶液.开启冷凝水,随后将烧瓶浸入油浴锅.搅拌,达沸点后继续回流 15 min .2 .将烧瓶移出油浴.如右图所示,用注射器取 1.0 mL 的碘乙烷,逐滴参加到热溶液中.继续将烧瓶置于油浴回流15 min .3 .将烧瓶从油浴中抬起,取下冷凝管趁热用砂芯漏斗抽滤.滤去不溶的淀粉(药片的填充物).将热滤液静置,得到沉淀.用另一个砂芯漏斗过滤得到非那西汀固体.步骤n :甘素的合成1 .将非那西汀固体转移到圆底烧瓶中,参加 5 mL 6 mol L11的盐酸.加热回流 15 min .2 .参加NaHCO 3调至pH 为6.0〜6.5,再向反响液中加1.37 g 尿素和2滴乙酸.加热回流60 min .3 .移出烧瓶,冷却,有沉淀析出,抽滤,用冰水洗涤,得到甘素. (1)将药片捣碎所用的仪器名称为 . (2)实验中用油浴加热的优点是 .(3)使用砂芯漏斗抽滤的优点是 且得到的沉淀较枯燥. (4)冷凝管的冷却水从 (填"a 〞或"b 〞)端进. (5)步骤n 中向热溶液中参加NaHCO 3中和,为防止大量 CO 2溢出,参加 NaHCO 3时应.扑热息痛2) CHjCHuT*非那西汀HCI(H «P---------> *甘素rcflu X(6)用冰水洗涤甘素固体的操作是.2021届高三模拟测试试卷〔苏北三市〕 化学参考答案及评分标准1. A2. C3. B4. B5. D6. C7. D8. C9. A 10. B 11. BD 12. C 13. A 14. CD 15. BC16. 〔12 分〕〔1〕加热或搅拌或适当增大硫酸浓度〔写一种〕〔2分〕 一 一 3十 一 2 (2) Fe+2Fe ===3Fe 〔2 分〕〔3〕① FeSO 4+2NH 4HCO 3===Fe 〔OH 〕2 J + 〔NH 4〕2SO 4+2CO 2T 〔2 分〕 ②140〔2分〕 (4) NaNO 2被复原为氮氧化物,污染空气 〔2分〕 〔5〕复原剂消耗完,空气进入使铁再次氧化 〔2分〕 17. 〔15 分〕〔1〕醒键、酰胺键〔或肽键〕〔2分〕18. 〔12 分〕(1) NH 3+CO2+H 2O+NaCl===NH 4Cl + NaHCO 3 J 〔2 分〕CO z 〔2 分〕 2 — .. 一 ,, (2) S 2O 2 +H 2O===2HSO 3〔2 分〕 ⑶ 由关系式:2MnO 4〜5c 2.、可得:步骤 2 中反响的 n 〔KMnO 4〕= 0.100 0 mol L 1X 48.00X 10 3 L X 2/5 = 1.92 X 10 3 mol 〔2 分〕 步骤 1 中反响的 n 〔KMnO 4〕=0.500 0 mol L 1 x 200X 10 3 L — 1.92x 10 3 mol x 10=8.08X10 2mol 〔2 分〕• 10 •HOOCILCH ;〔2〕取代反响〔2由关系式:Na2s2O5〜2SO2〜4/5MnO 4可得:220.000 g 广品中n〔Na2s2O5〕 =8.08X10 mol X 5/4 =0.101 mol〔1 分〕w〔Na2s2.5〕= 0.101 mol x190 g mol 1/20.00 g x 100% = 95.95% 〔1 分〕19.〔15 分〕〔1〕除去硫元素〔2分〕(2)O2〔2 分〕SiO2〔2 分〕(3)H2S+ Ni2===Ni J + 2H +S J 〔2 分〕〔4〕静置,向上层清液中继续滴加NiF2溶液,无白色沉淀生成,那么Ca2+已沉淀完全〔2分〕〔5〕〔溶于适当过量的1 mol L - 1H2SO4〕过滤〔1分〕;将滤液蒸发浓缩,降温至28 C结晶〔1分〕;趁热过滤〔1分〕;用乙醇洗涤〔1分〕,低温枯燥〔1分〕20.〔14 分〕(1)115.2〔2 分〕(2)2FeS2+ 7O2 + 2H2O===2FeSO4+2〞SO4〔2 分〕由于过程n 〔反硫化过程〕吸热,乳酸和硫酸反响放出的热量使温度升高促进了过程n 〔反硫化过程〕的进行〔2分〕(3)2NH 4 +2e ===2NH 3 T + H2 T 〔2 分〕〔4〕低于100 C时,相同时间内反响未到达平衡.温度升高,化学反响速率加快, NO转化率高〔2分〕温度高时,反响速率快,相同时间内已到达平衡,温度升高平衡左移发生反响NO2+O===NO + O2〔2 分〕21A. 〔12 分〕(1)[Ar]3d 104s24p3 或1s22s22p63s23p63d104s24p3〔2 分〕(2)sp2〔2分〕三角锥型〔2分〕⑶CCl4或SiF4等〔2分〕(4)CvOv N〔2 分〕(5)Na2cl〔2 分〕(218)〔12 分〕(219)〔2分〕(220)均匀,温度易于限制〔2分〕(221)速度〔2分〕(222)a〔2 分〕(223)次参加〔2分〕(224)滤器中参加冰水至刚刚没过固体,进行抽滤,再重复• 11 •〔2分〕2次〔2分〕。
2019年徐州市化学学业水平模拟试卷及答案

2019年徐州市学业水平第一次模拟考试化 学注意事项:1. 本试卷满分100分,考试时间75分钟。
2. 答题前,考生务必将自己的学校、班级、姓名写在密封线内。
可能用到的相对原子质量:H —1 C —12 N —14 O —16 Mg —24 S —32 C —35.5 Fe —56 Cu —64一、 单项选择题(本部分23题,每题3分,共69分。
每题只有一个选项符合题意) 1. 化学对社会发展与进步产生着巨大的贡献。
德国化学家哈伯(F.Haber)的重要贡献是( )A. 实验证实了夸克的存在B. 发现了黄绿色气体氯气C. 开发了合成氨的生产工艺D. 提出了蛋白质分子的螺旋结构模型 2. 下列过程属于化学变化的是( ) A. 过滤 B. 分液 C. 裂化 D. 蒸馏 3. 人工放射性核素131 53I 在核医学领域中有重要的用途。
该原子的中子数是( ) A. 53 B. 78 C. 131 D. 1844. 工业上制取高纯度硅的反应之一为SiCl 4+2H 2=====高温Si +4HCl 。
该反应属于( ) A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应 5. 下列化学用语表示正确的是( ) A. 葡萄糖的分子式:C 12H 22O 11B. CaCl 2的电子式:[··Cl ······]-Ca 2+[··Cl ······]-C. F -的结构示意图:D. 氯化铵的电离方程式:NH 4Cl===NH 3+HCl6. 下列气体可用右图所示方法干燥的是( ) A. CO 2 B. Cl 2 C. NH 3 D. SO 27. 下列物质属于共价化合物的是( ) A. H 2 B. Na 2OC. CH4D. KOH2SO3的说法不正确的是()8. 下列关于反应2SO2+O2催化剂高温A. 升高温度能加快反应速率B. 使用催化剂能加快反应速率C. 增大O2浓度能加快反应速率D. 反应中SO2和SO3的物质的量之和变小9. 下列物质的俗名与化学式对应正确的是()A. 苏打——Na2CO3B. 冰晶石——CaF2C. 石膏——MgSO4D. 水玻璃——SiO210. 在含有大量H+、Fe3+、SO2-4的溶液中,还可能大量共存的离子是()A. NO-3B. Ba2+C. CO2-3D. AlO2-211. 尿素[CO(NH2)2]是一种氮肥,它属于()A. 酸B. 碱C. 盐D. 有机物12. 下列关于碳酸钠的说法正确的是()A. 受热易分解B. 水溶液呈碱性C. 不与碱反应D. 具有漂白性13. 下列装置能达到实验目的的是()错误!错误!错误!错误!错误!,B. 测氯水的pH)错误!错误!,C. 除Cl2中HCl)),\s\do5(D. 蒸发NaCl溶液))14. 下列说法正确的是()A. 乙醇属于烃类化合物B. 苯能发生取代反应C. 乙酸能发生银镜反应D. 纤维素遇碘水变蓝15. 关于反应4Fe(OH)2+O2+2H2O===4Fe(OH)3,下列说法正确的是()A. O2发生还原反应B. Fe(OH)2被还原C. H2O发生氧化反应D. H2O是氧化剂16. 下列溶液不能与Ba(OH)2反应的是()A. 氯化钠溶液B. 硫酸铜溶液C. 硝酸铁溶液D. 氯化铵溶液17. 下列反应的离子方程式书写正确的是()A. 醋酸溶液与氢氧化钠溶液反应:H++OH-===H2OB. 碳酸钙跟盐酸反应:CO2-3+2H+===CO2↑+H2OC. 铜与稀硝酸反应:3Cu+8H++2NO-3===3Cu2++2NO↑+4H2OD. 铁与氯化铁溶液反应:2Fe+Fe3+===3Fe2+18. 下列反应吸收热量的是()A. 氧化钙与水反应B. 焦炭制水煤气C. 酸碱中和反应D. 钠与水反应 19. 下列实验方案能达到目的的是( ) A. 用品红溶液检验SO 2B. 用焰色反应鉴别KNO 3和KClC. 用澄清石灰水鉴别MgCl 2溶液和NaHCO 3溶液D. 用丁达尔效应区分FeCl 3溶液和Fe 2(SO 4)3溶液20. 某原电池装置如右图所示,下列说法正确的是( ) A. Fe 作正极B. 碳棒上有O 2生成C. 可将电能转化为化学能D. 电子从Fe 经导线流向碳棒21. 下列有机反应属于加成反应的是( ) A. 2CH 3CH 2OH +O 2――→Cu△2CH 3CHO +2H 2O B. CH 2===CH 2+Br 2―→CH 2BrCH 2BrC. CH 3COOH +CH 3CH 2OH ――→浓硫酸△CH 3COOCH 2CH 3+H 2O D. CH 4+Cl 2――→光照CH 3Cl +HCl22. X 、Y 、Z 、Q 、W 是原子序数依次增大的短周期主族元素,X 的原子序数等于其电子层数,Y 的原子最外层电子数是其电子层数的2倍,Z 在同周期的主族元素中原子半径最大,元素Q 的单质可被用作输电的导线,W 单质在常温下呈气态。
江苏省徐州市2019届高三第三次调研测试化学试题(word版,无答案)
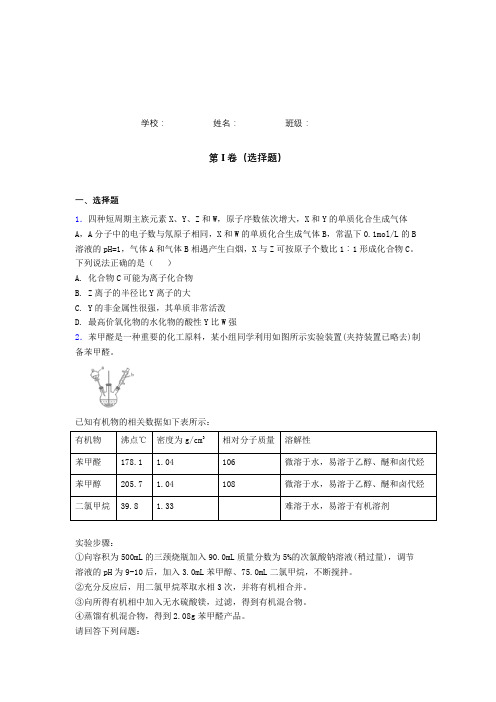
学校:__________ 姓名:__________ 班级:__________第I卷(选择题)一、选择题1.四种短周期主族元素X、Y、Z和W,原子序数依次增大,X和Y的单质化合生成气体A,A分子中的电子数与氖原子相同,X和W的单质化合生成气体B,常温下0.1mol/L的B 溶液的pH=1,气体A和气体B相遇产生白烟,X与Z可按原子个数比1︰1形成化合物C。
下列说法正确的是()A. 化合物C可能为离子化合物B. Z离子的半径比Y离子的大C. Y的非金属性很强,其单质非常活泼D. 最高价氧化物的水化物的酸性Y比W强2.苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。
已知有机物的相关数据如下表所示:实验步骤:①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9-10后,加入3.0mL苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到2.08g苯甲醛产品。
请回答下列问题:(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作,可能造成的后果是______。
(4)步骤②中,应选用的实验装置是___(填序号),该操作中分离出有机相的具体操作方法是___。
(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。
3.现有a、b、c、d四种金属,把a、b用导线连接后同时浸入稀硫酸溶液中,a极上有气泡;把c、d用导线连接后同时浸入稀盐酸溶液中,d极发生还原反应;把a、c用导线连接后同时浸入稀硫酸溶液中,电子流动方向为a→导线→c。
2019年江苏省苏北三市(徐州、淮安、连云港)高考化学一模试卷
2019年江苏省苏北三市(徐州、淮安、连云港)高考化学一模试卷一、单项选择题:本题包括10小题,每小题2分,共计20分.每小题只有一个选项符合题意.1.(2分)2018年10月,中国美丽乡村百家范例经验交流会在我省举办。
下列做法不应该提倡是()A.秸秆就地露天焚烧B.生活垃圾资源化利用C.消除农村黑臭水体D.推广使用可降解塑料2.(2分)用化学用语表示Na2O+2HCl═2NaCl+H2O中的相关微粒,其中正确的是()A.中子数为18的氯原子:ClB.Na2O的电子式:C.H2O的结构式:D.Na+的结构示意图:3.(2分)下列有关物质性质与用途具有对应关系的是()A.Al具有良好的导电性,可用于制铝箔B.Fe2O3粉末呈红色,可用于制颜料、油漆C.NaClO溶液显碱性,可用于杀菌、消毒D.HNO3有酸性,可用于洗涤附有银镜的试管4.(2分)室温下,下列各组离子在指定溶液中能大量共存的是()A.0.1 mol•L﹣1 NaHCO3溶液:K+、Al3+、NO3﹣、SO42﹣B.使蓝色石蕊试纸变红的溶液:Mg2+、Na+、SO42﹣、NO3﹣C.滴加KSCN溶液显红色的溶液:NH4+、K+、Cl﹣、I﹣D.由水电离产生的c(H+)=1×10﹣12 mol•L﹣1的溶液:NH4+、Ca2+、Cl﹣、AlO2﹣5.(2分)下列关于Cl2的制备、净化、收集及尾气处理的装置和原理能达到实验目的是()A.用装置甲制备Cl2B.用装置乙除去Cl2中的HClC.用装置丙收集Cl2D.用装置丁吸收尾气6.(2分)下列有关物质性质的叙述不正确的是()A.Na2O2与CO2反应生成O2B.铁片投入到冷的浓硫酸中,发生钝化C.NH4Cl溶液中滴加酚酞溶液,溶液变红D.AlCl3溶液中加入足量氨水,生成Al(OH)37.(2分)下列指定反应的离子方程式正确的是()A.KClO3溶液和浓盐酸反应:ClO3﹣+Cl﹣+6H+═Cl2↑+3H2OB.NaHSO3溶液和NaClO溶液混合:HSO3﹣+ClO﹣═HClO+SO32﹣C.酸性KMnO4溶液和双氧水混合:2MnO4﹣+5H2O2═2Mn2++5O2↑+6OH﹣+2H2O D.NaHCO3溶液加入少量的Ca(OH)2溶液:Ca2++2OH﹣+2HCO3﹣═CaCO3↓+CO32﹣+2H2O8.(2分)短周期主族元素X、Y、Z、W原子序数依次增大,X位于第ⅣA族,Y元素原子最外层电子数是次外层的3倍,Z原子半径为同周期中最大,W与Y同主族。
江苏省徐州市2019届高三考前模拟检测化学试卷(PDF版)
徐州市2018~2019学年度高三年级考前模拟检测化学试题可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Fe 56 Cu 64 I 127选择题单项选择题:本题包括10小题,每小题2分,共计20分。
每小题只有一个选项符合题意。
1.化学与生产、生活密切相关。
下列说法不正确的是A.对生活废弃物进行分类回收B.用聚乙烯生产快餐盒可降低白色污染C.生活污水无害化处理后用于绿化灌溉D.大力发展新型能源,减少对化石能源的依赖2.下列有关化学用语的表示正确的是A .过氧化氢的电子式:B .硫离子的结构示意图:C.中子数为16的磷原子:3116PD .对硝基苯甲醛的结构简式:3.下列有关物质性质与用途具有对应关系的是A.晶体硅的硬度大,可用作半导体材料B.氧化镁熔点很高,可用于耐高温材料C.乙烯具有可燃性,可用作果实的催熟剂D.次氯酸有酸性,可用于自来水的杀菌消毒4.室温下,下列各组离子在指定溶液中能大量共存的是A .无色透明的溶液中:K +、NH 4+、S 2-、ClO -B .与Al 反应能产生H 2的溶液中:Na +、Cu 2+、NO 3-、I -C .使甲基橙变红的溶液:Na +、NH 4+、SO 32-、Cl -D .c (H +)/c (OH-)=1×10-12的溶液:K+、AlO 2-、CO 32-、Na +5.下列有关利用Cl 2制备KClO 的实验原理和装置能达到实验目的的是甲 乙 丙 丁A .用装置甲制备Cl 2B .用装置乙除去Cl 2中的HClC .用装置丙制备KClOD .用装置丁吸收尾气6.下列有关物质性质的叙述正确的是A .氯气可使品红溶液褪色B .电解熔融的氯化铝制备铝C .硫在过量氧气中燃烧生成SO 3D .铁和过量硝酸反应生成Fe(NO 3)27.下列指定反应的离子方程式正确的是A .向FeBr 2溶液中通入过量Cl 2:2Br -+Cl 2=Br 2+2Cl -B .用铜电极电解CuSO 4溶液:2Cu 2++2H 2O 通电 2Cu +4H ++O 2↑C .向Fe(OH)3胶体中加入HI 溶液:Fe(OH)3+3H +=Fe 3++3H 2OD .向新制Cu(OH)2悬浊液中加入CH 3CHO 溶液并加热:CH 3CHO +2Cu(OH)2+OH -加热CH 3COO -+Cu 2O ↓+3H 2O8.短周期主族元素 X 、Y 、Z 、W 原子序数依次增大,X 的一种同位素原子质量数为1,X 、Z 同主族,二者的原子序数之和是Y 原子序数的1.5倍。
精选江苏省连云港市、徐州市、宿迁市2018-2019学年高三下学期第三次模拟考试化学试题word版附参考答案
苏北三市2019届高三年级第三次模拟考试化学试卷化学可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5Mn:55单项选择题:本题包括10小题,每小题2分,共计20分。
每小题只有一个....选项符合题意。
1. 液态或固态氢在超高压下解离成氢原子,氢原子像金属原子一样堆积在一起变成导电体,故称为“金属氢”。
下列关于“金属氢”的说法不正确...的是( )A. 不能与氧气反应B. 储有巨大能量C. 是氢的一种同素异形体D. 内部存在自由移动的电子2. 下列有关化学用语表示正确的是( )A. 中子数为8的氮原子:158NB. 乙醇的实验式:C2H6OC. 氯化镁的电子式:∶Cl,∶Mg∶Cl,∶D. 硫原子的结构示意图:3. 下列有关物质的性质与用途具有对应关系的是( )A. 氧化铁能与酸反应,可用于制作红色涂料B. SO2具有漂白性,可在白葡萄酒中微量添加C. 钠钾合金硬度小,可用作原子反应堆的导热剂D. 酒精能使蛋白质变性,可在医疗上用来杀菌消毒4. 短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的最高正价与最低负价的代数和为2,Y是地壳中含量最多的元素,Z原子的最外层电子数是Y原子的最外层电子数的一半,W与Y同主族。
下列说法正确的是( )A. 原子半径:r(X)<r(Y)<r(Z)<r(W)B. 由X、Y组成的化合物只有两种C. W的简单气态氢化物的热稳定性比Y的弱D. Q、Z的简单离子具有相同的电子层结构5. 下列指定反应的离子方程式正确的是( )A. Cl2通入水中:Cl2+H2O2H++Cl-+ClO-B. 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO-3===Ag++NO↑+H2OC. 用KIO3氧化酸性溶液中的KI:5I-+IO-3+3H2O===3I2+6OH-D. 向明矾溶液中逐滴加入Ba(OH)2溶液至SO2-4离子恰好沉淀完全:Al3++2SO2-4+2Ba2++4OH-===2BaSO4↓+AlO-2+2H2O6. 下列装置是用于实验室二氧化硫的制取、检验、收集、尾气处理,不能达到相应实验目的是( )甲乙丙丁A. 用装置甲制取二氧化硫B. 用装置乙检验二氧化硫的漂白性C. 用装置丙收集二氧化硫D. 用装置丁进行尾气处理7. 常温下,下列各组离子一定能在指定溶液中大量共存的是( )A. 0.1 mol ·L -1 FeCl 3溶液:K +、NH +4、I -、SO 2-4B. 使酚酞变红色的溶液:Na +、Al 3+、NO -3、Cl -C. 0.1 mol ·L -1 NH 4HCO 3溶液:K +、Na +、NO -3、Cl -D. 由水电离的c (H +)=1×10-13mol ·L -1的溶液:Mg 2+、Ca 2+、NO -3、ClO -8. 以下反应均可生成O 2。
【精品高考化学】2019年江苏省高考化学三模试卷+答案
2019年江苏省高考化学三模试卷一、单项选择题:本题包括10小题,每小题2分,共20分.每小题只有一个选项符合题意.1.(2分)2018年世界环境日主题为“塑战速决”。
下列做法不应该提倡的是( ) A .使用布袋替代一次性塑料袋购物 B .焚烧废旧塑料以防止“白色污染” C .用CO 2合成聚碳酸酯可降解塑料 D .用高炉喷吹技术综合利用废塑料 2.(2分)用化学用语表示C 2H 2+HCl →150~160℃HgCl 2C 2H 3Cl (氯乙烯)中的相关微粒,其中正确的是( )A .中子数为7的碳原子:67CB .氯乙烯的结构简式:CH 2CHClC .氯离子的结构示意图:D .HCl 的电子式:3.(2分)下列有关物质的性质与用途具有对应关系的是( ) A .Al 2O 3的熔点很高,可用作耐火材料B .NH 3具有还原性,可用作制冷剂C .SO 2具有氧化性,可用于纸浆的漂白D .钠钾合金的密度小,可用作快中子反应堆的热交换剂4.(2分)常温下,下列各组离子在指定溶液中能大量共存的是( ) A .使pH 试纸显蓝色的溶液中:Na +、Mg 2+、ClO ﹣、HSO 3﹣B .c (Fe 3+)=0.1 mol •L ﹣1的溶液中:K +、NH 4+、SO 42﹣、SCN ﹣C .Kw c(OH )=0.1 mol •L﹣1的溶液中:Na +、HCO 3﹣、K +、NO 3﹣D .0.1 mol •L﹣1的NaHCO 3溶液中:NH 4+、NO 3﹣、Na +、SO 42﹣5.(2分)实验室用Ca 与H 2反应制取氢化钙(CaH 2)。
下列实验装置和原理不能达到实验目的是()A.装置甲制取H2B.装置乙净化干燥H2C.装置丙制取CaH2D.装置丁吸收尾气6.(2分)下列指定反应的离子方程式正确的是()A.用过氧化氢从酸化的海带灰浸出液中提取碘:2I﹣+H2O2═I2+2OH﹣B.过量的铁粉溶于稀硝酸:Fe+4H++NO3﹣═Fe3++NO↑+2H2OC.用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O32﹣+5H2O═10H++2SO42﹣+8Cl﹣D.向NaAlO2溶液中通入过量CO2:2AlO2﹣+CO2+3H2O═2Al(OH)3↓+CO32﹣7.(2分)以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
徐州市2018~2019学年度高三年级考前模拟检测化学试题可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Fe 56 Cu 64 I 127选择题单项选择题:本题包括10小题,每小题2分,共计20分。
每小题只有一个选项符合题意。
1.化学与生产、生活密切相关。
下列说法不正确的是A.对生活废弃物进行分类回收B.用聚乙烯生产快餐盒可降低白色污染C.生活污水无害化处理后用于绿化灌溉D.大力发展新型能源,减少对化石能源的依赖2.下列有关化学用语的表示正确的是A .过氧化氢的电子式:B .硫离子的结构示意图:C.中子数为16的磷原子:3116PD .对硝基苯甲醛的结构简式:3.下列有关物质性质与用途具有对应关系的是A.晶体硅的硬度大,可用作半导体材料B.氧化镁熔点很高,可用于耐高温材料C.乙烯具有可燃性,可用作果实的催熟剂D.次氯酸有酸性,可用于自来水的杀菌消毒4.室温下,下列各组离子在指定溶液中能大量共存的是A .无色透明的溶液中:K +、NH 4+、S 2-、ClO -B .与Al 反应能产生H 2的溶液中:Na +、Cu 2+、NO 3-、I -C .使甲基橙变红的溶液:Na +、NH 4+、SO 32-、Cl -D .c (H +)/c (OH-)=1×10-12的溶液:K+、AlO 2-、CO 32-、Na +5.下列有关利用Cl 2制备KClO 的实验原理和装置能达到实验目的的是甲 乙 丙 丁A .用装置甲制备Cl 2B .用装置乙除去Cl 2中的HClC .用装置丙制备KClOD .用装置丁吸收尾气6.下列有关物质性质的叙述正确的是A .氯气可使品红溶液褪色B .电解熔融的氯化铝制备铝C .硫在过量氧气中燃烧生成SO 3D .铁和过量硝酸反应生成Fe(NO 3)2 7.下列指定反应的离子方程式正确的是A .向FeBr 2溶液中通入过量Cl 2:2Br -+Cl 2=Br 2+2Cl -B .用铜电极电解CuSO 4溶液:2Cu 2++2H 2O 通电 2Cu +4H ++O 2↑C .向Fe(OH)3胶体中加入HI 溶液:Fe(OH)3+3H +=Fe 3++3H 2OD .向新制Cu(OH)2悬浊液中加入CH 3CHO 溶液并加热:CH 3CHO +2Cu(OH)2+OH 加热CH 3COO -+Cu 2O ↓+3H 2O8.短周期主族元素 X 、Y 、Z 、W 原子序数依次增大,X 的一种同位素原子质量数为1,X 、Z 同主族,二者的原子序数之和是Y 原子序数的1.5倍。
W 原子最外层电子数比电子层数多3。
下列说法正确的是A .原子半径:r (Z )>r (X)>r (Y)B .X 、Y 、W 都可与Z 组成离子化合物C .Z 的最高价氧化物的水化物是一种弱碱D .Y 的简单气态氢化物的热稳定性比W 的弱9.在给定条件下,下列选项所示的物质间转化均能实现的是O 2 高温 A .FeS 2 SO 3 H 2SO 4 H 2O B . 盐酸 △SiCl 4 △ H 2SiO 3 SiO 2 NH 3、CO 2 BaSO 4(s) D . BaCO 3(s) BaCl 2(aq) Na 2SO 4(aq)C 6H 5ONa C . C 6H 5OH Na 2CO 3(aq) 盐酸 CO 210.下列说法正确的是A .铅蓄电池放电时的正极和充电时的阳极均发生氧化反应B .反应NH 3(g)+ HI(g)=NH 4I(s)在低温下可自发进行,则△H >0C .2 mol SO 2与1 mol O 2混合反应生成SO 3,转移电子的数目小于4×6.02×1023D .一定温度下,增大反应BaCO 3(s)BaO(s)+CO 2(g)容器的体积,平衡不移动 不定项选择题:本题包括5小题,每小题4分,共计20分。
每小题只有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得满分,但只要选错一个,该小题就得0分。
11.潘红、梦那红是常用的食品着色剂的主要成分,其结构如下图所示。
O OCOC 5H 11O O 红斑素O 红曲素 红斑素O O COC 5H 11O O 红曲素潘红 梦那红下列说法正确的是A .梦那红分子中至少含有三个手性碳原子B .潘红分子中所有碳原子一定在同一平面上C .潘红、梦那红均能使溴水或KMnO 4溶液褪色D .1 mol潘红最多能与5 mol H 2发生加成反应1213.根据下列图示所得出的结论不正确的是甲 乙 丙 丁A .图甲是2A(g)+B(g)2C(g) 的A 平衡转化率与温度、压强变化曲线,说明压强P 1<P 2B.图乙是MgCl2·6H2O在空气中加热时固体质量随时间的变化曲线,说明最终固体为MgCl2C.图丙是室温下V0 mL 0.10 mol·L-1MOH加水稀释至VmL,pH随lg的变化曲线,说明MOH是强碱D.图丁是HA、HB溶液稀释过程中导电能力变化曲线,说明HA酸性小于HB14.常温下,用0.1 mol·L-1盐酸或0.1 mol·L-1NaOH分别滴定10 mL 0.1mol·L-1NaH2PO4溶液,溶液的pH随加入盐酸或氢氧化钠溶液的体积变化曲线如图所示。
下列说法中正确的是A.0.1 mol·L-1H3PO4溶液的pH=1.5,0.1 mol·L-1Na3PO4溶液的pH=12B.0.1mol·L-1NaH2PO4溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-)C.V(HCl)=5mL时:c(Na+)+ c(H+ )>c(OH-)+3c(PO43-)+2c(HPO42-)+c(H2PO4-)D.V(NaOH)=20mL时:c(Na+)+c(OH-)=c(H+ )+3c(PO43-)+4c(HPO42-)+5c(H2PO4-)+6c(H3PO4)15.在三个容积均为1 L的恒容密闭容器中发生反应:H2(g)+CO2(g)HCOOH(g),下A.该反应为放热反应B.达平衡时,容器Ⅱ中H2的浓度大于容器Ⅰ中H2浓度的2倍C.达平衡时,容器Ⅱ中HCOOH的转化率与容器Ⅲ中CO2的转化率之和小于1D.容器Ⅰ达到平衡后保持其他条件不变,向平衡体系中再加入0.2mol CO2、0.2mol HCOOH(g),则反应向正反应方向进行非选择题16.(12分)利用磷精矿[主要成分为Ca5(PO4)3OH,还含有Ca5(PO4)3F和有机碳等]湿法制备磷酸的一种工艺流程如下:…42磷石膏(1)酸浸时,磷精矿中Ca 5(PO 4)3F 所含氟转化为HF ,该反应的化学方程式为 ▲ 。
(2)H 2O 2可将粗磷酸中的有机碳氧化为CO 2脱除,但要控制温度在80℃左右,其原因是 ▲ 。
(3)脱硫时,CaCO 3稍过量,充分反应后仍有SO 42-残留,原因是 ▲ ;加入BaCO 3可进一步提高脱硫效率,其离子方程式是 ▲ 。
(4)用碳作还原剂可以将磷石膏中的CaSO 4还原,所得SO 2可用于工业生产硫酸。
在不同的温度下,添加CaCl 2焙烧2.5h 对CaSO 4转化率的影响如右图。
CaCl 2的作用是 ▲ ;当温度高于1200 ℃时,无论有无CaCl 2,CaSO 4的转化率趋于相同,其原因是 ▲ 。
17.(15分)化合物G 是合成洛沙坦药物的中间体,其合成路线流程图如下:(1)B 中的含氧官能团名称为 ▲ 和 ▲ 。
(2)B→C 的反应类型为 ▲ 。
(3)写出同时满足下列条件的C 的一种同分异构体的结构简式: ▲ 。
①分子中有一个手性碳原子; ②能与FeCl 3溶液发生显色反应;③能发生银镜反应。
(4)D 的分子式为C 12H 15NO 2 ,其结构简式为 ▲ 。
(5)写出以、(CH 3)2SO 4和CH 2BrCH 2MgBr 为原料制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
18.(12分)抗坏血酸(C6H8O6)和柠檬酸(C6H8O7)常用于饮料添加剂。
为测定仅含这两种有机酸某饮料样品中抗坏血酸和柠檬酸的含量,进行以下实验。
(1)取50.00 mL样品溶液于锥形瓶中,加入25 mL 1 mol·L-1 HCl和2 mL 0.5 %的淀粉溶液,用0.010 mol·L-1的KIO3溶液滴定至终点,消耗KIO3溶液10.00 mL,滴定过程中发生反应:3C6H8O6+IO3―=3C6H6O6 +I-+ 3H2O。
(已知:5I-+ IO3―+6H+=3I2+ 3H2O)①滴定终点的现象为▲ 。
②据此计算样品中C6H8O6的物质的量浓度为▲ 。
(2)取25.00 mL样品溶液于锥形瓶中,加入2~3滴酚酞指示剂,用0.010 mol·L-1的NaOH溶液滴定至无色变为微红色(已知:1 mol抗坏血酸消耗1 mol NaOH)达到滴定终点,消耗了20.00 mL。
已知一个柠檬酸分子中含有三个羧基,则柠檬酸与氢氧化钠反应的物质的量之比为▲ 。
样品中柠檬酸的含量为多少mg/100mL。
(写出计算过程)19.(15分)工业上用低品铜矿(主要含CuS、FeO等)制备氯化亚铜(CuC1)的一种工艺流程如下:②“氧化”时,NH4NO3中N元素主要被还原为最低价态,少部分被还原为NO。
(1)“氧化”阶段的温度需控制在65 ℃,其适宜的加热方式▲ ;该步骤中FeO被NH4NO3氧化,写出主要反应的离子方程式▲ 。
(2)在实验室进行实验时,“氧化”阶段反应可在如图所示装置中进行:①实验开始时,温度计显示反应液温度低于室温,主要原因是▲ 。
②通入氧气的目的是▲ ;为便于观察和控制产生O2的速率,制备氧气的装置最好选用▲ (填字母)。
A B C(3)已知pH对CuCl沉淀率的影响如图所示,请设计从“过滤Ⅱ”所得的滤液中获取CuCl的实验方案:▲ 。
(实验中必须使用的试剂有:NaCl溶液、Na2SO3溶液、NaOH溶液、95%乙醇)。
20.(14分)醋酸不仅是重要的调味品还是重要的化工原料。
(1)醋酸的传统制法是乙醇在醋酸菌作用下被空气氧化。
已知:CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H1=-1366.8kJ·mol-1CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H2=-870.3kJ·mol-1则CH3CH2OH(l)+O2(g)=CH3COOH(l)+H2O(l)的△H= ▲ 。
