(大学物理课件)气体动理论
合集下载
大学物理气体动理论

气体分子之间的相互作用力产生的势能, 由于气体分子之间的距离非常大,因此气 体分子的势能通常可以忽略不计。
分子动理论的基本假设
分子之间无相互作用力
气体分子之间不存在相互作用的力,它们之间只 存在微弱的范德华力。
分子运动速度服从麦克斯韦分布
气体分子的运动速度服从麦克斯韦分布,即它们 的速度大小和方向都是随机的。
分子碰撞的统计规律
分子碰撞的随机性
01
气体分子之间的碰撞是随机的,碰撞事件的发生和结果都是随
机的。
分子碰撞频率
02
单位时间内分子之间的碰撞次数与分子数密度、分子平均速度
和分子碰撞截面有关。
碰撞结果的统计规律
03
碰撞后分子的速度方向和大小的变化遵循一定的统计规律,可
以用概率密度函数来描述。
热现象的统计解释
大学物理气体动理论
• 引言 • 气体动理论的基本概念 • 气体动理论的基本定律 • 气体动理论的统计解释 • 气体动理论的应用 • 结论
01Biblioteka 引言主题简介气体动理论
气体动理论是通过微观角度研究气体 运动状态和变化的学科。它以分子运 动论为基础,探究气体分子运动的规 律和特性。
分子模型
气体动理论中,将气体分子视为弹性 小球,相互之间以及与器壁之间发生 弹性碰撞。通过建立分子模型,可以 更好地理解气体分子的运动特性。
对未来研究的展望
随着科学技术的发展,气体动理 论仍有很大的发展空间和应用前
景。
未来研究可以进一步探索气体分 子间的相互作用和气体在极端条 件下的行为,例如高温、高压或
低温等。
气体动理论与其他领域的交叉研 究也将成为未来的一个重要方向, 例如与计算机模拟、量子力学和
《大学基础物理学》农科用教材自作ppt课件-02气体动理论

5.掌握理想气体的压强公式,了解理想气体压强公式的 物理意义;通过推导气体压强公式,了解从提出模型、进 行统计平均、建立宏观量与微观量的联系到阐明宏观量的 微观本质的思想和方法;了解系统的宏观性质是微观运动 的统计表现; 6*.了解分子平均碰撞频率及平均自由程的概念;
海 南 大 学
远
第二章 气体动理论( Kinetic theory of gases ) 教学重点内容
3. Van der Waals equation(范德瓦尔斯 方程)
海 纳 百 川
a ( p 2 )(V b) RT V
范德瓦尔斯等温线与实际气体 等温线颇为相似,修正是成功的. 在临界等温线以上,二者很接 近,并且温度愈高二者愈趋于 一致。但在临界等温线以下, 二者有明显的区别.因此,范德 瓦尔斯方程仍不完善. 因为此项工作,获得了1910 年诺贝耳物理学奖.
第二章 气体动理论
大 道
(Kinetic theory of gases)
致 远
海 南 大 学
第二章 气体动理论( Kinetic theory of gases )
Introduction
海 纳 百 川 大
In various matter states, the property of gas is simple relatively. But, Gas is very important in biology and agriculture. In this chapter, we will study macroscopic properties of gas and its statistic law. Statistic method willed be adopted.
第十二章 气体动理论
1 3 2 m v kT 2 2
v
2
v
2
3 RT 3kT M m
可见,在温度相同的情况下,分子质量大 13. 的气体,其方均根速率小. 七、道尔顿分压定律 在温度T一定的条件下,密闭容器中混合气 体(无化学反应)的总压强,等于各气体分压强 之和. 即 p p1 p2 pm 证明: T1 T2 Tm T
2 x
2 p nm v x
2 p nE t 3
1 Et mv 2 2
1 2 1 2 nm v n( m v 2 ) 3 3 2
10.
注意:这里m 为一个分子的质量; n为分子数密度.
称为气体分子的平均平动动能
物理意义:气体的压强是大量分子对器壁碰撞 的统计平均效应. 微观量的统计平均值 E t 及分 子数密度n越大,则气体压强p越大. (如雨点打雨伞) 注意: 1.)n太小或太大时,压强公式不成立; 2.)理想气体压强公式是统计规律,而不 是力学规律.
v v v v 1 2 2 2 2 v x v y vz v 3 2 为所有分子速率 v
2 2 x 2 y 2 z
平方的平均值
三、理想气体压强公式 设第i组分子的速度在vi~vi+dvi区间内 以ni表示第i组分子的分子数密度 总的分子数密度为n=n1+n2+· · · +ni+· · · 设 器壁上面积dA 的法向为 x 轴
1.
§ 12-1 分子运动论的基本概念及研究方法
(The Basic Concept and The Research Method for Molecular Kinematical Theory)
2.
v
2
v
2
3 RT 3kT M m
可见,在温度相同的情况下,分子质量大 13. 的气体,其方均根速率小. 七、道尔顿分压定律 在温度T一定的条件下,密闭容器中混合气 体(无化学反应)的总压强,等于各气体分压强 之和. 即 p p1 p2 pm 证明: T1 T2 Tm T
2 x
2 p nm v x
2 p nE t 3
1 Et mv 2 2
1 2 1 2 nm v n( m v 2 ) 3 3 2
10.
注意:这里m 为一个分子的质量; n为分子数密度.
称为气体分子的平均平动动能
物理意义:气体的压强是大量分子对器壁碰撞 的统计平均效应. 微观量的统计平均值 E t 及分 子数密度n越大,则气体压强p越大. (如雨点打雨伞) 注意: 1.)n太小或太大时,压强公式不成立; 2.)理想气体压强公式是统计规律,而不 是力学规律.
v v v v 1 2 2 2 2 v x v y vz v 3 2 为所有分子速率 v
2 2 x 2 y 2 z
平方的平均值
三、理想气体压强公式 设第i组分子的速度在vi~vi+dvi区间内 以ni表示第i组分子的分子数密度 总的分子数密度为n=n1+n2+· · · +ni+· · · 设 器壁上面积dA 的法向为 x 轴
1.
§ 12-1 分子运动论的基本概念及研究方法
(The Basic Concept and The Research Method for Molecular Kinematical Theory)
2.
大学物理-气体动理论
为漏气,经过若干时间后,压力降到原来的 5 8 ,温度降到 270c。
求: (1) 容器的容积,
(2) 漏去了多少氧气?
解: (1)
pv M RT
VM P RT8.21(升)
(2) 设漏气后的压力、温度、质量分别为 p' T' M'
p'V M' RT'
M' p'V0.06K 7 g
RT'
M 0 .1 0 0 .0 6 0 .0 7 K 3 3 g
平衡态: 在不受外界影响的条件下,一个系统的宏观性质不随时间
改变的状态。热动平衡
平衡过程:气体从一个状态变化到另一个状态,其间所经历的
过渡方式称为状态变化的过程.
如果过程所经历的所有中间状态都无限接近平衡状态,
该过程称为平衡过程.
2020/5/2
2
二、状态参量:
1、气体所占的体积 V: m 3
2、压强 P:
总的分子数密度为
n
n i
i
设 dA 法向为 x 轴
dA
一次碰撞单分子动量变化
vi dt
2 mvix
x 在 dt 时间内与dA碰撞的分子数
2020/5/2
ni vix dt dA 斜柱体体15积
dt 时间内传给 dA 的冲量为
dI = 2 mnivix2 dt dA
(vix>0)vx2= Nhomakorabeai
ni
vxi2
第三章 气体动理论
理想气体状态方程
麦克斯韦速率分布律
气体动理论的压强公式 玻耳兹曼分布律
气体动理论的温度公式
能量均分定理
2020/5/2
1
求: (1) 容器的容积,
(2) 漏去了多少氧气?
解: (1)
pv M RT
VM P RT8.21(升)
(2) 设漏气后的压力、温度、质量分别为 p' T' M'
p'V M' RT'
M' p'V0.06K 7 g
RT'
M 0 .1 0 0 .0 6 0 .0 7 K 3 3 g
平衡态: 在不受外界影响的条件下,一个系统的宏观性质不随时间
改变的状态。热动平衡
平衡过程:气体从一个状态变化到另一个状态,其间所经历的
过渡方式称为状态变化的过程.
如果过程所经历的所有中间状态都无限接近平衡状态,
该过程称为平衡过程.
2020/5/2
2
二、状态参量:
1、气体所占的体积 V: m 3
2、压强 P:
总的分子数密度为
n
n i
i
设 dA 法向为 x 轴
dA
一次碰撞单分子动量变化
vi dt
2 mvix
x 在 dt 时间内与dA碰撞的分子数
2020/5/2
ni vix dt dA 斜柱体体15积
dt 时间内传给 dA 的冲量为
dI = 2 mnivix2 dt dA
(vix>0)vx2= Nhomakorabeai
ni
vxi2
第三章 气体动理论
理想气体状态方程
麦克斯韦速率分布律
气体动理论的压强公式 玻耳兹曼分布律
气体动理论的温度公式
能量均分定理
2020/5/2
1
大学物理《气体动理论(5学时)》课件
特
(1)单一性(各处都有自己的P、V、T );
p,V ,T
征 (2)状态性质稳定性(与时间无关);
(3)热动平衡(不同与静力平衡)。 ( p ,V ,T )
p
否则为非平衡态系统。
oV
6/63
【A3.1.2】系统 平衡态 态参量
1 压强 p : 力学描述
单位: 1 Pa 1 N m2
标准大气压: 45纬度海平面处, 0C 时的 大气压. 1atm 1.01105 Pa
掌 握 麦 克 斯 韦 速 率 分 布律及三种统计速率 了解波尔兹曼分布
氢气分子
vrms 1.93103 m s1
氧气分子
vrms 483m s1
22/63
【A3.11.1】麦克斯韦速率分布律
1 兰媚尔实验 实验装置
接抽气泵
2
l v vl
A
Hg
金属蒸汽 狭 缝
23/63
BC D
显 示
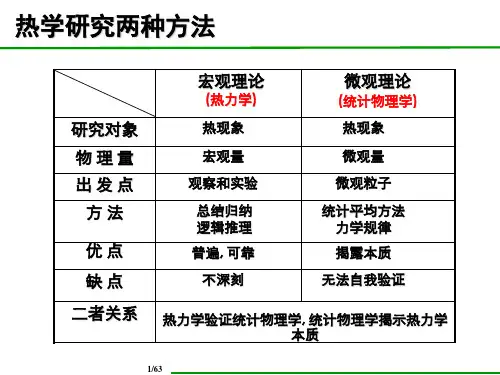
热学研究两种方法
研究对象 物理量 出发点
方法
优点 缺点 二者关系
宏观理论
(热力学)
热现象
宏观量 观察和实验
总结归纳 逻辑推理 普遍, 可靠 不深刻
微观理论
(统计物理学) 热现象
微观量 微观粒子
统计平均方法 力学规律 揭露本质
无法自我验证
热力学验证统计物理学, 统计物理学揭示热力学 本质
1/63
统计规律
(v)dv
3kT
N
N
m
v2 vrms
3kT m
3RT 1.73 kT
m
或
kt
1 2
mv2
3 2
kT ,
v2 3kT / m
大学物理气体动理论讲义省公开课获奖课件市赛课比赛一等奖课件

热力学第零定律: 假如两个系统分别与第三个系统到达热平衡,
那么这两个系统彼此也处于热平衡。 (热平衡定律)
当热接触旳两个系统处于热平衡状态时,就不会有 热传递,所以热力学第零定律阐明,处于相互热平 衡状态旳系统肯定拥有某一种共同旳宏观物理性质。 定义: 处于相互热平衡状态旳系统所具有旳共同旳 宏观性质叫着温度。
假如考虑A、B、C三个系统: A和B分别与C热接触, 并到达热平衡;然后将A和B分别与C系统隔离开,让 A和B热接触,则A和B两系统旳平衡态不会发生变化。 这表白: A和B两系统也到达了热平衡。
C AB
C AB
若A与C热平衡 则A与B必然热平衡
B也与C热平衡
-------------------------------------------------------------------------------
-------------------------------------------------------------------------------
二.热力学第零定律 温度
1.温度旳概念 温度表征物体旳冷热程度。冷热是人们对自然
界旳一种体验,是对物质世界旳直接感觉,但单 凭人旳感觉并不能精确而定量地表达出物质旳冷 热程度。
-------------------------------------------------------------------------------
热力学温标:是开尔文在热力学第二定律旳基础上建 立旳。要求水旳三相点(水、冰和水蒸气平衡共存旳 状态)为273.16K。由热力学温标可导出摄氏温度。 热力学温标:T ,SI (开尔文, K)
系统与外界之间 ①能量互换:做功;传送热量(传递热量)。 ②物质互换:蒸发、凝结、扩散、泄漏等。
大学物理学(第二版)课件:气体动理论
分子的自由度为i,则一个 分子平均能量为ikT/2, 1摩尔理想气体内能
E= i 2
kT
NA
i 2
RT
m/M摩尔理想气体内能
说明: •理想气体的内能与温度、分 子数和分子的自由度有关。 •理想气体内能仅是温度的函 数,即E=E(T)。 •理想气体从T1→T2,不论经 过什么过程,内能变化为
E= m i RT M2
3. 分子(或原子)之间存在相互作用力
如: 铅柱重新接合、流体很难压缩 吸引力——固、液体聚集在一起 排斥力——固、液体较难压缩
分子力f与分子间距离r的关系
分子力 f 与分子之间的距离r有关 存在一个r0——平衡位置
r= r0≈10-10m时,分子力为零 r < r0分子力表现在排斥力 r > r0分子力表现在吸引力
J z2
t = 3, r = 2, v = 0
i=t+r+v=5
(3)非刚性双原子分子气体,其分子运动比刚性双原子 分子多了一个沿x轴方向的振动
1 2
mvC2x
1 2
mvC2y
1 2
mvC2z
1 2
J
2 y
1 2
J
2 z
1 2
v
2 Rx
1 kx2 2
t = 3, r = 2, v = 2
i=t+r+v=7
t
1 2
mv
2 x
1 2
mv
2 y
1 2
mv
2 z
t = 3, r = 0, v = 0
i=t+r+v=3
(2)刚性双原子分子气体,即分子中两个原子之间的距离 固定不变,只有整体平动和转动,绕x轴的转动惯量近似为 零,没有振动
大学物理第6章气动理论 PPT
1 体积:
用V表示。宏观上讲体积表示容 器的容积。微观上看是容器中分 子所能够到达的区域。
单位:立方米,m3。
2 压强:
用p表示。宏观上看,压强表示容器内的气体对容器壁单位面积 上的压力。微观上看,压强表示容器内分子热运动对容器壁单 位面积上的平均冲力。
单位:帕(斯卡),Pa。1atm=1.013×105Pa。
3.状态方程的其他形式
pV NRTpNRT
NA
VNA
分子数密度 玻尔兹曼常量
n N V
kR1.3810 23JK1 NA
p nkT
当然也可利用摩尔数与气体质量的关系,导出其他形式。
MNmnm
VV
§6.2 理想气体的压强和温度 一、统计规律及其基本特征
孤立系统中,大量分子无休止的运动和彼此频繁的碰撞,使得动量、 能量以及分子自身在系统各处平均化,从而温度、压强等宏观量也趋 于相等,系统自发达到热力学平衡。
大学物理第6章气动理论
汇集全球三分之一智慧的照片: (1927年,第五届索尔维会议,比利时布鲁塞尔, 参加这次会议的29人中有17人获得或后来获得诺贝尔奖)
《大学物理学》 本学期教学内容
热学6-7章 《大学物理学》上册
振动与波动 《大学物理学》下册
光学
《大学物理学》下册
近代物理 《大学物理学》下册
三、理想气体及其状态方程
1.理想气体 热力学系统涉及的几个实验规律
玻意尔定律 盖-吕萨克定律 查里定律
pVConstant
p Constant T V Constant T
我们把严格遵守玻意尔定律、盖-吕萨克定律和查里定律的气体称 为理想气体。
理想气体一般是指密度足够低,温度足够高,压强不太大的气体。
用V表示。宏观上讲体积表示容 器的容积。微观上看是容器中分 子所能够到达的区域。
单位:立方米,m3。
2 压强:
用p表示。宏观上看,压强表示容器内的气体对容器壁单位面积 上的压力。微观上看,压强表示容器内分子热运动对容器壁单 位面积上的平均冲力。
单位:帕(斯卡),Pa。1atm=1.013×105Pa。
3.状态方程的其他形式
pV NRTpNRT
NA
VNA
分子数密度 玻尔兹曼常量
n N V
kR1.3810 23JK1 NA
p nkT
当然也可利用摩尔数与气体质量的关系,导出其他形式。
MNmnm
VV
§6.2 理想气体的压强和温度 一、统计规律及其基本特征
孤立系统中,大量分子无休止的运动和彼此频繁的碰撞,使得动量、 能量以及分子自身在系统各处平均化,从而温度、压强等宏观量也趋 于相等,系统自发达到热力学平衡。
大学物理第6章气动理论
汇集全球三分之一智慧的照片: (1927年,第五届索尔维会议,比利时布鲁塞尔, 参加这次会议的29人中有17人获得或后来获得诺贝尔奖)
《大学物理学》 本学期教学内容
热学6-7章 《大学物理学》上册
振动与波动 《大学物理学》下册
光学
《大学物理学》下册
近代物理 《大学物理学》下册
三、理想气体及其状态方程
1.理想气体 热力学系统涉及的几个实验规律
玻意尔定律 盖-吕萨克定律 查里定律
pVConstant
p Constant T V Constant T
我们把严格遵守玻意尔定律、盖-吕萨克定律和查里定律的气体称 为理想气体。
理想气体一般是指密度足够低,温度足够高,压强不太大的气体。
第十二章气体动理论_大学物理
2π kT
式中μ为分子质量,T 为气体热力学温度, k 为玻耳兹曼常量
k = 1.38×10-23 J / K
理想气体在平衡态下,气体中分子速率在v~v+ dv 区间
内的分子数与总分子数的比率为
dN f (v )dv 4π ( )3/ 2v 2ev2 / 2kT dv
N
2π kT
这一规律称为麦克斯韦速率分布定律
在温度为T 的平衡状态下,分子的每个自由度的平均动能均
为 1 kT 。这样的能量分配原则称为能量按自由度均分定理 2
说明
(1) 能量按自由度均分是大量分子统计平均的结果,是分子 间的频繁碰撞而致。
(2) 若某种气体分子具有t 个平动自由度和r 个转动自由度, s 个振动自由度, 则每个气体分子的平均总动能为
f(v) T
·在dv 间隔内, 曲线下 的面积表示速率分布
O
vv·1 v·+vd2v
v
在v~v+ dv 中的分子
( 速率分布曲线 )
数与总分子数的比率
f (v)dv dN N
·在v1~v2 区间内,曲线下的面积表示速率分布在v1~v2 之间
的分子数与总分子数的比率
v2 f (v)dv N
v1
N
·曲线下面的总面积, 等于分布Байду номын сангаас整个速
§12.5 麦克斯韦速率分布定律
一. 分布的概念
·问题的提出 气体系统是由大量分子组成, 而各分子的速率通过碰撞 不断地改变, 不可能逐个加以描述, 只能给出分子数按 速率的分布。
·分布的概念 例如学生人数按年龄的分布
年龄
人数按年龄 的分布
人数比率按 年龄的分布
15 ~16 2000 20%
式中μ为分子质量,T 为气体热力学温度, k 为玻耳兹曼常量
k = 1.38×10-23 J / K
理想气体在平衡态下,气体中分子速率在v~v+ dv 区间
内的分子数与总分子数的比率为
dN f (v )dv 4π ( )3/ 2v 2ev2 / 2kT dv
N
2π kT
这一规律称为麦克斯韦速率分布定律
在温度为T 的平衡状态下,分子的每个自由度的平均动能均
为 1 kT 。这样的能量分配原则称为能量按自由度均分定理 2
说明
(1) 能量按自由度均分是大量分子统计平均的结果,是分子 间的频繁碰撞而致。
(2) 若某种气体分子具有t 个平动自由度和r 个转动自由度, s 个振动自由度, 则每个气体分子的平均总动能为
f(v) T
·在dv 间隔内, 曲线下 的面积表示速率分布
O
vv·1 v·+vd2v
v
在v~v+ dv 中的分子
( 速率分布曲线 )
数与总分子数的比率
f (v)dv dN N
·在v1~v2 区间内,曲线下的面积表示速率分布在v1~v2 之间
的分子数与总分子数的比率
v2 f (v)dv N
v1
N
·曲线下面的总面积, 等于分布Байду номын сангаас整个速
§12.5 麦克斯韦速率分布定律
一. 分布的概念
·问题的提出 气体系统是由大量分子组成, 而各分子的速率通过碰撞 不断地改变, 不可能逐个加以描述, 只能给出分子数按 速率的分布。
·分布的概念 例如学生人数按年龄的分布
年龄
人数按年龄 的分布
人数比率按 年龄的分布
15 ~16 2000 20%
大学物理 气体动理论
二、 能量按自由度均分定理
1 3 2 W m v kT 2 2
v x v y vz
2 2
2
1 2 v 3
1 1 1 1 1 2 2 2 2 mv x mv y mv z ( mv ) 2 2 2 3 2
1 2 1 2 1 2 1 mvx mv y mvz kT 2 2 2 2
(kT )
(RT )
(m T )
讨论
一瓶氦气和一瓶氮气密度相同,分子平均平动动 能相同,而且它们都处于平衡状态,则它们 (A)温度相同、压强相同。 (B)温度、压强都不同。 (C)温度相同,但氦气的压强大于氮气的压强. (D)温度相同,但氦气的压强小于氮气的压强. 解
Nm k k T T p nkT V m m
M i E R T 2
是温度的单值函数E=f(T)
§3.4 麦克斯韦速率分布律
Maxwells law of distribution of speeds
对于由大量分 子组成的热力学系 统从微观上加以研 究时,必须用统计 的方法 .
小球在伽 尔顿板中的分 布规律 .
单个粒子行为--- 偶然 大量粒子行为--- 必然
Kinetic Theory of Gases
第三章 气体动理论
主要内容
§3-1 气体动理论的基本概念 §3-2 理想气体的压强和温度 §3-3 能量按自由度均分定理 §3-4 麦克斯韦速率分布律 §3-5 气体分子的平均碰撞频率和平均自由程 §3-6 输运过程
热学概述
与热现象有关的性质和规律。
P P2 P3 ... 1
在一定温度下,混合气体的总压强等 于相混合的各种气体的分压强之和。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
—气体压强公式
Ⅲ 温度的统计意义
由
p
2 3
n t
和p nkT
t
3 2
kT ,即T 和t
单值对应
由此给出温度的统计意义 —
T是大量分子热运动平均平动动能的量度。
t
1 2
mv 2
t
3 2
kT
v2 3kT m
3 RT
T,
v 2 称为方均根速率 (root-mean-square
Ⅳ 能量均分定理
2 . 理想气体
宏观上,满足理想气体状态方程的气体 微观假设: (1)大小 — 分子线度<<分子间平均距离; (2)分子力 — 除碰撞的瞬间,在分子之间
分子与器壁之间无作用力; (3)碰撞性质 — 弹性碰撞; (4)服从规律 — 牛顿力学。
二、等概率假设
(1)分子在各处出现的概率相同
ndNNcon.st dV V
dI dIi
(vix0)
1
2 i dIi
i
ni
mv
2 ix
d
t
d
A
(viy和viz可取任意值)
第4步:pd dF Add tdIA i nimvi2x
i
Ni V
mvi2x
V NmN Nivi2xnm v2x
1 nmv 2 3
由分子平均平动动能 t
1 2
mv 2
和p 1nmv2 3
有
p
2 3
n t
v — 振动自由度,
v=1
∴ 总自由度: i = t + r + v = 6
3. 多原子分子 (multi-atomic molecule)
如:H2O,NH3 ,…
z•
轴
N:分子中的原子数
•
•
C (x, y, z)
i = t + r + v = 3N
0
x
y r = 3 ( , ,)
v = 3N - 6
二 . 能量均分定理 一个平动自由度对应的平均动能为 1 kT
2
即: 1 2m v2 x1 2m v2 y1 2m vz21 2kT
由于分子碰撞频繁,平均地说,能量分配
没有任何自由度占优势。即:
在温度为T 的平衡态下,
个自由度所对应的平均动能都等于
1 2
kTBiblioteka —— 能量均分定理。对刚性分子(rigid molecule):v0, itr
Cp
dQ
(
) dT
p
定体热容:体积不变时某物质温度升高(或降 低)1度时所吸收(或放出)的热量
CV
(
dQ dT)V
定压摩尔热容:压强不变时1mol物质温度升高 (或降低)1度时所吸收(或放出)的热量
Cp
1
(ddQT)p
定体摩尔热容:体积不变时1mol物质温度升高 (或降低)1度时所吸收(或放出)的热量
基本实验规律 逻辑推理 宏观热现象规律
▲ 统计力学(statistical mechanics) (气体动理论)
对微观结构提 统计方法 出模型、假设
热现象规律
4.理想气体状态方程
pV M RT
p nkT
k R 1.381023JK NA
— 玻尔兹曼常量
(μ 气体质量,M 气体质量, NA 阿伏伽德罗常量,n 气体分子数密度)
(2)由于碰撞,分子可以有各种不同的速 度,速度取向各方向等概率
vxvyvz
0;v2x
v2y
vz2
1v2 3
Ⅱ 理想气体压强公式 前提:平衡态,忽略重力,分子看成质点
(只考虑分子的平动);
设:同种气体,分子质量为m,
N—总分子数,V—体积,
n N V
—分子数密度(足够大),
ni
Ni V
— 速度 vi的 为分子数密
i kT
2
3
2
5
2
kT kT
6 2
kT
(单) (双) (多)
一个分子平均内能
i kT
2
一摩尔分子内能
ii
ENA
kT RT 22
气体分子内能
E i M RT
2
二 热容
热容:某物质温度升高(或降低)1度时所吸收(或 放出)的热量单位为J/K。
C ' dQ dT
定压热容:压强不变时某物质温度升高(或降 低)1度时所吸收(或放出)的热量
第五章 气体动理论 (Kinetic Theory of Gases)
1 研究对象与基本假设
2 理想气体的压强 3 温度的统计意义 4 能量均分定理
5 麦克斯韦速率分布律
6 气体分子的平均自由程
Ⅰ 研究对象与基本假设
一、研究对象
1、多粒子体系:大量的作无规则运动 的分子构成
(1)大量的 (2) 激烈的无规则热运动 (3) 分子间力
CV
1
(ddQT)V
比热容(比热):单位质量物质温度升高 (或降低)1度时所吸收(或放出)的热量,
cm
1
dQ
单位为J/Kkg。
m dT
比定体热容:体积不变时,单位质量物质
温的度热升 量高。(或降低)1度时所吸收(或放出)cV
m1 (ddQT)V
比定压热容:压强不变时,单位质量物质
温的度热升 量高。(或降低)1度时所吸收(或放出)cP m1 (ddQT)P
N N i , n ni
i
i
推导:取器壁上小面元dA(>>分子截面面积)
小 柱
器 第1步:一个分子对dA冲量:2mvix
体
vi
壁
dA
第2步:dt内所有vi 分子对dA冲量:
vixdt
x
dIi = (2mvix)(nivixdtdA)
= 2 ni mvix2 dt dA
第3步:dt内所有分子对dA冲量:
气体动理论
Kinetic Theory of Gases
热学概述
与热现象有关的性质和规律。
研究对象:热现象与温度有关的物 理性质及其变化
宏观量:大量分子的集 体特性: 热现象微温观度压量强:热描容述等个别分子物理 量:
分子体积速度质量等
一、热学的研究方法 ▲ 热力学(thermodynamics)
• 一般地说:可以在几个独立的方向上运动。
1.单原子分子 如:He,Ne… 可作质点处理,因而只有平动。
t —平动自由度 i = t =3
2. 双原子分子
如:O2 , H2 , CO …
z
轴
•
l
t =3 — 平动自由度,
• C (x, y, z) 轴取向:(、、)
0
y r=2
x
距离 l 变化:
一. 气体分子自由度
自由度:决定物体空间位置的独立坐标数,
用 i 表示。
最少坐标数
为什么:独立坐标数为i =在i个独立方向上运动
举例:1、火车自由度为1 2、船只自由度:2 3、飞机自由度:3
• 讨论:
• 火车在一个方向上自由运动
• 用独立坐标( x,dx d)2 x描述运动
dt
dt 2
• 小结
• 严格地说:决定物体空间位置的独立坐标数。
