离子型综合推断题汇总
离子推断题汇总

离子推断题汇总(一)1.对某酸性溶液(可能含有Br-、SO42—、H2SO3、NH4+ )分别进行如下实验:①加热时放出的气体可以使品红溶液褪色②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸对于下列物质不能确认其在溶液中是否存在的是A.Br-B.SO42— C.H2SO3 D.NH4+2.(2010·浙江)某钠盐溶液中可能含有 NO2—、SO42—、SO32—、CO32—、Cl—、I—等阴离子。
某同学取5份此溶液样品,分别进行了如下实验:①用pH计测得溶液的pH大于7②加入盐酸,产生有色刺激性气体③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN 溶液,显红色该同学最终确定在上述六种离子中仅含CO32—、NO2—、Cl—三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A.①②④⑤B.③④ C.③④⑤ D.②③⑤3.某无色溶液中含有K+、Cl—、OH—、SO32—、SO42—,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。
检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
(1)图中试剂①~⑤溶质的化学式分别是①_____ ___,②_____ ___,③______ __,④____ ____,⑤_____ ___。
(2)图中现象a、b、c表明检验出的离子分别是a._____ 、b.____ _、c.____ _。
(3)白色沉淀A加试剂②反应的离子方程式是。
(4)无色溶液A加试剂③的主要目的是(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是。
离子推断题

(15分)某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:根据以上信息,回答下列问题:(1)上述离子中,溶液X中除H+外还肯定含有的离子是▲,不能确定是否含有的离子(M)是▲,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是▲。
(2)沉淀I的化学式为▲,气体F的电子式为▲。
(3)写出生成A的离子方程式:▲。
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4。
请写出制备过程中的离子方程式▲。
(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为▲。
(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含▲。
(2015秋•衡水校级月考)某强酸性溶液X,可能含有Al3+、Ba2+、NH、Fe2+、Fe3+、CO、SO、SiO、NO中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色.请回答下列问题:(1)由强酸性条件即可判断溶液X中一定不存在的离子有______.(2)溶液X中,关于N03-的判断一定正确的是______.a.一定有 b.一定没有 c.可能有(3)产生气体A的离子方程式为______.(4)转化⑥发生反应的现象为______.(5)转化④中产生H的离子方程式为______.(6)若转化③中,D、H20、02三种物质恰好发生化合反应生成E,则反应中D 与02的物质的量之比为______(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是______.①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMn04溶液,⑥氯水和KSCN的混合溶液.。
离子推断题汇总

离子推断题汇总(一)1.对某酸性溶液(可能含有Br-、SO42—、H2SO3、NH4+ )分别进行如下实验:①加热时放出的气体可以使品红溶液褪色②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸对于下列物质不能确认其在溶液中是否存在的是A.Br-B.SO42— C.H2SO3 D.NH4+2.(2010·浙江)某钠盐溶液中可能含有 NO2—、SO42—、SO32—、CO32—、Cl—、I—等阴离子。
某同学取5份此溶液样品,分别进行了如下实验:①用pH计测得溶液的pH大于7②加入盐酸,产生有色刺激性气体③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN 溶液,显红色该同学最终确定在上述六种离子中仅含CO32—、NO2—、Cl—三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A.①②④⑤B.③④ C.③④⑤ D.②③⑤3.某无色溶液中含有K+、Cl—、OH—、SO32—、SO42—,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。
检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
(1)图中试剂①~⑤溶质的化学式分别是①_____ ___,②_____ ___,③______ __,④____ ____,⑤_____ ___。
(2)图中现象a、b、c表明检验出的离子分别是a._____ 、b.____ _、c.____ _。
(3)白色沉淀A加试剂②反应的离子方程式是。
(4)无色溶液A加试剂③的主要目的是(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是。
高考离子推断题专项练习(非常全面)

高考离子推断题的类型一、定性推断型:主要考查常见阴、阳离子的性质,特别是常见阴、阳离子特殊的物理性质和特征的化学性质必须熟练掌握。
如:(1)特征颜色:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕黄色)、MnO4-(紫红色)、Fe[(SCN)]2+(红色)、Fe[(C6H5O)6]3-(紫色);(2)特征现象:焰色反应:K+:紫色(透过蓝色钴玻璃),Na+:黄色;遇OH-生成红褐色沉淀、遇苯酚溶液显紫色、遇SCN-显红色的离子是Fe3+;与碱反应生成白色沉淀,迅速变成灰绿色,最后变成红褐色或遇SCN-颜色无明显变化、通入Cl2后显红色的离子是Fe2+;与NaOH溶液共热,能产生使湿润的红色石蕊试纸变蓝、遇酚酞试液变红的碱性气体的离子是NH4+;加入HBr产生浅黄色沉淀的离子是Ag+或S2-和SO32-组成。
例1.某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。
分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。
为确定该溶液的组成,还需检验的离子是()A.Na+B.SO42-C.Ba2+D.NH4+例2.某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I一。
为鉴定这些离子,分别取少量溶液进行以下实验:①测得混合液呈碱性;②加HCl后,生成无色无味气体。
该气体能使饱和石灰水溶液变浑浊;③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;④加BaCl2溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解;⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验①____________________________________________________实验②____________________________________________________实验③____________________________________________________实验④____________________________________________________实验⑤____________________________________________________(2)上述5个实验不能确定是否存在的离子是________。
高中化学之离子反应推断题汇总1-80题(附答案及每题解析)

高中化学之离子反应推断题汇总80题(附答案及每题解析)1.某无色混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Cl-、CO32—、SO42—,现各取100mL溶液三份进行如下实验:①向第一份加入AgNO3溶液,有白色沉淀产生;②向第二份加入足量NaOH溶液后加热,收集到气体0.896L(标准状况);③向第三份加入足量BaCl2溶液,得到沉淀6.27克,经足量盐酸洗涤后,剩余2.33克。
试回答下列问题:(1)肯定存在的离子有,肯定不存在的离子有;(2)可能存在的离子是,判断该离子存在与否的方法是;(3)试计算肯定存在的阳离子在原溶液中的物质的量浓度。
【答案】(1)K+、NH4+、CO32-、SO42-;Mg2+、Cu2+;(2)Cl—取原溶液少许于试管中,滴加过量Ba(NO3)2溶液,过滤后往滤液中再加入AgNO3溶液,若有白色沉淀产生,说明有Cl-;反之,没有(3)c(K+)≥0.2mol/L、c(NH4+)=0.4mol/L【解析】试题分析:无色溶液说明没有铜离子;第一份:第一份加入硝酸银溶液,有白色沉淀产生,说明溶液中可能存在Cl-、CO32—、SO42—;第二份:加足量NaOH溶液加热后生成标准状况下0.896L气体为氨气,则溶液中一定含有NH4+,且物质的量为:0.896L÷22.4L/mol=0.04mol;第三份:根据题中信息可知2.33为硫酸钡,n(BaSO4)=n(SO42—)=2.33g÷233g/mol═0.01mol;生成的沉淀BaCO3物质的量=(6.27g−2.33g)÷197g/mol=0.02mol;因为一定含CO32—,所以不含Mg2+;再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol;n(-)=2n(CO32—)+2n(SO42—)=0.06mol,故一定有K+,至少0.02mol;(1)根据以上分析可知肯定存在的离子是K+、NH4+、CO32-、SO42-;肯定不存在的离子有Mg2+、Cu2+;(2)根据以上分析可知,无法确定是否含有氯离子,可先加过量Ba(NO3)2溶液,过滤后往滤液中再加入AgNO3溶液,若有白色沉淀说明有Cl-,否则无Cl-;(3)NH4+的物质的量是0.04mol,溶液体积是0.1L,所以c(NH4+)=0.04mol÷0.1L=0.4mol/L;由于不能确定是否含有氯离子,则钾离子的物质的量至少是0.02mol,其浓度至少是0.2mol/L。
专题:离子检验与离子推断
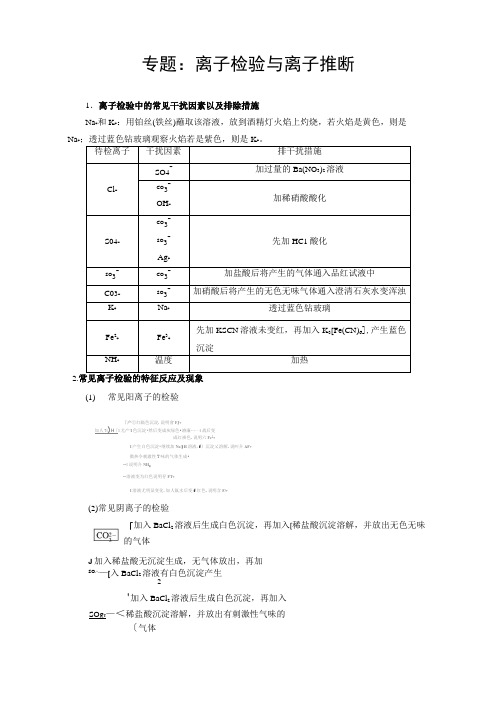
专题:离子检验与离子推断1.离子检验中的常见干扰因素以及排除措施Na+和K+:用铂丝(铁丝)蘸取该溶液,放到酒精灯火焰上灼烧,若火焰是黄色,则是Na+;透过蓝色钻玻璃观察火焰若是紫色,则是K +。
待检离子干扰因素排干扰措施Cl-SO4-加过量的Ba(NO3)2溶液CO3-OH-加稀硝酸酸化S04-CO3-SO3-Ag+先加HC1酸化SO3-CO3-加盐酸后将产生的气体通入品红试液中C03-SO3-加硝酸后将产生的无色无味气体通入澄清石灰水变浑浊K+Na+透过蓝色钻玻璃Fe2+Fe3+先加KSCN溶液未变红,再加入K3[Fe(CN)6],产生蓝色沉淀NH+温度加热2.常见离子检验的特征反应及现象(1)常见阳离子的检验「产①红隔色沉淀.说明會FJ+加人7()H「I尤产'I色沉淀•然后变成灰绿色•濬廉…—I战后变成红褂色.说明六Fe2+I产生白色沉淀•继续加Na()H溶液.f〕沉淀乂溶解.说叫介AF+微热令刺澈性Y味的气体生成•〜I说明介NH:〜溶液变为红色说明存FT+I溶液尤明显变化.加人氟水后变f红色.说明含F/+(2)常见阴离子的检验「加入BaCl2溶液后生成白色沉淀,再加入[稀盐酸沉淀溶解,并放出无色无味的气体J加入稀盐酸无沉淀生成,无气体放出,再加SO^—[入BaCl2溶液有白色沉淀产生2'加入BaCl2溶液后生成白色沉淀,再加入SO g T—<稀盐酸沉淀溶解,并放出有刺激性气味的〔气体叵T一加入AgNO3生成不溶于稀硝酸的白色沉淀[探高考•真题鉴赏]1.(2016・全国高考卷II)某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为()A.NaHCO3、A1(OH)3B.AgCl、NaHCO gC.NaSO、BaCOD.NaCO、CuSO233234解析:A项中,NaHCO3、A1(OH)3加入足量水中,NaHCO g溶解,Al(OH)3不溶解;加入稀盐酸,固体全部溶解,且有气泡产生;NaHCO3、A1(OH)3均能与H2SO4反应,最后不会有固体剩余。
高中化学之离子反应推断题汇总1-80题(附答案及每题解析)

高中化学之离子反应推断题汇总80题(附答案及每题解析)1.某无色混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Cl-、CO32—、SO42—,现各取100mL溶液三份进行如下实验:①向第一份加入AgNO3溶液,有白色沉淀产生;②向第二份加入足量NaOH溶液后加热,收集到气体0.896L(标准状况);③向第三份加入足量BaCl2溶液,得到沉淀6.27克,经足量盐酸洗涤后,剩余2.33克。
试回答下列问题:(1)肯定存在的离子有,肯定不存在的离子有;(2)可能存在的离子是,判断该离子存在与否的方法是;(3)试计算肯定存在的阳离子在原溶液中的物质的量浓度。
【答案】(1)K+、NH4+、CO32-、SO42-;Mg2+、Cu2+;(2)Cl—取原溶液少许于试管中,滴加过量Ba(NO3)2溶液,过滤后往滤液中再加入AgNO3溶液,若有白色沉淀产生,说明有Cl-;反之,没有(3)c(K+)≥0.2mol/L、c(NH4+)=0.4mol/L【解析】试题分析:无色溶液说明没有铜离子;第一份:第一份加入硝酸银溶液,有白色沉淀产生,说明溶液中可能存在Cl-、CO32—、SO42—;第二份:加足量NaOH溶液加热后生成标准状况下0.896L气体为氨气,则溶液中一定含有NH4+,且物质的量为:0.896L÷22.4L/mol=0.04mol;第三份:根据题中信息可知2.33为硫酸钡,n(BaSO4)=n(SO42—)=2.33g÷233g/mol═0.01mol;生成的沉淀BaCO3物质的量=(6.27g−2.33g)÷197g/mol=0.02mol;因为一定含CO32—,所以不含Mg2+;再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol;n(-)=2n(CO32—)+2n(SO42—)=0.06mol,故一定有K+,至少0.02mol;(1)根据以上分析可知肯定存在的离子是K+、NH4+、CO32-、SO42-;肯定不存在的离子有Mg2+、Cu2+;(2)根据以上分析可知,无法确定是否含有氯离子,可先加过量Ba(NO3)2溶液,过滤后往滤液中再加入AgNO3溶液,若有白色沉淀说明有Cl-,否则无Cl-;(3)NH4+的物质的量是0.04mol,溶液体积是0.1L,所以c(NH4+)=0.04mol÷0.1L=0.4mol/L;由于不能确定是否含有氯离子,则钾离子的物质的量至少是0.02mol,其浓度至少是0.2mol/L。
离子型推断题

离子型推断题1.在某未知溶液中检验出含有Ba 2+、NO 3-,且溶液的pH =1。
某学生还需检验此溶液中是否大量存在:①Al 3+,②NH 4+,③Fe 2+,④Cl -,⑤AlO 2-,⑥SO 42-,其实这些离子中有一部分不必再检验就能加以否定,你认为不必再检验的离子组是( )A .③⑤⑥B .④⑤⑥C .①②⑤D .①③④2.从下列实验事实得出的相应结论中正确的是( )选项 实验事实结论 A向某溶液加入氯水然后加入KSCN 溶液,溶液变为红色 该溶液中含Fe 3+ BSO 2通入Ba(NO 3)2溶液中出现白色沉淀 BaSO 3不溶于水 C Na 2SiO 3溶液中通入CO 2产生白色沉淀酸性H 2CO 3>H 2SiO 3 D 某溶液中加入稀盐酸产生无色无味、能使澄清石灰水变浑浊的气体该溶液中一定含有CO 32- 3.在含有Na +的中性溶液中,还可能存在NH 4+、Fe 2+、Br -、CO 32-、I -、SO 32-六种离子中的一种或几种,进行如下实验:(1)原溶液滴加足量氯水后,有气泡生成,溶液呈橙黄色;(2)向橙黄色溶液中加BaCl 2溶液无沉淀生成;(3)橙黄色溶液不能使淀粉变蓝。
由此推断原溶液中一定不存在的离子是( )A .NH 4+、Br -、CO 32-B .NH 4+、I -、SO 42-C .Fe 2+、I -、CO 32-D .Fe 2+、I -、SO 32-4.某种溶液可能含有下列阴离子中的一种或几种:SO 2-4、SO 2-3、CO 2-3、Cl -。
(1)当溶液中有大量H +存在时,则不可能有__________存在。
(2)当溶液中有大量Ba 2+存在时,溶液中不可能有____________存在。
(3)当溶液中有____________和____________等阳离子存在时,上述所有阴离子都不可能存在。
5.氧化铜是一种黑色固体,可溶于稀硫酸。
某同学想知道是稀硫酸的哪种粒子(H 2O 、H +、SO 2-4)能使氧化铜溶解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子型综合推断题汇总
定性推断
1、有一无色溶液,仅含有K +、Al 3+、Mg 2+、NH 4+、Cl -、SO 42-、HCO 3-、MnO 4-中的几种。
为确定其成分,做如下实验:①取部分溶液,加入适量Na 2O 2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH 溶液后白色沉淀部分溶解;②另取部分溶液,加入硝酸酸化的Ba (NO 3)2溶液,无沉淀产生。
下列推断正确的是( )
A .肯定有Al 3+、Mg 2+、Cl -,可能有NH 4+、K +
B .肯定有Al 3+、K +、Cl -,肯定没有MnO 4-
C .肯定有Al 3+、Cl -,一定没有SO 42-和HCO 3-
D .该溶液可能显弱酸性,也可能显中性
2.(14分) 某无色溶液,其中有可能存在的离子如下:Na +、Ag +、Ba 2+、Al 3+、AlO -
2、S 2-、
CO -23、SO -23、SO -24,现取该溶液进行有关实验,实验结果如下图所示: 试回答下列问题:
(1) 沉淀甲是____________,
(2) 沉淀乙是__________,
(3) 由溶液甲生成沉淀乙的离子方程式为:_________________________。
(4)
(5)综合上述信息,可以肯定存在的离子:_____________________________。
3.在一种酸性溶液中可能存在+3Fe 、-3NO 、-Cl 、-I 中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中( )
A .一定含有-I ,不能确定是否含有-Cl
B .可能含有-3NO 、-Cl 和-I
C .可能含有-
3NO D .不含有+3Fe
定量推断
2、某混合溶液中可能含有下列离子中的若干种:NH 4+、Na +、Al 3+、Fe 2+、Fe 3+、AlO 2-、SO 42-、
I -、NO 3-、CO 32-,已知离子浓度均约为0.1mo l ·L -1。
现取两份20mL 该溶液进行如下实验:
(1)第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl 2溶液,有白色沉淀产生。
(2)第二份逐滴滴加NaOH 浓溶液至过量,先产生沉淀不溶解,并有气体逸出。
根据上述实验,以下说法错误的是( )
A. 该混合溶液中一定不含Fe 3+、AlO 2-、Al 3+、CO 32-
B. 在溶液中滴加酚酞试液后呈红色,加入BaCl 2溶液,红色褪去,并产生白色沉淀
C. 该混合溶液中肯定含有Fe 2+、NH 4+、SO 42-、NO 3-
D .通过进行焰色反应可以确定是否含有I
- 3、今有一混合物的水溶液,只可能含有以下离子中的若干种:K +、NH 4+、Cl -、Mg 2+、Ba 2+、 CO 32-、SO 42-,现取三份各100mL 该溶液进行如下实验:
① 第一份加入AgNO 3溶液有沉淀产生;
② 第二份加足量NaOH 溶液加热后,收集到气体0.08mol ;
③第三份加足BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量
为4.66g。
根据上述实验,回答下列问题:
(1)由第二份进行的实验得知混合物中应含有离子,其物质的量浓度为。
(2)由第三份进行的实验可知12.54克沉淀的成分是(写沉淀化学式),其物质的量分别为。
(3)原溶液中是否存在K+(填“是”或“否)若存在则K+的浓度的取值范围是(若不存在此空可不填)
与图像、流程相结合的离子推断
4
阴离子CO2-3、SiO2-3、AlO-2、Cl-
阳离子Al3+、Fe3+、Mg2+、NH+4、Na+
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)
与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是,ab段发生反应的离子是,bc段发生反应的离子方程式为;
(2)若Y是NaOH溶液,则X中一定含有的离子是,ab段反应的离子方程式为_____________________________________________________________。
5、某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是()
A. d点溶液中含有的溶质只有Na2SO4
B. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
C. ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓
D. 原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+的哪一种
6、(2014·绍兴质检)某澄清透明待测溶液中,可能含有Mg2+、Al3+、Fe2+、Cu2+、B r-、SO42-、NO3-、SO32-等离子中的一种或几种,进行下列实验:下列说法不正确的是()A.溶液中一定不存在Fe2+、Cu2+
B.溶液中一定不存在SO32-
C.沉淀B中肯定含有Fe(OH)3,可能含有Mg(OH)2
D.溶液中一定存在SO42-、B r-、Fe2+、Al3+
7、(2014·宁波五校联考)某强酸性溶液X可能含有Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-中的一种或几种,取该溶液进行连续实验,实验过程及现象如下:
根据以上信息可知下列推断正确的是()
A.沉淀C可能是BaCO3、BaSO3、BaSO4的混合物
B.沉淀G一定含有Fe(OH)3,可能含有Fe(OH)2
C.溶液B与溶液J混合能产生白色沉淀,且该沉淀能被溶液E溶解
D.从化合价变化看,A和F不可能发生氧化还原反应
1 AC
2 B
3
4
5 B
6 A
7 C
19.某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。
若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。
下列说法不正确的是
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
13.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1 mol·L-1。
某同学进行了如下实验,下列说法正确的是
A.无法确定原试液中是否含有Al3+、Cl-
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.无法确定沉淀C的成分
D.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
16.已知,某无色溶液中含有下列离子中的几种:Na+、Ba2+、Br+、Cl-、SO32-、SO42-,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生。
根据上述实验判断,下列结论正确的是:
A.原溶液中一定含有Br-、SO42- B.原溶液一定含有Na+,不含Ba2+ C.实验①与上述离子的检验没有关系,可以省略
D.由实验④可以判断原溶液中含有Cl-。
