高考化学必考题型早知道专题九弱电解质的电离平衡溶液的酸碱性新人教版
【大高考】高考化学:五年高考真题 专题9弱电解质的电离平衡和溶液的酸碱性(含解析)

考点一 弱电解质的电离平衡1.(2015·海南化学,11,4分)下列曲线中,可以描述乙酸(甲,K a =1.8×10-5)和一氯乙酸(乙,K b =1.4×10-3)在水中的电离度与浓度关系的是( )解析 根据甲、乙的电离平衡常数得,这两种物质都是弱电解质,在温度不变、浓度相等时,电离程度CH 3COOH<CH 2ClCOOH ,可以排除A 、C ;当浓度增大时,物质的电离程度减小,排除D 选项,故B 项正确。
答案 B2.(2015·课标全国卷Ⅰ,13,6分)浓度均为0.10 mol·L -1、体积均为V 0的MOH 和ROH 溶液,分别加水稀释至体积V ,pH 随lg VV 0的变化如图所示,下列叙述错误的是( )A .MOH 的碱性强于ROH 的碱性B .ROH 的电离程度:b 点大于a 点C .若两溶液无限稀释,则它们的c (OH -)相等D .当lg V V 0=2时,若两溶液同时升高温度,则c (M +)/c (R +)增大解析 A 项,0.10 mol ·L-1的MOH 和ROH ,前者pH =13,后者pH 小于13,说明前者是强碱,后者是弱碱,正确;B 项,ROH 是弱碱,加水稀释,促进电离,b 点电离程度大于a点,正确;C 项,两碱溶液无限稀释,溶液近似呈中性,c (OH -)相等,正确;D 项,由MOH 是强碱,在溶液中完全电离,所以c (M +)不变,ROH 是弱碱,升高温度,促进电离平衡ROH R ++OH -向右进行,c (R +)增大,所以c (M +)c (R +)减小,错误。
答案 D3.(2014·山东理综,13,5分)已知某温度下CH 3COOH 和NH 3·H 2O 的电离常数相等,现向10 mL 浓度为0.1 mol·L-1的CH 3COOH 溶液中滴加相同浓度的氨水,在滴加过程中( )A .水的电离程度始终增大 B.c (NH +4)c (NH 3·H 2O )先增大再减小 C .c (CH 3COOH)与c (CH 3COO -)之和始终保持不变 D .当加入氨水的体积为10 mL 时,c (NH +4)=c (CH 3COO -)解析 CH 3COOH 溶液中水的电离被抑制,当CH 3COOH 与NH 3·H 2O 恰好反应时生成CH 3COONH 4,此时水的电离程度最大,再加入氨水,水的电离程度又减小,A 项错误;c (NH +4)c (NH 3·H 2O )=c (NH +4)·c (H +)·c (OH -)c (NH 3·H 2O )·c (H +)·c (OH -)=c (NH +4)·c (OH -)c (NH 3·H 2O )·c (H +)K W =K NH 3·H 2O ·c (H +)K W ,温度不变,NH 3·H 2O 的电离平衡常数及K W 均不变,随着NH 3·H 2O的滴加,c (H +)减小,故c (NH +4)c (NH 3·H 2O )减小,B 项错误;未滴加氨水时,c (CH 3COOH)+c (CH 3COO -)=0.1 mol·L -1,滴加10 mL 氨水时,c (CH 3COOH)+c (CH 3COO -)=0.05 mol ·L-1,C 项错误;由于CH 3COOH 和NH 3·H 2O 的电离常数相等,故当加入NH 3·H 2O 的体积为10 mL 时,c (NH +4)=c (CH 3COO -),D 项正确。
2013高考化学必考题型早知道 专题九 弱电解质的电离平衡 溶液的酸碱性.pdf

专题九 弱电解质的电离平衡 溶液的酸碱性 1.[2012·福建理综,10]下列说法正确的是( ) A.0.5 mol O3与11.2 L O2所含的分子数一定相等 B.25 ℃与60 ℃时,水的pH相等 C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等 D. 2SO2(g)+O2(g)===2SO3(g)和4SO2(g)+2O2(g)===4SO3(g)的ΔH相等 2.[2012·浙江理综,12]下列说法正确的是( ) A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。
若pH>7,则H2A是弱酸;若pH④=②>③ 3.[2012·课标全国理综,11]已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( ) A.a=b B.混合溶液的pH=7 C.混合溶液中,c(H+)= mol·L-1 D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) 4.[2012·安徽理综,27]亚硫酸盐是一种常见食品添加剂。
为检测某食品中亚硫酸盐含量(通常以1 kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程: (1)气体A的主要成分是________。
为防止煮沸时发生暴沸,必须先向烧瓶中加入________ ;通入N2的目的是________。
(2)写出甲方案第①步反应的离子方程式:______________ __________________________________________________________。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗。
其操作方法是________________________________________________ __________________________________________________________。
弱电解质的电离、水的电离和溶液的酸碱性知识点总结及习题

弱电解质的电离、水的电离和溶液的酸碱性知识点总结及习题、弱电解质的电离2、 电解质与非电解质本质区别: 电解质——离子化合物或共价化合物非电解质——共价化合物注意:①电解质、非电解质都是化合物②SO 、NH 、CO 等属于非电解质 ③强电解质不等于易溶于水的化合物(如BaSO 不溶于水,但溶于水的BaSO 全部电离,故BaSQ 为强电解质)一一 电解质的强弱与导电性、溶解性无关。
3、 电离平衡:在一定的条件下,当电解质分子电离成 离子的速率和离子结合成时,电离过程就达到了 平衡状态 ______ ,这叫电离平衡。
4、 影响电离平衡的因素:A 温度:电离一般吸热,升温有利于电离。
B 浓度:浓度越大,电离程度 越小 ;溶液稀释时,电离平衡向着电离的方向移动。
C 、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱 电离。
D其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
9、 电离方程式的书写:用可逆符号弱酸的电离要分布写(第一步为主)10、 电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓 度的乘积,跟溶液中未电离的分子浓度的比是一个常数。
叫做电离平衡常数,(一般用Ka 表示酸,Kb 表示碱。
)表示方法:A ++B - Ki=[ A +][ B -]/[AB] 11影响因素:a 、 电离常数的大小主要由物质的本性决定。
b 、 电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。
C 、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。
如: HSO>H 3PO>HF>CHCOOH>CO>HS>HCIO 二、水的电离和溶液的酸碱性非电解质: 强电解质: 弱电解质:: 在水溶液中或熔化状态下都不能导电的化合物 。
:在水溶液里全部电离成离子的电解质。
在水溶液里只有一部分分子电离成离子的电解质物质•:纯净物 (电解质* 化合物, 卩虽电解质: :弱电解质:讥0,非电解质:________ 强酸,强碱,大多数盐 ___________ 。
2024年新高考版化学专题十二弱电解质的电离平衡和溶液的酸碱性讲解部分

酸性 碱性
不变 不变
3)水的离子积:KW=c(H+)·c(OH-)。一定温度时,KW为常数,KW只与温度有 关。水的电离是吸热过程,温度越高,KW越大。常温下,KW=1×10-14。
注意:KW表达式中的H+和OH-不一定都是由水电离出来的,指的是溶液中 的c(H+)和c(OH-)。
2.溶液的酸碱性和pH 1)溶液的酸碱性
综合篇
综合 强酸、弱酸的比较与判断方法 1.一元强酸(HCl)与一元弱酸(CH3COOH)的比较
1)相同物质的量浓度、相同体积的盐酸与醋酸溶液的比较
c(H+) pH 中和碱的能力 与足量活泼金属反应产生H2的量 与金属反应的起始速率
盐酸 大 小 相同 相同 快
醋酸溶液 小 大
慢
2)相同pH、相同体积的盐酸与醋酸溶液的比较
偏低
锥形瓶用NaOH溶液润洗
偏高
滴定前有气泡,滴定后无气泡 偏高
滴定前无气泡,滴定后有气泡 偏低
盐酸滴出瓶外
偏高
振荡时瓶内溶液溅出
偏低
读数 其他
前仰后平
偏低
前平后仰
偏高
前仰后俯
偏低
滴定终点时滴定管尖嘴悬一滴 偏高 溶液
指示剂变色即停止滴定,半分钟 偏低 内恢复原来的颜色
三、滴定曲线(pH曲线)分析 1.强酸与强碱滴定过程中的pH曲线 (以0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1盐酸为例)
判断酸与盐反应是否能发生(强酸制弱酸)
Ka1(H2CO3)>Ka(HClO)> Ka2(H2CO3),则NaClO+CO2 +H2O NaHCO3+HClO
弱电解质的电离、水的电离和溶液的酸碱性知识点总结及习题

弱电解质的电离、水的电离和溶液的酸碱性知识点总结及习题一、弱电解质的电离1、定义:电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
非电解质:在水溶液中或熔化状态下都不能导电的化合物。
强电解质:在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质。
混和物物质单质强电解质:强酸,强碱,大多数盐。
如 HCl 、NaOH、 NaCl、 BaSO4纯净物电解质弱电解质:弱酸,弱碱,极少数盐,水。
如 HClO 、NH 3·H2O、Cu(OH)2、化合物H2O,,。
如 SO3、CO 2、C6H12O6、CCl 4、CH 2=CH2,,非电解质:非金属氧化物,大部分有机物2、电解质与非电解质本质区别:电解质——离子化合物或共价化合物非电解质——共价化合物注意:①电解质、非电解质都是化合物② SO2、NH3、CO2等属于非电解质③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的 BaSO 全部4电离,故 BaSO4为强电解质)——电解质的强弱与导电性、溶解性无关。
3、电离平衡:在一定的条件下,当电解质分子电离成离子的速率和离子结合成时,电离过程就达到了平衡状态,这叫电离平衡。
4、影响电离平衡的因素:A、温度:电离一般吸热,升温有利于电离。
B、浓度:浓度越大,电离程度越小;溶液稀释时,电离平衡向着电离的方向移动。
C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱电离。
D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
9、电离方程式的书写:用可逆符号弱酸的电离要分布写(第一步为主)10、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。
叫做电离平衡常数,(一般用 Ka 表示酸, Kb 表示碱。
)表示方法: AB A++B-Ki=[ A+][ B - ]/[AB]11、影响因素:a、电离常数的大小主要由物质的本性决定。
高考化学一轮总复习 专题九 弱电解质的电离平衡和溶液的酸碱性

而碱溶液稀释时,c(OH-)减小,c(H+)增大。
易失分点三 误认为电离平衡右移,电离平衡常数一定增大。 电离平衡常数只与温度有关,只有因为温度升高而导致平衡 右移的电离平衡常数才会增大。
易失分点四 误认为氨水中c(OH-)=10-2 mol·L-1,加水稀释 至原溶液体积100倍,此时氨水中c(OH-)=10-4 mol·L-1。 因NH3·H2O为弱电解质,存在电离平衡,加水稀释时,电离 平衡向正反应方向移动,故加水稀释至原溶液体积100倍时, 溶液中c(OH-)应大于10-4 mol·L-1。
质的量是不变的,因此加入等体积的 pH=11 的 NaOH 溶液时,
醋酸会过量,因此溶液显酸性,所以选项 D 不正确。
答案 B
考点二 水的电离和溶液的酸碱性
1.水的电离
(1)电离方程式
水是一种极弱的电解质,H2O+H2O 写为_H__2_O______H_+__+__O_H__-_。
H3O++OH-,可简
强酸、强碱 ―恰—好——中―和→pH=7 强酸、弱碱 ―碱—过 —―量→pH>7 弱酸、强碱 —酸—过――量→pH<7
(2)已知酸、碱溶液的 pH 之和为 14,若混合后溶液 的 pH 为 7,则溶液呈中性。 强酸、强碱 ―→V 酸∶V 碱=1∶1 强酸、弱碱 ―→V 酸∶V 碱>1∶1 弱酸、强碱 ―→V 酸∶V 碱<1∶1
(2)几个重要数据
1×10-7 mol·L-1 1×10-14
注意:Kw只与温度有关,温度升高,Kw __增__大___。 (3)影响水电离平衡的因素 ①升高温度,水的电离程度__增__大___ 。 ②加入酸或碱,水的电离程度__减__小___ 。 ③加入可水解的盐(如FeCl3、Na2CO3),水的电离程度__增__大___。
弱电解质的电离平衡和溶液的酸碱性的考点解析

弱电解质的电离平衡和溶液的酸碱性的考点解析摘要:弱电解质的电离平衡和溶液酸碱性是高中化学学习的重点和难点,也是每年高考的热点之一。
如何才能让学生把握好这部分知识呢?本文从几个典型例题入手,对这些考点进行深度解析。
关键词:弱电解质的电离平衡溶液的酸碱性对于弱电解质的电离和溶液酸碱性这部分知识,需要学生了解电解质、非电解质、强电解质、弱电解质的概念,会判断常见的强电解质和弱电解质;理解弱电解质的电离平衡,掌握一定条件下弱电解质的电离平衡的移动及电离平衡常数的计算;了解水的电离及水的离子积,理解温度、外加物质(酸、碱、盐等)对水的电离平衡的影响;会判断有关溶液的酸碱性及有关粒子浓度的大小,掌握有关溶液pH的计算。
其中水的电离、溶液的酸碱性、pH及电离平衡常数的计算、溶液中粒子浓度大小的比较是高考重点考查内容,几乎每年都考,复习时特别注意。
在今后高考中,外界条件对水的电离平衡的影响及有关水的离子积、电离平衡常数的计算仍是命题的热点。
考点一、弱电解质的电离平衡及电离平衡常数的计算例1 光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:据此,下列判断中正确的是()A.该溶液中存在着SO2分子B.该溶液中H+浓度是SO32 浓度的2倍C.向该溶液中加入足量的酸都能放出SO2气体D.向该溶液中加入过量NaOH可得到Na2SO3 、NaHSO3和NaOH的混合溶液【答案】A【解析】由于上述反应是可逆的,反应不可能进行到底,故溶液中存在着SO2分子,A正确。
该溶液中,SO2?xH2O的电离是分步进行的,第一步电离:SO2?xH2O H++HSO3 +(x-1)H2O,第二步电离:HSO3 H++SO32 ,且第一步电离程度远大于第二步电离,故溶液中的SO32 很少,H+浓度远大于SO32 浓度的2倍,故B项错误。
若向该溶液中加入足量的稀HNO3,则SO2?xH2O被HNO3氧化为H2SO4,就不会有SO2气体放出了,故C项错误。
弱电解质的电离平衡和PH值
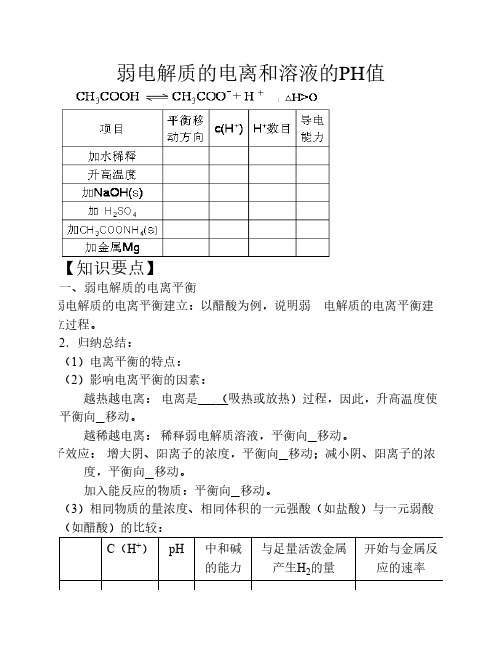
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中 的C(OH-) = __________。
例16. 某溶液中由水电离出来的C(OH—)=10-12mol/L,则该溶液中的溶质
不可能是( )
A.HCl
B.NaOH
C.NH4ClD.H2SO4 Nhomakorabea例17.(07北京)在由水电离产生的H+浓度为1×10-13mol·L-1的溶液
弱电解质的电离和溶液的PH值
【知识要点】
一、弱电解质的电离平衡
1.弱电解质的电离平衡建立:以醋酸为例,说明弱 电解质的电离平衡建
立过程。
2.归纳总结:
(1)电离平衡的特点:
(2)影响电离平衡的因素:
越热越电离: 电离是 (吸热或放热)过程,因此,升高温度使
平衡向 移动。
越稀越电离: 稀释弱电解质溶液,平衡向 移动。
例3.(04广东)pH相同的盐酸和醋酸两种溶液中,它们的( )
A.H+的物质的量相同
B.物质的量浓度相同
C.H+的物质的量浓度不同
D.H+的物质的量浓度相同
例4.(03广东)在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的
体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束
后得到等量的氢气。下列说法正确的是( )
例8.(05上海)欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、
c(HCO3-)都减少,其方法是( )
A.通入二氧化碳气体
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水溶液
题型二:电解质溶液导电原理及图像
例9. 下列各组物质反应后,溶液的导电性比反应前明显增强的是( )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题九弱电解质的电离平衡溶液的酸碱性
1.[2012·福建理综,10]下列说法正确的是( )
A.0.5 mol O3与11.2 L O2所含的分子数一定相等
B.25 ℃与60 ℃时,水的pH相等
C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等
D. 2SO2(g)+O2(g)===2SO3(g)和4SO2(g)+2O2(g)===4SO3(g)的ΔH相等
2.[2012·浙江理综,12]下列说法正确的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。
若pH>7,则H2A是弱酸;若pH<7,则H2A 是强酸
C.用0.2000 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L -1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
3.[2012·课标全国理综,11]已知温度T时水的离子积常数为K W,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( ) A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=K W mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
4.[2012·安徽理综,27]亚硫酸盐是一种常见食品添加剂。
为检测某食品中亚硫酸盐含量(通常以1 kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:
(1)气体A的主要成分是________。
为防止煮沸时发生暴沸,必须先向烧瓶中加入________ ;通入N2的目的是________。
(2)写出甲方案第①步反应的离子方程式:______________
__________________________________________________________。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗。
其操作方法是
________________________________________________
__________________________________________________________。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果________(填“偏高”“偏低”或“无影响”)。
(5)若取样品w g,按乙方案测得消耗0.01000 mol·L-1I2溶液V mL,则1 kg样品中含SO2的质量是________g(用含w、V的代数式表示)。
专题九 弱电解质的电离平衡溶液的酸碱性 解析
1.C A 项中没有说明对应的压强和温度,不能说明11.2 L O 2的物质的量就是0.5 mol ,故A 错误;水的离子积常数随温度的升高而增大,pH 随温度升高而减小,故B 错误;反应热ΔH 随相应的化学计量数的改变而改变,相同条件下,后者的ΔH 是前者的二倍,故D 错误。
2. C 醋酸溶液中存在CH 3COOH CH 3COO -+H +,加水稀释时,电离平衡向右移动,故将pH =3的醋
酸溶液稀释10倍,其pH 小于4,但大于3,A 项不正确;若H 2A 是弱酸,则HA -在溶液中存在两个平衡:
HA -H ++A 2-(电离平衡),HA -+H 2O H 2A +OH -
(水解平衡),电离程度和水解程度的相对大小决定了溶液的酸碱性,如NaHC O 3溶液显碱性,NaHSO 3溶液显酸性,故B 项不正确;完全中和时,生成正盐NaCl 和CH 3COONa ,由于CH 3COO -的水解而使溶液显碱性,故溶液呈中性时酸未被完全中和,C 项正确;氯化银的溶度积常数表达式为K sp =c (Ag +)·c (Cl -),c (Cl -)越大,c (Ag +)越小,故Ag +浓度大小顺序应为:④>①>②>③,D 项不正确。
3.C 当a =b 时,HA 与BOH 恰好完全反应生成正盐,由于HA 与BOH 的强弱未知,所以BA 溶液的酸碱性不能确定,A 错误;温度不一定是在25 ℃,B 错误;K W =c (H +)·c (OH -),依据c (H +)=K W =c (H +)·c (OH -),可知c (H +)=c (OH -),故溶液呈中性,C 正确;D 选项不论溶液显何性,依据电荷守恒均有c (H +)+c (B +)=c (OH -)+c (A -),错误。
4. 答案:(1)N 2和SO 2 碎瓷片(或沸石) 使产生的SO 2全部逸出
(2)SO 2+H 2O 2===2H ++SO 2-4
(3)向滴定管注入少量标准液,倾斜转动滴定管润洗全部内壁后从尖嘴放出液体,重复操作2~3次
(4)无影响
(5)0.64V w
解析:(1)亚硫酸盐与稀硫酸反应生成SO 2气体,因同时通入了N 2,所以气体A 的主要成分为N 2和SO 2。
为防止煮沸时发生暴沸,必须先向烧瓶中加入碎瓷片;为了减小实验操作误差,通入N 2可使生成的SO 2全部逸出,保证被吸收液全部吸收。
(2) SO 2具有还原性,可被氧化剂H 2O 2氧化,反应的离子方程式应为SO 2+H 2O 2===2H ++SO 2-4。
(3)用NaOH 标准溶液润洗滴定管的操作为:滴定管用蒸馏水洗涤干净后,加入少量NaOH 标准液,将滴定管横放,轻轻转动,均匀润洗滴定管内壁,然后将润洗液从下端尖嘴处放出,重复操作2~3次。
(4)若用盐酸代替硫酸,生成的SO 2气体中混有少量HCl ,因SO 2用碱液吸收后需再用盐酸调节溶液至弱酸性,因此混合气体中含有HCl ,对实验结果无影响。
(5)反应为H 2O +SO 2-3+I 2===SO 2-4+2I -+2H +,n (SO 2)=n (SO 2-3)=n (I 2)=0.01000 mol ·L -1×V ×10-3 L =V ×10-5
mol ,因此1 kg 样品中含SO 2的质量为:V ×10-5 mol ×64 g·mol -1w g ×1000 g =0.64 V w
g 。
]。
