测量空气中氧气含量的一种方法
测定空气中氧气含量的步骤
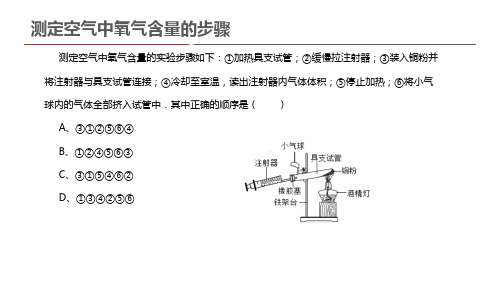
测定空气中氧气含量的步骤
分析:空气成分的测定要求装置的气密性要良好,在过程中要保证装置内的氧气与给定药 品充分反应,所以在实验过程中,要来回移动注射器保证要让气体完全消耗.
解答:解:装入铜粉并将注射器与具支试管连接(③),加热具支试管(①),缓慢拉注 射器(②),停止加热(⑤),将小气球内的气体全部挤入试管中(⑥),等到冷却到室温 读数(④).所以答案为A.故选A
测定空气中氧气含量的步骤
测定空气中氧气含量的实验步骤如下:①加热具支试管;②缓慢拉注射器;③装入铜粉并 将注射器与具支试管连接;④冷却至室温,读出注射器内气体体积;⑤停止加热;⑥将小气 球内的气体全部挤入试管中.其中正确的顺序是( )
A、③①②⑤⑥④ B、①②④⑤⑥③Biblioteka C、③①⑤④⑥② D、①③④②⑤⑥
空气中的氧气含量的测定

空气中的氧气含量的测定空气中的氧气含量是指单位体积空气中所含的氧气分子数量。
测定空气中的氧气含量对于环境保护、气候研究以及工业生产等领域具有重要意义。
本文将介绍几种常见的测定方法及其原理,包括气体分析仪法、电化学法和光学法。
一、气体分析仪法气体分析仪法是一种常见的测定空气中氧气含量的方法。
该方法利用气体分析仪对空气中的氧气进行定量测定。
气体分析仪根据氧气与其他气体的不同性质,通过物理或化学原理将氧气与其他气体分离,然后测量氧气的浓度。
常用的气体分析仪包括气相色谱仪、红外吸收法和质谱仪等。
二、电化学法电化学法是一种基于氧气与电极反应的测定方法。
该方法利用氧气与电极表面发生反应,产生电流信号,通过测量电流的大小来确定氧气的含量。
常见的电化学法有极谱法和电解法。
极谱法利用氧气在电极表面的还原或氧化反应产生的电流信号来测定氧气含量;电解法则通过电解液中氧气与电极表面的反应,利用电流大小来测定氧气含量。
三、光学法光学法是一种利用光的吸收或散射来测定氧气含量的方法。
该方法利用氧气对特定波长的光的吸收或散射特性进行测量。
常用的光学法有红外吸收法和荧光法。
红外吸收法利用氧气对红外光的吸收特性进行测定;荧光法则利用氧气与荧光染料的化学反应产生的荧光强度来测定氧气含量。
测定空气中的氧气含量可以采用气体分析仪法、电化学法和光学法等多种方法。
不同的方法适用于不同的情况和需求。
在实际应用中,需要根据具体的测量要求选择合适的方法,并注意测量的准确性和可靠性。
通过测定空气中的氧气含量,可以更好地了解环境质量,促进环境保护和科学研究的发展。
测定空气中氧气含量的实验

测定空气中氧气含量的实验实验一: 使用铁还原法测定空气中氧气含量引言:空气中的氧气是维持生命所必需的气体之一。
在某些领域,如医学、环境科学和工业生产中,了解空气中氧气含量的准确测量至关重要。
本实验将介绍一种简单而常用的方法,即铁还原法,来测定空气中的氧气含量。
材料与方法:1. 氧气仪:用于准确测量空气中的氧气含量。
2. 铁棒:作为还原剂。
3. 燃烧器:用于将氧气浓缩到一定程度。
4. 烧杯:用于容纳还原反应的产物。
5. 水:用于将产生的氧化铁溶解。
6. 毛细管:用于收集空气样品。
步骤:1. 启动氧气仪,并等待其稳定。
2. 将燃烧器与氧气仪连接,将氧气浓缩到一定程度。
3. 将铁棒放入燃烧器中,并点燃燃烧器,使铁棒开始燃烧。
4. 使用毛细管收集空气样品,将其导入氧气仪中,测量并记录氧气含量。
5. 将产生的氧化铁放入烧杯中,加入适量的水进行溶解。
6. 再次测量氧气含量,以验证实验结果的准确性。
结果与讨论:通过使用铁还原法测定空气中的氧气含量,可以得到准确的结果。
在实验中,我们观察到氧气与铁棒发生反应生成氧化铁的现象。
通过测量产生的氧化铁溶液中的氧气含量,我们能够推算出空气中的氧气含量。
此方法快捷、简单,并且实验结果可靠,因此被广泛应用于各个领域。
1 结论:本实验使用铁还原法测定空气中氧气含量的方法,通过观察铁与氧气反应生成氧化铁的现象,以及后续的氧化铁溶液中氧气含量的测量,得出了相对准确的结果。
这一方法具有简单、可靠、快捷的特点,适用于各个领域中对空气中氧气含量的测量需求。
实验二: 使用电解法测定空气中氧气含量引言:空气中的氧气含量对于生命的维持和环境的平衡至关重要。
本实验将介绍一种常用的方法,即电解法,用于测定空气中的氧气含量。
该方法基于氧气与电解液发生反应,通过电解液的变化来推算氧气的含量。
材料与方法:1. 电解槽:用于容纳电解液和电极。
2. 电极:用于引发氧气与电解液的反应。
3. 电解液:用于促进氧气与电极的反应。
测定空气中氧气的含量实验原理

的气密性要____良_好___;⑤反应完成后要待冷却至室温再读数。 常用药品是 红磷 、 铜丝 等。 可不不可可以以,用因蜡为烛蜡烛代燃替烧红生磷成来的是消气耗体氧二气氧?化碳和水,瓶内压强不会减小。
分析
• 装置的容量小,受热气体容易膨胀, 导致误差偏大
• 反应过程中当氧气的浓度下降到不 能支持可燃物燃烧时,反应也就终止 了,导致结果偏小。
实验装置的再设计 讨论分析:上述选用
的装置用哪些不足之 处?请指出来。
请你选用上述可以用的药品,设计一个 更好的装置,并简单说明设计的理由。
铁夹
红磷 水
一些测定氧气含量的装置,说出它的优缺点
空气中氧气含量测定实验考什么?
1、药品、器材的选择 2、关键步骤 3、关键操作及原因解释 4、关键现象的观察和记录 5、实验思想方法(控制变量法、转换法、如何重复实验---) 6、实验数据的分析处理 7、结论及应用 8、异常现象的解释 9、误差分析 10、实验改进及评价
思考:该反应之所以可以用来测定空气中的氧气, 其原理是什么?
可供选择的物质有:铁丝,铝箔
讨论分析:上述物质可否用来测 定氧气含量?
选择除氧剂
补充的物质有:白磷,化学性
铁夹
质与红磷相似,燃烧生成P2O5;
镁条,可直接在空气中燃烧,生
成物也是固体
镁条
镁条实验演示 水
根据实验现象思考:燃烧生成固体的,还需要考虑 什么因素?
镁
选择除氧剂
点燃
• 2Mg + O2= 2MgO
空气中氧气含量的测定

空气中氧气含量的测定测量原理:利用燃烧法测定空气中氧气的含量的原理是利用红磷燃烧消耗密闭容器中的氧气,使密闭容器内压强减小,在大气压的作用下,进入容器内水的体积即为减少的氧气的体积。
药品:红磷或白磷和水,并且红磷要过量。
所用的装置:图1(老教材)图2(新教材)实验成功的关键:(1)红磷需过量(2)装置必须密封(3)导管内先注满水(4)冷却到室温后,打开弹簧夹实验中出现的现象(打开止水夹前后)和结论:现象:红磷在集气瓶内燃烧,产生黄白色火焰,放出热量,生成大量白烟(五氧化二磷小颗粒),冷却后,打开弹簧夹,水经导管进入集气瓶,进入水的体积约占集气瓶内空气总体积的1/5。
反应的文字表达式:结论:空气中氧气约占空气总体积的1/5剩余气体主要是谁?有何性质?有何用途?主要是氮气。
氮气不支持燃烧,自身也不燃烧。
难溶于水,也不与水反应。
氮气是制硝酸和化肥的重要原料;氮气的化学性质很不活泼,是一种常用的保护气,如焊接金属时用氮气作保护气,灯泡中充入氮气以延长使用寿命,食品包装时充氮气以防腐;医疗上在液氮冷冻麻醉条件下做手术;超导材料在液氮的低温环境下显示超导性能。
误差分析:1.测得空气中氧气的体积分数偏小:(1)红磷不足(2)装置气密性不好(3)导管事先未注满水(4)装置未冷却就打开弹簧夹2.测得空气中氧气的体积分数偏大:(1)燃烧匙插入得太慢,导致空气受热膨胀逸出(2)弹簧夹没有夹紧,导燃烧红磷时空气从弹簧夹逸出实验探究:药品:用C、S、Fe、Mg、蜡烛代替红磷,行不行?装置:改变点燃红磷方法(如电打火、热的鹅卵石或玻璃棒,加热,热水,放大镜等)来使装置更严密,防止空气散失。
图3 图4图51.在“空气中氧气含量的测定”实验探究中,(1)甲同学设计了如下实验方案。
如图所示,在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开弹簧夹,水流入集气瓶。
实验过程中,观察到主要现象是__________________________________________________ ,反应方程式是________________________________________________________。
空气中氧气含量的测定实验

3.空气中氧气含量的测定实验
红磷燃烧现象
(1)实验装置:如下图所示。
(2)实验原理:利用红磷燃烧消耗密闭集气瓶内空气中的 氧气
,使密闭集气瓶内的 压强减小
,在大气压的作用下,将水压入集气瓶,进入集气瓶中水的体积即是 氧气的体积 。
(3)实验步骤:检查装置的 气密性
;集气瓶内加入少量水,以水面为基准线,把集气瓶分成五等份;点燃 过量的红磷
,立即伸入瓶中,把塞子塞紧;红磷燃烧停止后,冷却到 室温
,打开弹簧夹,观察现象。
(4)实验现象:烧杯中的水进入集气瓶内,水面上升约1/5
(5)实验结论:空气中含有约占空气体积1/5的O 2 。
(6)误差分析:①测量结果小于1/5的原因:红磷用量不足,氧气未消耗尽;装置的气密性不好,当集气瓶内氧气消耗尽时,瓶内压强减小,瓶外空气进入集气瓶;装置未冷却至室温就打开弹簧夹。
②测量结果大于1/5的原因可能是:弹簧夹未夹紧乳胶管,在红磷燃烧过程中,有少量瓶内气体沿导管排出。
温馨提示 ①测量氧气的体积必须是易和氧气反应且没有气体生成的物质。
此装置中铁、木炭、硫不能用作测定空气中氧气含量的反应物。
②测量的反应物一定要足量,装置必须密封。
(7)其他装置:。
空气中氧气含量的测定实验步骤

空气中氧气含量的测定实验步骤以空气中氧气含量的测定实验步骤为标题,下面将介绍一种简单可行的实验方法。
一、实验原理空气中氧气的含量可以通过化学方法进行测定。
实验中,我们将利用一种叫做亚硝酸铵的试剂来测定氧气的含量。
亚硝酸铵可以与氧气反应生成氮气和水,根据反应的化学计量关系,我们可以通过测定反应前后亚硝酸铵的消耗量来计算出空气中氧气的含量。
二、实验材料和仪器1. 亚硝酸铵试剂:用于测定氧气含量的化学试剂,可以在化学试剂商店购买到。
2. 硫酸:用于稀释亚硝酸铵试剂的化学试剂,可以在化学试剂商店购买到。
3. 烧杯:用于容纳试剂和反应溶液的实验器具,可以在实验室中找到。
4. 精密天平:用于称取试剂和反应溶液的质量,可以在实验室中找到。
5. 滴定管:用于滴定反应溶液的实验器具,可以在实验室中找到。
6. 酚酞指示剂:用于指示反应溶液中亚硝酸铵的消耗情况,可以在化学试剂商店购买到。
三、实验步骤1. 准备工作:将亚硝酸铵试剂称取一定量(例如1克)放入烧杯中,并加入适量的硫酸稀释。
注意,亚硝酸铵试剂具有一定的危险性,操作时需佩戴防护手套和眼镜,避免接触皮肤和眼睛。
2. 反应过程:将烧杯中的试剂溶液加热至沸腾,保持沸腾状态2-3分钟,以保证反应充分进行。
反应过程中会产生大量气泡,这是氮气的释放。
3. 滴定反应:使用滴定管将酚酞指示剂滴入反应溶液中,溶液会由无色变成粉红色。
继续滴定亚硝酸铵试剂,直到溶液从粉红色变回无色为止。
滴定过程中,每滴加入的亚硝酸铵试剂量需记录下来。
4. 实验结果计算:根据滴定过程中亚硝酸铵试剂的消耗量,可以计算出空气中氧气的含量。
根据化学计量关系,每滴亚硝酸铵试剂消耗量相当于一定体积的氧气。
通过测定滴定液中亚硝酸铵试剂的总消耗量,我们可以推算出空气中氧气的含量。
四、实验注意事项1. 在实验过程中,要注意安全操作,避免接触试剂和反应溶液。
实验结束后,要及时清洗实验器具。
2. 实验中的滴定过程要仔细,每滴加入的亚硝酸铵试剂量需准确记录,以保证实验结果的准确性。
空气中氧含量的测定

空⽓中氧含量的测定⼀、引⾔氧⽓是地球上所有⽣物⽣存的必要条件,对于空⽓中氧含量的准确测定,不仅对于环境科学、⼤⽓化学、⽣物学等领域的研究具有重要意义,也直接关系到⼈类⽣活质量和健康。
因此,掌握空⽓中氧含量的测定⽅法和技术,对于现代社会的发展⾄关重要。
⼆、空⽓中氧含量测定⽅法的分类⽬前,测定空⽓中氧含量的⽅法主要分为两⼤类:化学分析法和物理分析法。
1.化学分析法:这种⽅法主要通过化学反应来测定空⽓中的氧含量。
其中,燃烧法和碘量法是最常⽤的两种⽅法。
燃烧法是通过燃烧样品中的有机物,使氧⽓与有机物反应⽣成⼆氧化碳和⽔,然后通过测定⼆氧化碳或⽔的⽣成量来推算氧含量。
碘量法则是利⽤碘与氧⽓的化学反应,通过测定碘的消耗量来推算氧含量。
2.物理分析法:这种⽅法主要利⽤物理原理来测定空⽓中的氧含量。
其中,⽓相⾊谱法和氧电极法是最常⽤的两种⽅法。
⽓相⾊谱法是通过将空⽓中的氧⽓分离出来,然后通过⾊谱柱进⾏分离和检测,从⽽测定氧含量。
氧电极法则是利⽤氧电极对氧⽓的电化学性质进⾏测定,通过测定电流或电位的变化来推算氧含量。
三、空⽓中氧含量测定⽅法的优缺点1.化学分析法的优点在于操作简单、成本低廉,适⽤于⼤批量样品的测定。
但是,这种⽅法存在误差较⼤、易受⼲扰等缺点,且对于低氧含量的测定精度不⾼。
2.物理分析法的优点在于测定精度⾼、稳定性好,适⽤于对氧含量要求较⾼的场合。
但是,这种⽅法存在操作复杂、成本较⾼等缺点,且对于样品的处理和分析技术要求较⾼。
四、空⽓中氧含量测定的实际应⽤空⽓中氧含量的测定在环境保护、⼯业⽣产、医疗卫⽣等领域有着⼴泛的应⽤。
例如,在环境保护领域,通过对空⽓中氧含量的监测,可以评估空⽓质量,为环保政策的制定提供科学依据。
在⼯业⽣产领域,氧含量的准确测定对于保证产品质量、提⾼⽣产效率具有重要意义。
在医疗卫⽣领域,氧含量的测定对于评估患者的呼吸功能、指导氧疗等具有重要作⽤。
五、结论综上所述,空⽓中氧含量的测定⽅法和技术对于现代社会的发展具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
测量空气中氧气含量的一种方法
一、实验原理
白磷或红磷的燃烧要消耗掉空气中的氧气,生成固体P2O5,几乎不占气体空间。
4P + 5O22P2O5
在密闭容器中,稍过量的磷燃烧停止后,容器中的氧气应被耗尽。
为了防止出现因局部缺氧而使磷的燃烧停止的现象,实验中采用推动注射器的方法使空气流动,从而保证燃烧充分。
二、实验装置(如图)
三、实验用品
具支试管、100mL注射器、玻璃棉、自制燃烧匙、乳胶管、玻璃导管、白磷、红磷。
四、实验操作
实验一
①用水量法测量出具支试管(反应管)的体积V1。
②按实验装置图1连结好装置,在反应管底部首先铺上一些玻璃棉,再将左边注射器的活塞玻筒调整到V2=50mL处。
③放入少量白磷后,在试管底部稍微加热,大约在55℃时开始燃烧,生成的P2O5呈白烟。
在狭窄的反应管中,空气很快消耗掉,产生的火焰不明显,对温度计不会有危险。
④在白磷燃烧的同时用两个注射器将空气来回推动,直到燃烧结束为止。
⑤等反应结束,试管完全冷却后,读取注射器剩下的空气体积V3。
⑥氧气含量的计算:理论值==(V1+V2)/5 实验值==V2-V3
实验二
①用水量法测量出具支试管(反应管)的体积V1。
②按实验装置图2连接好装置,实验中所用燃烧匙是用铁丝或丝制得,再将左边注射器的活塞玻筒调整到V2==50mL处。
③点燃燃烧匙中的红磷,迅速插入具支试管中,将塞子塞紧,在密闭反应管中生成P2O5的白烟。
④在红磷燃烧的同时用两个注射器将空气来加推动,直到燃烧结束为止。
⑤等反应结束,度管完全冷却后,读取注射器剩下的空气体积V3,氧气的计算方法同实验一。
五、优点
该实验装置具有读数快捷准确的特点,有较好的教学意义。
