高二化学镁和铝及其化合物
02镁、铝及其化合物-【化学方程式】高考重要化学方程式汇总

(1)用惰性电极电解熔融MgCl2
①化学反应:MgCl2 Mg+Cl2↑
②离子反应:Mg2++2Cl- Mg+Cl2↑
③反应应用:工业上炼镁原理
(2)用惰性电极电解MgCl2溶液
①化学反应:MgCl2+2H2O Mg(OH)2↓+Cl2↑+H2↑
②离子反应:Mg2++2Cl-+2H2O Mg(OH)2↓+Cl2↑+H2↑
①化学反应:KAl(SO4)2+2Ba(OH)2 K[Al(OH)4]+2BaSO4↓
②离子反应:Al3++2SO42-+2Ba2++4OH- 2BaSO4↓+[Al(OH)4]-
(2)向明矾溶液中滴加Ba(OH)2溶液至Al3+沉淀完全
①化学反应:2KAl(SO4)2+3Ba(OH)2 K2SO4+3BaSO4↓+2Al(OH)3↓
(3)MgCl2溶液与石灰乳反应
①化学反应:MgCl2+Ca(OH)2 Mg(OH)2↓+CaCl2
②离子反应:Ca(OH)2+Mg2+ Mg(OH)2↓+Ca2+
③反应应用:海水提镁中富集镁的原理
(4)氯化镁晶体脱水
①化学反应:MgCl2·6H2O MgCl2+6H2O
②HCl的作用:带走部分水蒸气,抑制MgCl2的水解,得到无水MgCl2
2.四羟基合铝酸盐溶液和二氧化碳反应
(1)量不同,反应不同,现象相同
①少量CO2:2[Al(OH)4]-+CO2 2Al(OH)3↓+CO32-+H2O
镁铝及其化合物(1)概要

反应现象:镁条剧烈燃烧,放出大量的热,发出耀
眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有 熔融物落入沙中。
高温
Fe2O3+2Al === 2Fe + Al2O3
铝热剂 问题 1、镁条的作用是什么?
2、氯酸钾的作用是什么? 结论:铝也是还原剂,在一定的条件下与某些金属
氧化物反应,把其中的金属还原成单质。所以一些 活泼的金属也可作还原剂。
O2
具有抗腐蚀的性能
点燃
点燃
2Mg+ O2 = 2MgO 4Al+ 3O2 = 2Al2O3
点燃
N2 3Mg+ N2 = Mg3N2
质
加热
反 S Mg+ S = MgS
加热
2Al+ 3S =Al2S3
应
点燃
点燃
Cl2 Mg+Cl2 = MgCl2
2Al+ 3Cl2 = 2AlCl3
与 氧
H2O Mg+2冷H水2O反应=△缓M慢g(OH)2↓+2HA2l↑+6H冷2O水△几= 乎2A不l(反O应H)3 ↓+3H2↑
Al(OH)3+OH-=AlO2ˉ+2H2O
类别 主要用途
中强碱,水溶液能够使酚 酞变红
两性氢氧化物
制MgO和镁盐 制备Al2O3和净水剂,治疗胃酸
实验室 制法
Mg2++2OHˉ = Mg(OH)2↓Al3++3NH3•H2O=Al(OH)3
↓+Biblioteka NH4+ 其它方法思考:
(1)Al(OH)3为何既能与酸又能与强碱液反应?
4、镁、铝的制备及用途
高三化学一轮复习【镁、铝及其化合物】

在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有自我抗腐蚀能力铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等易错点:(1)常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
(2)铝不但能与酸(H +)反应,还能够与碱溶液反应,表现为特殊性。
2Al +2OH -+2H 2O===2AlO -2+3H 2↑。
其反应机理应为:铝先与强碱溶液中的水反应生成H 2和Al(OH)3,然后Al(OH)3再与NaOH 反应生成H 2O 和NaAlO 2,反应中铝作还原剂,水作氧化剂,NaOH 无电子得失。
(3)铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动性顺序其后的金属氧化物反应。
铝不能与MgO 反应,铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
(4)Mg 在CO 2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
同时镁与氮气反应生成Mg 3N 2。
二、铝的重要化合物1.氧化铝(1)物理性质 色态: ;硬度: ;熔点: 。
(2)化学性质①属于两性氧化物,写出有关反应的离子方程式:,②电解 化学方程式为 2Al 2O 3(熔融)=====电解4Al +3O 2↑。
(3)用途熔点很高,是一种较好的耐火材料,天然产刚玉的成分是Al 2O 3,还可制作各种宝石。
2.氢氧化铝 (1)物理性质Al(OH)3是一种难溶于水的白色胶状物质,具有较强的吸附能力。
(2)化学性质 ①两性Al(OH)3的电离方程式为Al(OH)3既能溶于强酸又能溶于强碱,且都生成盐和水。
与强酸反应: , 与强碱溶液反应: 。
②不稳定性Al(OH)3受热分解: 。
(3)制备①向铝盐中加入氨水,离子方程式为 。
②NaAlO 2溶液中通入足量CO 2,离子方程式为 。
③NaAlO 2溶液与AlCl 3溶液混合:离子方程式为 。
高考化学一轮复习 专题十四 镁、铝及其化合物 考点二 镁、铝化合物的性质及应用教学案
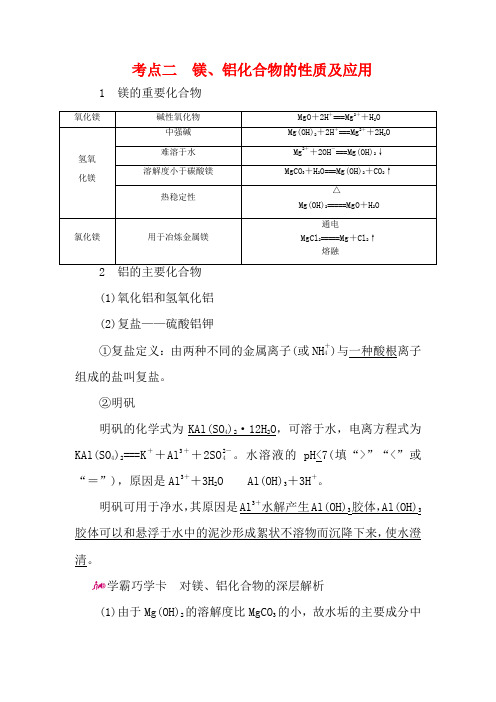
考点二 镁、铝化合物的性质及应用1 镁的重要化合物 氧化镁 碱性氧化物 MgO +2H +===Mg 2++H 2O 氢氧化镁 中强碱Mg(OH)2+2H +===Mg 2++2H 2O 难溶于水 Mg 2++2OH -===Mg(OH)2↓ 溶解度小于碳酸镁MgCO 3+H 2O===Mg(OH)2+CO 2↑ 热稳定性 Mg(OH)2=====△MgO +H 2O氯化镁 用于冶炼金属镁 MgCl 2=====通电熔融Mg +Cl 2↑2 铝的主要化合物(1)氧化铝和氢氧化铝(2)复盐——硫酸铝钾①复盐定义:由两种不同的金属离子(或NH +4)与一种酸根离子组成的盐叫复盐。
②明矾明矾的化学式为KAl(SO 4)2·12H 2O ,可溶于水,电离方程式为KAl(SO 4)2===K ++Al 3++2SO 2-4。
水溶液的pH<7(填“>”“<”或“=”),原因是Al 3++3H 2O Al(OH)3+3H +。
明矾可用于净水,其原因是Al 3+水解产生Al(OH)3胶体,Al(OH)3胶体可以和悬浮于水中的泥沙形成絮状不溶物而沉降下来,使水澄清。
学霸巧学卡 对镁、铝化合物的深层解析(1)由于Mg(OH)2的溶解度比MgCO 3的小,故水垢的主要成分中是Mg(OH)2,而非MgCO3。
(2)Al2O3、Al(OH)3只与强酸、强碱溶液反应,与氨水和碳酸溶液不反应。
(3)Al3+只能存在于酸性溶液中,AlO-2只能存在于碱性溶液中。
若将分别含Al3+和AlO-2的盐溶液混合,发生反应:Al3++3AlO-2+6H2O===4Al(OH)3↓。
(4)Al2O3、Al(OH)3是中学阶段接触的唯一与碱反应的金属氧化物和氢氧化物,经常应用到除杂、计算题中,所以一定要熟记这两个反应的离子方程式。
(5)明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,与氯气消毒原理不同。
1.思维辨析(1)在加热情况下利用氢气还原氧化铝的方法得到金属铝。
镁、铝及其化合物方程式

镁及其化合物1.镁与氮气、氧气、氯气等非金属单质反应 2Mg+O 2点燃2MgO Mg +Cl 2点燃MgCl 2 3Mg+N 2点燃Mg 3N 22.镁与CO 2反应3. Mg 3N 2与水反应 2Mg+CO 2点燃2MgO+C Mg 3N 2+6H 2O=3Mg(OH)2↓+2NH 3↑4.镁与氯化铵反应5.镁的冶炼Mg+2NH 4Cl=MgCl 2 + 2NH 3↑+ H 2↑ MgCl 2(熔融)= Mg+Cl 2↑铝及其化合物1、铝在氧气、氯气中燃烧:4Al +3O 22Al 2O 32Al +3Cl 22AlCl 32、铝与稀硫酸反应:2Al +3H 2SO 4=Al 2(SO 4)3 +3H 2 ↑(2Al +6H +=2Al 3++3H 2 ↑) 3、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O =2NaAlO 2+3H 2 ↑ (2Al +2OH -+2H 2O =2AlO 2-+3H 2 ↑) 4、铝和氧化铁高温下反应:2Al +Fe 2O 3=Al 2O 3+2Fe 5、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4=Al 2(SO 4)3 +3H 2O (Al 2O 3+6H +=2Al 3++3H 2O ) 6、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH =2NaAlO 2+H 2O (Al 2O 3+2OH -=2AlO 2-+H 2O )8、电解氧化铝的熔融液:2Al 2O 3(熔融)== 4Al +3O 2 ↑ 9、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4=Al 2(SO 4)3 +6H 2O (Al(OH)3 +3H +=Al 3++3H 2O ) 10、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH=NaAlO 2+2H 2O (Al(OH)3 +OH -=AlO 2-+2H 2O )11、加热氢氧化铝:2Al(OH)3 =Al 2O 3+3H 2O 12、向氯化铝溶液中加入氨水:AlCl 3 +3NH 3·H 2O=Al(OH)3 ↓+3NH 4Cl(Al 3++3NH 3·H 2O=Al(OH)3 ↓+3NH 4+)13、氯化铝溶液与氢氧化钠溶液:氢氧化钠不足时:AlCl 3+3NaOH=3NaCl +Al(OH)3 ↓ (Al 3++3OH -=Al(OH)3 ↓)氢氧化钠过量时:AlCl 3 +4NaOH=NaAlO 2+3NaCl +2H 2O (Al 3++4OH -=AlO 2-+2H 2O ) 14、向偏铝酸钠溶液通入二氧化碳气体:CO 2不足时:2NaAlO 2+CO 2+3H 2O =2Al(OH)3 ↓+Na 2CO 3(2AlO 2-+CO 2+3H 2O =2Al(OH)3 ↓+CO 32-)CO 2过量时:NaAlO 2+CO 2+2H 2O =Al(OH)3 +NaHCO 3(AlO 2-+CO 2+2H 2O=Al(OH)3 +HCO 3-)15、偏铝酸钠溶液与盐酸:盐酸不足时:NaAlO 2+HCl +H 2O =Al(OH)3 ↓+NaCl (AlO 2-+H ++H 2O=Al(OH)3 ↓)盐酸过量时:NaAlO 2+4HCl =NaCl +AlCl 3+2H 2O (AlO 2-+4H +=Al 3++2H 2O ) 16、偏铝酸钠溶液与氯化铝溶液:AlCl 3+3NaAlO 2+6H 2O =3NaCl +4Al(OH)3↓(Al 3++3 AlO 2-+6H 2O =4Al(OH)3 ↓)电解电解。
高考化学专项复习——镁、铝及其化合物

高考化学专项复习——镁、铝及其化合物金属镁的有关化学方程式1、镁在O 2中点燃: 2Mg + O 2== 2MgO2、与N 2反应: 3Mg + N 2== 3Mg 3N 23、与热水反应:Mg +2H 2O=== Mg(OH)2+H 2↑4、镁与酸反应: Mg +2HCl===MgCl 2+H 2↑5、与CO 2反应:2Mg +CO 2 === 2MgO +C6、海水提镁时,沉淀镁 :Mg 2++2OH -=== Mg(OH)2↓7、电解得Mg :MgCl 2(熔融)=== Mg+Cl 2↑8、MgO 与HCl 反应: MgO + 2HCl== MgCl 2 + H 2O9、Mg(OH)2与酸反应:Mg(OH)2 + 2H +==Mg 2++2H 2O金属铝的有关化学方程式Δ 点燃通电 点燃1.Al 与Cl 2反应:2Al+3Cl 2=== 2AlCl 32.Al 与O 2反应:4Al+3O 2=== 2Al 2O 33.铝热反应:2Al+Fe 2O 3===Al 2O 3+2Fe4.Al 与HCl 反应:2Al + 6H + == 2Al 3++ 3H2↑5.Al 与NaOH 反应:2Al+2OH --+2H 2O == 2AlO 2-- +3H 2↑6.Al 2O 3与HCl 反应:Al 2O 3+6H + === 2Al 3+ + 3H 2O7.Al 2O 3与NaOH 反应:Al 2O 3+2OH -===2AlO -2+H 2O8.Al 2O 3熔融电解:2Al 2O 3(熔融)=====通电冰晶石 4Al + 3O 2↑9.Al(OH)3与HCl 反应:Al(OH)3+3H + ===2Al 3+ + 3H 2O10. Al(OH)3与NaOH 反应:Al(OH)3+OH -===AlO -2+2H 2O11.Al(OH)3受热分解:2Al(OH)3===Al 2O 3+ 3H 2O12.Al(OH)3制备方法(1)Al 3+与碱(NH 3·H 2O )反应:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4(2)AlO 2—与酸(CO 2+H 2O )反应:(CO 2少量):2NaAlO 2+CO 2+3H 2O ===CO 32- +2Al(OH)3↓(CO 2过量):AlO -2+CO 2+2H 2O===Al(OH)3↓+HCO -3(3)双水解反应(Al 3++AlO 2—):Al 3++ 3AlO -2+6H 2O=== 4Al(OH)3↓13.明矾净水原理:Al 3++ 3H 2O===Al(OH)3↓+3H +Δ高温14.AlCl3与NaOH反应:(1)向AlCl3中加NaOH:Al3++ 3OH-===Al(OH)3↓Al(OH)3+ OH-==AlO-2+2H2O(2)向NaOH中加AlCl3:Al3++4OH-===AlO-2+2H2O15.偏铝酸盐的水解:AlO-2+2H2O===Al(OH)3↓+OH --16.偏铝酸盐与HCl反应:(1)向NaAlO2加HCl:AlO-2+H++2H2O===Al(OH)3↓+H2OAl(OH)3↓+3H+===Al3++3H2O(2)向HCl加NaAlO2:AlO-2+4H+===Al3++2H2O镁、铝及其重要化合物一、镁及其重要化合物的性质及用途1、镁(1)物理性质银白色、有金属光泽、密度、硬度均较小、熔点低、有良好的导电、传热、延展性(2)化学性质①与O 2、Cl 2、N 2等非金属非金属反应与O 2反应: 2Mg + O 2 == 2MgO与Cl 2反应: Mg + Cl 2 == MgCl 2与N 2反应: 3Mg + N 2 == 3Mg 3N 2②与热水反应 Mg +2H 2O===Mg(OH)2+H 2↑③与酸反应:发生置换反应、放出H 2Mg +2HCl===MgCl 2+H 2↑④与CO 2反应2Mg +CO 2 === 2MgO +C(3)用途可用于生产合金、冶金工业上作还原剂和脱氧剂2、海水提镁沉淀Mg 2+ :Mg 2++2OH -=== Mg(OH)2↓制取MgCl 2 : Mg(OH)2 + 2HCl==MgCl 2+2H 2OΔ点燃电解得Mg :MgCl 2(熔融) === Mg+Cl 2↑3、镁的重要化合物(1)MgO :碱性氧化物与H 2O 反应: MgO + H 2O== Mg(OH)2与HCl 反应: MgO + 2HCl== MgCl 2 + H 2O(2)Mg(OH)2 :中强碱、难溶于水Mg(OH)2 + 2H +==Mg 2++2H 2O二、铝及其重要化合物的性质及用途1、铝(1)物理性质银白色固体、硬度较软、有良好的导电、传热性;(2)主要化学性质①与非金属单质反应 与Cl 2反应:2Al+3Cl 2===2AlCl 3 点燃 通电与O 2反应:4Al+3O 2===2Al 2O 3(常温下生成氧化膜)②与酸反应氧化性算:与冷的、浓的浓硫酸、浓硝酸-钝化非氧化性酸:2Al + 6HCl== 2AlCl 3+ 3H2↑2Al + 6H + ==2Al 3++3H2↑③与强碱反应:2Al+2NaOH+2H 2O == 2NaAlO 2+3H 2↑2Al+2OH --+2H 2O == 2AlO 2-- +3H 2↑④铝热反应:2Al+Fe 2O 3==Al 2O 3+2Fe(3)制备2Al 2O 3(熔融)=====通电冰晶石4Al + 3O 2↑镁、铝性质比较:判断正误,正确的划“√”,错误的划“×”(1)铝粉与氧化镁共热可制取金属镁( ×)(2)将镁条点燃后迅速伸入集满CO2的集气瓶,集气瓶中产生浓烟并有黑色颗粒产生(√)(3)MgO的熔点很高,可用于制作耐高温材料(√)(4)铝在自然界中有游离态和化合态两种形式( ×)(5)一定条件下,镁能与一些非金属氧化物反应,铝能与一些金属氧化物反应(√)(6)足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气(×)2.氧化铝和氢氧化的性质(1)氧化铝的性质(2)氢氧化铝的性质Al2O3+2OH-===2AlO-2+H2O2Al2O3(熔融)=====电解4Al+3O2↑氢氧化铝的制备①向铝盐中加入氨水:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4(不能用强碱)②NaAlO 2溶液中通入足量CO 2:AlO -2+CO 2+2H 2O===Al(OH)3↓+HCO -3(不能用强酸)③NaAlO 2溶液与AlCl 3溶液混合:Al 3++ 3AlO -2+6H 2O=== 4Al(OH)3↓ 注意1、氧化铝和氢氧化铝是两性化合物,但叙述时应强调是与强酸和强碱。
高考化学一轮复习专题十四镁、铝及其化合物考点一镁、铝单质的性质及应用教学案

专题十四 镁、铝及其化合物考纲展示 命题探究考点一 镁、铝单质性质及应用1 镁(1)物理性质具有银白色金属光泽固体,密度、硬度均较小,熔点较低,有良好导电、传热与延展性。
(2)构造――→-2e -(3)化学性质①与非金属单质反响(O 2、N 2、Cl 2)2Mg +O 2=====点燃2MgO (产生耀眼白光)3Mg +N 2=====点燃Mg 3N 2Mg +Cl 2=====点燃MgCl 2②与水(反响)Mg +2H 2O=====△Mg(OH)2+H 2↑③与酸反响Mg +2H +===Mg 2++H 2↑④与盐反响Mg +Cu 2+===Mg 2++Cu⑤与CO 2反响2Mg +CO 2=====点燃2MgO +C(4)用途生产合金,冶金工业上用作复原剂与脱氧剂。
(5)冶炼工业炼镁:MgCl 2=====通电熔融Mg +Cl 2↑ 2 铝(1)铝物理性质及用途(2)铝构造与存在铝位于元素周期表第3周期ⅢA 族,原子构造示意图为。
铝元素在地壳中含量丰富,仅次于硅。
自然界中铝全部以化合态存在。
(3)化学性质①与非金属单质反响(O 2、Cl 2、S)2Al +3Cl 2=====△2AlCl 32Al +3S=====△Al 2S 3(水溶液不存在)②与酸反响③与碱反响2Al +2OH -+2H 2O===2AlO -2+3H 2↑④与盐反响Al +3Ag +===Al 3++3Ag⑤与氧化物反响(铝热反响)2Al +Fe 2O 3=====高温2Fe +Al 2O 34Al +3MnO 2=====高温3Mn +2Al 2O 3Cr 2O 3+2Al=====高温2Cr +Al 2O 3(4)冶炼工业炼铝:2Al 2O 3=====通电熔融4Al +3O 2↑ 学霸巧学卡 对镁、铝性质深层理解(1)Mg 在CO 2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器与泡沫灭火器灭火。
同时镁与氮气反响生成Mg 3N 2。
镁和铝及其重要化合物

镁、铝及其重要化合物一、镁及其化合物镁合金强度高,机械性能好,制造汽车,飞机,火箭的重要材料,冶金时,镁常用作还原剂和脱氧剂.常温下氧化生成氧化物保护层,具有抗腐蚀的性质.镁与O2,N2,CO2等气体燃烧.2Mg+O22MgO CO2+2Mg2MgO+C 3Mg+N2Mg3N2镁与SiO2:2Mg+SiO2=2MgO+Si镁与冷水反应很慢,在加热时反应加快.Mg+2H2O=Mg(OH)2+H2↑镁与非氧化性酸.Mg+2HCl=MgCl2+H2↑镁与水解显酸性的盐溶液的反应. Mg+2NH4Cl =MgCl2+2NH3+H2↑镁盐与氨水,产生Mg(OH)2沉淀.Mg(OH)2又能溶解在NH4Cl溶液中.前者由Mg(OH)2的特殊溶解性决定.在常见的难溶性氢氧化物中,Mg(OH)2的溶解度最大.故产生Mg(OH)2的条件:浓的Mg2+ 盐溶液与浓氨水反应.后者是由Mg(OH)2的电离性质和的水解性质决定.通常认为Mg(OH)2完全电离,能溶解在饱和NH4Cl溶液中,MgCl2+2NH3·H2OMgOH2+2NH4Cl海水提镁:㈠海水加碱,得氢氧化镁沉淀,沉淀分离出来再加盐酸,变成氯化镁;后过滤,干燥,电解得镁.Mg2++2OH-==Mg(OH)2↓,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2Mg+Cl2↑㈡从海水提取出食盐、KCl、Br2以后留下的母液浓缩,得到卤块,主要成分是MgCl2·6H2O,然后脱水, MgCl2·6H2OMgCl2+6H2O,最后电解熔融的氯化镁得到镁.氧化镁(白色粉末,高熔点,碱性氧化物,)与水缓慢作用,与酸反应.MgO+2HCl=MgCl2+H2O MgO+H2OMg(OH)2氢氧化镁(白色粉末,难溶于水)与H+作用,与NH4Cl溶液作用,对热不稳定.Mg(OH)2+2HCl=MgCl2+2H2O Mg(OH)2MgO+H2O↑二、铝及其化合物铝(银白色金属,导电性仅次于银、铜和金。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京小赛车多久开奖
[单选]制图物体的形状概括通过合并、()和夸大来实现。A.选取B.删除C.修改 [单选]中度以上支气管扩张病人适当而有效的治疗方案()A.病变局限于一肺段、一叶或多段者,可作肺段或肺叶切除B.应用抗生素治疗感染C.体位引流排除脓液D.一般支持疗法E.以上均不正确 [多选]下面对于“如何服从上司”说法正确的是?()A、服从、汇报B、补台、挡驾C、尽职、贪功D、尊重、参谋 [单选]检查隐患,除观察表面迹象外,对于隐患的具体情况应采用()方法查明。A.探测B.巡查C.目测D.目估 [单选]吸啜作用发生在下列哪个阶段。()A、水流上升初期B、水流上升末期C、水流下降初期D、水流下降末期 [名词解释]船体装配 [单选]根据国际惯例,若分保接受人1型题]下列各类疾病中,主要应采取第一级预防的是()A.职业病B.冠心病C.糖尿病D.高血压E.病因不明,难以觉察预料的疾病 [配伍题,B1型题]发生在输血2小时内最常见的并发症是()</br>输血的同时输注低渗性液体易发生()A.变态反应B.发热反应C.过敏反应D.溶血反应E.细菌污染反应 [填空题]教育行政部门负责学校卫生工作的行政管理。()负责对学校卫生工作的监督指导。 [单选,A1型题]妇女怀孕早期,胎儿生长缓慢,基础代谢增加不明显,一般从怀孕第几个月开始增加热能供给量()A.2个月B.3个月C.4个月D.5个月E.6个月 [单选]扩张型心肌病M型超声心动图检查时,二尖瓣前、后叶开放幅度小且时间短而呈()A.拱桥状改变B.鱼口样改变C.城墙样改变D.圆顶形改变E.钻石样改变 [单选]衡器使用后,必须将秤盘、秤体仔细擦干净,并存放在()处A、固定、干燥B、固定、平稳C、干燥、阴凉D、固定 [单选]甲公司成立后在某银行申请开立了一个用于办理日常转账结算和现金收付的账户,该账户的性质属于()。A.基本存款账户B.一般存款账户C.专用存款账户D.临时存款账户 [单选]以下不是属于系统的特性的是()。A、抽象性B、目的性C、相关性D、整体性 [单选]对个人购买自用普通住房发放的按揭贷款最长不得超过()年。A.30B.35C.40D.45 [单选]抵御对化脓性细菌感染的非特异性免疫细胞是()A.单核细胞B.巨噬细胞C.中性粒细胞D.TCRγδ+细胞E.肥大细胞 [单选]制作胶版前要检查()上的文字是否有错误、是否符合规范要求等问题。A.稿纸B.轮廓C.小版样D.大版样 [单选]货物采购合同属于().A.承包合同B.货物合同C.采购合同D.买卖合同 [多选]使用IC卡进行劳务实名制管理可实现的管理功能有()。A.人员信息管理B.门禁管理C.工资管理D.实时跟踪E.考勤管理 [单选]下列哪项不是前列腺增生的并发症()A.尿毒症B.血尿C.感染D.肾结石E.腹股沟疝 [单选]港口与航道工程施工总承包一级资质企业,一级资质项目经理应不少于()人。A.10B.15C.20D.30 [单选]皮肤直接与外界接触具有().A、保护、排泄作用,但不具有调节作用B、保护、排泄、调节体温的作用C、保护、调节作用,但不具有排泄作用 [问答题]对初步核实的结果如何处理? [单选]“第三者责任险”是()。A.因施工给对第三者造成的物资损失或人员伤亡承担赔偿责任B.承保施工过程中由于第三者的责任造成承包商人身伤亡、疾病或财产损失C.施工过程中施工人员发生的意外事故保险D.承保施工过程中因发生意外事故造成工地及邻近地区第三者的人身伤亡、疾病或财 [单选,A型题]下列哪种片剂要求在21℃±1℃的水中3分钟即可崩解分散()A、泡腾片B、分散片C、舌下片D、普通片E、溶液片 [单选]自2001年1月1日起,进出口电池产品()由检验检疫机构实施强制检验。A.汞含量B.铅含量C.硫含量D.含量 [单选,A1型题]对医术与医德之间关系错误的理解是()A."医乃仁术"B.有能力做的就应该去做C."大医精诚"D.临床医学决策同时也是伦理决策E.前沿医学技术应用于临床必须有医德参与 [单选]关于会计的职能,下列说法错误的是()。A.会计的职能是会计本质的外在表现形式B.会计的基本职能是核算和监督C.预算、检查、考核分析等手段是会计的核算职能D.会计核算具有完整性、连续性和系统性的特点 [单选,A2型题,A1/A2型题]问带下,量不多,色黄,质稠,有臭气,阴部干涩,五心烦热,失眠多梦,多为()A.湿热下注B.湿毒蕴结C.阴虚挟湿D.脾阳虚E.肾阳虚 [填空题]WindowsServer2003的安装可分为()和()两种方式。 [单选]下列子宫肌瘤病理特点和声像图的表现,哪一项是错误的A.肌瘤由平滑肌与纤维结缔组织交叉组成B.肌瘤周围有被压缩的肌纤维所组成的假包膜C.假包膜与肌瘤间有疏松的结缔组织D.肌瘤变性时,声像图可为圆形无回声区E.肌瘤结节多呈圆形无回声区 [单选]对多个四线组来说,()在红组的顺时针方向时,该端为A端。A.绿线B.兰线C.绿组D.兰组 [单选,A1型题]第三次卫生革命的目标是()A.预防和控制传染病B.心脑血管疾病和肿瘤C.促进人类健康长寿D.医学社会化E.发展初级卫生保健 [多选]按照《建设工程质量管理条例》,工程竣工验收应当具备的条件有()。A.有完整的技术档案和施工管理资料B.部分工程的质量必须优良C.有施工单位签署的工程保修书D.有勘察、设计、监理单位共同签署的质量合格文件E.已经办理竣工结算 [单选,A1型题]"热因热用"属于()A.正治B.反治C.扶正D.因地制宜E.标本兼治 [单选]张某受到本单位的降职处分,现欲行使申诉控告权,以下说法正确的有:()A.只能先向原处理机关申请复核,不能直接向同级公务员主管机关提出申诉B.张某若向原处理机关申请复核,应在15日以内提出申请C.若张某直接向作出降职处分的机关的上一级机关提出申诉,该机关应当在受理 [判断题]检验检疫机构对获得《出口玩具质量许可证》企业出口的玩具实行抽查检验。()A.正确B.错误 [单选,A1型题]中药说明书中所列的【主要成分】系指处方中所含的()A.有效部位B.主要药味C.有效成分D.有效部位或有效成分E.主要药味、有效部位或有效成分 [问答题,简答题]清洁生产与可持续发展的关系是什么?
