镁和铝及其化合物共30页
第二节 铝、镁及其化合物

沉淀
Mg2++2OH-===gCl2+2H2O
蒸发 结晶
析出MgCl2·6H2O
脱水 在氯化氢气流中使MgCl2·6H2O脱水制得无水氯化镁 电解熔融氯化镁制得镁:
电解
电解 MgCl2(熔融) ===== Mg+Cl2↑
[注意] ①由MgCl2·6H2O到无水MgCl2,必须在HCl气流 中加热,以防MgCl2水解。
解析:稀释浓硫酸应该是把浓硫酸慢慢注入水中,A项错误; 两者反应为Mg2++2OH-===Mg(OH)2↓,因此能够观察到沉 淀产生,B项正确;过滤应该用玻璃棒引流,而不是直接倒入 已装好滤纸的漏斗中,C项错误;氮气与镁反应生成氮化镁, 得不到镁粉,D项错误。 答案:B
4.(2020·雅礼中学月考)从海水中提取镁的工艺流程如图所示:
2.根据如图的转化关系判断,下列说法正确的是(反应条件已
略去)
()
A.生成等质量H2时,①和②反应消耗n(HCl)=n(NaOH) B.反应③中氧化剂与还原剂的物质的量之比为2∶3 C.反应③和④消耗等量的Al时,生成的n(Cu)∶n(Fe)=
3∶2 D.反应⑤的离子方程式为Al3++3OH-===Al(OH)3↓
Cr2O3等金属氧化 物
发生铝热反应
能在CO2中燃烧: 点燃
2Mg+CO2=====2MgO+C
3.用途 (1)镁合金——用于制造火箭、导弹和飞机的部件。 (2)镁——制造信号弹和焰火。
4.从海水中提取镁 (1)工艺流程
(2)基本步骤及主要反应
制熟 石灰
高温 CaCO3=====
CaO+CO2↑,CaO+H2O===Ca(OH)2
第二节 铝、镁及其化合物
考点一
镁、铝/ 理清概念 基础需抓牢
第8讲 镁、铝及其化合物

报 (H-除外):_r_(_H_+__)<_r_(_M__g_2+__)<__r(_N_3_-_)_<_r_(_C_l_-_)_____,Mg在元素
作 业
报
_A_lO__2-_+__C__O_2_+__2_H_2_O_=__=_=_A_l_(O__H__)3_↓__+__H_C__O_- 3___________。
告
二
③NaAlO2 溶液与 AlCl3 溶液混合:
_3_A_lO__2-_+__A__l3_+_+__6_H_2_O_=__=_=_4_A_l_(O__H__)3_↓_________________。
可用于焊接金属、冶炼高熔点贵重金属
第2部分 第3章 第8讲
第7页
名师伴你行 ·高考一轮总复习 ·化学
报 告
(4)铝的工业制备
通电
一
电解熔融Al2O3:__2_A__l2_O__3(_熔__融__)_冰=_=_晶=_=_石=__4_A_l_+__3_O_2_↑_______
课 时
(5)铝的用途
作 业
报 告
3.(2016浙江理综)化合物Mg5Al3(OH)19(H2O)4可作环保型
一 阻燃材料,受热时按如下化学方程式分解:
课
时
△ 2Mg5Al3(OH)19(H2O)4=====27H2O↑+10MgO+3Al2O3
作 业
报
(1)写出该化合物作阻燃剂的两条依据__反__应__分__解__吸__热__降__低__
告
二 _温__度__,__固__体__氧__化__物__隔__绝__空__气__,__水__蒸__气__稀__释__空__气_______。
第2部分 第3章 第8讲
镁铝及其化合物1.ppt
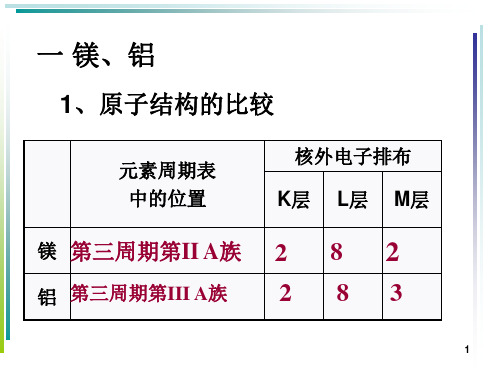
1、原子结构的比较
元素周期表 中的位置
核外电子排布 K层 L层 M层
镁 第三周期第II A族 2 8 2
铝 第三周期第III A族
2 83
1
2、物理性质的比较
相似点:均为 银白色 ;均为 轻金属 ; 熔点均 较低 ;硬度均 较小。都具有金属的 通性 不同点:镁在密度、熔点、沸点、硬度上 均 小于(或低于) 铝。
D.反应速率之比为2∶3
【解析】由关系式:Mg~H2,2Al~3H2,可知产生 等量H2时,消耗Mg、Al物质的量之比为3∶2,故A 项 正 确 。 二 者 质 量 之 比 为 4∶3 , 摩 尔 质 量 之 比 为
8∶9,反应速率之比为3∶2。
25
二、“铝三角”及其应用
1.“铝三角”是指Al3+、Al(OH)3和AlO2-相 互转化的三角关系(如下图)
分析依据:
2Al+6HCl === 2AlCl3+3H2↑ 2Al~6HCl~3H2↑
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
2Al~2NaOH~3H2↑
【思考】
1.等质量的铝分别与足量的盐酸、氢氧化钠溶液反应,
所得H2的体积之比是多少? VHCl(H2):VNaOH(H2)=1:1
共存
②AlO2-不能与 H+、HCO3-(直接反应); Al3+、NH4+、 Fe3+(双水解)大量共存 28
即时巩固
4、某无色溶液中加入铝粉只产生氢气,则下列离子
组中可能大量共存的是 ( C D )
A.K+ 、NH4+、Cl- 、NO3- B.K+、Na+、Cl-、HCO3C.K+、NH4+、Cl-、SO42- D.K+、CO32-、Cl-、SO325、某无色透明溶液跟金属Al反应,放出H2。试判断 下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、 OH-、 CO32-、HCO3-、NO3-,下列两种情况能存在此溶液中。 当生成Al3+时,可能存在 __H_+_、__M__g_2_+_、__S_O_4_2- 当生成AlO2-时,可能存在_O__H_-_、__B__a_2_+、__N_ O3_-_ 29
2024届高考一轮复习化学课件(人教版):金属及其化合物-铝、镁及其化合物

_M__g_(_O_H__)2_+__C_a_2_+_;
HCl
(3)制备MgCl2:___M__g_(O__H_)_2_+__2_H_C_l_=_=_=_M__g_C_l_2_+__2_H_2_O__、__M_g_C__l2_·_6_H_2_O_=_=_△=_=_=__M_g_C__l2__
_+__6_H__2O__; (4)电解MgCl2:__M_g_C__l2_(_熔__融__)=_电=_=_解=_=__M_g_+__C__l2_↑__。
4. 在 Mg(HCO3)2 溶 液 中 加 入 足 量 的 Ca(OH)2 溶 液 , 最 终 得 到 的 沉 淀 是 MgCO3 和
CaCO3( × )
关键能力
化工流程中的“镁”
1.以混有SiO2的MgCO3为原料制备氧化镁的实验流程如图: 下列说法错误的是
√A.酸浸的离子方程式为 CO23-+
返回
<
>
镁 海水提镁
必备知识
1.从海水中提取镁的流程
主要化学反应为 (1)制石灰乳:_C_a_C_O__3=_高_=_=温_=_=_C__a_O__
_+__C_O_2_↑__、C__a_O_+__H_2_O__=_=_=_C_a_(_O_H__)2;
(2)沉淀Mg2+:M__g_2_+_+__C_a_(_O_H__)2_=_=_=_
2.从海水中提取镁的工艺流程如图所示:
回答下列问题:
(1)海水通过结晶、过滤得到的固体物质主要是__N__a_C_l__。
(2)怎样使MgCl2·6H2O失去结晶水得到MgCl2? 答案 将晶体置于HCl气体氛围中脱水。
(3)上述工艺流程涉及到的基本反应类型有__化__合__反__应__、__分__解__反__应__、__复__分__解__反__应___。
2020届高考化学一轮复习人教版镁、铝及其化合物PPT课件(127张)

Mg+Cl2↑ Mg(OH)2+H2↑
【易错警示】 (1)由MgCl2·6H2O到无水MgCl2,必须在 HCl气流中加热,以防MgCl2水解。
(2)因镁在高温下能与O2、N2、CO2等气体发生反应,故工 业电解MgCl2得到的镁,应在H2氛围中冷却。
高频考点二 铝的性质及应用
1.判断正误(正确的打“√”,错误的打“×”)。 (1)铝制餐具可长时间存放酸性或碱性食物(×) (2)常温下,铝与稀硝酸反应可以制取氢气(×) (3)铝在空气中耐腐蚀,所以铝是不活泼金属(×)
(4)氧化铝是金属氧化物,也是碱性氧化物(×) (5)冶炼铝时常用焦炭作还原剂(×) (6)1 mol Al与足量的硫酸或足量的氢氧化钠溶液反应转移 电子数相同(√) (7)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液 反应生成偏铝酸盐(×)
2.在做铝的燃烧实验时,用坩埚钳夹住一小块铝箔,在 酒精灯上加热至其熔化,会看到的现象是铝箔熔化,失去光 泽,但熔化的铝并不滴落。原因是____________________
【答案】 D
考点2 海水中提取镁
【解析】 从海水中提取镁时,首先用石灰乳将海水中的 Mg2+沉淀出来,然后再用盐酸将其溶解得到MgCl2溶液,从 MgCl2溶液中冷却结晶得到MgCl2·6H2O,在HCl气流中加 热MgCl2·6H2O得到无水MgCl2,最后电解熔融MgCl2得到 单质Mg。
【答案】 D
【解析】 金属Mg可以在CO2中燃烧生成MgO和C,同时 放出大量的热,A项正确;工业上通过电解熔融MgCl2来制取 金属镁,B项错误;Mg和稀硫酸反应时,滴加少量硫酸铜溶 液,Mg置换出Cu,形成原电池,化学反应速率加快,C项正 确;Mg在空气中燃烧发出耀眼的白光,常用来制造信号弹和 焰火,MgO的熔点很高,常用作耐高温材料,D项正确。
镁、铝及其化合物1 人教课标版精选教学PPT课件

一、金属的通性
1.金属的晶体结构 金属具有一些共同性质,是由它们的原子 结构和晶体结构的相似性决定的。金属的价电子 较少,容易失去价电子变成金属离子,这些释放 出的价电子,在整个晶体内自由移动,人称“自 由电子”。金属晶体内的实际情况是“金属离子 沉浸在自由电子的海洋中”。换言之,是金属离 子和自由电子之间存在着较强的电性作用,使许 多金属离子和自由电子相互结合在一起形成晶体。
另外,加热并蒸干AlCl3的水溶液,由于AlCl3
+ 3H2O
Al(OH)3 + 3HCl 为 一 吸 热 反 应 , 且
HCl易挥发,加热会使平衡不断向右移动,AlCl3最
终 变 成 Al(OH)3 , 再 灼 烧 , 2Al(OH)3
Al2O3 +
3H2O , 最 后 留 下 的 物 质 为 Al2O3 。 而 加 热 并 蒸 干
是无色晶体,易溶于水,在水中电离的方程式
为KAl(SO4)2=K++Al3++2SO,同时发生水解
反应:Al3++3H2O
Al(OH)3+3H+,使
其水溶液显酸性。明矾水解所产生的胶状
Al(OH)3吸附能力很强,能吸附水里的杂质,并 形成沉淀,使水澄清,所以明矾常用作净水剂。
向KAl(SO4)2溶液中滴加Ba(OH)2生成的沉淀 的量判断:
铝热反应的应用:焊接钢轨,冶炼熔点 较高的金属,如:钒、铬、锰等。
4.有关Al(OH)3沉淀的图象规律
①向一定量的AlCl3溶液中逐滴加入NaOH溶液至 过量。见图(a)
有关离子方程式为Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=
+2H2O
②向一定量的NaOH溶液中逐滴加入AlCl3溶液至
镁、铝及其重要化合物精品课件2021届高考化学创新复习(95张PPT)
错因:Al(OH)3 胶粒具有吸附性,可用于净水,但不能消毒。
(5)相同质量的镁条分别在足量的 CO2 和 O2 中完全燃烧,所得固体的质 量相同。( × )
错因:Mg 与 CO2 反应除 MgO 外还有固体 C 生成,得到的固
体质量大。 (6)工业上制造镁粉时,可将镁蒸气在 N2 中冷却。( × ) 错因:热的镁蒸气可与 N2 发生反应。
2.铝的化学性质
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
写出图中标号反应的化学方程式或离子方程式:
② 02 2Al+3Cl2=点==燃==2AlCl3
④ 04 ⑤ 05
2Al+2OH-+2H2O===2AlO- 2 +3H2↑ 2Al+Fe2O3=高==温==Al2O3+2Fe (铝热反应)
解析 答案
考点二 铝的性质及应用
答案
[解析] 其反应原理分别为 2Al+6HCl===2AlCl3+3H2↑,2Al+ 2NaOH+2H2O===2NaAlO2+3H2↑。可见当参加反应的 HCl 和 NaOH 的 物质的量一样多时,产生 H2 的体积比是 1∶3,而题设条件体积比为 1∶2,说明此题投入的铝粉对盐酸来说是过量的,而对于 NaOH 来说是
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
基础自测
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
1.判断正误,正确的画“√”,错误的画“×”,并指明错因。
(1)工业电解熔融 MgCl2 得到的镁需在 CO2 气体中冷却。( × ) 错因:镁在高温下与 CO2 发生反应。 (2)常温下将铝片放入到浓硝酸或浓硫酸中没有明显现象,说明铝与这 两种溶液不能发生化学反应。( × ) 错因:铝片与浓硝酸(或浓 H2SO4)迅速反应,表面形成一层致密的
镁和铝及其重要化合物
镁、铝及其重要化合物一、镁及其化合物镁合金强度高,机械性能好,制造汽车,飞机,火箭的重要材料,冶金时,镁常用作还原剂和脱氧剂.常温下氧化生成氧化物保护层,具有抗腐蚀的性质.镁与O2,N2,CO2等气体燃烧.2Mg+O22MgO CO2+2Mg2MgO+C 3Mg+N2Mg3N2镁与SiO2:2Mg+SiO2=2MgO+Si镁与冷水反应很慢,在加热时反应加快.Mg+2H2O=Mg(OH)2+H2↑镁与非氧化性酸.Mg+2HCl=MgCl2+H2↑镁与水解显酸性的盐溶液的反应. Mg+2NH4Cl =MgCl2+2NH3+H2↑镁盐与氨水,产生Mg(OH)2沉淀.Mg(OH)2又能溶解在NH4Cl溶液中.前者由Mg(OH)2的特殊溶解性决定.在常见的难溶性氢氧化物中,Mg(OH)2的溶解度最大.故产生Mg(OH)2的条件:浓的Mg2+ 盐溶液与浓氨水反应.后者是由Mg(OH)2的电离性质和的水解性质决定.通常认为Mg(OH)2完全电离,能溶解在饱和NH4Cl溶液中,MgCl2+2NH3·H2OMgOH2+2NH4Cl海水提镁:㈠海水加碱,得氢氧化镁沉淀,沉淀分离出来再加盐酸,变成氯化镁;后过滤,干燥,电解得镁.Mg2++2OH-==Mg(OH)2↓,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2Mg+Cl2↑㈡从海水提取出食盐、KCl、Br2以后留下的母液浓缩,得到卤块,主要成分是MgCl2·6H2O,然后脱水, MgCl2·6H2OMgCl2+6H2O,最后电解熔融的氯化镁得到镁.氧化镁(白色粉末,高熔点,碱性氧化物,)与水缓慢作用,与酸反应.MgO+2HCl=MgCl2+H2O MgO+H2OMg(OH)2氢氧化镁(白色粉末,难溶于水)与H+作用,与NH4Cl溶液作用,对热不稳定.Mg(OH)2+2HCl=MgCl2+2H2O Mg(OH)2MgO+H2O↑二、铝及其化合物铝(银白色金属,导电性仅次于银、铜和金。
镁、铝及其化合物课件(78张)
题组一 Al2O3 和 Al(OH)3 的性质
应
能在 CO2 中燃烧:2Mg+ CO2=点==燃==2MgO+C
[深化] 1.铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保 护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。 2.铝与酸、碱反应的实质都是:A0l ―失―3e→- Al3+,2H+―得―2e→- H2, 只不过碱中的 H+来源于水的电离。氧化剂分别为酸和水。
[考纲要求] 1.了解镁、铝及其重要化合物的制备方法。 2.掌握镁、铝的主要性质及应用。 3.掌握镁、铝的重要化合物的主要性质及应用。
基础讲练 考点一 镁、铝的性质及应用
1.镁、铝的结构 镁和铝分别位于第三周期的ⅡA 族和ⅢA 族。它们的原子核外
均 有 3 个 电 子 层 , 其 原 子 结 构 示 意 图 分 别 为 Mg
1.下列物质既能与盐酸反应,又能与氢氧化钠溶液反应的是
() ①Ca(OH)2 ②Al2O3 ③Ca(HCO3)2 ④Al(OH)3 ⑤NaHSO4 ⑥Al ⑦(NH4)2S A.②④⑥ B.②③⑤⑥ C.①③④⑥ D.②③④⑥⑦
答案:A
3.铝对生物有毒害作用,尤其对人体的毒害更加严重。下列 说法不正确的是( )
A.不吃或少吃使用了含铝食品添加剂的食品 B.不能用铝制器皿长期存放酸性或碱性食品 C.杜绝铝制品在生产、生活中的应用 D.铝不属于重金属,它使人体中毒的原理与铅不同
解析:铝在生物体内长期积累会对神经系统等造成危害,故 A 正确;无论是铝还是其氧化物都能与酸或碱反应,故 B 正确;作为 金属材料,铝的优良性能比较多,比如导电性好、导热率高、轻便 易加工等,不能因其缺点而否定其优点,故 C 不正确;重金属使人 体中毒的原理是使蛋白质变性失活,与铝不同,故 D 正确。
镁和铝的重要化合物PPT高中化学精选教学课件课件 人教课标版
A.是碱性氧化物
B.与水化合成碱
C.高熔点
D.不易分解
2.用海水加石灰来提取Mg(OH)2是利用了Mg(OH)2的 性质:
A.溶解度比Ca(OH)2的小 B.不稳定受热分解生成MgO
C.碱性比Ca(OH)2的弱 D.白色粉末状固体
二、铝的重要化合物
1、氧化铝(Al2O3) (1)物理性质:
白色固体、熔点高、不溶于水,不与水化合。 (2)化学性质: ①与酸反应:Al2O3+6HCl=AlCl3+3H2O ②与碱反应:Al2O3+2NaOH=2NaAlO2+H2O
酸性: Al(OH)3+NaOH=NaAlO2+H2O
氢氧化铝既能跟酸反应生成盐和水, 又能跟碱反应生成盐和水,所以氢氧
化铝是两性氢氧化物。
氢氧化铝的两性可以下电离方程式来说明:
AlO2-
Al(OH)3
Al3+
当Al(OH)3遇碱时反应向左方向发展,遇酸 时反应向右方向发展。
注意:(1)氢氧化铝作为碱时是三元碱;作 为酸时是一元酸(HAlO3)。
舅舅拿着诊断单去询问另一位医生, 希望有 更好的 治疗方 法。不 久,他 从医生 的办公 室走出 来,只 见他步 履赼趄 ,满脸 哀愁。 姥姥对病情的诊断结果浑然不知。她 心疼我 们昼夜 照顾她 ,嘟囔 说:“ 我已经 活了将 近九十 岁,比 我的父 母、兄 弟和姐 妹活得 都长。 我活得 很知足 ,我活 够了! 我不想 再呆在 医院看 病,我 要回家 ,我要 回家! ”她在 病床上 吵着回 家,不 断用手 捶打着 病床, 她突然 间像是 一个小 孩子。
(2)氢氧化铝与酸碱反应时,弱酸弱 碱是不能把氢氧化铝溶解的。
3、硫酸铝钾( KAl(SO4)2 )
复盐的概念: 由两种不同的金属离子和一种酸根离子组
