(完整word版)南京工业大学2010-2011年分析化学试卷1.doc
有机试题答案B

南京工业大学 有机化学 试题 (B )卷试题标准答案2010--2011 学年第一学期 使用班级一、命名或写出下列化合物的结构式(本大题共10小题,每小题1。
5分,共15分)CH 3CCHCH 2CH 3CH 3CH 3CH 31.2. (Z)-3-甲基-4-异丙基-3-庚烯3. 反-1,3-二甲基环己烷4. 2,6-二甲基双环[3.1.1]庚烷5. 3-氯环己烯6. 3-丁烯-1-醇7.R-2-氯丙酸8.α-D-葡萄糖CH 2CH 2C CN BrO9.10. 3-溴噻吩二、单项选择题(本大题共20小题,每小题1。
5分,共30分)在每小题列出的四个备选项中只有一个是符合题目要求的,请将其代码填写在题后的括号三、用化学方法鉴别下列各组化合物(本大题共3小题,每小题3分,共9分) 苯酚环己醇环戊酮++1.2.乙二胺二乙胺三乙胺+3.甲酸乙酸乙二酸+四.完成下列反应(本大题共20个空,每空1分,共20分)1.CH 2ClCH 2CCHCH 2COCH 3CH 2COCH 3BrBr2.CH 3CH OHCH CH 3OH 3.BrMgBrCH 2CH 2OHCH 2CH 2OHBrBrCH 2CH 2CN4.NO 2CH 3CH 32CH 3CH 3NHAcBrCH 3Br NH 2CH 3BrCH 3CH 3NH 2COOHCOClCONH 26.CH 2OHHCOONa7.5.N CH 3CH 3+I-CH 2(H 3C)2NCH 2CH 2N(CH 3)38.CH 2OHCH 2OOCCH 39.N N SO 3HNH 2五、简答题(本大题共两小题,每题4分,共8分)1.(a ) (b )CH 3CH 332.由于伯卤烃首先形成碳正离子过度态,而伯碳正离子是很不稳定的,所以很快会重排为较稳定的仲碳正离子,所以很难形成题中的产物。
可以先用丙酰氯与苯发生酰基化,然后再利用克莱门森还原,即可得到较为理想的产品。
南京工业大学无机与分析化学试卷(下、A)

南京工业大学 无机与分析化学 试卷(下、下、A)A)(一页开卷一页开卷))2012—2013学年第二学期学年第二学期 使用班级使用班级 :全校相关专业:全校相关专业学院学院 专业专业 学号学号 姓名姓名题号题号 一 二 三 四 五 六 七 总分总分 得分得分一 、每题只有一个答案是正确的,请选择(每题2分,将答案填入答题表中)将答案填入答题表中)题号题号12 3 4 5 6 7 8 9 10 答案答案 题号题号 11 12 13 14 15 16 17 18 19 20 答案答案1. 取同浓度的Zn 2+-EDTA 配合物的溶液两份,分别用A :用NaOH 溶液控制pH=10.0,其条件稳定常数记作K'ZnY ZnY,A ,A ,B :用氨-氯化铵缓冲溶液控制pH= 10.0,条件稳定常数记作K'ZnY ZnY,B ,B ,。
正确的关系式是:正确的关系式是:2. 佛尔哈德法测定Cl -时,使用的指示剂是:时,使用的指示剂是:(A) Ag 2CrO 4 (B) 二氯荧光黄二氯荧光黄 (C) 甲基橙 (D) FeNH 4(SO 4)2 3. 在下列物质中,不能将KI 氧化成I 2的是:的是: (A) KIO 3 (B) FeNH 4(SO 4)2 (C) Fe(NH 4)2(SO 4)2 (D) CuSO 44. 下列说法正确的是:下列说法正确的是:(A) 非构晶离子的盐浓度越大,沉淀溶解度越大非构晶离子的盐浓度越大,沉淀溶解度越大 (B) 非构晶离子的盐浓度越大,沉淀溶解度越小非构晶离子的盐浓度越大,沉淀溶解度越小(C) 两种沉淀的溶度积相比,溶度积小的溶解度也小两种沉淀的溶度积相比,溶度积小的溶解度也小 (D) 不同种类沉淀的溶解度越大,溶度积也越大不同种类沉淀的溶解度越大,溶度积也越大5. 从磷元素的电位图φo (V) H 2PO 2-____-2.25V ____P 4_______________PH 3 |_____________-1.23V -1.23V____________| 可计算电对P 4/ PH 3的标准电极电位φo P4/PH3为:为:(A) -1.02V (B) -1.74V (C) -0.89V (D) -1.16V 6. 在配离子[Co(C 2O 4)2(en)]-中(en 为H 2N-CH 2-CH 2-NH 2),中心离子Co 3+的配位数是:的配位数是:(A) 3 (B) 4 (C) 5 (D) 6 7. 用Na 2C 2O 4标定KMnO 4,加入第一滴KMnO 4时,KMnO 4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO 4很快退色,最有效的措施是:很快退色,最有效的措施是:(A) 加大H 2C 2O 4浓度浓度(B) 加大酸度加大酸度 (C) 事先加入Mn 2+ (D) 加快滴KMnO 4的速度的速度opH lgαY(H)pH lgαY(H)pH lgαY(H)0.0 23.64 5.0 6.45 10.0 0.45 1.0 18.01 6.0 4.65 11.0 0.07 2.0 13.51 7.0 3.32 12.0 0.01 3.0 10.60 8.0 2.27 4.0 8.44 9.0 1.28 17. 碘量法中所用的指示剂为:碘量法中所用的指示剂为: (A) 淀粉溶液淀粉溶液 (B) 二甲酚橙二甲酚橙 (C) 亚甲基蓝亚甲基蓝 (D) 二苯胺磺酸钠二苯胺磺酸钠18. 晶形沉淀陈化的主要目的是:晶形沉淀陈化的主要目的是:(A) 增大沉淀的溶解度增大沉淀的溶解度 (B) 小颗粒长大,使沉淀更纯净小颗粒长大,使沉淀更纯净 (C) 避免后沉淀现象避免后沉淀现象 (D) 形成非晶型沉淀形成非晶型沉淀19. 当含有Mg 2+、Na +、Ag +、Al 3+离子混合液流过阳离子交换树脂时,最先流出和最后流出的离子分别是:的离子分别是:(A) Na +,Mg 2+(B) Ag +,Al 3+(C) Na +,Al 3+(D) Mg 2+,Ag +20. 已知M 与EDTA(Y)的lg K MY = 13.2,在pH = 5.0的HAc-NaAc 缓冲溶液中,αY(H) =106.45;αM(L) =102.4;αM(OH) =100.4;则在此条件下,lgK’MY 为:为: (A) 6.75 (B) 4.35 (C) 3.95 (D) 2.95 二、填空和简单计算(每题2分) 1. 称取0.3581g 的ZnO(M = 81.38)定容250.00mL ,吸取该溶液20.00mL ,用EDTA 溶液滴定。
南京工业大学《无机与分析化学》测试题答案

南京工业大学《无机与分析化学》测试题答案南京工业大学《无机与分析化学》测试题答案一.单选题(共4题,40.0分)1下列说法正确的是:A、溶解度小的沉淀总是向溶解度大的沉淀转化B、盐效应使沉淀的溶解度减小C、酸效应使沉淀的溶解度增大D、加水稀释后仍含有AgCl(s)的溶液来说,稀释前后的溶解度和溶度积均不变正确答案:D 我的答案:D2进行重量法分析,下列说法正确的是:A、称量形式和沉淀形式应一致B、对溶度性大的沉淀可用大量水洗涤对非晶型沉淀可用冷水洗涤D、对非晶型沉淀可用热溶液洗涤正确答案:D 我的答案:A3pH=3.5时用莫尔法测定Cl-含量,则测定结果A、偏高B、偏低C、无影响D、不确定正确答案:A 我的答案:A4下列条件中适于采用佛尔哈德法的是:A、滴定酸度在中性或弱酸性条件B、以荧光黄为指示剂滴定酸度为0.1~1.0mol·L-1D、以K2CrO4为指示剂正确答案:C 我的答案:C二.简答题(共3题,30.0分)1pH= 4时用莫尔法滴定Cl-,分析结果是准确的,还是偏低或偏高,为什么?正确答案:结果偏高。
pH≈4时,CrO42-酸效应较大,溶液中CrO42-浓度减小,指示终点的AgCrO4沉淀出现过迟。
我的答案:偏高,酸性增强使铬酸根转化为重铬酸根,铬酸银难溶,重铬酸银溶解度较大,所以此时铬酸银沉淀将出现延迟,故偏高2若试液中含有铵盐,在pH≈10时,用莫尔法滴定Cl-,分析结果是准确的,还是偏低或偏高,为什么?正确答案:结果偏高。
在pH≈10时,溶液中NH3型体的浓度较高,形成Ag-NH3络合物,需加入过量的Ag+才能出现终点,故结果偏高。
我的答案:偏高,因为银和铵盐会作用行成络合物3用佛尔哈德法测定Cl-时,未将沉淀过滤也未加硝基苯,分析结果是准确的,还是偏低或偏高,为什么?正确答案:结果偏低。
因为用佛尔哈德法测定Cl-时,若未将沉淀过滤也未加硝基苯,那么AgCl沉淀将发生转化,成为AgSCN,消耗过多滴定剂SCN-,由于是返滴定,故结果偏低。
南京工业大学无机分析化学题库试题1

南京工业大学无机分析化学题库试题1第二学期模拟试卷一、选择题1. 配合物[Cu(NH3)4]SO4的导电性和加入Ba2+后的现象是:(A) 导电、有沉淀(B) 导电、无沉淀(C) 不导电、有沉淀(D) 不导电、无沉淀2. 当0.01mol氯化铬(III)(CrCl3·6H2O)在水溶液中用过量的硝酸银处理时,有0.02mol 氯化银沉淀析出,此样品的分子式应表示为:(A) [Cr(H2O)6]Cl3 (B) [CrCl(H2O)5]Cl2 (C) [CrCl2(H2O)4]Cl (D)[CrCl3(H2O)3]3. 根据晶体场理论,形成高自旋配合物的理论判据是:(A) 晶体场分裂能>电子成对能(B) 电离能>电子成对能(C) 晶体场分裂能>成键能(D) 电子成对能>晶体场分裂能4. 有关EDTA酸效应的叙述中,正确的是:(A) pH越大,αY(H)越大(B) pH越大,αY(H)越小(C) pH值愈大,酸效应系数愈大(D) 酸度越大,酸效应系数愈小5. 关于EDTA滴定法滴定突跃的说法不正确的是(忽略金属离子的水解):(A) pH越大,突跃范围越小(B) KMY越大,突跃范围越大(C) M或Y浓度约达,突跃范围越大(D) pH越大,突跃范围越大6. 在化学反应Mn(NO3)2 + PbO2 + HNO3→HMnO4 + Pb(NO3)2中,还原剂是:(A) Pb(NO3)2 (B) PbO2 (C) Mn(NO3)2 (D) HMnO47. 原电池(-)Zn│Zn2+(mo l?L-1 )‖Ag+(mo l?L-1 )│Ag(+),已知:φoAg+/Ag=0.80V,φoZn2+/Zn=-0.76V,在298.15 K 时,该电池的反应平衡常数lgKθ为:(A) 26.4 (B) 52.9 (C) 63.3 (D) 79.8. Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O;能斯特方程表达式是:(A) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059lg [Cr2O72-](B) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059/3 lg [Cr2O72-][H+]14/[ Cr3+](C) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059/3 lg [Cr2O72-][H+]14/[ Cr3+]2(D) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059/6 lg [Cr2O72-]/[ Cr3+]29. 用Na2C2O4标定KMnO4,加入第一滴KMnO4时,KMnO4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO4很快退色,有效的措施是:(A) 加大H2C2O4浓度(B) 加大酸度(C) 加快滴KMnO4的速度(D) 加热10. φo Cr2O72-/ Cr3+ = 1.33V,φoFe3+/Fe2+= 0.68V,以K2Cr2O7滴定Fe2+,([H+]=1mol·L-1)滴淀突跃范围为:(A) 0.86~1.15V (B) 0.86~1.33V (C) 0.68~1.33V (D) 0.68~1.14V11. 可以用作标定Na2S2O3标准溶液的基准物质是:(A) KBrO3 (B) K2S2O8 (C) ZnO (D) 无水Na2CO312. 下列测定中需要加热的有:(A) KMnO4溶液测定H2O2 (B) KMnO4法测定MnO2(C) 碘量法测定Na2S (D) 溴量法测定苯酚13. 晶形沉淀陈化的目的是:(A) 增大沉淀的溶解度(B) 小颗粒长大,使沉淀更纯净(C) 避免后沉淀现象(D) 形成非晶型沉淀14. BaSO4在稀硫酸、氯化钠、EDTA和水中溶解度从大到小的顺序为:(A) EDTA>NaCl> H2O>稀H2SO4 (B) EDTA>NaCl>稀H2SO4>H2O(C) NaCl>稀H2SO4>H2O> EDTA (D) 稀H2SO4>NaCl>EDTA>H2O15. 进行重量法分析,下列说法正确的是:(A) 欲使沉淀净化,洗涤水量越多越好(B) 非晶型沉淀,一定用热溶液洗涤(C) 沉淀的洗涤剂只能是蒸馏水(D) 沉淀的体积越大越易洗净16. 下列哪组试剂是佛尔哈德法测定Cl-时全需使用?(A) FeNH4(SO4)2、K2CrO4 (B) KSCN、FeNH4(SO4)2(C) Fe(NH4)2(SO4)2 、硝基苯(D) K2CrO4、硝基苯17. 锰形成多种氧化态的化合物,其中最稳定的是:(A) 酸性介质中的Mn (Ⅱ) (B) 酸性介质中的Mn (Ⅶ)(C) 中性介质中的Mn (Ⅳ) (D) 中性介质中的Mn (Ⅵ)18. 下列混合离子能用氨水分离的是:(A) Cr3+和Cu2+ (B) Cu2+和Zn2+ (C) Fe3+和Cr3+ (D) Cr3+和Zn2+19. K+与四苯硼钠可以形成晶体沉淀,这种沉淀是:(A) 离子化合物(B) 螯合物(C) 分子晶体化合物(D) 离子对化合物20. 用等体积萃取并要求一次萃取率不小于99%,则分配比最小为:(A) 50 (B) 100 (C) 99 (D) 199二、填充题1. 配合物[Co(en)3]Cl3(en为乙二胺简写符号)的名称为______________________。
南京工业大学有机化学试卷整理集(吐血整理必做)
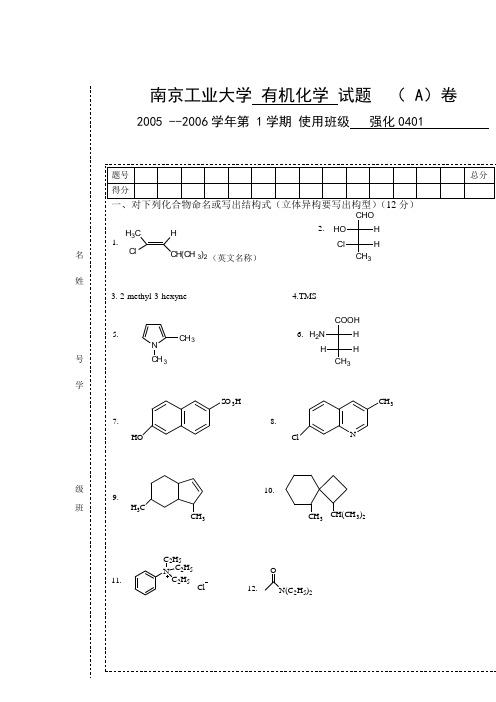
名姓号学级班11混酸混酸NHOKOHCH 3CH 2OHCH 3CH 2Br12N13.24+NaOH+Br 2N H 2O14NaNO , HClNH 20-5℃OH15.三:排序(6 )1.将下列化合物对亲电取代反应的容易程度排列成序BrNO2.比较下列羧酸的酸性COOHCH 3COOHNO 2COOHNO 2COOH3.比较下列化合物的碱性甲胺 二甲胺 氨 苯胺四、区别下列各组化合物:(4)1 甲酸 乙酸 乙醇CH 3OCH 3OOCH 3OCH 3OO CH 3C H 32.五 用化学方法分离下列各组化合物(6)1.邻甲苯酚 水杨酸 N-甲基苯胺 对甲基苯胺 甲苯2CH 3NO 2CH 3CN六 用指定的原料合成下列各化合物(小分子及无机试剂任选) (25)C H 2COOH1.BrC H 32.3.从苯出发合成多巴胺O HO HN H 24从丙二酸脂出发合成OCOOCH 3CH 3CH 3OOOC H 3CH 3CH 3COOH5.七、简要回答问题(19分)1 写出下述反应的机理H 5C 6H 2CCH 2C 6H 5O+C H 2C H 3ONaO CH CH 3OHOH 5C 6C 6H 5C H 3H 3H 3H3H 32.(1) 哪个化合物是手性分子? (2) 写出手性分子的稳定构象式。
3.化合物A (C 9H 10O )不能起碘仿反应,其红外光谱表明在1690cm -1处有一强吸收峰,其核磁共振数据如下:δ1.2(3H,t),δ3.0(2H,q),δ7.2(5H,m)。
写出A的结构并标注对应的化学位移。
南京工业大学有机化学B 试题(A)卷试题标准答案2008--2009 学年第二学期使用班级化学0701-2一:命名1.甲基丁二酸酐2.N,N-二甲基环戊甲酰胺3.3-吡啶磺酸4.溴化二甲基苄基十二烷基铵5.α-环己酮甲酸甲酯6.4-甲基-4’-乙氧基偶氮苯7.3-甲基-丁腈8.(2S,3S)-2-乙基-2,3-二羟基丁二酸9.3-呋喃甲酸10.-甲基葡萄糖二:完成反应C O O HC O O HN H OO1.2CH2NH2ONC H3C H3O H3CH3OC H34.ClON HO H5CH 3CH 3OC H 3OO C H 36NO 27.NH28.H 339.CH 3CNO HCH 3COOH O H10.N H 2NO 211.O 2NO 2NNO 2+NO 2NO 212.OONC H 3OONKNSO 3H13.N H 214.N 2ClNNOH15.三:排序BrNO>>>1.C O O HNO 2COOHNO 2COOHCOOHCH 3>>>2苯胺>>3.二甲胺甲胺>氨四:区别化合物1. 银镜反应,碳酸钠溶液 2. FeCl 3溶液 3. 五:分离1. 兴斯堡反应,蒸馏。
南京工业大学无机分析化学题库试题2

一、选择题1. 配位化合物的内界,若有多种无机配体和有机配体,其命名顺序为:(A) 无机阴离子-无机分子-有机配体(B) 无机分子-无机阴离子-有机配体(C) 有机配体-无机分子-无机阴离子(D) 有机配体-无机阴离子-无机分子2. [Cu(NH3)4]2+为内轨型配合物、平面四方形构型,其磁矩为:(A) 5.75?SUB>B (B) 3.87?SUB>B (C) 1.73?SUB>B (D) 0?SUB>B3. Fe2+有6个3d电子,配合物[Fe(CN)6]4-,△o= 395kJ·mol-1;Ep=213kJ·mol-1。
则晶体场稳定化能CFSE等于(kJ·mol-1):(A) -522 (B) -470.4 (C) -948 (D) -3094. 在等年度的Ca2+、Mg2+、Al3+、Fe3+溶液中,加入EDTA溶液,首先与EDTA形成配合物的是:(A) Ca2+ (B) Mg2+ (C) Al3+ (D) Fe3+5. 在pH = 12.00的溶液中,用EDTA滴定Ca2+和Mg2+混合液,测定的是:(A) Mg2+的量(B) Ca2+的量(C) Ca2+-Mg2+的量(D) Ca2++Mg2+的量6. 物质Fe3O4中的Fe的氧化数是(A) +2 (B) +3 (C) +4/3(D) +8/37. 已知: Fe3++ e = Fe2+φo = 0.77V;Zn2++ 2e = Zn φo = -0.76 VFe2++ 2e = Fe φo = -0.44V;Al3++ 3e = Al φo = -1.66 V上述物质中还原性最强的是(A) Zn (B) Fe2+(C) Fe (D) Al8. 人们规定标准电极在标准状态下的电极电位为0。
标准电极是:(A) 甘汞电极(B) 银电极(C) 氢电极(D) 铂电极9. 用能斯特方程φ=φθ+ (0.0592/n)lgC(氧化型)/C(还原型)计算φCr2O72-/Cr3+的电极电位时,说法不正确的是:(A) 温度应为298 K (B) Cr3+浓度增大则φ减小(C) H+浓度的变化对φ无影响(D) Cr2O72-浓度增大,则φ增大10. φo MnO4-/ Mn2+ = 1.45V,φoSn4+/Sn2+= 0.15V,以MnO4-滴定Sn2+,([H+]=1mol·L-1)其化学计量点的电极电位为:(A) 0.80V (B) 1.48V (C) 1.30V(D) 1.08V11. 可以直接配制的标准溶液是:(A) K2Cr2O7 (B) K2S2O8 (C) Na2S2O3 (D) Ce(SO4)212. 碘量法用纯Cu标定Na2S2O3标准溶液,将Cu溶解说Cu2+所用的溶剂为:(A) HNO3 (B) HCl (C) 浓H2SO4 (D) HCl + H2O213. 下列说法正确的是:(A) 聚集速度越大越易形成晶体沉淀(B) 过饱和度越大,定向速度越大(C) 聚集速度越小越易形成晶体沉淀(D) 过饱和度越小,定向速度越大14. 在下列措施中,不能增加ZnS沉淀溶液中Zn2+浓度(mol·L-1)的措施是:(A) 加HNO3 (B) 加水(C) 加Cu2+ (D) NaCl15. 下列说法不正确的是:(A) 称量形式的组成必须单一(B) 沉淀形式溶度积一定要小(C) 沉淀剂不纯对重量分析法无影响(D) 加入的沉淀剂的量不必准确16. 法扬司法测定Cl-时,使用的指示剂是:(A) Ag2CrO4 (B) 二氯荧光黄(C) Fe(NH4)2(SO4)2 (D) FeNH4(SO4)217. 工业上五氧化二钒的主要用途是做(A) 吸附剂(B) 表面活性剂(C)催化剂(D)氧化剂18. 下列离子的颜色为粉红色的是(A) [Fe(H2O)6]2+ (B) [Ni(H2O)6]2+ (C) [Ni(NH3)6]2+ (D) [Co(H2O )6]2+19. 阴离子交换树脂可分离下列哪组物质?(A) 氯化钠和氯化钾(B) 苯酚和醋酸(C) 氯化钠和溴化钠(D) 水和NaOH20. 用薄层层析法,以苯-乙酸乙酯为展开剂分离黄连素时,已知比移值为0.41,溶剂前沿距离为24.5 cm,则斑点中心只原点的距(A) 10.0cm (B) 14.5cm (C)10.3cm (D) 无法确定二、填充题1. 配离子[Co(NH3)4(NO2)Cl]+的名称为_____________________(若有多个答案,用”;“号间隔。
分析化学试题及答案[汇总].doc
![分析化学试题及答案[汇总].doc](https://img.taocdn.com/s3/m/d0bec9e102020740bf1e9b78.png)
分析化学试题及答案一.填空(每空1分,共28分,答在试卷上)1 •定量分析过程包插_______________ , _________________________ ,_____________________ 和______________ 四个步骤.2.根据有效数字计算规则计算:1.683 + 37.42x7. 3321.4-0. 056二14.43. _____________________________________________________________ 某酸的水溶液中,若6哄为0.28, 6 a-=5 8 那么6 为 _______________________________________________________ 。
4.含有ZF和A广的酸性缓冲溶液,欲在pH=5〜5. 5的条件下,用EDTA标准溶液滴定其中的Zn2;加入一定量六亚甲基四胺的作用是 _______ :加入NHF的作用是________ 「5.NaOH滴定HC1时,浓度增大10倍,则滴定曲线突跃范围增大___ 个pH单位;若为滴定叽,则突跃范围増大 ___ 个pll单位.6. _______________________________________________ 对于实验数据中的异常值的取舍,通常可根据_____________________________________________________ 、________ 和_________ 方法來判断。
7. _____________________________________________________ 莫尔法与佛尔哈徳法的指示剂分别为、_____________________________________________________________ 。
8.紫外可见分光光度计由_________ . ______________ , ________ 和____________ 四部分组成.9.检验两组结果是否存在显著性差异采用____ 检验法,检验两组数据的精密度是否存在显著性差异采用 ___ 检验法。
南京工业大学 无机与分析化学 试卷(下、A)

南京工业大学无机与分析化学试卷(下、A)(一页开卷)2012—2013学年第二学期使用班级:全校相关专业学院专业学号姓名一1. 取同浓度的Zn2+-EDTA配合物的溶液两份,分别用A:用NaOH溶液控制pH=10.0,其条件稳定常数记作K'ZnY,A,B:用氨-氯化铵缓冲溶液控制pH= 10.0,条件稳定常数记作K'ZnY,B,。
正确的关系式是:2. 佛尔哈德法测定Cl-时,使用的指示剂是:(A) Ag2CrO4(B) 二氯荧光黄(C) 甲基橙(D) FeNH4(SO4)23. 在下列物质中,不能将KI氧化成I2的是:(A) KIO3 (B) FeNH4(SO4)2(C) Fe(NH4)2(SO4)2(D) CuSO44. 下列说法正确的是:(A) 非构晶离子的盐浓度越大,沉淀溶解度越大(B) 非构晶离子的盐浓度越大,沉淀溶解度越小(C) 两种沉淀的溶度积相比,溶度积小的溶解度也小(D) 不同种类沉淀的溶解度越大,溶度积也越大5. 从磷元素的电位图φo(V) H2PO2-____-2.25V____P4_______________PH3|_____________-1.23V____________|可计算电对P4/ PH3的标准电极电位φo P4/PH3为:(A) -1.02V (B) -1.74V (C) -0.89V (D) -1.16V6. 在配离子[Co(C2O4)2(en)]-中(en为H2N-CH2-CH2-NH2),中心离子Co3+的配位数是:(A) 3 (B) 4 (C) 5 (D) 67. 用Na2C2O4标定KMnO4,加入第一滴KMnO4时,KMnO4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO4很快退色,最有效的措施是:(A) 加大H2C2O4浓度(B) 加大酸度(C) 事先加入Mn2+(D) 加快滴KMnO4的速度8. 下列混合离子能用氨水分离的是:(A) Cr3+和Cu2+(B) Cu2+和Zn2+(C) SO42-和Cl-(D) Fe3+和Al3+9. φo Cr2O72-/ Cr3+ = 1.33V,φo Fe3+/Fe2+= 0.68V,以K2Cr2O7滴定Fe2+,([H+] = 2mol·L-1)滴至70%时,溶液的电极电位为:(A) 0.70V (B) 1.01V (C) 1.35V (D) 0.67V10. 已知lgK MY =14.51,[M] = 0.010mol·L-1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、选择题(每小题 2 分,共 40 分)1(A)(B)(C)(D)23(A) 1.030 mol/L (B) pH = 12.023(C) 1.023 mol/L (D) pH = 1.233(A) (B)(C)(D)4 NaOH(A)K b = 4.6× 10-10 (B) NH 4NO 3 NH 3 K b = 1.8× 10-5(C)K a =1.4×10-4(D) Na 2SO 45 pH 3(A) HAc pK =4.74(B) pKa =3.74a(C)pK a =2.86 (D)pK a =1.306 H 3PO 42.12 7.20 12.36NaOHpH(A) 2.12(B) 5.66(C) 7.20(D) 9.787nn(A)(C)Y(H)Y(H)1K a i[ H]i(B)i 1niH[ H ] i1(D)i1Y(H)Y(H)1[ H ] ii 1n [H ]i 1K a ii 18EDTABi 3+ Pb 2+ Bi 3+Pb 2+lg K BiY27.94 lg K PbY 18.04 pK sp,Bi(OH) 3 30.4 pK sp,Bi(OH) 3 14.93(A) pH(B) pH(C) Bi 3+Bi(OH) 3Bi(OH) 3Bi 3+(D) Pb 2+Pb(OH) 2Bi 3+9lg K ZnY16.5pH45 67lgY(H)8.44 6.454.563.200.02000 mol/L EDTA0.02 mol/L Zn2+0.1%(A) pH 4(B) pH 6(C) pH8(D) pH 1010Fe 3+ Fe 2+Fe 3+/Fe 2+(A)H SO4(B)(C) NHF(D) K Cr O7242 211E 0' 4/Ce 31.44 V E 0' 3/Fe 20.68VCe 4++ Fe 2+ = Ce 3+ + Fe 3+CeFeFe 3+ Fe 2+(A) 1.08 × 10-18 (B) 92.5(C) 36.2(D) 2.76 × 106(A) [Fe 3+ ]=[Cr 3+ ], [Fe 2+2-] (B) 3+ 3+2+2- ]]=[Cr 2 O 73[Fe ]=[Cr] , [Fe]=6[Cr 2O 7(C) [Fe 3+]=3[Cr 3+], [Fe 2+]=6[Cr 2O 72- ] (D) [Fe 3+]=3[Cr 3+] , 6[Fe 2+]=[Cr 2O 72- ]13 间接碘量法的主要误差来源是 ()(A) 碘的挥发和空气中的氧对碘离子的氧化 (C) 淀粉指示剂对大量碘的吸附(B) 碘的溶解度较小,易在溶液中析出(D) 碘的黄色褪去不易观察14 在不另加试剂的情况下, 可以用莫尔法直接滴定的含氯试样是()(A) FeCl3(B) BaCl2(C) NaCl + NaS (D) NaCl + Na SO42215 某荧光吸附指示剂 HFl 形式为黄色,游离的 Fl -形式呈蓝色, Fl -被吸附后显紫红色。
碱性条件下,将其加入用 AgNO 3 滴定 Cl -的体系中,化学计量点前后的颜色转变是( )(A) 黄色→蓝色(B) 黄色→紫红色 (C) 蓝色→紫红色(D) 紫红色→蓝色16 能使沉淀的溶解度降低的因素是 ()(A) 同离子效应(B) 酸效应(C) 络合效应(D) 盐效应17 移取 FeCl 3 溶液 20.00 mL ,每次用 2.00 mL 含 HCl 的乙醚溶液萃取, 连续萃取三次。
已知 FeCl 3在乙醚和水中的分配比 D = 100,则上述操作中 FeCl 3 的萃取百分率为()(A) 90.9%(B) 99.0% (C) 99.1% (D) 99.9%18 用酸碱滴定法滴定硼酸时,痕量重金属离子杂质对滴定有妨害,若用离子交换法去除痕量重金属阳离子, 则应选用的离子交换树脂是 ()(A) 强酸性阳离子交换树脂 (B) 弱酸性阳离子交换树脂(C) 强碱性阴离子交换树脂肪 (D) 弱碱性阴离子交换树脂19 测定肉类试样中的易挥发重金属, 可以采用的试样预处理方法是()(A) 用氢氧化钠溶解(B) 高温灰化后用酸溶液(C) 在密封罐中用氧化性强酸消解(D) 蒸馏20 完成一项酸碱滴定方案设计的合理步骤是 ()① 根据指示剂的变色范围需部分与滴定突跃范围重叠的原则选择指示剂; ② 写出反应方程式,确定化学计量比和滴定终点的产物; ③ 估算滴定终点产物的 pH 值和滴定突跃范围; ④ 估算终点误差以检验滴定方法是否合理。
(A) ①②③④(B) ③①②④(C) ④②③① (D) ②③①④二、填空题(每空 1 分,共 10 分)1 若使用 50 mL 滴定管进行常量分析, 则设计实验时应使滴定剂消耗的体积不少于 。
若使用分析天平称样进行常量分析,则设计实验时应使称样质量不少于。
2 写出含 c 1 mol/L NaAc 和 c 2 mol/L NaOH 的混合水溶液的质子条件式:。
写出浓度为 c mol/L 的 Na 2CO 3 水溶液中 HCO 3-的分布分数计算公式:。
0.02000 mol/L HCl 溶液滴定相同浓度的 NaOH 溶液,突跃范围是。
3 根据标定与测定条件相近的原则,以二甲酚橙为指示剂,用EDTA 测定废水中的 Pb 2+时,所用 的 EDTA 标准溶液宜用标定(填“高纯 CaCO 3”或“ ZnO ”);若将在弱酸性条件下标 定的 EDTA 用于在强碱性条件下测定金属离子, 则所得结果。
(填“不受影响” 、“偏高”或“偏低” )4 得失电子数均为 1 的两个电对之间的可逆氧化-还原反应,其电位差至少达到时,反应的完全程度才能达到 99.9%以上;而对于得失电子数分别为 1 和 2 的两个电对之间的反应,该差值需达到。
5 纸上层析分离中,固定相是指,流动相是指起展开作用的溶剂。
三、问答题(每题 5 分,共 10 分)1 用 0.1000 mol/L NaOH标准溶液滴定浓度约为0.1mol/L 的 CH 3COOH ( pK a = 4.74 ),试通过简单的计算说明下列 4 种指示剂中哪个最合适。
A. 酚酞( pK a = 9.1 );B. 中性红( pK a = 7.4 );C. 甲基橙( pK a = 3.4 );D. 溴酚蓝( pK a = 4.1)2为了得到便于分离的沉淀,晶形沉淀和无定形沉淀的条件各是什么?四、计算题(每题8 分,共 40 分)1 测定黄铁矿中的硫的质量分数,六次测定结果分别为30.48% ,30.42% ,30.59%,30.51%,30.56%,30.49% 。
计算平均值、相对平均偏差、相对标准偏差和置信度为95%的平均值的置信区间。
置信度,显著性水准f P = 0.90,α= 0.10 P = 0.95,α= 0.05 P = 0.99,α= 0.015 2.02 2.57 4.036 1.94 2.45 3.712. 现有含 0.1000 mol/L HCl 和 0.1000 mol/L HAc 的混合溶液,能否用甲基橙作指示剂(变色点pH 为 4.0),用 0.1000 mol/L 的 NaOH 标准溶液准确测定其中HCl 的浓度?(要求测量误差小于 1.0%,已知 HAc 的 pK a = 4.74)3 称取三聚磷酸钠( 5 3 1043-,在 NH 34Cl Na P O )样品 0.3627 g ,溶于水,加强酸将其分解为PO-NH 缓冲溶液中,加入 0.2145 mol/L 的 Mg 2+溶液 25.00 mL 将 PO 43- 全部形成 MgNH 4PO 4 沉淀,过滤、洗涤。
沉淀灼烧成 Mg 2P 2O 7,称重为 0.3192 g ,滤液和洗液混合后用 EDTA 滴定多余的沉淀剂Mg 2+,终点时,问消耗 EDTA 标准溶液( c = 0.1241 mol/L )多少毫升?样品中三聚磷酸钠的质量分数是多少?已知 Mr(Na 5P 3O 10) = 367.9 ,M r(Mg 5P 2O 7) = 222.6。
4 计算在 1mol/LHCl 溶液中,用 Fe 3+滴定 Sn 2+至化学计量点时的电位,并计算滴定至99.9%和θ'θ'0.14 V 。
100.1% 时的电位。
已知 E Fe 3 /Fe 2 0.68V , E Sn 4 /Sn 2-49, Ka 1 ,H 2S=1.3× 10 -7 ,Ka 2 ,H 2 S =7.1 ×10 -15,Ag-NH 3 络合物的 1,5 已知 K sp,Ag 2S =2.0× 10lg β=3.24 lg β=7.05。
计算 Ag S 在 pH 8.00 、 [NH ]=0.01 mol/L 的水溶液中的溶解度。
22 3。
