必修二有机化学方程式
必修二 有机化学 方程式总结

乙烯与HX:C2H4+HX催CH3CH2X
乙烯与H2O:C2H4+H2O催CH3CH2OH
乙烯的加聚:nC2H4催[CH2-CH2]n
苯的燃烧: +15O2点12CO2+6H2O
苯的溴代:+Br2Br
苯的硝化:+HNO3浓硫酸50-60℃NO2+H2O
苯的磺化:+H2SO4(浓)70-80℃SO3H +H2O
乙醇与HX:C2H5OH+HX C2H5OX+H2O
乙酸与钠:2CH3COOH+Na 2CH3COONa+H2O
乙酸与NaOH:CH3COOH+NaOH CH3COONa+H2O
乙酸Na2CO3:CH3COOH+Na2CO3CH3COONa+H2O+CO2
乙醇与乙酸:CH3COOH+C2ห้องสมุดไป่ตู้5OH浓硫酸△CH3COOC2H5+H2O
必修二
甲烷和Cl2:CH4+Cl2CH3Cl+HCl
CH3Cl+Cl2CH2Cl2+HCl
CH2Cl2+Cl2CHCl3+HCl
CHCl3+Cl2CCl4+HCl
甲烷燃烧:CH4+2O2点CO2+2H2O
甲烷分解:CH41000℃C+2H2
乙烯燃烧:C2H4+3O2点2CO2+2H2O
乙烯与Br2:C2H4+Br2C2H4Br2
苯与H2:+3H2Ni△
乙醇和钠:2C2H5OH+2Na 2CH3COONa+H2
必修二有机物化学方程式

必修二有机物化学方程式有机物化学方程式1.甲烷燃烧CH+2O→CO+2HO(条件为点燃) 24222.甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH→C+2H(条件为高温高压,催化剂)243.甲烷和氯气发生取代反应CH+Cl→CHCl+HCl CHCl+Cl→CHCl+HCl 2324322CHCl+Cl→CHCl+HCl CHCl+Cl→CCl+HCl (条件都为光照。
)42323224.实验室制甲烷CHCOONa+NaOH→NaCO+CH(条件是CaO 加热)42335.乙烯燃烧CH=CH+3O→2CO+2HO(条件为点燃)222226.乙烯和溴水CH=CH+Br→CHBr-CHBr 222227.乙烯和水CH=CH+HO→CH3CH2OH (条件为催化剂)2228.乙烯和氯化氢CH=CH+HCl→CH-CHCl 22329.乙烯和氢气CH=CH+H→CH-CH (条件为催化剂)3223210.乙烯聚合nCH=CH→-[-CH-CH-]n-(条件为催化剂)222211.氯乙烯聚合nCH=CHCl→-[-CH-CHCl-]-(条件为催化剂)n2212.实验室制乙烯CHCHOH→CH=CH↑+HO (条件为加热,浓HSO)422232213.乙炔燃烧CH+3O→2CO+HO (条件为点燃)2222214.乙炔和溴水CH+2Br→CHBr 42222215.乙炔和氯化氢两步反应:CH+HCl→CHCl--------CHCl+HCl→CHCl 2 2232324216.乙炔和氢气两步反应:CH+H→CH →CH+2H→CH (条件为催化6422222222剂)17.实验室制乙炔CaC+2HO→Ca(OH)+CH↑2222218.以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO === CaO + CO 2CaO+5C===2CaC+CO 2223CaC+2HO→CH+Ca(OH)C+HO===CO+H-----高温2222222CH+H→CH----乙炔加成生成乙烯CH可聚合42224 2219.苯燃烧2CH+15O→12CO+6HO (条件为点燃)2262620.苯和液溴的取代CH+Br→CHBr+HBr 5666221.苯和浓硫酸浓硝酸CH+HNO→CHNO+HO (条件为浓硫酸)265623622.苯和氢气C6H6+3H2→C6H12 (条件为催化剂)23.乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)24.乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)25.乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸170摄氏度)26.两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸140摄氏度) 27.乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O28.乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H22Ca+H2O )2CH3COOH+CaO→(CH3CH2 乙酸和氧化钙29.30.乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH31.乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑32.甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O33.乙醛和新制的氢氧化铜CH3CHO+2CU(OH)2=CH3COOH+CU2O+2H2O34.乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)一.烯烃是指含有C=C键的碳氢化合物。
高中化学必修一二化学方程式汇总

高中化学必修一二化学方程式汇总一、必修一化学方程式1. 钠及其化合物- 钠与氧气常温反应:4Na + O_{2}=2Na_{2}O- 钠在氧气中燃烧:2Na + O_{2}{点燃}{=!=!=}Na_{2}O_{2}- 钠与水反应:2Na + 2H_{2}O = 2NaOH+ H_{2}↑- 过氧化钠与水反应:2Na_{2}O_{2}+2H_{2}O = 4NaOH + O_{2}↑- 过氧化钠与二氧化碳反应:2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2} - 向碳酸钠溶液中滴加少量盐酸:Na_{2}CO_{3}+HCl = NaHCO_{3}+NaCl - 向碳酸钠溶液中滴加过量盐酸:Na_{2}CO_{3}+2HCl = 2NaCl +H_{2}O+CO_{2}↑- 碳酸氢钠受热分解:2NaHCO_{3}{}{=!=!=}Na_{2}CO_{3}+H_{2}O + CO_{2}↑- 碳酸氢钠与氢氧化钠反应:NaHCO_{3}+NaOH = Na_{2}CO_{3}+H_{2}O2. 铝及其化合物- 铝与氧气反应:4Al + 3O_{2}=2Al_{2}O_{3}- 铝与盐酸反应:2Al+6HCl = 2AlCl_{3}+3H_{2}↑- 铝与氢氧化钠溶液反应:2Al + 2NaOH+2H_{2}O = 2NaAlO_{2}+3H_{2}↑ - 氧化铝与盐酸反应:Al_{2}O_{3}+6HCl = 2AlCl_{3}+3H_{2}O- 氧化铝与氢氧化钠溶液反应:Al_{2}O_{3}+2NaOH = 2NaAlO_{2}+H_{2}O - 氢氧化铝的制备(向氯化铝溶液中滴加氨水):AlCl_{3}+3NH_{3}· H_{2}O = Al(OH)_{3}↓+3NH_{4}Cl- 氢氧化铝与盐酸反应:Al(OH)_{3}+3HCl = AlCl_{3}+3H_{2}O- 氢氧化铝与氢氧化钠溶液反应:Al(OH)_{3}+NaOH = NaAlO_{2}+2H_{2}O3. 铁及其化合物- 铁与氧气反应:3Fe + 2O_{2}{点燃}{=!=!=}Fe_{3}O_{4}- 铁与氯气反应:2Fe+3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 铁与盐酸反应:Fe + 2HCl = FeCl_{2}+H_{2}↑- 铁与硫酸铜溶液反应:Fe + CuSO_{4}=FeSO_{4}+Cu- 氯化亚铁与氯气反应:2FeCl_{2}+Cl_{2}=2FeCl_{3}- 氯化铁与铁反应:2FeCl_{3}+Fe = 3FeCl_{2}- 氯化铁与铜反应:2FeCl_{3}+Cu = 2FeCl_{2}+CuCl_{2}4. 硅及其化合物- 硅与氧气反应:Si + O_{2}{}{=!=!=}SiO_{2}- 硅与氢氧化钠溶液反应:Si + 2NaOH + H_{2}O=Na_{2}SiO_{3}+2H_{2}↑ - 二氧化硅与氢氧化钠溶液反应:SiO_{2}+2NaOH = Na_{2}SiO_{3}+H_{2}O - 二氧化硅与氢氟酸反应:SiO_{2}+4HF = SiF_{4}↑+2H_{2}O- 硅酸的制备(硅酸钠溶液与盐酸反应):Na_{2}SiO_{3}+2HCl =H_{2}SiO_{3}↓+2NaCl5. 氯及其化合物- 氯气与金属铁反应:2Fe + 3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 氯气与金属铜反应:Cu+Cl_{2}{点燃}{=!=!=}CuCl_{2}- 氯气与氢气反应:H_{2}+Cl_{2}{点燃}{=!=!=}2HCl- 氯气与水反应:Cl_{2}+H_{2}O = HCl + HClO- 次氯酸光照分解:2HClO{光照}{=!=!=}2HCl+O_{2}↑- 氯气与氢氧化钠溶液反应:Cl_{2}+2NaOH = NaCl + NaClO + H_{2}O- 氯气与氢氧化钙反应制漂白粉:2Cl_{2}+2Ca(OH)_{2}=CaCl_{2}+Ca(ClO)_{2}+2H_{2}O6. 硫及其化合物- 硫与氧气反应:S+O_{2}{点燃}{=!=!=}SO_{2}- 二氧化硫与水反应:SO_{2}+H_{2}O = H_{2}SO_{3}- 二氧化硫与氧气反应:2SO_{2}+O_{2}{催化剂}{underset{}{⇌}}2SO_{3} - 三氧化硫与水反应:SO_{3}+H_{2}O = H_{2}SO_{4}- 铜与浓硫酸反应:Cu + 2H_{2}SO_{4}(浓){}{=!=!=}CuSO_{4}+SO_{2}↑+2H_{2}O- 碳与浓硫酸反应:C + 2H_{2}SO_{4}(浓){}{=!=!=}CO_{2}↑+2SO_{2}↑+2H_{2}O7. 氮及其化合物- 氮气与氧气反应:N_{2}+O_{2}{放电或高温}{=!=!=}2NO- 一氧化氮与氧气反应:2NO+O_{2}=2NO_{2}- 二氧化氮与水反应:3NO_{2}+H_{2}O = 2HNO_{3}+NO- 工业合成氨:N_{2}+3H_{2}{催化剂}{underset{高温高压}{⇌}}2NH_{3}- 氨气与水反应:NH_{3}+H_{2}O = NH_{3}· H_{2}O- 氨气与氯化氢反应:NH_{3}+HCl = NH_{4}Cl- 氯化铵受热分解:NH_{4}Cl{}{=!=!=}NH_{3}↑+HCl↑- 碳酸氢铵受热分解:NH_{4}HCO_{3}{}{=!=!=}NH_{3}↑+H_{2}O↑+CO_{2}↑- 硝酸铵与氢氧化钠反应:NH_{4}NO_{3}+NaOH{}{=!=!=}NH_{3}↑+NaNO_{3}+H_{2}O- 铜与稀硝酸反应:3Cu + 8HNO_{3}(稀)=3Cu(NO_{3})_{2}+2NO↑+4H_{2}O- 铜与浓硝酸反应:Cu + 4HNO_{3}(浓)=Cu(NO_{3})_{2}+2NO_{2}↑+2H_{2}O二、必修二化学方程式1. 元素周期律相关反应(以碱金属和卤素为例)- 锂与氧气反应:4Li + O_{2}=2Li_{2}O- 钾与水反应:2K+2H_{2}O = 2KOH + H_{2}↑- 氯气与溴化钠溶液反应:Cl_{2}+2NaBr = 2NaCl+Br_{2}- 溴与碘化钾溶液反应:Br_{2}+2KI = 2KBr+I_{2}2. 化学反应与能量- 氢气燃烧:2H_{2}+O_{2}{点燃}{=!=!=}2H_{2}O(放热反应)- 碳酸钙受热分解:CaCO_{3}{}{=!=!=}CaO + CO_{2}↑(吸热反应)3. 有机化学基础(必修部分)- 甲烷燃烧:CH_{4}+2O_{2}{点燃}{=!=!=}CO_{2}+2H_{2}O- 甲烷与氯气发生取代反应(以一氯取代为例):CH_{4}+Cl_{2}{光照}{=!=!=}CH_{3}Cl+HCl- 乙烯燃烧:C_{2}H_{4}+3O_{2}{点燃}{=!=!=}2CO_{2}+2H_{2}O- 乙烯与溴水反应:C_{2}H_{4}+Br_{2}to C_{2}H_{4}Br_{2}- 乙烯与水加成反应:C_{2}H_{4}+H_{2}O{催化剂}{to}C_{2}H_{5}OH- 苯燃烧:2C_{6}H_{6}+15O_{2}{点燃}{=!=!=}12CO_{2}+6H_{2}O- 苯与液溴反应:C_{6}H_{6}+Br_{2}{FeBr_{3}}{=!=!=}C_{6}H_{5}Br+HBr - 乙醇燃烧:C_{2}H_{5}OH + 3O_{2}{点燃}{=!=!=}2CO_{2}+3H_{2}O - 乙醇与钠反应:2C_{2}H_{5}OH + 2Nato 2C_{2}H_{5}ONa+H_{2}↑- 乙醇的催化氧化:2C_{2}H_{5}OH + O_{2}{Cu或Ag}{underset{}{to}}2CH_{3}CHO + 2H_{2}O- 乙酸与乙醇的酯化反应:CH_{3}COOH+C_{2}H_{5}OH{浓硫酸}{underset{}{⇌}}CH_{3}COOC_{2}H_{5}+H_{2}O。
必修二有机化学方程式
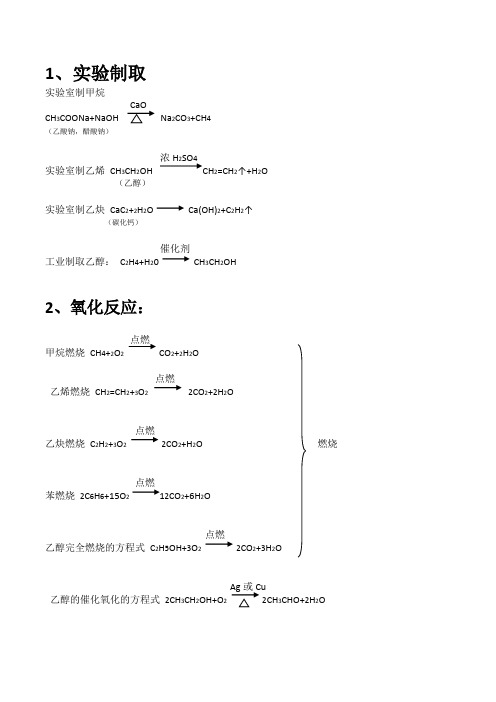
1、实验制取实验室制甲烷CH3COONa+NaOH Na2CO3+CH4(乙酸钠,醋酸钠)浓H2SO4实验室制乙烯CH3CH2OH CH2=CH2↑+H2O(乙醇)实验室制乙炔CaC2+2H2O Ca(OH)2+C2H2↑(碳化钙)催化剂工业制取乙醇:C2H4+H20 CH3CH2OH2、氧化反应:点燃甲烷燃烧CH4+2O2CO2+2H2O点燃乙烯燃烧CH2=CH2+3O22CO2+2H2O点燃乙炔燃烧C2H2+3O22CO2+H2O 燃烧点燃苯燃烧2C6H6+15O212CO2+6H2O点燃乙醇完全燃烧的方程式C2H5OH+3O22CO2+3H2O乙醇的催化氧化的方程式2CH3CH2OH+O22CH3CHO+2H2O甲烷和氯气发生取代反应光照CH4+Cl2CH3Cl+HCl光照CH3Cl+Cl2CH2Cl2+HCl光照CH2Cl2+Cl2CHCl3+HCl光照CHCl3+Cl2CCl4+HCl(注:反应物是卤素单质的蒸汽)苯和浓硫酸浓硝酸C6H6+HNO3C6H5NO2+H2O(硝基苯)FeBr3苯与溴在FeBr3催化作用下反应C6H6+Br2C6H5Br+HBr浓硫酸乙酸乙酯的水解:CH3COOC2H5+H2O CH3COOH+C2H5OH (注:苯的同系物也可以发生取代反应)4、加成反应:乙烯和溴水CH2=CH2+Br2CH2Br-CH2Br催化剂乙烯和水CH2=CH2+H20 加热加压CH3CH2OH催化剂乙烯和氯化氢CH2=H2+HCl CH3-CH2Cl乙烯和氢气CH2=CH2+H2CH3-CH3苯和氢气C6H6+3H2C6H12催化剂乙烯聚合nCH2=CH2-[-CH2-CH2-]n- (条件为催化剂)催化剂氯乙烯聚合nCH2=CHCl -[-CH2-CHCl-]n- (条件为催化剂)6、酯化反应:浓硫酸乙醇乙酸反应的方程式CH3CH2OH+CH3COOH CH3COOC2H5 +H2O (酸脱羟基,醇脱氢)(乙酸乙酯)7、补充:乙醇与钠反应2C2H5OH+2Na 2C2H5ONa+H2↑。
必修二有机物化学方程式

有机物化学方程式1.甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)2.甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)3.甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HCl CH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HCl CHCl3+Cl2→CCl4+HCl (条件都为光照。
)4.实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)5.乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)6.乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br7.乙烯和水CH2=CH2+H2O→CH3CH2OH (条件为催化剂)8.乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl9.乙烯和氢气CH2=CH2+H2→CH3-CH3(条件为催化剂)10.乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)11.氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)12.实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)13.乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)14.乙炔和溴水C2H2+2Br2→C2H2Br415.乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl216.乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6(条件为催化剂)17.实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑18.以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO + CO22CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH)2C+H2O===CO+H2-----高温C2H2+H2→C2H4 ----乙炔加成生成乙烯C2H4可聚合19.苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)20.苯和液溴的取代C6H6+Br2→C6H5Br+HBr21.苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)22.苯和氢气C6H6+3H2→C6H12 (条件为催化剂)23.乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)24.乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)25.乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸170摄氏度)26.两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸140摄氏度) 27.乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O28.乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H229.乙酸和氧化钙2CH3COOH+CaO→(CH3CH2)2Ca+H2O30.乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH31.乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑32.甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O33.乙醛和新制的氢氧化铜CH3CHO+2CU(OH)2=CH3COOH+CU2O+2H2O34.乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)一.烯烃是指含有C=C键的碳氢化合物。
必修二有机化学方程式归纳+答案

必修二有机化学方程式归纳一.写出下列反应的方程式(除燃烧外,有机物必须用结构简式表示)1.甲烷与氯气混合光照CH 4+Cl 2 CH 3Cl+HCl CH 3Cl+Cl 2 CH 2Cl 2+HClCH 2Cl 2+Cl 2 CHCl 3+HCl CHCl 3+Cl 2 CCl 4+HCl2.乙烯通入溴水(或通入溴的CCl 4溶液)中CH 2 = CH 2 + Br 2 CH 2BrCH 2Br3.乙烯与水反应 CH 2 = CH 2 + H 2O CH 3CH 2OH4.乙烯与溴化氢反应CH 2 = CH 2 + HBr CH 3CH 2Br5.乙炔与氯化氢反应生成氯乙烯CH ≡CH + HCl H 2C = CHCl6.苯和浓硝酸反应 + HO -NO 2 NO 2 +H 2O7.苯和液溴反应+ Br 2 Br + HBr8.苯和氢气反应+ 3H 2 9.某烃燃烧 CxHy+(x+y/4)O 2 xCO 2+y/2H 2O10.乙醇与钠反应2C 2H 5OH+2Na 2CH 3COONa+H 2↑11.乙醇催化氧化2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O 12.乙醛氧化成乙酸2CH 3CHO + O 2 2CH 3COOH13.银镜反应 CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O 光照 光照 光照 光照 催化剂 催化剂 催化剂浓H 2SO 450-60℃ Fe 催化剂 加热、加压点燃 Cu △催化剂水浴加热14.乙醛与新制氢氧化铜反应 CH 3CHO+2Cu(OH)2+NaOH CH 3COONa+Cu 2O ↓+2H 2O15.乙酸与钠反应2CH 3COOH+2Na CH 3COONa+H 2↑16.乙酸与碳酸钠反应2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑17.乙酸与氢氧化铜反应2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O18.乙酸与乙醇酯化反应 CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3+H 2O 19.乙酸乙酯在酸性条件下水解CH 3COOC 2H 5+H 2O ⇋ CH 3COOH+ C 2H 5OH 20.乙酸乙酯在碱性条件下水解 CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH 21.硬脂酸甘油酯与烧碱混合加热C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH 3 C 17H 35COONa+CH-OH C 17H 35COO-CH 2 CH 2-OH水浴加热 催化剂 △稀硫酸 △△△。
高中必修二化学方程式大全汇总(精华版)

高中必修二化学方程式大全汇总(精华版)方程式是化学学科内容的重中之重。
下面是高中必修二化学方程式,希望对大家有所帮助。
高中必修二化学方程式1必修二各章节化学方程式第一章物质结构元素周期律1、li与o2反应(点燃):4li+o22li2ona与o2反应(点燃):2na+o2na2o2na与h2o反应:2na+2h2o===2naoh+h2↑k与h2o反应:2k+2h2o===2koh+h2↑2、卤素单质f2、cl2、br2、i2与氢气反应:f2+h2===2hfcl2+h2===2hclbr2+h2===2bri2+h2===2hi3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:①cl2+2nabr===br2+2nacl②cl2+2nai===i2+2nacl(2)溴水与碘化钠溶液反应:br2+2nai===i2+2nabr4、mg与h2o反应:mg+2h2o===mg(oh)2+h2↑al与hcl反应:2al+6hcl===2alcl3+3h2↑mg与hcl反应:mg+2hcl===mgcl2+h2↑点击查看:高一必修二常用化学方程式总结第二章化学反应与能量1、ba(oh)2?8h2o与nh4cl的反应:ba(oh)2·8h2o+2nh4cl==bacl2+2nh3↑+10h2o2、原电池原理典型的原电池(zn-cu原电池)负极(锌):zn-2e-===zn2+(氧化反应)正极(铜):2h++2e-===h2↑(还原反应)、用电子式表示电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:zn+2h+===zn2++h2↑3、h2o2在催化剂作用下受热分解:2h2o22h2o+o2↑4、na2so4与cacl2反应:na2so4+cacl2===caso4↓+na2co35、高炉炼铁:2c+o2===2cofe2o3+3co==2fe+3co2第三章有机化合物1、甲烷的主要化学性质(1)氧化反应(与o2的反应):ch4(g)+2o2(g)co2(g)+2h2o(l)(2)取代反应(与cl2在光照条件下的反应,生成四种不同的取代物):2、乙烯的主要化学性质(1)氧化反应(与o2的反应):c2h4+3o22co2+2h2o(2)加成反应((与br2的反应):(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:ch2=ch2+h2ch3ch3ch2=ch2+hclch3ch2cl(一氯乙烷)ch2=ch2+h2och3ch2oh(乙醇)(4)聚合反应:(乙烯制聚乙烯)(氯乙烯制聚氯乙烯)3、苯的主要化学性质:(1)氧化反应(与o2的反应):2c6h6+15o212co2+6h2o br(2)取代反应:①与br2的反应:+br2+hbr②苯与硝酸(用hono2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。
人教版高中化学必修一必修二化学方程式汇总

必修一、必修二化学方程式汇总必修一1、硫酸根离子的检验:BaCl2+Na2SO4====BaSO4↓+2NaCl2、碳酸根离子的检验:CaCl2+Na2CO3=====CaCO3↓+2NaCl3、碳酸钠与盐酸反响:Na2CO3+2HCl=====2NaCl+H2O+CO2↑高温4、木炭复原氧化铜:2CuO+C2Cu+CO2↑5、铁片与硫酸铜溶液反响:Fe+CuSO4=====FeSO4+Cu6、氯化钙与碳酸钠溶液反响:CaCl2+Na2CO3=====CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na+O2Na2O2钠与氧气反响:4Na+O2====2Na2O8、过氧化钠与水反响:2Na2O2+2H2O====4NaOH+O2↑9、过氧化钠与二氧化碳反响:2Na2O2+2CO2====2Na2CO3+O210、钠与水反响:2Na+2H2O====2NaOH+H2↑11、铁与水蒸气反响:3Fe+4H2O(g)====Fe3O4+4H2↑12、铝与氢氧化钠溶液反响:2Al+2NaOH+2H2O====2NaAlO2 +3H2↑13、氧化钙与水反响:CaO+H2O====Ca(OH)214、氧化铁与盐酸反响:Fe2O3+6HCl=====2FeCl3+3H2O第1页共11页15、氧化铝与盐酸反响:Al2O3+6HCl=====2AlCl3+3H2O16、氧化铝与氢氧化钠溶液反响:Al2O3+2NaOH=====2NaAlO2 +H2O17、氯化铁与氢氧化钠溶液反响:FeCl3+3NaOH=====Fe(OH)3 ↓+3NaCl18、硫酸亚铁与氢氧化钠溶液反响:FeSO4+2NaOH====Fe(OH)2 ↓+Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+O2====4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3Fe2O3+3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3+6NH3·H2O====2Al(OH)3↓+3(NH3)2SO422、氢氧化铝与盐酸反响:Al(OH)3+3HCl====AlCl3+3H2O23、氢氧化铝与氢氧化钠溶液反响:Al(OH)3+NaOH====NaAlO2 +2H2O24、氢氧化铝加热分解:2Al(OH)3Al2O3+3H2O25、三氯化铁溶液与铁粉反响:2FeCl3+Fe====3FeCl226、氯化亚铁中通入氯气:2FeCl2+Cl2=====2FeCl327、二氧化硅与氢氟酸反响:SiO2+4HF====SiF4+2H2O硅单质与氢氟酸反响:Si+4HF====SiF4+2H2↑第2页共11页高温28、二氧化硅与氧化钙高温反响:SiO2+CaOCaSiO329、二氧化硅与氢氧化钠溶液反响:SiO2+2NaOH====Na2SiO3+H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓31、硅酸钠与盐酸反响:Na2SiO3+2HCl===2NaCl+H2SiO3↓点燃32、氯气与金属铁反响:2Fe+3Cl22FeCl3点燃33、氯气与金属铜反响:Cu+Cl2CuCl2点燃34、氯气与金属钠反响:2Na+Cl22NaCl35、氯气与水反响:Cl2+H2O====HCl+HClO光照36、次氯酸光照分解:2HClO2HCl+O2↑37、氯气与氢氧化钠溶液反响:Cl2+2NaOH=====NaCl+NaClO+H2O38、氯气与消石灰反响:2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O39、盐酸与硝酸银溶液反响:HCl+AgNO3====AgCl↓+HNO340、漂白粉长期置露在空气中:Ca(ClO)2+H2O+CO2====CaCO3↓+2HClO41、二氧化硫与水反响:SO2+H2O===H2SO3第3页共11页放电42、氮气与氧气在放电下反响:N2+O22NO43、一氧化氮与氧气反响:2NO+O2====2NO244、二氧化氮与水反响:3NO2+H2O====2HNO3+NO催化剂45、二氧化硫与氧气在催化剂的作用下反响:2SO2+O22SO346、三氧化硫与水反响:SO3+H2O====H2SO447、浓硫酸与铜反响:Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑48、浓硫酸与木炭反响:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O49、浓硝酸与铜反响:Cu+4HNO3(浓)====Cu(NO3)2+2H2O+2NO2↑50、稀硝酸与铜反响:3Cu+8HNO3(稀)3Cu(NO3)2+4H2O+2NO↑51、氨水受热分解:NH3·H2ONH3↑+H2O52、氨气与氯化氢反响:NH3+HCl====NH4Cl53、氯化铵受热分解:NH4ClNH3↑+HCl↑54、碳酸氢氨受热分解:NH4HCO3NH3↑+H2O↑+CO2↑55、硝酸铵与氢氧化钠反响:NH4NO3+NaOHNH3↑+NaNO3+H2O第4页共11页56、氨气的实验室制取:2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑点燃57、氯气与氢气反响:Cl2+H22HCl58、硫酸铵与氢氧化钠反响:〔NH4〕2SO4+2NaOH2NH3↑+ Na2SO4+2H2O59、SO2+CaO====CaSO360、SO2+2NaOH====Na2SO3+H2O61、SO2+Ca(OH)2====CaSO3↓+H2O62、SO2+Cl2+2H2O====2HCl+H2SO463、SO2+2H2S====3S+2H2O64、NO、NO2的回收:NO2+NO+2NaOH====2NaNO2+H2O65、Si+2F2===SiF466、Si+2NaOH+H2O====Na2SiO3+2H2↑67、硅单质的实验室制法高温电炉粗硅的制取:SiO2+2CSi+2CO〔石英沙〕〔焦碳〕〔粗硅〕粗硅转变为纯硅:Si〔粗〕+2Cl2SiCl4高温SiCl4+2H2Si〔纯〕+4HCl第5页共11页必修二第一章物质构造元素周期律1、Li与O2反响〔点燃〕:4Li+O22Li2ONa与O2反响〔点燃〕:2Na+O2Na2O2Na与H2O反响:2Na+2H2O===2NaOH+H2↑K与H2O反响:2K+2H2O===2KOH+H2↑2、卤素单质F2、Cl2、Br2、I2与氢气反响:F2+H2===2HFCl2+H2===2HClBr2+H2===2BrI2+H2===2HI3、卤素单质间的置换反响:〔1〕氯水与饱和溴化钠、氯水与饱和碘化钠溶液反响:①Cl2+2NaBr===Br2+2NaCl②Cl2+2NaI===I2+2NaCl〔2〕溴水与碘化钠溶液反响:Br2+2NaI===I2+2NaBr 4、Mg与H2O反响:Mg+2H2O===Mg(OH)2+H2↑Al与HCl反响:2Al+6HCl===2AlCl3+3H2↑Mg与HCl反响:Mg+2HCl===MgCl2+H2↑5、Na与Cl2反响〔点燃〕:6、用电子式表示氯化氢的形成过程:第二章化学反响与能量第6页共11页1、Ba(OH)2?8H2O与NH4Cl的反响:Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O2、原电池原理典型的原电池〔Zn-Cu原电池〕负极〔锌〕:Zn-2e-===Zn-===Zn2+〔氧化反响〕正极〔铜〕:2H ++2e-===H 2↑〔复原反响〕电子流动方向:由锌经过外电路流向铜。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
必修二有机化学方程式有机化学是一门研究有机化合物结构和性质的学科。
有机化合物是指含碳元素的化合物,其中也包括含碳氢元素的化合物。
在有机化学的学习中,掌握各种有机化合物的官能团、结构、性质和反应机理是至关重要的。
其中,有机化学方程式是表达有机化合物反应的重要手段。
有机化学方程式可以用来表达有机化合物的合成、分解、氧化、还原等反应过程。
在书写有机化学方程式时,需要注意以下几点:1、遵守原子经济性原则:即反应物中的原子应该尽可能地转化为目标产物,避免浪费和污染。
2、正确表示电子转移和氧化态:在有机化合物中,碳原子的氧化态通常用“-”表示,而氢原子的氧化态则用“+”表示。
3、表明反应条件:反应条件对于反应的进行和产物的生成都至关重要,因此需要在方程式中注明。
4、书写正确的有机化合物结构:在方程式中,需要准确地表示反应物和产物的结构,这有助于理解反应机理和性质。
下面列举一些常见的有机化学方程式:1、烷烃的燃烧反应:CH4 + 2O2 → CO2 + 2H2O2、烷烃的卤化反应:CH4 + Cl2 → CH3Cl + HCl3、烯烃的加成反应:CH2=CH2 + H2 → CH3-CH34、炔烃的加成反应:HC≡CH + 2H2 → CH2=CH-CH35、醇的氧化反应:R-CH2OH + PCC → R-CO-R + HCP6、醛的还原反应:R-CHO + H2 → R-CH2-OH7、羧酸的酯化反应:R-COOH + R′-OH → R-COO-R′ + H2O 8、酰胺的水解反应:R-CONH-R′ + H2O → R-COOH + R′-NH2以上是有机化学方程式的一些例子,掌握这些方程式对于理解有机化合物的结构和性质非常重要。
通过学习有机化学方程式,我们可以更好地了解有机化合物的合成、转化和分解过程,为后续深入学习有机化学奠定基础。
高中化学必修二方程式总结高中化学必修二方程式是化学学习中的重要内容,它们是描述化学反应的语言。
在这篇文章中,我们将总结高中化学必修二中的一些重要方程式,并解释它们的意义和用途。
首先,我们需要了解什么是化学方程式。
化学方程式是用符号表示化学反应的式子,包括反应物和生成物,以及反应的条件和摩尔比例。
在化学方程式中,反应物写在等号的左边,生成物写在等号的右边。
化学反应按反应物和生成物的不同,可以分为化合反应、分解反应、置换反应和复分解反应等。
接下来,我们将逐一总结这些反应的方程式。
1、化合反应化合反应是指两种或多种物质反应生成一种物质的反应。
典型的化合反应包括酸碱中和反应、金属氧化物与酸的反应等。
例如,酸碱中和反应的方程式可以表示为:HCl + NaOH -> NaCl + H2O,其中HCl和NaOH分别表示盐酸和氢氧化钠,NaCl表示氯化钠,H2O表示水。
2、分解反应分解反应是一种物质分解成两种或多种物质的反应。
典型的分解反应包括水的电解、碳酸钙受热分解等。
例如,水的电解方程式可以表示为:2H2O -> 2H2 + O2,其中H2O表示水,H2表示氢气,O2表示氧气。
3、置换反应置换反应是一种单质与一种化合物反应生成另一种单质和化合物的反应。
典型的置换反应包括金属与酸的反应、金属与盐的反应等。
例如,金属与酸的反应方程式可以表示为:Mg +2HCl ->MgCl2+H2,其中Mg表示镁,HCl表示盐酸,MgCl2表示氯化镁,H2表示氢气。
4、复分解反应复分解反应是两种化合物互相交换成分生成另外两种化合物的反应。
典型的复分解反应包括酸碱中和反应、盐与酸的反应等。
例如,酸碱中和反应的方程式可以表示为:NaOH + HCl -> NaCl + H2O,其中NaOH和HCl分别表示氢氧化钠和盐酸,NaCl表示氯化钠,H2O 表示水。
总结起来,化学方程式是化学反应的符号表示,可以描述一种物质如何转化为另一种物质。
在高中化学必修二中,我们学习了多种类型的化学反应,包括化合反应、分解反应、置换反应和复分解反应等。
这些反应的方程式是化学反应的基础,也是我们理解和应用化学的重要工具。
有机化学方程式汇总有机化学方程式汇总:探索化学反应的奥秘有机化学是一门研究碳(C)氢(H)氧(O)氮(N)等有机元素组成化合物的科学。
有机化学方程式是描述这类化合物所发生化学反应的规范工具,对于理解有机化学反应的机制、预测新化合物的性质以及合成目标分子等方面具有重要意义。
本文将汇总一些常见的有机化学方程式,并探讨其应用和反应机理。
首先,我们简要了解一下有机化学反应的类型。
有机化学反应可分为多种类型,如取代反应、加成反应、消除反应、氧化反应和还原反应等。
这些反应在特定条件下发生,每一种反应都涉及到不同的原子或原子团在化学键上的转移。
一、取代反应取代反应是有机化学中一类重要的反应类型,涉及一个原子或原子团从分子中被另一个原子或原子团替换的过程。
以下是一些常见的取代反应方程式:1、烷烃的氯代反应:CH4 + Cl2 → CH3Cl + HCl2、苯环的卤代反应:C6H6 + Br2 → C6H5Br + HBr3、醇与氢碘酸的反应:ROH + HI → R-I + H2O二、加成反应加成反应是通过打破和形成化学键,将两个分子结合成一个分子的过程。
以下是一些常见的加成反应方程式:1、烯烃与氢气的加成反应:CH2=CH2 + H2 → CH3-CH32、炔烃与氢气的加成反应:HC≡CH + H2 → CH2=CHH三、消除反应消除反应是通过打破一个不稳定的化合物,同时形成一个新的双键或三键的过程。
以下是一些常见的消除反应方程式:1、消去反应:CH3CH2OH → CH2=CH2 + H2O2、贝克曼重排反应:四、氧化反应氧化反应是通过增加化合物中氧原子的数量,或者通过提高碳原子的氧化态来改变化合物。
以下是一些常见的氧化反应方程式:1、醇的氧化:C2H5OH + O2 → C2H5-COOH + H2O2、醛的氧化:R-CHO + O2 → R-CO-R五、还原反应还原反应是通过减少化合物中氧原子的数量,或者通过降低碳原子的氧化态来改变化合物。
以下是一些常见的还原反应方程式:1、醛的还原:R-CHO + H2 → R-CH2-R2、酮的还原:RCOR' + H2 → RH + R'HOH以上仅是一些常见的有机化学方程式的示例,实际上有机化学的反应类型和方程式非常丰富。
掌握这些方程式及其反应机理,对于理解有机化学的基本原理、合成新的有机化合物以及解决与有机化学相关的问题都具有重要的意义。
有机化学方程式总结有机化学方程式是描述有机化合物在化学反应中如何相互转化的重要工具。
它们不仅揭示了化学反应的机理,而且还展示了反应中的物质和能量变化。
本文旨在总结有机化学方程式的特点、书写规则以及重要反应类型,以便更好地理解和应用有机化学方程式。
有机化学方程式是描述有机化合物在化学反应中如何相互转化的重要工具。
它们不仅揭示了化学反应的机理,而且还展示了反应中的物质和能量变化。
有机化学方程式具有以下特点:1、使用标准符号和缩写:有机化学方程式使用标准的符号和缩写来代表化学物质和反应过程。
例如,箭头表示反应方向,短线表示键,方括号表示取代基或特定原子团,等等。
2、表明反应条件:有机化学方程式会明确表明反应的条件,例如温度、压力和催化剂等。
这些条件对于预测和控制化学反应的进程至关重要。
3、物质状态的变化:有机化学方程式可以展示反应物和生成物在反应过程中的状态变化,例如气体、液体和固体等。
书写有机化学方程式需要遵循一定的规则。
首先,需要准确地表示反应物和生成物的结构。
其次,要确保方程式中的电子转移和原子守恒。
最后,应该注明反应的条件和物质状态。
重要反应类型包括取代反应、加成反应和消除反应等。
取代反应是指一个原子或原子团被另一个原子或原子团取代的反应。
加成反应是通过加成双键或三键等方式引入新原子的反应。
消除反应则是通过消除不稳定的中间产物而生成双键或三键的反应。
总之,有机化学方程式是描述有机化合物在化学反应中如何相互转化的重要工具。
通过总结有机化学方程式的特点、书写规则以及重要反应类型,我们可以更好地理解和应用它们,进一步深化对有机化学反应的理解。
随着有机化学领域的不断发展,我们有理由相信,有机化学方程式的应用和理解将会不断进步。
化学必修二有机化学基础知识点化学必修二有机化学基础知识点一、有机化学概述有机化学是研究有机化合物的化学,涉及有机物的结构、性质、合成、反应及鉴定等领域。
有机化合物是指含碳元素的化合物,但不包括二氧化碳、一氧化碳、碳酸盐等无机化合物。
二、有机物的分类有机物根据它们的分子组成和结构特点,可以分成以下几类:1、烃类:包括烷烃、烯烃、炔烃、芳香烃等。
2、烃的衍生物:包括醇、酚、醚、醛、酮、羧酸、酯等。
3、生物碱:是一类具有生理活性的有机化合物,如嘌呤、嘧啶等。
4、有机高分子化合物:包括天然橡胶、合成树脂、合成纤维等。
三、有机物的结构特点有机物的结构特点是其分子中存在着化学键,这些化学键包括碳-碳键、碳-氢键、碳-氧键等。
有机分子的三维结构对其性质有很大影响,例如烷烃分子中的碳-碳单键使其具有较大的稳定性,而双键和三键则使其易发生化学反应。
四、有机物的性质有机物的性质主要取决于其分子结构和化学键的性质,以下是有机物的一些重要性质:1、物理性质:有机物的熔点、沸点、密度、溶解度等物理性质与它们的分子结构和分子间作用力有关。
2、化学性质:有机物的化学性质主要包括加成反应、取代反应、消除反应等。
这些反应的机理与有机分子的三维结构有很大关系。
五、有机物的合成和鉴定有机物的合成是通过一系列的化学反应,将简单的有机化合物转化为更复杂的有机化合物的过程。
有机物的鉴定则是通过各种物理和化学方法,对未知有机物进行结构解析和确认的过程。
六、有机化学的应用有机化学在日常生活、工业生产、医疗保健等领域中有着广泛的应用。
例如,有机合成方法可用于生产塑料、合成纤维、药物等;有机化合物的性质研究可以帮助我们更好地理解生物体内的化学过程;有机化合物的合成方法还可以用于研究化学反应机理,提高我们对化学本质的理解。
总之,有机化学是化学学科中的一个重要分支,它涉及到有机化合物的结构、性质、合成、反应及鉴定等领域。
学习和掌握有机化学的基础知识,对于我们理解自然现象、解决实际问题,以及进一步深入研究化学学科都具有重要的意义。
化学选修5有机化学方程式汇总化学选修5有机化学方程式汇总有机化学是化学学科的一个重要分支,涉及到有机化合物的结构、性质、合成、分解等各个方面。
掌握有机化学方程式是学习有机化学的基础,因此,本文将汇总化学选修5中的有机化学方程式,并简要介绍每个方程式的反应类型和特点。
