大学生基础化学——电解质溶液
无机化学第五章 电解质溶液(学生内容)
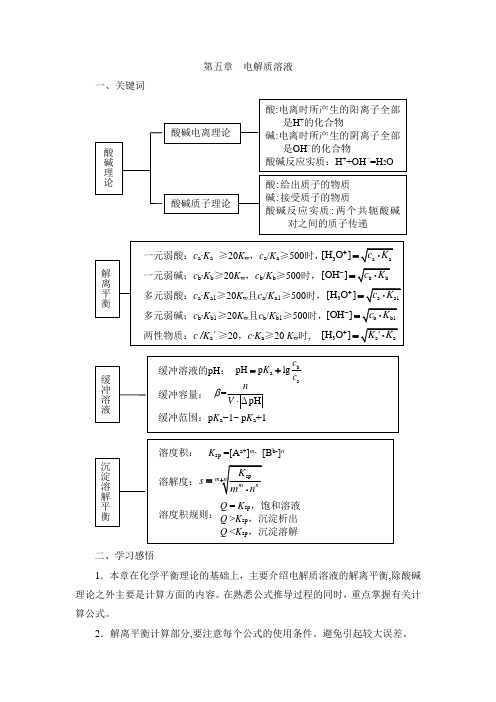
第五章电解质溶液一、关键词二、学习感悟1.本章在化学平衡理论的基础上,主要介绍电解质溶液的解离平衡,除酸碱理论之外主要是计算方面的内容。
在熟悉公式推导过程的同时,重点掌握有关计算公式。
2.解离平衡计算部分,要注意每个公式的使用条件。
避免引起较大误差。
3.本章的重点是弱电解质溶液和缓冲溶液的pH计算及难溶电解质溶度积规则的应用。
三、难点辅导1. 为什么任何物质的水溶液中都含有H3O+和OH−,而且在常温时,[H3O+]∙[OH−]=K w=1.0×10−14?无论是酸性还是碱性的物质,一旦与水形成溶液后,由于水发生的质子自递平衡中,会产生H3O+和OH−,所以任何物质的水溶液都含有H3O+和OH−。
在水溶液中,按照酸碱质子理论,酸会给出质子,碱会接受质子,这样必定会引起水的解离平衡发生移动,但水的解离平衡常数不会因平衡的移动发生改变,其解离平衡常数只与温度有关,在常温时,[H3O+]∙[OH−]=K w=1.0×10−14。
对酸性溶液来说,H3O+主要来自酸性物质(水的极少量解离可忽略),OH−则来自水的少量解离;对碱性溶液来说,OH−主要来自碱性物质(水的极少量解离可忽略),H3O+则来自水的少量解离。
2. 酸碱的强弱由哪些因素决定?酸碱的强弱首先取决于酸碱本身给出和接受质子的能力,其次取决于溶剂接受和给出质子的能力。
同一种物质在不同溶剂中的酸碱性不同,如HCl 在水中是强酸,在冰醋酸中是弱酸,这是因为水接受质子的能力比冰醋酸强;NH3在水中是弱碱,在冰醋酸中是强碱,冰醋酸给予质子的能力比水强的缘故。
所以在比较不同酸碱的强弱时,应在同一溶剂中进行,一般以水为溶剂比较其酸碱性的强弱,即比较在水溶液中的离解平衡常数K a或K b。
3. 缓冲溶液通常由一对共轭酸碱组成,那么HCl-NaCl这对共轭酸碱可组成缓冲溶液吗?为什么?缓冲溶液是由共轭酸碱对组成,其中共轭酸是抗碱成分,共轭碱是抗酸成分。
医用基础化学电解质溶液

OH-
§3.3 水溶液中的质子转移平衡及有关计算
例 已知NH3的Kb为1.79×10-5,试求NH4+的Ka。 解 NH4+是NH3的共轭酸,故 Ka=Kw/Kb =1.00×10-14/(1.79×10-5)
ห้องสมุดไป่ตู้
=5.59×10-10
§3.3 水溶液中的质子转移平衡及有关计算
(2)多元弱酸或多元弱碱
2、离子的活度和活度因子 (1)活度:电解质溶液中实际上起作用的浓度,用 aB 表示,单位为一。活度与浓度的关系
aB B cB / cB
γB称为溶质B的活度因子。 cB 称为标准浓度,单 位为mol/L。
§3.1
强电解质溶液理论
(2)活度因子 由于aB<cB,故B <1 当溶液中的离子浓度很小时, B≈1。 通常把中性分子、弱电解质溶液的活度因子视为1。
25℃时
Kw= 1.00×10-14
§3.3 水溶液中的质子转移平衡及有关计算
水的离子积不仅适用于纯水,也适用于所有稀水溶液。 25℃的纯水中
[H+] = [OH-] = K w =1.0×10-7 mol· -1 L
中性溶液中 [H+] = [OH-] = 1.0×10-7 mol· -1 L
酸性溶液中 [H+] >1.0×10-7 mol· -1> [OH-] L
§3.1
强电解质溶液理论
3、解离度:达解离平衡时,已解离的分子数和分 子总数之比。单位为一,可以百分率表示。
通常0.1 mol· kg-1溶液中,强电解质α>30%;弱电解 质α<5%;中强电解质α=5%~30%。
表3-1 强电解质水溶液的解离度 (298K,0.10mol· L-1)
医用化学基础电解质溶液

非电解质:在水溶液里或熔融状态下,都不 能导电的化合物。
包括:多数有机物、非金属氧化物等。 ------ 蔗糖、酒精
电解质: 在水溶液里或熔融状态下,能够 导电的化合物。
(真正电离出自由移动的离子的物质才是电解质)
常见的电解质包括: 酸、碱、盐
2.强电解质和弱电解质
强、弱电解质的区分是看在水溶液里(或熔 融状态)电离成阴、阳离子的程度.
多元弱酸分步水解:电离程度依次减小
强电解质和弱电解质
强电解质
弱电解质
定义 溶于水后能够全部电
离的电解质在溶液中 存在形式 Nhomakorabea离子
溶于水后只有部分 电离的电解质
离子、分子
化合物 类型
强酸 HCl / HNO3 强碱 NaOH 绝大多数盐NaCl/AgCl
弱酸 CH3COOH H2CO3
弱碱 NH3·H2O
弱电解质的电离方程式
(1)弱电解质在水溶液中的电离是部分可逆的,
用 ⇌ 表示可逆性
例如: NH3·H2O ⇌ NH4++OH-
CH3COOH ⇌ H++ CH3COO-
醋酸
醋酸根
(2)多元弱酸的电离是分步可逆的,用分步电离 方程式表示。
例如: H2CO3 ⇌ H+ + HCO3-
HCO3- ⇌ H+ + CO32-
电离平衡的移动:
由于条件(浓度)的改变,弱电解质由原来的电离 平衡达到新的电离平衡的过程,称为电离平衡的移动。
三、同离子效应:
弱电解质: NH3·H2O 强电解质: NH4Cl
NH4+ + OHNH4+ + Cl-
基础化学第三章(电解质溶液)

2 共有的特性
探讨酸和碱之间的一些共同特征。
3 反应类型
介绍酸碱反应的不同类型和常见反应方程。
酸碱指示剂及其应用
什么是酸碱指示剂?
解释酸碱指示剂的作用原理和常 见的指示剂种类。
指示剂的应用
介绍在实验室和日常生活中使用 指示剂的示例。
pH测试
探讨如何使用指示剂测量溶液的 pH值。
基础化学第三章(电解质 溶液)
在这个大纲中,我们将深入讨论基础化学第三章的内容,重点是电解质溶液 的概念、性质和相关的化学反应。拟好心态,准备好展开一段奇妙的化学之 旅吧!
电解质概述
什么是电解质?
介绍电解质的定义和基本特 征。
电解质的分类
区分电解质的不同类型和特 性。
电解质的重要性
探讨电解质在生活和工业中 的应用。
2
气体扩散法
解释气体扩散法的原理和实施方法。
3
液体混合法
介绍液体混合法的步骤和常见应用。
pH计的原理和校准
1
pH计的校准
2
详细步骤和常见校准方法。
3
pH计的原理
阐述pH计测量pH值的基本原理。
校准的重要性
解释为什么校准pH计是必要的。
摩尔浓度和摩尔体积浓度
摩尔浓度
定义并解释如何计算化学物质的摩尔浓度。
摩尔体积浓度
介绍摩尔体积浓度的概念以及如何进行计算。
溶解度概述
什么是溶解度?
解释溶解度的定义和基本概念。
溶解度曲线
讲解溶解度曲线的含义和图像。
影响因素
探讨影响溶解度的因素,如温度和压力。
标准溶液的制备方法
1
液体浸染法
详细步骤和注意事项。
基础化学第三章(电解质溶液)5

Kb1 =
10-14 Ka ( HPO 2-)
4
=
10-14 Ka3
Kb2 = Ka (H Kb3 = Ka (H
10-14
PO 2 4)
10-14
3PO4)
10-14 = Ka2 10-14 = Ka1
三、酸碱平衡的移动 1、浓度对酸碱平衡的影响
酸溶液
H C
C Ka
第三章 电解质溶液 (Electrolytic solution)
• 体液(血浆、胃液、泪水、尿液)含有许多 电解质离子,如Na+、K+、Ca2+、Mg2+、Cl-、 HCO3-、CO32-、HPO42-、H2PO4-、SO42- 等,它 们维持体液渗透浓度、pH值。 • 体液中的电解质溶液是其他生理功能的必需 成分,并对神经、肌肉等组织的生理、生化 功能起着重要的作用
(二)水溶液的pH
中性溶液: [H+ ] = [OH- ]= 1.010-7 mol · L-1 酸性溶液 :[H+ ] >1.010-7 mol · L-1 > [OH- ] 碱性溶液: [H+ ] <1.010-7 mol · L-1 < [OH- ] pOH= -lg OH- pH= -lg H+ pH + pOH = -lg H+OH-= - lg 10-14 = 14.00
• 钾的代谢:
来源:食物,婴儿每天需2.0-3.0mmol/kg,成人只
需1.0-1.5mmol/kg。饥饿者进食后,由于细胞代谢
的需要,钾的需求增多。其中90%以上由尿排出,其 余大部分由粪便排出。
第一节
强电解质溶液
基础化学习题及详细答案

第三章电解质溶液首页难题解析学生自测题学生自测答案章后习题解答难题解析 [TOP]例3-1 (1) NaOH和H3PO4溶液等体积混合,测得溶液pH值为4.66,溶液的渗透浓度为200 mmol·L-1,求混合前NaOH和H3PO4溶液的浓度各为多少?(2)若此 NaOH和H3PO4溶液以2:1的体积混合,溶液pH 和渗透浓度各为多少? (已知H3PO4:p K a1=2.16;p K a2=7.21;p K a3=12.32)分析 (1) NaOH和H3PO4溶液等体积混合,由pH=4.66知混合后只有NaH2PO4,那么NaOH和H3PO4浓度相等,再由混合溶液渗透浓度求得NaOH和H3PO4溶液的浓度。
(2)NaOH和H3PO4以2:1体积混合,可计算出溶液pH和渗透浓度。
解 (1)因NaOH和H3PO4溶液等体积混合后pH=4.66=(p K a1+p K a2)/2,可判断混合溶液只含有NaH2PO4,因此混合前NaOH和H3PO4浓度相等,又混合溶液的渗透浓度为200 mmol·L-1,即2×c(NaH2PO4)= 200 mmol·L-1c(NaH2PO4)= 0.10 mol·L-1根据c(NaH2PO4)推出混合前c(NaOH)= 0.20 mol·L-1,c(H3PO4)= 0.20 mol·L-1(2) NaOH和H3PO4溶液以2:1的体积混合发生的反应为:2NaOH(aq) + H3PO4(aq)Na2HPO4(aq) + 2H2O(aq)由于混合前c(NaOH)= 0.20 mol·L-1,c(H3PO4)=0.20 mol·L-1,混合后溶液只含有Na2HPO4,浓度为c(Na2HPO4)= (2/3)×0.20 mol·L-1因此溶液的渗透浓度为3×(2/3)×0.20×1000 mmol·L-1=400 mmol·L-1由于混合溶液只含有Na2HPO4两性物质,pH=(p K a2 + p K a3)/2=(7.21+12.32)/2=9.76例3-2在0.100 mol·L-1HA溶液的解离度α为1.32%,(1)计算HA的解离常数。
大学基础化学第二章电解质溶液_思维导图

盐效应
注意 理解
近似计算 解离度的求解
对于强酸与强碱溶液
对于浓度较稀时 对于浓度不稀时
c(H+)=c(HA)
满足两个条件
一元弱酸与弱碱
例题
条件
酸碱溶液PH的计算
多元弱酸与弱碱
结论
例题 例子
条件
两性物质溶液
例题
标准平衡常数
计算结果注意
结果不可以有分数 不可以有10^1.4这样的结果,次幂必须是整数 注意有效数字取得原则(参考第一章)
化学平衡
酸碱理论
补充知识
平衡常数
注:C0=1,P0=100
化学平衡的移动
水的自递平衡
水的离子积 pH,pOH与pKw之间的关系
与什么有关 大小代表什么
酸常数与碱常数
共轭酸碱常数之间的关系
电解质溶液
忽略近似思想
弱酸与弱碱溶液的解离平衡
浓度对酸碱平衡的影响
理解 例题
稀释定律
酸碱平衡的移动
理解
Байду номын сангаас
同离子效应
例题
电解质 解离度
定义 分类 定义 与什么有关
强电解质溶液
例题
子主题1
离子互吸理论
定义
离子系数
影响因素(2个)
离子活度
公式与单位
应用
平均活度
离子强度
公式与单位 与活度之间的关系
电离理论 酸碱质子理论
酸碱半反应式 酸碱定义 共轭酸碱对 通过质子理论得出的观点(3个) 酸碱反应的实质 拉平效应与区分效应
定义及重要特点
浓度c=1mol/L 压强p=100Kpa
教学设计4---电解质溶液

课件演示
学生讨论
例题讲解
课件演示
课件演示
学生讨论
例题讲解
课件演示
课件演示
课件演示
·强酸、强酸的酸式根、强碱、大部分盐
·某些金属氧化物
弱电解质
·在水溶液中不能全部离解成离子的化合物
强弱电解质的区分不是靠物质的溶解度,而是物质溶解部分的电离情况
【PPT】
[几种典型的强电解质]
【讲述】
介绍离解方程式的写法
以硫酸钡为例强调强弱电解质的区分要看物质溶解部分的是否能完全离解
2.水的电离和离子积
【PPT】[一元弱酸弱碱在水中的离解方程及其离解常数的表达式]
【讲述】比较弱酸弱碱离解常数表达式的异同
【PPT】离解常数
Kaθ或Kbθ越大,离解程度越大,该弱电解质相对越强
[Kaθ或Kbθ的数值大小与电解质强弱的对应关系]
8.离解度
【PPT】
[离解度的定义式]
除与温度有关外,还与溶液浓度有关,使用时必须指出酸或碱的浓度
【例题】
一定浓度的强酸的pH和pOH值;强酸与强酸混合;强碱与强碱混合;强酸与强碱混合
7.一元弱酸弱碱的离解平衡
【提问】
(1)一元弱酸HA溶于水后,存在哪些趋势?
(2)在HA分子刚溶于水时,哪种趋势占优势?为什么?
(3)HA水溶液中都有哪些粒子?
【板书】HA、H+、A-(重新结合)、OH-,H2O
【PPT】电离平衡
3.溶液的酸碱性
【PPT】
无论是纯水、酸溶液中还是碱溶液中都同时存在H+和OH-,而且KWθ= c’(H+)*c’(OH-)的关系始终成立
[常温下,溶液的酸碱性跟H+和OH-浓度的关系]
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HAc
H+ + Ac-
编辑ppt
11
例3-1:某弱酸电解质HA溶液,其质量摩
尔浓度b(HA)为0.1mol·kg-1,测得此溶液的 Tf为0.19,求该物质的解离度。(Kf=1.86)
解:设解离度为:
HA 平衡时 b-b
H+ + Ab b
粒子的总浓度b总=b-b+b+b= (1+)b
Tf=Kfb总 =Kf b(1+)
=
已解离的分子数 原有分子总数
编辑ppt
8
强电解质溶液理论
例:0.10mol·L-1 NaCl溶液,实验测得凝 固点为–0.348℃,求NaCl的表观解离度。
=
已解离的分子数 原有分子总数
根据公式推导:
= i-1
表观解离度: =1.87-1=0.87=87%
编辑ppt
9
强电解质溶液理论
凝固点法测定电解质的解离度
实验中:Na+ 质点浓度﹤ 1mol·L-1Na+ Cl- 质点浓度﹤ 1mol·L-1 Cl-
Debye-Hűckl理论: 优点:解释强电解质的表观电离度非100%的原因 缺点:只适用于1-1型电解质的稀溶液
编辑ppt
22
强电解质溶液理论
例:NaCl溶液 浓度极稀时 i=2 一定浓度时 1﹤i﹤2
=
Tf Kfb
-1 =
i-1
通式 = i-1
= 0.19 -1= 2.2%
编辑ppt
1.860.1
12
①当0.1mol/kg的电解质溶液解离度:
②
大于30%的称为强电解质
③
5%~30%为中强度电解质
④
小于5%的为弱电解质
⑤是人为的一般划分。按强电解质溶液理论,
⑥这种划分不是概念性的。即正确的划分是:
NaCl NaOH
HAc H2CO3
H2SO4
HNO3
…
H PO 编辑ppt
34
H2C2O4
…4
强电解质溶液理论
电解质溶液的依数性
⊿p =i K ·bB
⊿Tb=i Kb·bB ⊿Tf=i Kf·bB
П =i bBRT
公式的适用范围:难挥发电解质的稀溶液
电解质的稀溶液的 沸点、凝固点、
滲透压的实验测定值偏离计算值.
若CNaCl =1 mol·L-1
a 实验中:Na+ 质:点浓Na度+ ﹤ 1mol·L-1Na+ a Cl- :质点浓Cl-度﹤ 1mol·L-1 Cl-
a 实验中: Na+ ﹤ CNa+
aCl- ﹤ CCl-
编辑ppt
23
强电解质溶液理论
三、离子的活度和活度因子
(1)活度和活度因子
a 某离子B: B= B·CB
第三章
电解质溶液
编辑ppt
1
第三章 电解质溶液
在溶解于水中或熔融状态下
非电解质
合非 物导
电 的 化
合能 物导
电 的 化
编辑ppt
电解质
2
第一节
强电解质溶液理论
编辑ppt
3
强电解质溶液理论
一、 强电解质和弱电解质 电解质
强电解质
弱电解质
在水中完全解离 为离子的化合物 不存在解离平衡
在水中部分解离 为离子的化合物 存在解离平衡
25
强电解质溶液理论 (2)平均活度和平均活度因子
强电解质在溶液中是以正负离子存在的
-和+不能分别测定
可惜!
对于1—1价型电解质:
1-1价型:NaCl 1-2价型:MgCl2
…
平均活度因子: ±=√ +· -
注意! ±= += -
编辑ppt
26
强电解质溶液理论
平均活度: a±=√ +C+·-C-
例:0.10mol·Kg-1 NaCl溶液,实验测得 凝固点为–0.348℃,求NaCl的校正因子i=?
i的理论值应=2, i 的实验值=1.87 i 的实验值< i 的理论值
结论:NaCl在水中不完全离解?
NO,是完全电离,不存在电离平衡。
NaCl编N辑ppat + + Cl-
7
强电解质溶液中,实验测得的解 离度称为表观解离度。其表观解 离度并不是100%。
离 活离 子 度子 活 因浓
编辑ppt
度 子度
离子的 有效浓 度称为 活度
24
强电解质溶液理论
关于活度因子 B
(1)通常情况下: 溶液中:0< B <1
(2)溶液无限稀时, B =1
(3)中性分子, B =1
(4)弱电解质溶液, B =1
(5)溶液中H2O的H2O =1
(6)液态和固态的编辑Bppt=1
编辑ppt
5
强电解质溶液理论
例:0.10mol·Kg-1 NaCl溶液,实验测得 凝固点为–0.348℃,求NaCl的校正因子i=?
解: 实验值≠理论值
即求: i 的实验值=?
⊿Tf = i b B·Kf
i= ⊿Tf
bB·Kf
0.348 = 1.86×0.10
≠2 =1.87 编辑ppt
6
强电解质溶液理论
c±=cB
a±= ±cB
= ±C±
通怎过样离求子±强?度I !
编辑ppt
27
强电解质溶液理论
离子强度
离子强度是溶液中所有离子 产生的电场强度的量度
I=d=e=f
1 2
∑i bi Zi2
I = ½(C1Z12 + C2Z22 + C3Z32 +‥‥) =1/2∑ CiZi2
一定浓度时,
编辑ppt
19
Na+ Cl-
强电解质溶液理论
一定浓度时,
编辑ppt
20
强电解质溶液理论
一定浓度时, 离子氛 Na+
Cl-
统计 模型
每一NaCl分子产生 1<i<2 个质点
编辑ppt
21
强电解质溶液理论
例:NaCl溶液 浓度极稀时 i=2 一定浓度时 1﹤i﹤2
若CNaCl =1 mol·L-1
. . (2) 离子间静电吸引和排斥,形成离子氛
编辑ppt
15
强电解质溶液理论
Na+ Cl-
编辑ppt
16
强电解质溶液理论
Na+ Cl-
溶液极稀时,每一NaCl分子可产生两个质点
i = 2 编辑ppt
17
强电解质溶液理论
Na+ 溶液极浓时, i → 1
Cl-
编辑ppt
18
强电解质溶液理论
Na+ Cl-
强电解质:100%解离 弱电解质:部分解离
编辑ppt
13
强电解质溶液理论
瑞典化学家S.A.Arrhenius认为: 强电解质不完全解离
X射线实验和强电解质溶液理论认为: 强电解质完全解离
编辑ppt
14
强电解质溶液理论
二、强电解质溶液理论要点
离子相互作用理论——Debye-Hűckl理论 (1) 强电解质在水溶液中100%解离
电解质 CB(mol·L-1) 理论i 值 实验i 值 解离度
NaCl 0.10
2
1.87 87%
KNO3 0.10
2
MgCl2 0.10
3
Ca(NO3)2 0.10
3
编辑ppt
1.79 79%
2.79 89.5%
2.48
74%
10
解离度可通过测定电解质溶液的依数性 Tf、 Tb、求得
弱电解质在水溶液存在解离平衡
