化学必修二 甲烷、乙烯、乙醇、乙酸相关化学方程式
必修二 有机化学 方程式总结

乙烯与HX:C2H4+HX催CH3CH2X
乙烯与H2O:C2H4+H2O催CH3CH2OH
乙烯的加聚:nC2H4催[CH2-CH2]n
苯的燃烧: +15O2点12CO2+6H2O
苯的溴代:+Br2Br
苯的硝化:+HNO3浓硫酸50-60℃NO2+H2O
苯的磺化:+H2SO4(浓)70-80℃SO3H +H2O
乙醇与HX:C2H5OH+HX C2H5OX+H2O
乙酸与钠:2CH3COOH+Na 2CH3COONa+H2O
乙酸与NaOH:CH3COOH+NaOH CH3COONa+H2O
乙酸Na2CO3:CH3COOH+Na2CO3CH3COONa+H2O+CO2
乙醇与乙酸:CH3COOH+C2ห้องสมุดไป่ตู้5OH浓硫酸△CH3COOC2H5+H2O
必修二
甲烷和Cl2:CH4+Cl2CH3Cl+HCl
CH3Cl+Cl2CH2Cl2+HCl
CH2Cl2+Cl2CHCl3+HCl
CHCl3+Cl2CCl4+HCl
甲烷燃烧:CH4+2O2点CO2+2H2O
甲烷分解:CH41000℃C+2H2
乙烯燃烧:C2H4+3O2点2CO2+2H2O
乙烯与Br2:C2H4+Br2C2H4Br2
苯与H2:+3H2Ni△
乙醇和钠:2C2H5OH+2Na 2CH3COONa+H2
必修二有机物化学方程式

必修二有机物化学方程式有机物化学方程式1.甲烷燃烧CH+2O→CO+2HO(条件为点燃) 24222.甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH→C+2H(条件为高温高压,催化剂)243.甲烷和氯气发生取代反应CH+Cl→CHCl+HCl CHCl+Cl→CHCl+HCl 2324322CHCl+Cl→CHCl+HCl CHCl+Cl→CCl+HCl (条件都为光照。
)42323224.实验室制甲烷CHCOONa+NaOH→NaCO+CH(条件是CaO 加热)42335.乙烯燃烧CH=CH+3O→2CO+2HO(条件为点燃)222226.乙烯和溴水CH=CH+Br→CHBr-CHBr 222227.乙烯和水CH=CH+HO→CH3CH2OH (条件为催化剂)2228.乙烯和氯化氢CH=CH+HCl→CH-CHCl 22329.乙烯和氢气CH=CH+H→CH-CH (条件为催化剂)3223210.乙烯聚合nCH=CH→-[-CH-CH-]n-(条件为催化剂)222211.氯乙烯聚合nCH=CHCl→-[-CH-CHCl-]-(条件为催化剂)n2212.实验室制乙烯CHCHOH→CH=CH↑+HO (条件为加热,浓HSO)422232213.乙炔燃烧CH+3O→2CO+HO (条件为点燃)2222214.乙炔和溴水CH+2Br→CHBr 42222215.乙炔和氯化氢两步反应:CH+HCl→CHCl--------CHCl+HCl→CHCl 2 2232324216.乙炔和氢气两步反应:CH+H→CH →CH+2H→CH (条件为催化6422222222剂)17.实验室制乙炔CaC+2HO→Ca(OH)+CH↑2222218.以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO === CaO + CO 2CaO+5C===2CaC+CO 2223CaC+2HO→CH+Ca(OH)C+HO===CO+H-----高温2222222CH+H→CH----乙炔加成生成乙烯CH可聚合42224 2219.苯燃烧2CH+15O→12CO+6HO (条件为点燃)2262620.苯和液溴的取代CH+Br→CHBr+HBr 5666221.苯和浓硫酸浓硝酸CH+HNO→CHNO+HO (条件为浓硫酸)265623622.苯和氢气C6H6+3H2→C6H12 (条件为催化剂)23.乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)24.乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)25.乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸170摄氏度)26.两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸140摄氏度) 27.乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O28.乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H22Ca+H2O )2CH3COOH+CaO→(CH3CH2 乙酸和氧化钙29.30.乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH31.乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑32.甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O33.乙醛和新制的氢氧化铜CH3CHO+2CU(OH)2=CH3COOH+CU2O+2H2O34.乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)一.烯烃是指含有C=C键的碳氢化合物。
必修二有机化学方程式
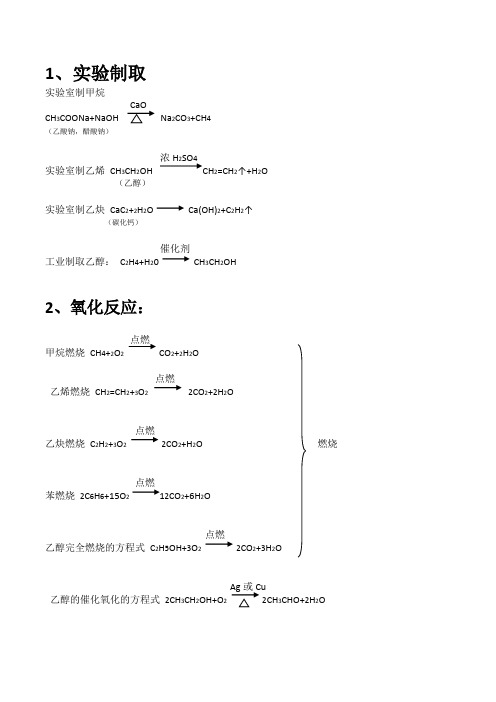
1、实验制取实验室制甲烷CH3COONa+NaOH Na2CO3+CH4(乙酸钠,醋酸钠)浓H2SO4实验室制乙烯CH3CH2OH CH2=CH2↑+H2O(乙醇)实验室制乙炔CaC2+2H2O Ca(OH)2+C2H2↑(碳化钙)催化剂工业制取乙醇:C2H4+H20 CH3CH2OH2、氧化反应:点燃甲烷燃烧CH4+2O2CO2+2H2O点燃乙烯燃烧CH2=CH2+3O22CO2+2H2O点燃乙炔燃烧C2H2+3O22CO2+H2O 燃烧点燃苯燃烧2C6H6+15O212CO2+6H2O点燃乙醇完全燃烧的方程式C2H5OH+3O22CO2+3H2O乙醇的催化氧化的方程式2CH3CH2OH+O22CH3CHO+2H2O甲烷和氯气发生取代反应光照CH4+Cl2CH3Cl+HCl光照CH3Cl+Cl2CH2Cl2+HCl光照CH2Cl2+Cl2CHCl3+HCl光照CHCl3+Cl2CCl4+HCl(注:反应物是卤素单质的蒸汽)苯和浓硫酸浓硝酸C6H6+HNO3C6H5NO2+H2O(硝基苯)FeBr3苯与溴在FeBr3催化作用下反应C6H6+Br2C6H5Br+HBr浓硫酸乙酸乙酯的水解:CH3COOC2H5+H2O CH3COOH+C2H5OH (注:苯的同系物也可以发生取代反应)4、加成反应:乙烯和溴水CH2=CH2+Br2CH2Br-CH2Br催化剂乙烯和水CH2=CH2+H20 加热加压CH3CH2OH催化剂乙烯和氯化氢CH2=H2+HCl CH3-CH2Cl乙烯和氢气CH2=CH2+H2CH3-CH3苯和氢气C6H6+3H2C6H12催化剂乙烯聚合nCH2=CH2-[-CH2-CH2-]n- (条件为催化剂)催化剂氯乙烯聚合nCH2=CHCl -[-CH2-CHCl-]n- (条件为催化剂)6、酯化反应:浓硫酸乙醇乙酸反应的方程式CH3CH2OH+CH3COOH CH3COOC2H5 +H2O (酸脱羟基,醇脱氢)(乙酸乙酯)7、补充:乙醇与钠反应2C2H5OH+2Na 2C2H5ONa+H2↑。
必修二有机化学方程式归纳+答案

必修二有机化学方程式归纳一.写出下列反应的方程式(除燃烧外,有机物必须用结构简式表示)1.甲烷与氯气混合光照CH 4+Cl 2 CH 3Cl+HCl CH 3Cl+Cl 2 CH 2Cl 2+HClCH 2Cl 2+Cl 2 CHCl 3+HCl CHCl 3+Cl 2 CCl 4+HCl2.乙烯通入溴水(或通入溴的CCl 4溶液)中CH 2 = CH 2 + Br 2 CH 2BrCH 2Br3.乙烯与水反应 CH 2 = CH 2 + H 2O CH 3CH 2OH4.乙烯与溴化氢反应CH 2 = CH 2 + HBr CH 3CH 2Br5.乙炔与氯化氢反应生成氯乙烯CH ≡CH + HCl H 2C = CHCl6.苯和浓硝酸反应 + HO -NO 2 NO 2 +H 2O7.苯和液溴反应+ Br 2 Br + HBr8.苯和氢气反应+ 3H 2 9.某烃燃烧 CxHy+(x+y/4)O 2 xCO 2+y/2H 2O10.乙醇与钠反应2C 2H 5OH+2Na 2CH 3COONa+H 2↑11.乙醇催化氧化2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O 12.乙醛氧化成乙酸2CH 3CHO + O 2 2CH 3COOH13.银镜反应 CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O 光照 光照 光照 光照 催化剂 催化剂 催化剂浓H 2SO 450-60℃ Fe 催化剂 加热、加压点燃 Cu △催化剂水浴加热14.乙醛与新制氢氧化铜反应 CH 3CHO+2Cu(OH)2+NaOH CH 3COONa+Cu 2O ↓+2H 2O15.乙酸与钠反应2CH 3COOH+2Na CH 3COONa+H 2↑16.乙酸与碳酸钠反应2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑17.乙酸与氢氧化铜反应2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O18.乙酸与乙醇酯化反应 CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3+H 2O 19.乙酸乙酯在酸性条件下水解CH 3COOC 2H 5+H 2O ⇋ CH 3COOH+ C 2H 5OH 20.乙酸乙酯在碱性条件下水解 CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH 21.硬脂酸甘油酯与烧碱混合加热C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH 3 C 17H 35COONa+CH-OH C 17H 35COO-CH 2 CH 2-OH水浴加热 催化剂 △稀硫酸 △△△。
高中必修二化学方程式大全汇总(精华版)

高中必修二化学方程式大全汇总(精华版)方程式是化学学科内容的重中之重。
下面是高中必修二化学方程式,希望对大家有所帮助。
高中必修二化学方程式1必修二各章节化学方程式第一章物质结构元素周期律1、li与o2反应(点燃):4li+o22li2ona与o2反应(点燃):2na+o2na2o2na与h2o反应:2na+2h2o===2naoh+h2↑k与h2o反应:2k+2h2o===2koh+h2↑2、卤素单质f2、cl2、br2、i2与氢气反应:f2+h2===2hfcl2+h2===2hclbr2+h2===2bri2+h2===2hi3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:①cl2+2nabr===br2+2nacl②cl2+2nai===i2+2nacl(2)溴水与碘化钠溶液反应:br2+2nai===i2+2nabr4、mg与h2o反应:mg+2h2o===mg(oh)2+h2↑al与hcl反应:2al+6hcl===2alcl3+3h2↑mg与hcl反应:mg+2hcl===mgcl2+h2↑点击查看:高一必修二常用化学方程式总结第二章化学反应与能量1、ba(oh)2?8h2o与nh4cl的反应:ba(oh)2·8h2o+2nh4cl==bacl2+2nh3↑+10h2o2、原电池原理典型的原电池(zn-cu原电池)负极(锌):zn-2e-===zn2+(氧化反应)正极(铜):2h++2e-===h2↑(还原反应)、用电子式表示电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:zn+2h+===zn2++h2↑3、h2o2在催化剂作用下受热分解:2h2o22h2o+o2↑4、na2so4与cacl2反应:na2so4+cacl2===caso4↓+na2co35、高炉炼铁:2c+o2===2cofe2o3+3co==2fe+3co2第三章有机化合物1、甲烷的主要化学性质(1)氧化反应(与o2的反应):ch4(g)+2o2(g)co2(g)+2h2o(l)(2)取代反应(与cl2在光照条件下的反应,生成四种不同的取代物):2、乙烯的主要化学性质(1)氧化反应(与o2的反应):c2h4+3o22co2+2h2o(2)加成反应((与br2的反应):(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:ch2=ch2+h2ch3ch3ch2=ch2+hclch3ch2cl(一氯乙烷)ch2=ch2+h2och3ch2oh(乙醇)(4)聚合反应:(乙烯制聚乙烯)(氯乙烯制聚氯乙烯)3、苯的主要化学性质:(1)氧化反应(与o2的反应):2c6h6+15o212co2+6h2o br(2)取代反应:①与br2的反应:+br2+hbr②苯与硝酸(用hono2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。
高中化学化学方程式总结

高中化学(苏教版必修二)化学方程式总结甲烷1.甲烷燃烧2O2+CH4 C02+2H20燃2•甲烷与氯气光照(①T②T③-►④)光分步① CH4+C12 CH3CI+HCI昭*光合并①CH4+CI2昭CH3CI+HCI光② CH3C I+CI2 CH2C 12+HC I昭光② CFL+2C12昭八•、CH2C12+2HCI光③ CH2CI2+CI2 CHC13+HCI昭光③ CFL+3C12昭CHC13+3HCI光④ CHC13+C12 CC 14+HCI昭八•、CC14+4HCI高3.甲烷高温分解CH4 C+2H/皿4.十六烷裂化:C2H34加热、CeHw+CsHu力口压乙烯点1.乙烯燃烧CH2=CH2+3022CO2+2H2O2.乙烯与涣水反应CH2=CH2+Br2^CH2BrCH2Br (1,2-二渙乙烷)光④ CH4+4C12昭3.乙烯与水反应CH?二CH2+H2O化CH3CH2OH4•乙烯与氢气、氯气、氟化氢反应CH2=CH2+H2-^CH2CH3CH2=CH2+C 12-^ CH2CICH2CICH2 二CH2+HCI—CH3CH2CI僵化5.乙烯反应生成聚乙烯nCH?二CH? [CH2 CH2]n剂—>催乙烯与氧气反应2CH2=CH2+02化2CH3CH0剂催CH2=CH2+O2化CHaCOOH1•苯燃烧 2 O +150212C02+6H 202.苯与纯渙反应O +B“化 O Br+HBr浓H £?O +HNO 35O ~ O NO2+H2O-60 °CO 0^04.苯与氢气反应O +3出式,结构与之相同)乙醇乙醇与钠反应 2C 2H 50H+2Na->2C 2H 50Na+H 2T3.苯与浓硝酸反应是6个CH?各个C 相连接的简点2.乙醇燃烧C2H50H+3022C02+3H20—>催△3.乙醇催化氧化总式2C2H50H+02化2CH3CH0+2H20剂银)分式2C U+02D 2CuO2C U+2CH3CH0+2H20乙酸—>催1.乙醛氧化2CH3CH0+02化2CH3C00H剂2.乙酸与镁反应2CH3C00H+Mg^ (CH3C00)2Mg+H2T(催化剂为铜或2C U O+2C2H5OH43.乙酸与氧化铜反应2CH3C00H+C U0-> (CH3COO)2C U+H2O4.乙酸与氢氧化钠反应CHsCOOH+NaOH—CHsCOONa+bbO5.乙酸与碳酸钠反应2CH£00H+ Na2CO3-^2CH3C00Na+H20+C02 f6.乙酸与乙醇反应CH3CH20H+CH3C00H ^H2S°4 . CH3C00CH2CH3+H207 人酯----- >1.乙酸乙酯与水反应CH3COOCH2CH3+H2O 冀H2SO4CH3CH2OH+CH3COOH2.乙酸乙酯与氢氧化钠反应CH3C00CH2CH3+ NaOH △ CH3C00Na+ CH3CH2OH3.油脂反应G7H35COOCH2 飞出0HI IC17H35COOCH +3 H2OA3G7H35COOH+ CH 钿C17H35C00CH2CH2 OHG7H35COOCH2CH2 OHG7H35COOCH +3 Na0H^3C17H35C00Na+CH OHI IG7H35C00CH2 CH7 OH糖类1.葡萄糖与氧气反应CH2O6+6O2—6CO2+6H2O—>酒2.葡萄糖发酵C6H,206化2C2H50H+2C02T酶3.1分子麦芽糖水解生成2分子葡萄糖;1分子蔗糖水解生成1分子葡萄糖与1分子果糖;纤维素、淀粉水解:(C6H W05)n,即有n分子纤维素或淀粉,生成n分子葡萄糖。
高中有机物化学方程式

高中有机物化学方程式
高中有机化学是化学学科的重要组成部分,涉及的有机物种类繁多,反应类型多样。
以下是一些常见的高中有机化学方程式,供您参考:
1、烷烃的燃烧反应
CH4 + 2O2 →CO2 + 2H2O
C2H6 + 7O2 →2CO2 + 3H2O
2、烷烃与卤素单质的取代反应
CH4 + Cl2 →CH3Cl + HCl
C2H6 + Cl2 →C2H5Cl + HCl
3、烯烃与卤素单质的加成反应
CH2=CH2 + X2 →CH2XCH2X
CH2=CH2 + HX →CH3CH2X
4、乙醇的燃烧反应
C2H5OH + 3O2 →2CO2 + 3H2O
5、乙醇的催化氧化反应
2C2H5OH + O2 →2CH3CHO + 2H2O
6、乙酸乙酯的水解反应
CH3COOC2H5 + H2O →CH3COOH + C2H5OH
7、酯化反应
CH3COOH + C2H5OH →CH3COOC2H5 + H2O
8、苯与浓硝酸的取代反应
C6H6 + HNO3(浓) →C6H5NO2 + H2O
9、苯的燃烧反应
C6H6 + 7O2 →6CO2 + 3H2O
10、乙烯与浓硫酸的反应
CH2=CH2 + H2SO4(浓) →CH3CH2SO3H
以上仅列举了一些常见的高中有机化学方程式,实际上还有许多其他类型的有机反应,如酯化反应、水解反应、消去反应、加氢还原反应等等。
学习高中有机化学时,建议系统地学习和掌握各类有机物的性质和反应规律,以便更好地理解和应用这些方程式。
人教版高中化学必修二方程式大全

人教版高中化学必修二方程式大全 高中化学必修二的作用是承上启下,连接着高中化学无机部分和有机部分,这本书的重要性不言而喻。
现在小编将人教版高中化学必修二的化学方程式进行了整理,方便大家的复习。
人教版高中化学必修二化学方程式—物质结构,元素周期律 1、Li与O2反应(点燃):4Li + O2 2Li2 ONa与O2反应(点燃): 2Na+O2 Na2O22、卤素单质F2 、Cl2 、Br2 、I2与氢气反应:F2 + H2 === 2HF Cl2 + H2 === 2HClBr2 + H2 === 2Br I2 + H2 === 2HI3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:①Cl2+2NaBr===Br2+2NaCl②Cl2+2NaI===I2+2NaCl(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr4、Mg与H2O反应:Mg+2H2O === Mg(OH)2+H2↑Al 与HCl反应: 2Al+6HCl===2AlCl3+3H2↑Mg与HCl反应: Mg+2 HCl === MgCl2+ H2↑5、Na与Cl2反应(点燃):2 Na+cl2=(点燃)2Nacl 人教版高中化学必修二化学方程式—化学反应与能量 1、Ba(OH)2?8H2O与NH4Cl的反应:Ba(OH) 2?8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O2、原电池原理典型的原电池(Zn-Cu 原电池)负极(锌):Zn-2e-===Zn2+(氧化反应)正极(铜):2H++2e-===H2↑(还原反应)电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:Zn+2H+===Zn2++H2↑3、H2O2在催化剂作用下受热分解:2H2O2 2H2O+O2↑4、Na2SO4与CaCl2反应:Na2SO4+CaCl2===CaSO4↓+Na2CO35、高炉炼铁:2C + O2 === 2CO Fe2O3 + 3CO ==2Fe + 3CO2。
