高中化学工艺流程图题库
高中化学:工艺流程综合题(解析版)

专题工艺流程综合题1(2024届·天津河西·统考二模)铋(Bi)及其化合物在电子材料等领域有着广泛作用。
以某铋矿(主要成分为Bi x O y、MnSO4,主要杂质Fe2O3和SiO2)制取Bi x O y并回收锰的工艺流程如下:按要求回答下列问题。
(1)元素Bi较同主族N的周期数大4,写出基态Bi原子的价层电子排布式。
(2)回收Mn时,Mn2+被还原为Mn的过程中,电子填入原子轨道的名称是。
(3)滤渣1的主要成分的晶体类型为。
(4)“还原”步骤中Bi粉的作用为。
(5)已知BiCl3在2.0<pH<11.0的环境中,易水解成BiOCl沉淀。
写出该反应的化学方程式:。
若实验室配制BiCl3溶液,需用的试剂有BiCl3、蒸馏水、。
(6)已知:常温下,K sp Fe OH2=5×10-17;“沉Bi”步骤得到BiOCl沉淀。
此“沉Bi”步骤控制溶液的pH范围为。
(7)Bi x O y(相对分子质量为Mr)的立方晶胞结构如图所示(棱长为apm)。
Bi x O y的化学式为;晶胞密度为g/cm3(用含a、Mr、N A的代数式表示;N A为阿伏伽德罗常数的值)。
【答案】(1)6s26p3(2)4s(3)共价晶体(4)将Cu2+还原成Cu,Fe3+还原成Fe2+(5)BiCl3+H2O=BiOCl↓+2HCl浓盐酸(6)小于6.5×1030(7)Bi2O32Mra3N A【分析】含铋烧渣先水浸除锰,另加入少量稀硫酸可促进MnS溶解,同时MnSO4溶于水通过过滤分离;用浓盐酸处理浸出固体后过滤,二氧化硅不反应得到滤渣1为SiO2,铋、铁、铜元素反应进入滤液,滤液中含有Fe3+、Cu2+、Bi3+;氧化性:Fe3+>Cu2+>Bi3+,则加入Bi粉处理滤液,Cu2+被还原成Cu,Fe3+被还原成Fe2+,过滤滤渣2中含有Cu以及过量的Bi,滤液中含有Fe2+、Bi3+;加入NaOH使得铋转化为沉淀过滤分离出来,沉淀加入氢氧化钠溶液脱氯处理得到Bi2O3。
高考化学复习题型十八 化学工艺流程题.docx

高中化学学习材料(灿若寒星**整理制作)题型十八化学工艺流程题通关演练(建议完成时间:30分钟)1.(2013·汕头二模,26)铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:请回答下列问题:(1)若A为H2O(g),可以得到Fe3O4,写出H2O的电子式:________________。
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)________________。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾的化学方程式,并配平:(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00 mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI 充分反应后,再用0.1 000 mol·L -1 Na 2S 2O 3标准溶液滴定至终点,消耗标准溶液20.00 mL 。
已知:2Fe 3++2I -===2Fe 2++I 2 I 2+2S 2O 2-3===2I -+S 4O 2-6。
①写出滴定选用的指示剂________,滴定终点观察到的现象________________。
②溶液Ⅰ中铁元素的总含量为________g·L -1。
若滴定前溶液中H 2O 2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
(5)设计实验方案,检验溶液Ⅰ中的Fe 2+________________________________________________________________ ________________________________________________________________。
高中化学工艺流程题

高中化学工艺流程题
《高中化学工艺流程》
高中化学课程中,学生将学习化学工艺流程,这是一个重要的主题,涵盖了化学原理在实际生产中的应用。
化学工艺流程是指将化学原料转化成最终产品的整个过程,它涉及到许多化学反应、控制条件、设备和安全措施。
首先,化学工艺流程需要确定原料和产物的化学成分和结构,然后设计和选择合适的反应条件和催化剂,以提高反应效率和产物纯度。
同时,需要考虑到反应的热力学和动力学条件,以便进行反应控制和优化。
其次,化学工艺流程需要设计和选择合适的反应设备,确保反应可以高效进行,并且保障操作人员的安全。
例如,需要考虑反应器的尺寸、材料、加热和冷却方式等因素。
随后,化学工艺流程还需要考虑产物的分离和纯化,以及废物处理。
这包括蒸馏、结晶、萃取、膜分离等技术,以及废物的处理和回收利用。
最后,化学工艺流程还需要考虑生产规模、成本和环境影响等因素。
这需要对生产过程进行经济性分析和环境评估,以找到合适的生产规模和工艺条件。
总的来说,化学工艺流程是化学学科的一个重要内容,它涉及到化学原理、工程技术和经济管理等多个方面。
通过学习化学
工艺流程,学生可以更好地理解化学在工业生产中的应用,为未来的学习和工作打下坚实的基础。
高中化学高考工艺流程选择(含有详细过程)
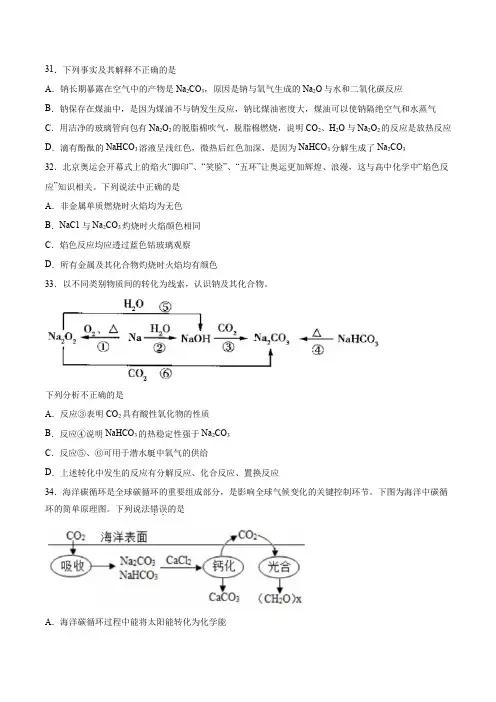
31.下列事实及其解释不正确的是A.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应D.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO332.北京奥运会开幕式上的焰火“脚印”、“笑脸”、“五环”让奥运更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。
下列说法中正确的是A.非金属单质燃烧时火焰均为无色B.NaC1与Na2CO3灼烧时火焰颜色相同C.焰色反应均应透过蓝色钴玻璃观察D.所有金属及其化合物灼烧时火焰均有颜色33.以不同类别物质间的转化为线索,认识钠及其化合物。
下列分析不正确的是A.反应③表明CO2具有酸性氧化物的性质B.反应④说明NaHCO3的热稳定性强于Na2CO3C.反应⑤、⑥可用于潜水艇中氧气的供给D.上述转化中发生的反应有分解反应、化合反应、置换反应34.海洋碳循环是全球碳循环的重要组成部分,是影响全球气候变化的关键控制环节。
下图为海洋中碳循环的简单原理图。
下列说法错误..的是A.海洋碳循环过程中能将太阳能转化为化学能B .钙化释放CO 2的离子方程式:2HCO 3-+Ca 2+=CaCO 3↓+CO 2↑+H 2OC .影响海洋碳循环的因素主要有海水的酸碱性、水温、藻类生物的分布等D .光合作用,每生成0.1mol(CH 2O)x 转移电子数为4N A (N A 表示阿伏伽德罗常数)35.为了检验某含有NaHCO 3杂质的Na 2CO 3样品的纯度,现将w 1 g 样品加热,其质量变为w 2 g ,则该样品的纯度(质量分数)是A .211845331w w w -B .12184()31w w w -C .211734231w w w -D .2111158431w w w - 36.侯德榜是我国近代化学工业的奠基人之一,他将氨碱法和合成氨工艺联合起来,发明了“联合制碱法”。
高中化学课件-工艺流程题

题型示例1:某厂废水中含5.00×10-3mol·L-1的
Cr2O72-,其毒性较大。某研究性学习小组为了变 废为宝,将废水处理得到磁性材料
Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计 了如下实验流程: 碱性条件三种
离子都沉淀 滤液
含 Cr2O72的酸性 废水
①加 FeSO4·7H2O
cv×10-3mol
cv×10-3mol
则TiO2质量分数=M·cv×10-3/w
质量分数计算、滴定--源于教材 铁、钛之间的氧化还原--高于教材
⑺判断下列操作对TiO2质量分数测定结果的影响 (填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的 NH4Fe(SO4)2溶液有少量溅出,使测定结果_偏__高___。 ②若在滴定终点读取滴定管刻度时,俯视标准液 液面,使测定结果_偏__低______。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴 定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还 原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标 准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
⑴ TiCl4水解生成TiO2·xH2O的化学方程式
为__T_i_C_l_4_+_(x__+_2_)_H_2_O_______T_i_O__2·_x_H__2O__↓_+_4_H__C_l__。
理论上需要加入_1__3_._9___gFeSO4·7H2O。
1×5.00×10-3×2×5×278=13.9g
M(FeSO4·7H2O)=278g/mol
PH试纸使用技能 守恒计算技能
2人.工类业及废生水态中系常统含产有生一很定大量损的害C,r2必O须72-和进C行r处O4理2-,。它常们用会的对处 理方法有两种。
高中化学流程图选择(含详细过程)

高中化学流程图选择一、单选题1.下列“类比”结果正确的是A .()32Ca HCO 的溶解度比3CaCO 的大,则3NaHCO 的溶解度也比23Na CO 的大B .2CO 、2SO 是酸性氧化物,则2NO 也是酸性氧化物C .pH=1的盐酸稀释100倍后pH=3,则pH=6的3CH COOH 稀释100倍后pH=8D .将丙三醇加入新制()2Cu OH 中溶液呈绛蓝色,则将葡萄糖溶液加入新制()2Cu OH 中溶液也呈绛蓝色 2.下列说法中,正确说法的个数是 ①酸性氧化物在一定条件下能与碱发生反应②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物 ③蔗糖、硫酸钡和水分别属于非电解质、电解质和非电解质 ④根据是否有丁达尔效应将分散系分为溶液、胶体和浊液⑤因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来 ⑥Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的⑦用洁净铂丝蘸某溶液在无色火焰上灼烧,直接观察火焰为黄色,则该溶液一定含钠盐 ⑧测定新制氯水的pH 时,先用玻璃棒蘸取液体滴在pH 试纸上,再与标准比色卡对照 ⑨根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸 ⑩为增强“84”消毒液的消毒效果,可加入稀盐酸 A .3个B .4个C .5个D .6个3.某工厂用提取粗盐后的盐卤(主要成分为MgCl 2)制备金属镁,其工艺流程如下,下列说法中,错误的是( )A .操作①发生的反应为非氧化还原反应B .若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器C .操作①是蒸发浓缩结晶D .在整个制备过程中,未发生置换反应4.(2021·湖南雅礼中学高二期末)黄铁矿(主要成分FeS 2),在空气中会被缓慢氧化,氧化过程如图所示。
下列说法不正确的是A .发生反应a 时,FeS 2被还原B .为了验证b 过程反应后溶液中含Fe 3+,可选用KSCN 溶液C .c 发生反应的离子方程式为:3+2+2-+22414Fe +FeS +8H O=15Fe +2SO +16HD .已知25℃时,393]Ksp[Fe(OH) 2.7910-=⨯,则该温度下d 逆反应的平衡常数为3K 2.7910=⨯ 5.利用NaClO 氧化尿素制备242N H H O ⋅ (水合肼)的实验流程如图所示:已知:①氯气与烧碱溶液的反应是放热反应;②242N H H O ⋅有强还原性,能与NaClO 剧烈反应生成2N 。
考点15 工艺流程题(原卷版)
考点15 工艺流程题1.(2020·云南高三模拟)实验室模拟工业利用废铁镁矿渣(含SiO2、MgCO3及少量Fe2O3、FeCO3)和高纯硅工业制备的副产物SiCl4为原料,制备二氧化硅和氯化镁晶体,流程如下:回答下列问题:(1)反应前通常会将废矿渣粉碎,目的是______。
沉淀1是______(填名称),SiCl4与水反应的化学方程式为______。
(2)向溶液2中加H2O2的目的是______。
试剂1可以是下列试剂中的______ (填标号)。
A.NaOH B.MgCl2C.MgCO3D.MgO(3)为使Fe3+完全沉淀,应调节pH为______。
(完全沉淀是指溶液中离子浓度小于1×10-5mol·L-1,)K sp[Fe(OH)3]=4×10-38,lg0.2(4)直接加热蒸发溶液3无法获得氯化镁晶体,原因是______,应该采取的措施是______。
(5)若该流程制备MgCl2·2H2O的产率为95%,则制得655gMgCl2·2H2O需含MgCO3质量分数为42%的铁镁矿渣______g(保留一位小数)。
2.(2020·河南郑州一中高三开学考试)三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色、微溶于水的配合物,是合成其他一些含钴配合物的原料。
下图是某小组以含钴废料( 含少量Fe 、Al 等杂质) 制取[Co(NH3)6]Cl3的工艺流程:回答下列问题:(1)写出加“适量NaClO3”后发生反应的离子方程式_________________。
(2)“加Na2CO3调pH 至a”会生成两种沉淀,分别为________________(填化学式)。
(3)操作Ⅰ的步骤包括________________、冷却结晶、减压过滤。
(4)流程中NH4Cl 除作反应物外,还可防止加氨水时c(OH-) 过大,其原理是_______________。
高中化学 二轮复习 化学工艺流程图题 专项训练
专题强化练(一)物质的分离、提纯、反应条件的控制1.某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:请回答下列问题:操作1主要包括:__________、____________、_______。
洗涤CuSO4·5H2O 粗产品不能用大量水洗,而用冰水洗涤,原因是_____________________________________ ______________________________________________________________________________。
答案蒸发浓缩冷却结晶过滤冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失2.利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:沉淀物Fe(OH)3Fe(OH)2Co(OH)2Co(OH)3Al(OH)3Ni(OH)2开始沉淀pH 2.27.47.60.1 4.07.6完全沉淀pH 3.28.99.2 1.1 5.29.2(1)用硫酸浸取金属电极芯时,提高浸取率的方法有______________(写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、____________,“浸出液”调节pH的范围为________,调节pH选用的试剂可以是________(填字母)。
a.铁b.氨水c.碳酸钠溶液d.稀硫酸(3)由“母液4”获取NiSO4·7H2O的操作是_______________,____________,过滤,洗涤。
答案(1)适当的升高温度(或将金属电极芯研成粉末)(2)Al(OH)3 5.2≤pH<7.6 bc(3)蒸发浓缩 冷却结晶解析 (2)金属电极芯中的主要成分是Co 、Ni ,还含少量Fe 、Al 等,加入稀硫酸酸浸时,金属单质都转化为金属离子(Ni 2+、Co 2+、Fe 2+、Al 3+),浸出液中加入过氧化氢的作用是氧化亚铁离子为铁离子,由流程图中最终产物可知,调节pH 的作用是除去溶液中的Fe 3+、Al 3+,故沉淀A 的主要成分是Fe(OH)3、Al(OH)3;为了保证Fe 3+、Al 3+沉淀完全而Ni 2+、Co 2+不沉淀,由表格数据可知,要调节pH 的范围为5.2≤pH<7.6;调节pH 时不能加入铁,因为铁能还原铁离子为亚铁离子,不能加入稀硫酸,因为要将溶液的pH 调大,由流程图中后续所加试剂可知,调节pH 选用的试剂可以是氨水、碳酸钠溶液。
高中化学工艺流程题
高中化学工艺流程专题训练Co1.〔共14分〕一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co 2O 3·CoO 的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴〔CoO 〕的工艺流程如下:〔1〕过程I 中采用NaOH 溶液溶出废料中的Al ,反应的离子方程式为。
〔2〕过程II 中加入稀H 2SO 4酸化后,再加入Na 2S 2O 3溶液浸出钴。
则浸出钴的化学反应方程式为〔产物中只有一种酸根〕。
在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
〔3〕过程Ⅲ得到锂铝渣的主要成分是LiF 和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
〔4〕碳酸钠溶液在过程III 和IV 中所起作用有所不同,请写出在过程IV 中起的作用是__________。
〔5〕在Na 2CO 3溶液中存在多种粒子,下列各粒子浓度关系正确的是______〔填序号〕。
A c (Na +) = 2c (CO 32-)B c (Na +) > c (CO 32-) > c (HCO 3-)C c (OH -) > c (HCO 3-) > c (H +)D c (OH -) - c (H +) == c (HCO 3-) + 2c (H 2CO 3)〔6〕CoO 溶于盐酸可得粉红色的CoCl 2溶液。
CoCl 2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl 2吸水变色这一性质可制成变色水泥和显隐墨水。
下图是粉红色的CoCl 2·6H 2O 晶体受热分解时,剩余固体质量随温度变化的曲线,A 物质的化学式是______。
〔共14分〕〔1〕2Al+2OH -+2H 2O = 2AlO 2-+3H 2↑〔2〕4Co 2O 3·CoO + Na 2S 2O 3 + 11H 2SO 4 = 12CoSO 4 + Na 2SO 4 + 11H 2O Co 2O 3·CoO 可氧化盐酸产生Cl 2,污染环境。
高中化学工业流程题(含详细过程)
高中化学工业流程题86.超细纳米铜粉的比表面积大、表面活性中心数目多,在冶金和石油化工中是优良的催化剂。
利用铜屑制备超细纳米铜粉的工艺流程如下:回答下列问题:(1)“溶解”的离子方程式为_______,为了加快“溶解”反应,可采取的措施有_______(写出一种即可)。
(2)“滤饼B”是一种白色晶体,元素分析表明含有Cu、S、O、N、H五种元素,Cu、S、N的原子数目比为1:1:1,光谱分析显示所含阴离子呈三角锥形,其中一种阳离子呈正四面体形,则该晶体的化学式为_______。
(3)“酸解”的化学方程式为_______;验证酸解后所得铜粉为纳米级的简便方法是_______(填操作及现象)。
(4)“溶液C”可以循环利用,应将其导入到_______操作中(填操作单元的名称)。
87.四水合磷酸锌[Zn3(PO4)2·4H2O],摩尔质量为457g·mol-1,难溶于水]是一种性能优良的绿色环保防锈颜料。
实验室以锌灰(含ZnO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如图,回答下列问题:已知:6NH4HCO3+3ZnSO4ΔZnCO3·2Zn(OH)2·H2O↓+3(NH4)2SO4+5CO2↑提示:在本实验条件下,高锰酸钾的还原产物是MnO2(1)实验前需要将锌灰研磨成粉末状,原因是_______。
(2)步骤I中需将溶液pH调至5,应选择的最佳试剂是_______(填字母)a.NaOHb.ZnOc.Ba(OH)2(3)步骤II中加入的a是_______。
(4)写出步骤I滴加KMnO4溶液发生的离子方程式_______。
(5)步骤IV反应结束后得到Zn3(PO4)2·4H2O的操作包括_______和干燥。
(6)称取45.7mgZn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为_______。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工艺流程图专项1.四川攀枝花蕴藏丰富的钒、钛、铁资源。
用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如图:请回答下列问题:(1)硫酸与二氧化钛反应的化学方程式是。
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为:、。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。
水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。
请用所学化学平衡原理分析通入高温水蒸气的作用:。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、、、(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556akgA(摩尔质量为278g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体,再向红褐色胶体中加入3336bkgA和112ckg铁粉,鼓入足量空气搅拌,反应完全后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料,若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料kg。
2.硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下:(1)将菱锌矿研磨成粉的目的是.(2)完成“氧化除铁”步骤中反应的离子方程式:□Fe(OH)2+□+□═□Fe (OH)3+□Cl﹣(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学相对分子质量为89,化学式是.(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为.Mg(OH)2Zn(OH)2MgCO3CaCO3开始沉淀的pH 10.4 6.4 ﹣﹣沉淀完全的pH 12.4 8.0 ﹣﹣开始溶解的pH ﹣10.5 ﹣﹣Ksp 5.6×10﹣12﹣ 6.8×10﹣6 2.8×10﹣9(5)“滤液4”之后的操作依次为、、过滤,洗涤,干燥.(6)抽滤装置如下图所示,该装置中的错误之处是;抽滤完毕或中途需停止抽滤时,应先,然后.(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于.3.钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有少量MgO、CaO、SiO2等杂质.利用钛铁矿制备锂离子电池电极材料(钛酸锂LiTi5012和磷酸亚铁锂LiFePO4)的工业流程如图所示:已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl﹣=Fe2++TiOCl42﹣+2H2O (I)化合物FeTiO3中铁元素的化合价是.(2)滤渣A的成分是.滤渣A的熔点大于干冰的原因是.(3)滤液B中TiOCI42﹣转化生成Ti02的离子方程式是.(4)由滤液D制备LiFeP04的过程中,所需17%双氧水与H2C204的质量比是.(5)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4LiTi5012+3FePO4.该电池充电时阳极反应.二.实验题(共1小题)4.锡及其化合物在生产、生活中有着重要的用途.已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为﹣33℃、沸点为114℃.请按要求回答下列相关问题:(1)元素锡比同主族碳的周期数大3,锡的原子序数为.(2)用于微电子器件生产的锡粉纯度测定:①取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1 000mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00mL.步骤②中加入Fe2(SO4)3的作用是;此锡粉样品中锡的质量分数:.(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:①步骤Ⅰ加入Sn粉的作用:及调节溶液pH.②步骤Ⅱ用到的玻璃仪器有烧杯、.③步骤Ⅲ生成SnO的离子方程式:.④步骤Ⅳ中检验SnO是否洗涤干净的操作是,证明已洗净.⑤步骤Ⅴ操作依次为、过滤、洗涤、低温干燥.(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:.实验室欲用图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是.三.解答题(共46小题)5.电镀污泥主要含有Cr2O3、NiO和Fe2O3等物质,可制备Na2Cr2O7溶液和NiSO4•6H2O 晶体,实现有害物质的资源化利用.已知黄钠铁矾[NaFe3(SO4)2(OH)6]是一种浅黄色的难溶物,具有沉淀颗粒大、沉降速率快、容易过滤的特点.(1)焙烧时Cr2O3被氧化为Na2CrO4,该反应的化学方程式为.(2)写出酸化时CrO42﹣转化为Cr2O72﹣的离子方程式:.(3)①加入CaCO3的目的是中和溶液中的酸,调节溶液pH,提高铁的去除率.溶液pH对除铁效率影响如图2所示.则除铁时应控制溶液的pH为(填序号).A.0.5~1.5 B.1.5~2.5 C.2.5~3.5②除铁时发生反应的离子方程式为.③若除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是.(4)从滤液中获取NiSO4•6H2O晶体的操作为、冷却结晶、过滤、、干燥.6.信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt 等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线图1:请回答下列问题:(1)第①步Cu与酸反应的离子方程为;得到滤渣1的主要成分为.(2)第②步加H2O2的作用是,使用H2O2的优点是;调溶液pH的目的是使生成沉淀.(3)用第③步所得CuSO4•5H2O制备无水CuSO4的方法是.(4)由滤渣2制取Al2(SO4)3•18H2O,探究小组设计了三种方案如图2.上述三种方案中,方案不可行,原因是;(5)探究小组用滴定法测定CuSO4•5H2O (Mr=250)含量.取a g试样配成100mL 溶液,每次取20.00mL,消除干扰离子后,用c=mol L﹣1EDTA(H2Y2﹣)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:Cu2++H2Y2﹣=CuY2﹣+2H+写出计算CuSO4•5H2O质量分数的表达式ω=;下列操作会导致CuSO4•5H2O含量的测定结果偏高的是.a.未干燥锥形瓶b.滴定终点时滴定管尖嘴中产生气泡c.未除净可与EDTA反应的干扰离子.7.二氧化氯(ClO2)被称作第四代杀菌消毒剂.(1)工业上用NaCl还原NaClO3生产ClO2的工艺流程如下图所示:①反应器中发生反应的化学方程式为:2NaClO3+2NaCl+2H2SO4=2ClO2↑+Cl2↑+2Na2SO4+2H2O生产中将NaClO3和NaCl按物质的量之比1:1.05的混合水溶液加入反应器,NaCl 稍过量的目的是.②反应器中生成的ClO2和Cl2由通入空气驱出进入ClO2吸收塔,产生的混合液进入汽提塔,汽提塔排出的废液成分主要是(填化学式,下同).③以上生产流程中循环②循环利用的物质是.④为提高ClO2的产量,可用亚氯酸钠(NaClO2)与反应器中Cl2反应生成ClO2,该反应的化学方程式为.尾气中的Cl2可用SO2水溶液吸收,该反应的化学方程式为.(2)用阳离子交换膜分隔的电解池电解450g/L NaClO2溶液,可在阳极室产生ClO2,在阴极室产生H2和NaOH.下列有关说法正确的是(填字母符号).A.电解时电子流向为:电源负极→导线→阴极,阳极→导线→电源正极B.在电解过程中,Na+向阳极移动,ClO2﹣向阴极移动C.在电解过程中阳极周围的pH基本不变D.电解的离子方程式可表示为:2ClO2﹣+2H2O2ClO2↑+H2↑+2OH﹣.8.高锰酸钾是一种常用的氧化剂.下图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去):相关物质不同温度下的溶解度(单位:g)数据如表:KMnO4CH3COOK K2SO4KCl物质温度20℃ 6.34 217 11.1 34.290℃45.2 398 22.9 53.9(1)“熔融”步骤反应的化学方程式为.(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:.(3)操作2是、、.(4)图中可以直接进行循环利用的物质是(填化学式).(5)KMnO4粗晶体中的主要杂质(填化学式)有和;操作3用到的试剂和;若用硫酸代替图中的冰醋酸,则导致的问题及原因是.9.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:查询资料,得25℃时有关物质的数据如表:饱和H2S溶液SnS沉淀完全FeS开始沉淀FeS沉淀完全pH值 3.9 1.6 3.0 5.5(1)操作II中,先通入硫化氢至饱和,目的是;后加入硫酸酸化至pH=2的作用是.(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②.(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol•L﹣1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:;②滴定时盛放KMnO4溶液的仪器为(填仪器名称).③判断此滴定实验达到终点的方法是.④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:.10.工业上采用氯化铵焙烧菱锰矿制备高纯度碳酸锰,工艺流程如下:已知相关信息如下:①菱猛矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.7、3 2;Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③“焙烧”过程的主要反应MnCO3+2NH4Cl=MnCl2+2NH3↑+CO2↑+H2O。
④常温下,几种难溶物的Ksp如下表所示:难溶物Mn(OH)2MnCO3CaF2MgF2Ksp 2.0×10﹣13 2.0×10﹣11 2.0×10﹣107.0×10﹣11(1)分析图1、图2、图3,最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(美锰矿粉)分别为、、、。
