高中化学工艺流程练习题(3)
高中化学:工艺流程综合题(解析版)

专题工艺流程综合题1(2024届·天津河西·统考二模)铋(Bi)及其化合物在电子材料等领域有着广泛作用。
以某铋矿(主要成分为Bi x O y、MnSO4,主要杂质Fe2O3和SiO2)制取Bi x O y并回收锰的工艺流程如下:按要求回答下列问题。
(1)元素Bi较同主族N的周期数大4,写出基态Bi原子的价层电子排布式。
(2)回收Mn时,Mn2+被还原为Mn的过程中,电子填入原子轨道的名称是。
(3)滤渣1的主要成分的晶体类型为。
(4)“还原”步骤中Bi粉的作用为。
(5)已知BiCl3在2.0<pH<11.0的环境中,易水解成BiOCl沉淀。
写出该反应的化学方程式:。
若实验室配制BiCl3溶液,需用的试剂有BiCl3、蒸馏水、。
(6)已知:常温下,K sp Fe OH2=5×10-17;“沉Bi”步骤得到BiOCl沉淀。
此“沉Bi”步骤控制溶液的pH范围为。
(7)Bi x O y(相对分子质量为Mr)的立方晶胞结构如图所示(棱长为apm)。
Bi x O y的化学式为;晶胞密度为g/cm3(用含a、Mr、N A的代数式表示;N A为阿伏伽德罗常数的值)。
【答案】(1)6s26p3(2)4s(3)共价晶体(4)将Cu2+还原成Cu,Fe3+还原成Fe2+(5)BiCl3+H2O=BiOCl↓+2HCl浓盐酸(6)小于6.5×1030(7)Bi2O32Mra3N A【分析】含铋烧渣先水浸除锰,另加入少量稀硫酸可促进MnS溶解,同时MnSO4溶于水通过过滤分离;用浓盐酸处理浸出固体后过滤,二氧化硅不反应得到滤渣1为SiO2,铋、铁、铜元素反应进入滤液,滤液中含有Fe3+、Cu2+、Bi3+;氧化性:Fe3+>Cu2+>Bi3+,则加入Bi粉处理滤液,Cu2+被还原成Cu,Fe3+被还原成Fe2+,过滤滤渣2中含有Cu以及过量的Bi,滤液中含有Fe2+、Bi3+;加入NaOH使得铋转化为沉淀过滤分离出来,沉淀加入氢氧化钠溶液脱氯处理得到Bi2O3。
高中化学工艺流程题

高中化学工艺流程题
《高中化学工艺流程》
高中化学课程中,学生将学习化学工艺流程,这是一个重要的主题,涵盖了化学原理在实际生产中的应用。
化学工艺流程是指将化学原料转化成最终产品的整个过程,它涉及到许多化学反应、控制条件、设备和安全措施。
首先,化学工艺流程需要确定原料和产物的化学成分和结构,然后设计和选择合适的反应条件和催化剂,以提高反应效率和产物纯度。
同时,需要考虑到反应的热力学和动力学条件,以便进行反应控制和优化。
其次,化学工艺流程需要设计和选择合适的反应设备,确保反应可以高效进行,并且保障操作人员的安全。
例如,需要考虑反应器的尺寸、材料、加热和冷却方式等因素。
随后,化学工艺流程还需要考虑产物的分离和纯化,以及废物处理。
这包括蒸馏、结晶、萃取、膜分离等技术,以及废物的处理和回收利用。
最后,化学工艺流程还需要考虑生产规模、成本和环境影响等因素。
这需要对生产过程进行经济性分析和环境评估,以找到合适的生产规模和工艺条件。
总的来说,化学工艺流程是化学学科的一个重要内容,它涉及到化学原理、工程技术和经济管理等多个方面。
通过学习化学
工艺流程,学生可以更好地理解化学在工业生产中的应用,为未来的学习和工作打下坚实的基础。
2022年中考化学:工艺流程专项训练(3)(Word版含答案)

工艺流程图专项训练(三)1、铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al2O3 和SiO2,不考虑其它杂质)制取金属铝的基本流程如下:已知:①SiO2 是一种难溶于水,也不与盐酸、硫酸反应的物质.②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐.请回答下列问题:(1)滤液I 的溶质有(写化学式)。
(2)该流程中涉及到的基本化学反应类型有和分解反应。
(3)写出滤液II 中溶质的一种用途。
2、硫酸钙转化为K2SO4和CaCl2·6H 2O 的工艺流程如图:(1)蒸氨过程中涉及的反应类型(填编号)。
A.复分解反应B.化合反应C.分解反应D.置换反应(2)操作Ⅲ制取CaCl2·6H 2O 晶体,包含一系列操作:蒸发浓缩、、过滤、洗涤、干燥。
(3)可循环利用的物质除了NH3 外,还有(填化学式)。
3、下图为某化工厂用废硫酸制备K2SO4 的流程如下:(1)生产上将CaCO3 研成粉末的目的是。
(2)上述流程中,可循环使用的物质是。
(填写化学式)(3)洗涤反应③所得晶体不用水而用饱和K2SO4 溶液的目的是。
4、海水是一种取之不尽、用之不竭的资源宝库.请围绕科学利用海水资源,填写空格:用海水“晒盐”的方法得到的粗盐中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质。
将此粗盐提纯的部分实验方案如下:(1)加入过量氢氧化钠溶液的目的是。
(2)过滤后得到的沉淀成分有:氢氧化镁、碳酸钙、。
(3)请设计实验,能通过清晰可见的现象,准确控制在少量滤液样品中加入稀盐酸,至恰好完全反应:。
5、高纯碳酸钙广泛应用医药、生活生产中。
如图是由工业副产品氯化钙(含有氯化亚铁和氯化镁)制取高纯碳酸钙的工艺流程图。
有关资料:①氯化铵受热会分解;②在室温下,氯化铵的溶解度随氯化钙的质量分数的变化关系如图如示;回答下列问题:(1)工艺流程中操作1 的名称是;(2)向工业氯化钙溶液中加入氧化钙,氧化钙与水发生反应的基本反应类型是,所需氧化钙为粉末状,其目的是。
高中化学高考工艺流程选择(含有详细过程)
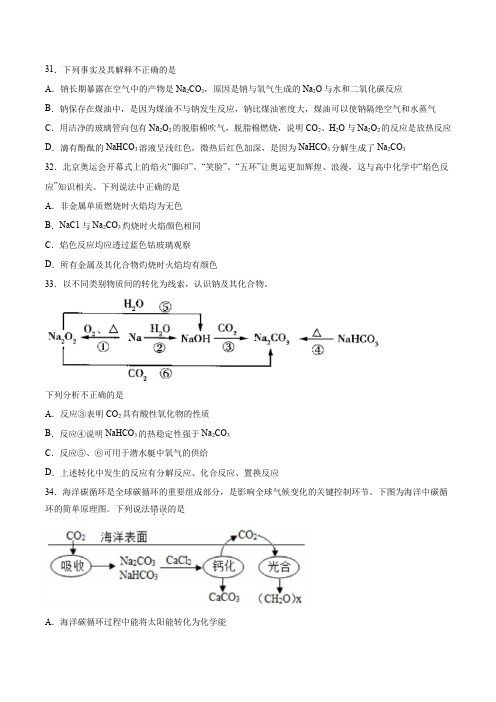
31.下列事实及其解释不正确的是A.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应D.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO332.北京奥运会开幕式上的焰火“脚印”、“笑脸”、“五环”让奥运更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。
下列说法中正确的是A.非金属单质燃烧时火焰均为无色B.NaC1与Na2CO3灼烧时火焰颜色相同C.焰色反应均应透过蓝色钴玻璃观察D.所有金属及其化合物灼烧时火焰均有颜色33.以不同类别物质间的转化为线索,认识钠及其化合物。
下列分析不正确的是A.反应③表明CO2具有酸性氧化物的性质B.反应④说明NaHCO3的热稳定性强于Na2CO3C.反应⑤、⑥可用于潜水艇中氧气的供给D.上述转化中发生的反应有分解反应、化合反应、置换反应34.海洋碳循环是全球碳循环的重要组成部分,是影响全球气候变化的关键控制环节。
下图为海洋中碳循环的简单原理图。
下列说法错误..的是A.海洋碳循环过程中能将太阳能转化为化学能B .钙化释放CO 2的离子方程式:2HCO 3-+Ca 2+=CaCO 3↓+CO 2↑+H 2OC .影响海洋碳循环的因素主要有海水的酸碱性、水温、藻类生物的分布等D .光合作用,每生成0.1mol(CH 2O)x 转移电子数为4N A (N A 表示阿伏伽德罗常数)35.为了检验某含有NaHCO 3杂质的Na 2CO 3样品的纯度,现将w 1 g 样品加热,其质量变为w 2 g ,则该样品的纯度(质量分数)是A .211845331w w w -B .12184()31w w w -C .211734231w w w -D .2111158431w w w - 36.侯德榜是我国近代化学工业的奠基人之一,他将氨碱法和合成氨工艺联合起来,发明了“联合制碱法”。
高中化学工艺流程题

高中化学工艺流程题高中化学工艺流程题:制备硝酸铵硝酸铵(NH4NO3)是一种重要的化学品,在农业、炸药、火箭燃料等领域有广泛的应用。
本文将介绍硝酸铵的制备工艺流程。
首先,制备硝酸铵的原材料是铵盐和硝酸。
一般来说,使用的铵盐是氨水(NH3)和氮气(N2)的反应生成的铵盐。
制备硝酸铵的流程如下:1. 反应槽:准备一个反应槽,反应槽内部应具有耐腐蚀性,可用不锈钢或玻璃材料制成。
2. 加入铵盐:在反应槽中加入足够的铵盐,一般以氯化铵(NH4Cl)为例,用来生成硝酸铵。
保持反应槽内的温度在适宜的范围内,一般为30-40摄氏度。
3. 加入硝酸:慢慢地向反应槽中加入浓硝酸(HNO3),并保持搅拌。
高浓度硝酸对反应原料有很强的腐蚀性,所以在操作过程中要格外小心。
4. 反应反应:铵盐和硝酸之间会发生反应生成硝酸铵。
反应过程中会产生大量的热量,反应槽中的温度会升高。
5. 催化剂:为了加快反应速度,可以添加一些催化剂。
常用的催化剂有碱式碳酸铵(NH4HCO3)或偏铵盐(NH4NO2)。
催化剂能够提高反应速度,并且会参与到反应中,消耗掉一些废物。
6. 过滤:反应完成后,将反应物进行过滤,将产生的硝酸铵溶液和未反应的铵盐分离。
利用滤纸或其他适合的过滤材料进行过滤。
7. 结晶:将过滤后的溶液进行结晶,除去多余的水分和杂质。
可利用加热和冷却的方法萃取结晶。
8. 干燥:最后,将结晶的硝酸铵晾干,去除残留的水分。
通常可以将其置于干燥器中进行干燥。
这样,通过以上的步骤,就可以成功地制备硝酸铵了。
需要注意的是,硝酸铵是一种危险品,我们在制备过程中要注意安全操作,使用化学实验室中的安全设备,并且需要储存和处理硝酸铵时要遵守相应的规定和法律要求。
综上所述,硝酸铵的制备工艺流程是一个复杂的过程,需要仔细控制各个环节。
通过科学的仪器和操作,可以安全、高效地制备出所需的硝酸铵。
高中化学实验解题指导(三)1概要

金属:
Fe:Fe→Fe2+→Fe3+(Fe→FeO→Fe2O3/Fe3O4) Cr:Cr3+→Cr2O72-/CrO42 Co:Co2+→Co3+
Ni:Ni2+→Ni3+
V:VO+/V2O3→VO2+/V2O4→(VO2)+/V2O5
Mn:Mn2+→Mn2O3→MnO2→Mn2O5→MnO42-→MnO4-
①分液: 原理:两种互不混溶的液体分离开 仪器:分液漏斗、铁架台
②萃取: 原理:某种溶质在互不相溶的两种溶剂里溶解度不同 仪器:分液漏斗、铁架台 操作:检漏、装液、振荡、静置、分液,蒸馏
高中化学实验解题指导
6
三、化学工艺流程题
③蒸馏(分馏): 原理:混合液体或液-固体系中各组分沸点不同,逐渐蒸馏出沸点依次
例题
高中化学实验解题指导
18
三、化学工艺流程题
1、(2008广东·19)碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料 。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂 质,提纯工艺路线如下:
高中化学实验解题指导
19
三、化学工艺流程题
已知碳酸钠的溶解度(S)
(4)滤渣中的成分主要是____________(写化学式);从过滤后的溶液 中获得KClO3晶体的方法是_______________、______________、洗涤、 烘干。
三、化学工艺流程题
【答案】 (1)CaC2+2H2O →Ca(OH)2+HC≡CH↑ (2)6Cl2+ 6Ca(OH)2 5CaCl2+Ca(ClO3)2+6H2O;加热溶液 (3)KClO3的溶解度比Ca(ClO3)2小 (4)C、SiO2;蒸发结晶、趁热过滤
2023届高三化学三轮冲刺 工艺流程题

巩固练习
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
③步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是减少Na2S2O4的溶解 损失,易于干燥,“后续处理”最终要加入少量Na2CO3固体,其原因是Na2CO3 为碱性物质,“保险粉”在碱性介质中较稳定。 解析:③根据Na2S2O4易溶于水,难溶于乙醇可知,步骤Ⅲ中得到的Na2S2O4 固体用乙醇洗涤,可以减少Na2S2O4的溶解损失,且易于干燥。根据Na2S2O4 在碱性介质中较稳定,在空气中易被氧化可知,“后续处理”最终要加入少量 Na2CO3固体,其原因是Na2CO3为碱性物质,“保险粉”在碱性介质中较稳定。
巩固练习
练1.连二亚硫酸钠(Na2S2O4)俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白 剂。Na2S2O4易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列 问题: (3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇 水溶液中,然后通入SO2使之发生反应,有CO2气体放出,总反应的离子方程式是 ________________________________________________________________________。 (4)有人设计了如图方法同时制备连二亚硫酸钠和过二硫酸钠(Na2S2O8)。电解过程中,阴极室 生成Na2S2O4,a极的电极反应式为________________,通过阳离子交换膜的离子主要是Na+ ,其迁移方向是________________________(填“由左侧向右侧移动”或“由右侧向左侧移动”) 。
技巧1——物质制备型问题解题方法
解题思路
读题头,明确目的为以铁硼矿(主要成分为MgB2O5·H2O和Fe3O4,还有少量Fe2O3、 FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)。流程分为原材料,预处理, 反应转化,分离提纯,目标产品5个部分。
高中化学 二轮复习 化学工艺流程图题 专项训练
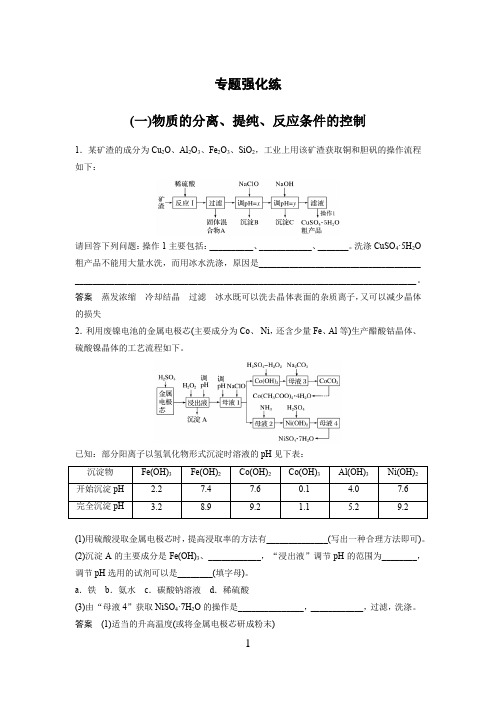
专题强化练(一)物质的分离、提纯、反应条件的控制1.某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:请回答下列问题:操作1主要包括:__________、____________、_______。
洗涤CuSO4·5H2O 粗产品不能用大量水洗,而用冰水洗涤,原因是_____________________________________ ______________________________________________________________________________。
答案蒸发浓缩冷却结晶过滤冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失2.利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:沉淀物Fe(OH)3Fe(OH)2Co(OH)2Co(OH)3Al(OH)3Ni(OH)2开始沉淀pH 2.27.47.60.1 4.07.6完全沉淀pH 3.28.99.2 1.1 5.29.2(1)用硫酸浸取金属电极芯时,提高浸取率的方法有______________(写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、____________,“浸出液”调节pH的范围为________,调节pH选用的试剂可以是________(填字母)。
a.铁b.氨水c.碳酸钠溶液d.稀硫酸(3)由“母液4”获取NiSO4·7H2O的操作是_______________,____________,过滤,洗涤。
答案(1)适当的升高温度(或将金属电极芯研成粉末)(2)Al(OH)3 5.2≤pH<7.6 bc(3)蒸发浓缩 冷却结晶解析 (2)金属电极芯中的主要成分是Co 、Ni ,还含少量Fe 、Al 等,加入稀硫酸酸浸时,金属单质都转化为金属离子(Ni 2+、Co 2+、Fe 2+、Al 3+),浸出液中加入过氧化氢的作用是氧化亚铁离子为铁离子,由流程图中最终产物可知,调节pH 的作用是除去溶液中的Fe 3+、Al 3+,故沉淀A 的主要成分是Fe(OH)3、Al(OH)3;为了保证Fe 3+、Al 3+沉淀完全而Ni 2+、Co 2+不沉淀,由表格数据可知,要调节pH 的范围为5.2≤pH<7.6;调节pH 时不能加入铁,因为铁能还原铁离子为亚铁离子,不能加入稀硫酸,因为要将溶液的pH 调大,由流程图中后续所加试剂可知,调节pH 选用的试剂可以是氨水、碳酸钠溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学工艺流程练习题(3)
1.CoCl2·6H2O是一种饲料营养强化剂。
以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O 的一种新工艺流程如下图:
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物Fe(OH)3Fe(OH)2Co(OH)2Al(OH)3
开始沉淀 2.37.57.6 3.4
完全沉淀 4.19.79.2 5.2
请回答下列问题:
⑴在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为。
⑵加入碳酸钠调节pH至a,a的范围是。
⑶操作Ⅰ包含3个基本实验操作,它们是、和过滤。
⑷制得的CoCl2·6H2O需减压烘干的原因是。
⑸为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。
通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是。
⑹在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是。
答案..⑴减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐
⑵5.2~7.6
⑶蒸发浓缩、冷却结晶
⑷降低烘干温度,防止产品分解
⑸样品中含有NaCl杂质;烘干时失去了部分结晶水
⑹将产品溶于乙醚过滤后,再蒸馏
【例10】某工厂用CaSO4、NH3、CO2制备(NH4)2SO4,其工艺流程如下。
回答下列问题:
(1)硫酸铵在农业生产中的用途是(一种即可) ,写出利用该流程制备(NH4)2SO4的总化学方程式:。
(2)a和b分别是(填序号)。
A.足量CO2、适量NH3 B.足量NH3、适量CO2
C.适量CO2、足量NH3 D.适量NH3、足量CO2
(3)上述流程中,可以循环使用的物质有(写化学式)。
(4)从滤液中获得(NH4)2SO4晶体,必要的操作步骤是。
(5)上述流程中,有关NH3作用的说法正确的是。
的浓度促进反应发生A.提供制备所需的氮元素B.增大CO2
3
C.作反应的催化剂D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3答案(1)化肥CaSO4+2NH3+CO2+ H2O=CaCO3↓+(NH4)2SO4
(2)B (3)CO2、NH3(4)蒸发
..过滤
..(5)ABD
..浓缩冷却结晶
【例11】医用氯化钙可用于生产补钙、抗过敏和消炎等药物。
以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为
97.0%~103.0%)的主要流程如下:
(1)除杂操作是加入Ca(OH)2,调节溶液pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。
检验Fe(OH)3是否沉淀完全的实验操作
是。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止Ca2+在蒸发时水解;②。
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴
定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有。
②计算上述样品中CaCl2·2H2O的质量分数为。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可
忽略),其可能原因有;。
答案.(1)取上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3沉淀完全(2)中和Ca(OH)2;防止溶液吸收空气中的CO2
(3)①酸式滴定管②99.9% ③样品中存在少量的NaCl;少量CaCl2·2H2O失水
【例12】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)从海水中可以得到食盐。
为了除去粗盐中的Ca2+、Mg2+、SO2-4及泥沙,可将
粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量NaCO3溶液,⑤加过量BaCl2溶液。
正确的操作顺序是。
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④⑤①③
(2)请写出氯碱工业的核心反应的化学方程
式。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。
(5)某化学研究性学习小组为了解从工业
溴中提纯溴的方法,查阅了有关资料,Br2
的沸点为59℃。
微溶于水,有毒性和强腐
蚀性。
他们参观生产过程后,绘制了如右装
置简图,请你参与分析讨论:
①整套实验装置中仪器连接均不能用橡胶
塞和橡胶管,其原因
是。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。
③C中液体产生颜色为。
为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是。
答案(1)C(2)2NaCl+2H2O======2NaOH+H2↑+Cl2↑(3)富集溴元素
(4)Br2+SO2+2H2O=4H++2Br-+SO2-4强酸对设备的严重腐蚀(5)①B r2腐蚀橡胶②控制温度计b的温度,并收集59℃时的馏分③深红棕色分液(或蒸馏)。
