实验六 ds区金属(铜、银、锌)
ds区元素

1ds区元素1.1 本章学习要求(1)掌握铜和银的重要化合物的性质,Cu(Ⅰ)和Cu(Ⅱ)的相互转化。
(2)掌握锌和汞的重要化合物的性质,Hg(Ⅰ)和Hg(Ⅱ)的相互转化。
(3)了解镉的重要化合物性质。
(4)了解含汞、镉废水的处理。
ds区元素包括铜族元素(铜、银、金)和锌族元素(锌、镉、汞)。
这两族元素原子的价电子构型与其它过渡元素有所不同,为(n-1)d10n s1~2。
由于它们的次外层d能级有10个电子(全满结构),而最外层的电子构型又和s区相同,所以称为ds区。
1.2 铜族元素通性和单质1.2.1概述ⅠB族元素包括铜(Cu)、银(Ag)、金(Au)三种元素,通常称为铜族元素。
铜族元素原子的价电子构型为(n-1)d10n s1。
最外层与碱金属相似,只有1个电子,而次外层却有18个电子(碱金属有8个电子)。
因此与同周期的ⅠA族元素相比,铜族元素原子作用在最外层电子上的有效核电荷较多,最外层的s电子受原子核的吸引比碱金属元素原子要强得多,所以铜族元素的电离能比同周期碱金属元素显著增大,原子半径也显著减小,铜族元素单质都是不活泼的重金属,而相应的碱金属元素的单质都是活泼的轻金属。
表 1.2-1 碱金属与铜族元素比较自然界的铜、银主要以硫化矿存在,如辉铜矿(Cu2S),黄铜矿(CuFe S2),孔雀石[Cu2(OH)2C O3]等;银有闪银矿(Ag2S);金主要以单质形式分散在岩石或沙砾中,我国江南、甘肃、云南、新疆、山东和黑龙江等省都蕴藏着丰富的铜矿和金矿。
铜族元素密度较大,熔点和沸点较高,硬度较小,导电性好,延展性好,尤其是金。
1克金可抽3公里长的金丝,可压成0.1微米的金箔,500张的总厚度比头发的直径还薄些。
金易生成合金,尤其是生成汞齐。
铜是宝贵的工业材料,它的导电能力虽然次于银,但比银便宜得多。
目前世界上一半以上的铜用在电器、电机和电讯工业上。
铜的合金如黄铜(Cu-Zn)、青铜(Cu-Sn)等在精密仪器、航天工业方面都有广泛的应用。
铜银锌实验报告

一、实验目的1. 了解铜、银、锌三种金属的性质及其在化学反应中的表现。
2. 掌握金属与酸、盐溶液反应的实验操作方法。
3. 通过实验,验证金属活动性顺序。
二、实验原理金属活动性顺序是指金属在化学反应中失电子的难易程度。
在金属活动性顺序中,位置越靠前的金属越容易失电子,表现出较强的还原性。
本实验通过铜、银、锌三种金属与酸、盐溶液反应,观察反应现象,从而判断三种金属的活动性顺序。
三、实验材料与仪器1. 实验材料:- 铜、银、锌金属片- 稀盐酸- 硫酸铜溶液- 氯化钠溶液- 滴管- 试管- 烧杯- 玻璃棒- 铁夹- 滤纸2. 实验仪器:- 电子天平- 移液器- 容量瓶- 滴定管- 酸式滴定瓶四、实验步骤1. 铜与酸反应实验(1)将铜片用砂纸打磨干净。
(2)取一只试管,加入少量稀盐酸。
(3)将铜片放入试管中,观察反应现象。
2. 银与酸反应实验(1)将银片用砂纸打磨干净。
(2)取一只试管,加入少量稀盐酸。
(3)将银片放入试管中,观察反应现象。
3. 锌与酸反应实验(1)将锌片用砂纸打磨干净。
(2)取一只试管,加入少量稀盐酸。
(3)将锌片放入试管中,观察反应现象。
4. 金属与盐溶液反应实验(1)取两只试管,分别加入少量硫酸铜溶液和氯化钠溶液。
(2)将铜片、银片、锌片分别放入试管中,观察反应现象。
五、实验结果与分析1. 铜与酸反应实验观察现象:铜片表面无明显变化。
2. 银与酸反应实验观察现象:银片表面无明显变化。
3. 锌与酸反应实验观察现象:锌片表面产生气泡,溶液由无色变为浅绿色。
4. 金属与盐溶液反应实验观察现象:铜片与硫酸铜溶液反应,溶液颜色加深;银片与硫酸铜溶液反应,无明显现象;锌片与硫酸铜溶液反应,溶液颜色变浅;铜片与氯化钠溶液反应,无明显现象;银片与氯化钠溶液反应,无明显现象;锌片与氯化钠溶液反应,无明显现象。
根据实验结果,可以得出以下结论:1. 锌的活动性最强,能与稀盐酸反应产生氢气。
2. 铜的活动性次之,不能与稀盐酸反应,但能与硫酸铜溶液反应。
ds区铜族与锌族元素

M+(g)
M2+(g)
/(kJ ·mol–1) /(kJ ·mol–1)
铜 Cu 3d104s1 1.90
-582
-2121
银 Ag 4d105s1 1.93
-485
-
金 Au 5d106s1 2.54
-644
-
第一页,编辑于星期四:十六点 一分。
铜族元素最外电子层结构与碱金属一样,都只 有一个S电子。但是次外层电子数不同,铜 族元素为18电子构型。由于18电子构型对 核的屏蔽效应比8电子构型的小得多,使得 铜族元素的原子有效核电荷较多,对最外层 的一个S电子吸引力比碱金属要强得多,因 而同族元素原子相应的电离能高得多,具有 金属半径小密度大等特点。
AgNO3和某些试剂反应,得到难溶的化合物,如:白
色Ag2CO3、黄色Ag3PO4、浅黄色Ag4Fe(CN)6、桔黄色
Ag3Fe(CN)6、砖红色Ag2CrO4。
第十七页,编辑于星期四:十六点 一分。
7. 金的化合物
Au(Ⅲ)是金的常见的氧化态,如:
AuF3,AuCl3,AuCl4–,AuBr3,Au2O3 ·H2O等 AuCl3无论在气态或固态,它都是以二聚体Au2Cl6的
键型 离子 过渡 过渡 共价
晶格类型 NaCl NaCl NaCl ZnS
第十五页,编辑于星期四:十六点 一分。
AgCl、AgBr、AgI都有感光分解的性质,可作感光材料。
hν
2AgX
2Ag+X2
AgX hν
银核 AgX
对苯二酚 米吐尔
Ag AgX
Na2S2O3 Ag
定影
α-AgI是一种固体电解质。把AgI固体加热,在418K时发生相 变,这种高温形态α-AgI具有异常高的电导率,比室温时大四个数 量级。实验证实AgI晶体中,I–仍保持原先位置,而Ag+离子的 移动,只需一定的电场力作用就可发生迁移而导电。
实验六 ds区金属(铜、银、锌)
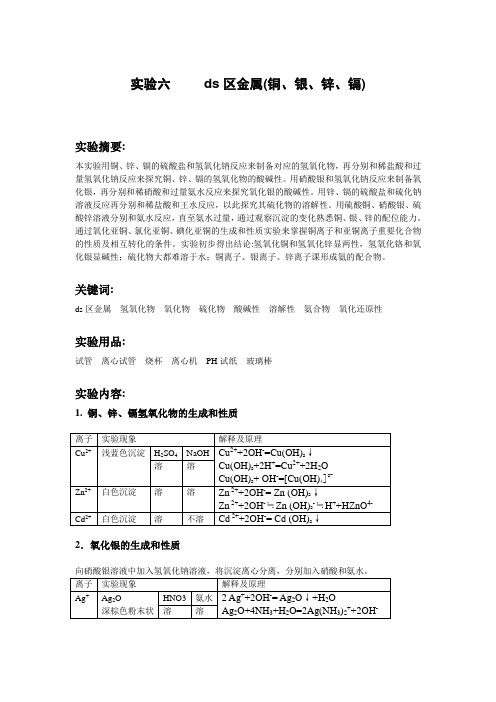
实验六ds区金属(铜、银、锌、镉)实验摘要:本实验用铜、锌、镉的硫酸盐和氢氧化钠反应来制备对应的氢氧化物,再分别和稀盐酸和过量氢氧化钠反应来探究铜、锌、镉的氢氧化物的酸碱性。
用硝酸银和氢氧化钠反应来制备氧化银,再分别和稀硝酸和过量氨水反应来探究氧化银的酸碱性。
用锌、镉的硫酸盐和硫化钠溶液反应再分别和稀盐酸和王水反应,以此探究其硫化物的溶解性。
用硫酸铜、硝酸银、硫酸锌溶液分别和氨水反应,直至氨水过量,通过观察沉淀的变化熟悉铜、银、锌的配位能力。
通过氧化亚铜、氯化亚铜、碘化亚铜的生成和性质实验来掌握铜离子和亚铜离子重要化合物的性质及相互转化的条件。
实验初步得出结论:氢氧化铜和氢氧化锌显两性,氢氧化铬和氧化银显碱性;硫化物大都难溶于水;铜离子、银离子、锌离子课形成氨的配合物。
关键词:ds区金属氢氧化物氧化物硫化物酸碱性溶解性氨合物氧化还原性实验用品:试管离心试管烧杯离心机PH试纸玻璃棒实验内容:1. 铜、锌、镉氢氧化物的生成和性质2.氧化银的生成和性质3.锌、镉硫化物的生成和性质分别往硫酸锌、硫酸铬溶液中加入硫化钠溶液,观察沉淀的颜色,将沉淀离心分离,洗涤,分成三份,再分别加入稀盐酸、浓盐酸、王水,水浴加热,观察沉淀的溶解情况。
4. 铜、银、锌的氨配合物分别往硫酸铜、硝酸银、硫酸锌溶液中加入氨水,观察沉淀的生成,继续加氨水至过量,观5.氧化亚铜的生成和性质6.氯化亚铜的生成和性质7.碘化亚铜的生成和性质结果及讨论:氢氧化锌、氢氧化铜具有两性,以碱性为主,能溶于浓的强碱中生成配离子,氢氧化铬的碱性比强氧化锌强,仅能缓慢溶于热浓强碱。
氢氧化银沉淀极不稳定,易脱水生成碱性氧化银。
ds区金属硫化物都不溶于水,有的可溶于酸,都能溶于王水。
铜离子、银离子、锌离子都可生成氨配合物。
亚铜离子在水溶液中极不稳定,易歧化为铜离子和铜。
参考文献:[1] 北京师范大学等校编.《无机化学实验》[M](第三版),高等教育出版社,2004,164-166[2]孙一平,朱锡海《十二烷基硫酸钠气浮氢氧化铬沉淀的机理》[J],《水技术处理》,199301期,38-42[3]罗耀宗《铜氨络离子废水的处理》[J],《甘肃环境研究与检测》,1997年第10卷第二期,34-35[4]舒余德《电解法制取氧化亚铜的研究》[J],《沈阳化工》,1994年03期,20-24。
ds区金属元素实验报告

ds区金属元素实验报告【引言】金属元素是化学中重要的一类元素,其具有良好的导电性、导热性和延展性等特点,被广泛应用于工业、建筑、电子等领域。
本实验旨在通过对不同金属元素的实验研究,探究它们的性质和特点,为深入理解金属元素提供实验依据。
【实验一:金属元素的导电性】首先,我们选取了几种常见的金属元素,包括铜、铁、铝和锌。
通过将它们分别连接到电池的两极,我们可以观察到它们是否能够导电。
实验结果显示,铜和铁能够很好地导电,灯泡发出明亮的光;而铝和锌的导电性较差,灯泡只发出微弱的光。
这是因为铜和铁具有较好的导电性能,而铝和锌的导电性能较差。
【实验二:金属元素的导热性】接下来,我们进行了金属元素的导热性实验。
我们选取了相同大小和形状的铜、铁、铝和锌棒,并将它们的一端依次置于火焰中加热。
实验结果显示,铜棒迅速传导热量,火焰附近的部分迅速变热;铁棒次之,传热速度较慢;铝棒传热速度更慢,火焰附近的部分变热较慢;而锌棒传热速度最慢,火焰附近的部分几乎没有明显变化。
这说明铜具有较好的导热性能,而锌的导热性能较差。
【实验三:金属元素的延展性】我们进一步研究了金属元素的延展性。
选取了铜、铁、铝和锌的薄片,并使用锤子进行敲击。
实验结果显示,铜薄片在敲击后没有明显的变形,仍然保持原来的形状;铁薄片稍微有些变形,但仍能保持较好的形状;而铝薄片和锌薄片则发生了明显的变形,形状不再规则。
这说明铜具有较好的延展性能,而铝和锌的延展性能较差。
【实验四:金属元素的化学性质】最后,我们研究了金属元素的化学性质。
我们选取了铜、铁、铝和锌的片状样品,并将它们分别放入盛有酸性溶液的试管中。
实验结果显示,铜片和铁片没有明显的变化;而铝片在酸性溶液中发生了剧烈的反应,产生了气体并迅速腐蚀;锌片也发生了类似的反应,但稍微缓慢一些。
这说明铝和锌具有较强的化学活性,而铜和铁的化学活性较低。
【结论】通过以上实验,我们得出了一些关于金属元素的结论。
铜具有良好的导电性、导热性和延展性,化学活性较低;铁具有较好的导电性和导热性,延展性较好,化学活性较低;铝的导电性和导热性较差,延展性较差,但化学活性较高;锌的导电性、导热性和延展性均较差,但化学活性较高。
无机化学实验报告

无机化学实验报告以下是给大家整理收集的无机化学实验报告,仅供参考。
无机化学实验报告1Ds区元素(铜、银、锌、镉、汞)【学习目标】认知目标:把握铜、银、锌、镉、汞的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。
技能目标:把握Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件,正确使用汞;思想目标:培养学生观察现象、思考题目的能力。
【教学安排】一课时安排:3课时二实验要点:1、铜、银、锌、镉、汞氢氧化物或氧化物的天生和性质;2、锌、镉、汞硫化物的天生和性质;3、铜、银、锌、汞的配合物;4、铜、银、汞的氧化还原性。
【重点、难点】Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件;这些元素的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。
【教学方法】实验指导、演示、启发【实验指导】一、铜、银、锌、镉、汞氢氧化物或氧化物的天生和性质1、铜、锌、镉操纵:0.5mL 0.2 mol;L-1MSO4;2 mol;L-1NaOH;; ;2 mol;L-1H2SO4; ;;2 mol;L-1 NaOH指导:离子Cu2+实验现象H2SO4NaOH溶解释及原理Cu2+ +OH-=Cu(OH)2; Cu(OH)2+2H+=Cu2++2H2O Cu(OH)2++OH-=[Cu(OH)4]2-Zn2+ +OH-=Zn(OH)2;方程式同上溶溶浅蓝; 溶Zn2+Cd2+结论白; 白; 溶不溶Cd2+ +OH-=Cd(OH)2; Zn(OH)2、Cu(OH)2具有两性,以碱性为主,能溶于浓的强碱中天生四羟基合M(Ⅱ)酸根配离子。
Cd(OH)2碱性比Zn(OH)2强,仅能缓慢溶于热浓强碱。
2、银、汞氧化物的天生和性质操纵::0.5 mL 0.1 mol;L-1 AgNO3 ;2 mol;L-1NaOH;;;+ 2 mol;L-1HNO3(2 mol;L-1 NH3;H2O):0.5 mL 0.2 mol;L-1 Hg(NO3)2 ; 2 mol;L-1NaOH;;;+ 2 mol;L-1HNO3(40% NaOH) 指导:离子实验现象解释及原理Ag+Ag2O褐;HNO3溶溶无色氨水溶NaOH 不溶Ag2O+ 4NH3 + H2O =2Ag(NH3)2+ +2OHHgO + 2H+=Hg2+ +H2O-Hg2+HgO 黄;结论AgOH、Hg(OH)2沉淀极不稳定,脱水天生成碱性的Ag2O、HgO。
铜银锌镉汞实验报告
铜银锌镉汞实验报告实验目的,通过对铜银锌镉汞等金属的性质进行实验,探究它们在不同环境下的化学反应和物理特性。
实验材料和方法:1. 实验材料,铜、银、锌、镉、汞等金属样品;盐酸、硫酸、氢氧化钠等化学试剂。
2. 实验方法,首先将金属样品分别置于不同的试剂中,观察其化学反应情况;然后将金属样品暴露在不同环境中,观察其物理特性变化。
实验结果:1. 铜,在盐酸中产生气体,并发生化学反应;在空气中暴露后,表面会逐渐氧化变色。
2. 银,在硫酸中产生沉淀,发生化学反应;在潮湿环境中暴露后,表面会出现氧化现象。
3. 锌,在氢氧化钠中产生气体,发生化学反应;在潮湿环境中暴露后,会出现表面腐蚀。
4. 镉,在盐酸中产生气体,发生化学反应;在潮湿环境中暴露后,会出现表面变色和腐蚀。
5. 汞,在硫酸中没有明显反应;在高温环境中暴露后,会出现蒸发。
实验分析:通过实验结果可以得出,不同金属在不同环境中表现出不同的化学反应和物理特性。
铜、银、锌、镉在一定条件下会发生化学反应,而汞在常温下没有明显反应。
另外,金属暴露在不同环境中会出现氧化、腐蚀等现象,这些都与金属的性质和环境的影响有关。
结论:通过本次实验,我们对铜银锌镉汞等金属的化学反应和物理特性有了更深入的了解。
这些实验结果对于我们进一步研究金属的性质和应用具有一定的参考价值。
实验总结:本次实验通过对铜银锌镉汞等金属的实验,深入了解了它们在不同环境下的化学反应和物理特性。
实验结果对于我们进一步研究金属的性质和应用具有一定的参考价值。
希望通过这次实验,能够对金属的性质有更深入的了解,为今后的研究工作提供更多的参考依据。
ds区金属铜银锌镉汞
实验 ds 区金属(铜、银、锌、镉、汞)一、实验目的:1、了解铜、银、锌、镉、汞的氧化物或氢氧化物的酸碱性、硫化物的溶解性。
2、掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件。
3、试验并熟悉铜、银、锌、镉、汞的配位能力,以及Hg2 2+ 和Hg 2+ 的转化。
二、实验用品:仪器:试管、烧杯、离心机、离心试管固体药品:碘化钾、铜屑液体药品: HCl(2mol/L、 浓)、 H2SO4(2mol/L)、 HNO3(2mol/L、 浓)、 NaOH(2mol/L、 6mol/L、 40%)、氨水(2mol/L、浓)、CuSO4(0.2mol/L)、ZnSO4(0.2mol/L)、CdSO4(0.2mol/L)、 CuCl2(0.5mol/L) 、 Hg(NO3)2(0.2mol/L) 、 SnCl2(0.2mol/L) 、 AgNO3(0.1mol/L) 、 Na2S(0.1mol/L)、KI(0.2mol/L)、KSCN(0.1mol/L)、Na2S2O3(0.5mol/L)、NaCl(0.2mol/L)、 金属汞、葡萄糖溶液(10%)材料:pH试纸、玻璃棒三、实验内容:(一)铜、银、锌、镉、汞氧化物或氢氧化物的生成和性质1、铜、锌、镉氢氧化物的生成和性质在分别装有 0.5mL0.2mol/L CuSO4、ZnSO4、CdSO4 溶液的三支试管中滴加新配制 的2mol/L NaOH溶液,观察溶液颜色及状态。
将各沉淀分成两份:分别加入2mol/L H2SO4 和2mol/L NaOH,观察现象。
CuSO4 + 2NaOH === Cu(OH)2↓(兰)+ Na2SO4ZnSO4 + 2NaOH === Zn(OH)2↓(白) + Na2SO4CdSO4 + 2NaOH === Cd(OH)2↓(白)+ Na2SO4Cu(OH)2 + H2SO4 === CuSO4 + 2H2OCu(OH)2 + 2NaOH === Na2[Cu(OH)4]Zn(OH)2 + H2SO4 === ZnSO4 + 2H2OZn(OH)2 + 2NaOH === Na2[Zn(OH)4]Cd(OH)2 + H2SO4 === CdSO4 + 2H2OCd(OH)2 酸性特别弱,不易溶于强碱中,只缓慢溶于热、浓的强碱中。
Ds区元素重要化合物的性质实验
ds区元素(铜、银、锌、镉、汞)的性质一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质;6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu(+2,+1)Zn(+2)Ag Cd Ag(+1)Cd(+2)Au Hg Au(+1,+3)Hg(+2,+1)蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO。
AgOH在常温下极易脱水而转化为棕色的Ag2O。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg2O(I)。
易形成配合物是这两副族的特性,Cu2+、Ag+、Zn2+、Cd2+与过量的氨水反应时分别生成[Cu(NH3)4]2+、[Ag(NH3)2]+、[Zn(NH3)4]2+、[Cd(NH3)4]2+。
但是Hg2+和Hg22+与过量氨水反应时,如果没有大量的NH4+存在,并不生成氨配离子。
如:HgCl2 +2NH3=Hg(NH2)Cl↓白+2 NH4ClHg2Cl2+2NH3=Hg(NH2)Cl↓白+Hg↓黑+NH4Cl (观察为灰色)Cu2+具有氧化性,与I-反应,产物不是CuI2,而是白色的CuI:Cu2+ +I- =2CuI↓白+I2将CuCl2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl2]-的溶液。
将溶液稀释,得白色CuCl沉淀:Cu +Cu2+ +4Cl-=2[CuCl2]-[CuCl2]-←稀释→CuCl↓白+Cl-卤化银难溶于水,但可利用形成配合物而使之溶解。
例如:AgCl +2NH3 =[Ag(NH3)2]+ +Cl-红色HgI2难溶于水,但易溶于过量KI中,形成四碘合汞(II)配离子:HgI2 +2I- =[HgI4]2-黄绿色Hg2I2与过量KI反应时,发生歧化反应,生成[HgI4]2-和Hg:Hg2I2+2I- =[HgI4]2-+Hg↓黑三、实验内容1、氧化物的生成和性质(1)Cu2O的生成和性质Cu2++2OH-=Cu(OH)2↓ 蓝色Cu(OH)2+2OH- = [Cu(OH)4]-2-蓝色2[Cu(OH)4]2-+C6H12O6 (葡萄糖) =Cu2O↓(红) +4OH-+C16H12O7+2H2O或:2Cu2+ + 5OH- +C6H12O6 = Cu2O↓+ C6H11O7- + 3H2O (须加热)分析化学上利用此反应测定醛,医学上利用此反应检查糖尿病。
ds区金属(铜、银、锌、镉、汞).ppt
0.5 mL 0.1 mol ·L-1 AgNO3+2 mol ·L-1NaOH 棕↓
2 mol ·L-1HNO3 棕↓溶解
2 AgNO3 +2 NaOH→Ag2O(s)+ 2Na NO3 +H2O
Ag2O(s)+2 HNO3→2AgNO3+ H2O
2 mol ·L-1氨水 棕↓溶
Hale Waihona Puke Ag2O(s)+ 4NH3+ H2O →2[Ag(NH3)2]+ +2 OH-
❖ 在所得的溶液中,滴入几滴40%KOH溶液, 再与氨水反应,观察沉淀的颜色。
0.5 mL 0.2 mol·L1Hg(NO3)2滴加0.2 mol·L-1KI溶液
金红↓ Hg2++2I-→Hg I 2(s)
之后溶 解
Hg I 2(s) +2I- → [Hg I 4]2-
滴入几滴40%KOH溶 液再与氨水反应
无色 CuCl (s) + 2NH3 →[ Cu (NH3)2]+ 溶液
3 mL浓盐酸
?溶 液
CuCl (s) + HCl(浓) → [CuCl2]-+H-
3. 碘化亚铜的生成和性质
❖ 在盛有0.5 mL 0.2 mol ·L-1CuSO4溶液的试管中,边滴加0.2 mol ·L-1 KI溶液边振荡,溶液变为棕黄色(CuI为白色沉淀、 I2溶于KI呈黄色)。再滴加适量0.5 mol ·L-1 Na2S2O3溶液,以 除去反应中生成的碘。观察产物的颜色和状态,写出反应式。
在0.5mL 0.2 mol ·L-1 Hg(NO3)2溶液, 滴入1滴金属汞
Hg2+ +Hg → Hg22+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验六ds区金属(铜、银、锌、镉)
实验摘要:
本实验用铜、锌、镉的硫酸盐和氢氧化钠反应来制备对应的氢氧化物,再分别和稀盐酸和过量氢氧化钠反应来探究铜、锌、镉的氢氧化物的酸碱性。
用硝酸银和氢氧化钠反应来制备氧化银,再分别和稀硝酸和过量氨水反应来探究氧化银的酸碱性。
用锌、镉的硫酸盐和硫化钠溶液反应再分别和稀盐酸和王水反应,以此探究其硫化物的溶解性。
用硫酸铜、硝酸银、硫酸锌溶液分别和氨水反应,直至氨水过量,通过观察沉淀的变化熟悉铜、银、锌的配位能力。
通过氧化亚铜、氯化亚铜、碘化亚铜的生成和性质实验来掌握铜离子和亚铜离子重要化合物的性质及相互转化的条件。
实验初步得出结论:氢氧化铜和氢氧化锌显两性,氢氧化铬和氧化银显碱性;硫化物大都难溶于水;铜离子、银离子、锌离子课形成氨的配合物。
关键词:
ds区金属氢氧化物氧化物硫化物酸碱性溶解性氨合物氧化还原性
实验用品:
试管离心试管烧杯离心机PH试纸玻璃棒
实验内容:
1. 铜、锌、镉氢氧化物的生成和性质
2.氧化银的生成和性质
3.锌、镉硫化物的生成和性质
分别往硫酸锌、硫酸铬溶液中加入硫化钠溶液,观察沉淀的颜色,将沉淀离心分离,洗涤,分成三份,再分别加入稀盐酸、浓盐酸、王水,水浴加热,观察沉淀的溶解情况。
4. 铜、银、锌的氨配合物
分别往硫酸铜、硝酸银、硫酸锌溶液中加入氨水,观察沉淀的生成,继续加氨水至过量,观
5.氧化亚铜的生成和性质
6.氯化亚铜的生成和性质
7.碘化亚铜的生成和性质
结果及讨论:
氢氧化锌、氢氧化铜具有两性,以碱性为主,能溶于浓的强碱中生成配离子,氢氧化铬的碱性比强氧化锌强,仅能缓慢溶于热浓强碱。
氢氧化银沉淀极不稳定,易脱水生成碱性氧化银。
ds区金属硫化物都不溶于水,有的可溶于酸,都能溶于王水。
铜离子、银离子、锌离子都可生成氨配合物。
亚铜离子在水溶液中极不稳定,易歧化为铜离子和铜。
参考文献:
[1] 北京师范大学等校编.《无机化学实验》[M](第三版),高等教育出版社,2004,164-166
[2]孙一平,朱锡海《十二烷基硫酸钠气浮氢氧化铬沉淀的机理》[J],《水技术处理》,199301期,38-42
[3]罗耀宗《铜氨络离子废水的处理》[J],《甘肃环境研究与检测》,1997年第10卷第二期,34-35
[4]舒余德《电解法制取氧化亚铜的研究》[J],《沈阳化工》,1994年03期,20-24。
