2020届高三化学题型专练十八 化学反应原理综合题
2020-2021高考化学 化学反应原理 综合题含答案解析

2020-2021高考化学 化学反应原理 综合题含答案解析一、化学反应原理1.为了证明化学反应有一定的限度,进行了如下探究活动:步骤1:取8mL0.11mol L -⋅的KI 溶液于试管,滴加0.11mol L -⋅的FeCl 3溶液5~6滴,振荡; 请写出步骤1中发生的离子反应方程式:_________________步骤2:在上述试管中加入2mLCCl 4,充分振荡、静置;步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.11mol L -⋅的KSCN 溶液5~6滴,振荡,未见溶液呈血红色。
探究的目的是通过检验Fe 3+,来验证是否有Fe 3+残留,从而证明化学反应有一定的限度。
针对实验现象,同学们提出了下列两种猜想:猜想一:KI 溶液过量,Fe 3+完全转化为Fe 2+,溶液无Fe 3+猜想二:Fe 3+大部分转化为Fe 2+,使生成Fe (SCN )3浓度极小,肉眼无法观察其颜色为了验证猜想,在查阅资料后,获得下列信息:信息一:乙醚比水轻且微溶于水,Fe (SCN )3在乙醚中的溶解度比在水中大。
信息二:Fe 3+可与46[()]Fe CN -反应生成蓝色沉淀,用K 4[Fe (CN )6]溶液检验Fe 3+的灵敏度比用KSCN 更高。
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A 、B 中,请将相关的实验操作、预期现象和结论填入下表空白处:【答案】322222FeI Fe I +-++=+ 若液体分层,上层液体呈血红色。
则“猜想一”不成立 在试管B 中滴加5-6滴K 4[Fe (CN )6]溶液,振荡 【解析】【分析】【详解】(1) KI 溶液与FeCl 3溶液离子反应方程式322222Fe I Fe I +-++=+;(2)①由信息信息一可得:取萃取后的上层清液滴加2-3滴K 4[Fe (CN )6]溶液,产生蓝色沉淀,由信息二可得:往探究活动III 溶液中加入乙醚,充分振荡,乙醚层呈血红色,实验操作预期现象结论若液体分层,上层液体呈血红色。
2020-2021高考化学综合题专练∶化学反应原理含答案

2020-2021高考化学综合题专练∶化学反应原理含答案一、化学反应原理1.钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。
一种利用钛铁矿( 主要成分为FeTiO3和少量Fe2O3 )进行钛白粉和LiFePO4的联合生产工艺如下图所示:回答下列问题:(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。
操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,K sp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
【答案】+2 增加钛铁矿与硫酸按触面积,增大酸溶速率2H++Fe==H 2↑+Fe2+、Fe+2Fe3+==3Fe2+蒸发皿 TiO2++2H2O TiO(OH)2+2H+促进水解( 或加快水解反应速率) 1.0×10-5 20:9【解析】【分析】钛铁矿[主要成分为钛酸亚铁(FeTiO)3,含有少量Fe2O3]加硫酸溶解生成TiO2+和Fe3+、Fe2+,加入铁还原铁离子:2Fe3++Fe=3Fe2+,得到硫酸亚铁和TiOSO4,对溶液蒸发浓缩、冷却结晶,过滤得到绿矾晶体和TiOSO4溶液,将TiOSO4溶液加热,促进TiO2+的水解生成TiO(OH)2,TiO2++2H2O=TiO(OH)2+2H+,分解得到钛白粉(TiO2);将绿矾与过氧化氢、H3PO4混合沉铁:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,将得到的FePO4与草酸、Li2CO3焙烧生成锂离子电池的正极材料LiFePO4。
2020高三第十八次考试理综化学试题Word版附答案及解析

2020高三第十八次考试理综化学试题满分100分。
考试时间50分钟★祝考试顺利★注意事项:1.答题前,请考生认真阅读答题卡上的注意事项。
务必将自己的姓名、考号填写在答题卡上指定位置,贴好考号条形码或将考号对应数字涂黑。
用2B 铅笔将试卷类型A 填涂在答题卡相应位置上。
2.选择题每小题选出答案后,用2B 铅笔把对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。
答在试题卷、草稿纸上无效。
3.非选择答题用0.5毫米黑色墨水签字笔直接答在答题卡上每题对应的答题区域内,答在试题卷、草稿纸上无效。
4.考生必须保持答题卡的清洁。
考试结束后,监考人员将答题卡和试卷一并收回。
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32 Cl-35.5 Ca-40 Ti-48 Fe-56 Cu-64第Ⅰ卷 选择题(共42分)一、选择题:本卷共7小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与社会、生产、生活密切相关,下列说法正确的是 ( )A. 汽车尾气中的氮氧化合物是汽油或柴油不完全燃烧造成的B. 我国全面启动的北斗导航系统的信号传输与硅有关C. 液氯罐泄漏时,可将其移入水塘中,并向水塘中加入熟石灰D. 工程兵开山使用的炸药“TNT”是有机高分子化合物2.设N A 表示阿伏加德罗常数的值,下列说法正确的是 ( )A. 14g 乙烯和丙烯的混合物中极性键数目为2N AB. 标准状况下,422.4LCH 与2Cl 在光照条件下反应生成HCl 分子数为A 4NC. 容器中2molNO 与1molO 2充分反应,产物的分子数为2N AD. 电解精炼铜时阳极减轻32 g ,电路中转移电子数目一定为N A3.降冰片二烯类化合物是一类太阳能储能材料。
降冰片二烯在紫外线照射下可以发生下列转化。
下列说法错误的是( )A. 降冰片二烯与四环烷互为同分异构体B. 降冰片二烯能使酸性高锰酸钾溶液褪色C. 四环烷的一氯代物超过三种(不考虑立体异构)D. 降冰片二烯分子中位于同一平面的碳原子不超过4个4.根据下列实验操作,预测的实验现象和实验结论或解释均正确的是()A. AB. BC. CD. D5.短周期元素X、Y、Z的原子序数依次递増,其原子的最外层电子数之和为13。
2020-2021高考化学——化学反应原理综合考查的综合压轴题专题复习含答案解析

2020-2021高考化学——化学反应原理综合考查的综合压轴题专题复习含答案解析一、化学反应原理综合考查1.资源化利用CO2,可以减少温室气体排放,还可以获得燃料或重要的化工产品。
回答下列问题:(1)CO2的捕集①用饱和Na2CO3溶液做吸收剂可“捕集”CO2。
写出“捕集”CO2反应的离子方式_____________。
②聚合离子液体是目前广泛研究的CO2吸附剂。
结合图像分析聚合离子液体吸附CO2的有利条件是_________________________。
(2)生产尿素:工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:2NH3(g)+CO2(g)⇌H2NCOONH4(s) △H = - 159.5 kJ·mol-1第二步:H2NCOONH4(s)⇌CO(NH2)2(s)+ H2O(g) △H = +116.5 kJ·mol-1①写出上述合成尿素的热化学方程式___________________________。
该反应化学平衡常数K的表达式:_________________________。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2,实验测得反应中各组分物质的量随时间的变化如图所示:已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第__________步反应决定,总反应进行到___________min时到达平衡(3)合成乙酸:中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如图所示:①原料中的CH 3OH 可通过电解法由CO 2制取,用稀硫酸作电解质溶液,写出生成CH 3OH 的电极反应式_______________________。
②根据图示,写出总反应的化学方程___________。
【答案】H 2O + CO 32- + CO 2=2HCO 3- 低温,低流速 2NH 3(g)+ CO 2(g)⇌CO(NH 2)2(s)+H 2O(g)△H= -43kJ·mol -1 K=[H 2O]/[NH 3]2.[CO 2] 二 55 CO 2 + 6e - + 6H + = CH 3OH + H 2O CH 3OH + CO 2 + H 2*HI 、Rh CH 3COOH + H 2O【解析】 【分析】(1)①H 2O 、CO 32-、CO 2反应生成HCO 3-; ②根据图知,温度越低、流速越小吸附量越大;(2)利用盖斯定律求解热化学方程式;K 等于气体生成物浓度幂之积与气体反应物浓度幂之积的比;②达到平衡时时间越长,反应速率越慢,慢反应决定整个反应速率;各物质的物质的量不变时反应达到平衡状态;(3)①电解时,CO 2失电子和H +反应生成CH 3CH 2OH ;②根据图知,反应物是CH 3CH 2OH 、CO 2和H 2,生成物是CH 3COOH 和水,LiI 和Rh 作催化剂。
2020-2021高考化学化学反应原理综合考查综合经典题含答案解析
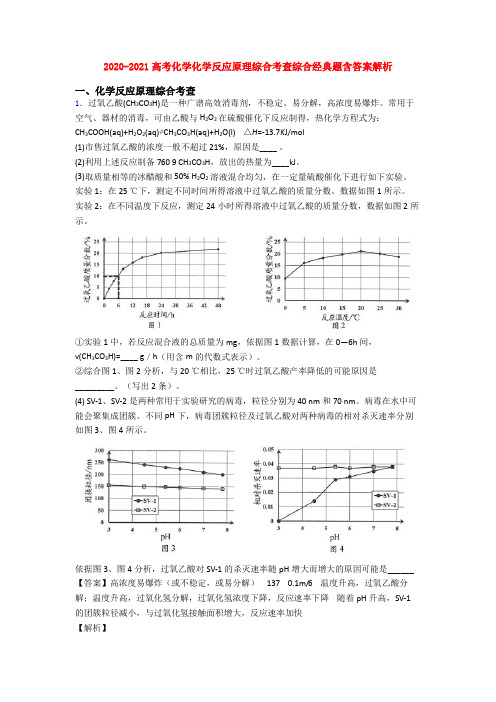
2020-2021高考化学化学反应原理综合考查综合经典题含答案解析一、化学反应原理综合考查1.过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。
常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq)⇌CH3CO3H(aq)+H2O(l) △H=-13.7K J/mol(1)市售过氧乙酸的浓度一般不超过21%,原因是____ 。
(2)利用上述反应制备760 9 CH3CO3H,放出的热量为____kJ。
(3)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25 ℃下,测定不同时间所得溶液中过氧乙酸的质量分数。
数据如图1所示。
实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数,数据如图2所示。
①实验1中,若反应混合液的总质量为mg,依据图1数据计算,在0—6h间,v(CH3CO3H)=____ g/h(用含m的代数式表示)。
②综合图1、图2分析,与20 ℃相比,25 ℃时过氧乙酸产率降低的可能原因是_________。
(写出2条)。
(4) SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40 nm和70 nm。
病毒在水中可能会聚集成团簇。
不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是______【答案】高浓度易爆炸(或不稳定,或易分解) 137 0.1m/6 温度升高,过氧乙酸分解;温度升高,过氧化氢分解,过氧化氢浓度下降,反应速率下降随着pH升高,SV-1的团簇粒径减小,与过氧化氢接触面积增大,反应速率加快【解析】【分析】(1)过氧乙酸(CH3CO3H)不稳定、易分解,高浓度易爆炸,为了安全市售过氧乙酸的浓度一般不超过21%(2) 利用热化学方程式中各物质的系数代表各物质的物质的量来计算(3) 结合图象分析计算【详解】(1)市售过氧乙酸的浓度一般不超过21%,原因是不稳定、易分解,高浓度易爆炸。
高考化学压轴题专题化学反应原理的经典综合题含答案
高考化学压轴题专题化学反应原理的经典综合题含答案一、化学反应原理1.自20世纪60年代以后,人们发现了120多种含铁硫簇(如22Fe S 、44Fe S 、87Fe S 等)的酶和蛋白质。
它是存在于生物体的最古老的生命物质之一。
某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验:实验一:测定硫的质量:(1)连接装置,请填写接口顺序:b 接____________________(2)检查装置的气密性,在A 中放入0.4g 铁硫簇的样品(含有不溶于水和盐酸的杂质),在B 中加入品红溶液,在C 中加入30mL 0.1mol/L 的酸性4KMnO 溶液.(3)通入空气并加热,发现固体逐渐转变为红棕色.(4)待固体完全转化后,取C 中的4KMnO 溶液3mL ,用0.1mol/L 的碘化钾()10%溶液进行滴定。
记录数据如下: 滴定次数 待测溶液体积/mL消耗碘化钾溶液体积/mL滴定前刻度滴定后刻度 13.00 1.00 7.50 23.00 1.02 6.03 3 3.00 1.005.99 实验二:测定铁的质量:取实验Ⅰ中A 的硬质玻璃管中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH 溶液,过滤后取滤渣,经灼烧得0.32g 固体.试回答下列问题:(1)检查“实验一”中装置A 的气密性的方法是_________(2)滴定终点的判断方法是_________(3)装置B 中品红溶液的作用是_______.有同学提出,撤去B 装置,对实验没有影响,你的看法是______(选填“合理”或“不合理”),理由是_________(4)用KI 溶液滴定4KMnO 溶液时发生反应的离子方程式为_________(5)请计算这种铁硫簇结构的化学式_________(6)下列操作,可能引起x y :偏大的是_________a.滴定剩余4KMnO 溶液时,KI 溶液滴到锥形瓶外边一滴b.配制KI 溶液时,定容时俯视刻度线c.用碘化钾溶液滴定剩余4KMnO 溶液时,滴定前有气泡,滴定后无气泡d.实验二中,对滤渣灼烧不充分【答案】b 接()efdc g (g 写不写都对) 在导管b 接上长导管,把末端插入水槽中,关闭活塞,用酒精灯微热硬质试管A ,导管长导管口有气泡产生,撤去酒精灯,导管形成一段水柱,说明装置气密性良好 加入最后一滴KI 溶液,溶液紫色褪去,且半分钟不恢复为紫色 检验二氧化硫是否被酸性高锰酸钾完全吸收 合理 若B 中高锰酸钾溶液的紫色不褪去,说明二氧化硫被吸收完全 24222MnO 16H 10I 2Mn 5I 8H O -+-+++===++45Fe S acd【解析】【分析】铁硫簇的样品在装置中与O 2反应,得到SO 2,测点SO 2的含量,用酸性高锰酸钾吸收,再用品红溶液检查SO 2是否吸收完全,再接尾气吸收。
高考化学化学反应原理综合练习题含答案.doc
高考化学化学反应原理综合练习题含详细答案一、化学反应原理1.过碳酸钠( 2Na2CO3?3H2O2)俗称固体双氧水。
实验室可用碳酸钠和双氧水等为原料来制备,具体流程如下:已知:①相关反应的方程式如下:2Na2CO3+3H2O2=2Na2 CO3?3H2 O2△ H< 0② 工业上常以产品活性氧的质量分数[ω(活性氧)=× 100%]来衡量产品的优劣, 13.00%以上为优等品。
请回答:表 1 反应温度对产品收率及活性氧含量的影响反应温度 / ℃产品收率 /% 活性氧质量分数 /%5 65.3 12.7110 73.2 13.2415 85.0 13.5520 83.2 13.3025 55.1 12.78表 2 加料时间对产品收率及活性氧含量的影响加料时间 /min 产品收率 /% 活性氧质量分数 /%5 65.7 13.3010 76.8 14.7515 81.3 14.2620 89.0 13.8225 87.9 13.51(1)分析表1,一般选择的反应温度为_____。
(2)分析表 2,加料时间对产品收率也有很大影响,时间太短或太长均不利于生产,加料时间太短导致产品收率较低的原因是_____。
(3)结晶过程中加入氯化钠,作用是_____。
(4)下列关于抽滤操作,正确的是_____。
A.准备略大于漏斗内径的滤纸,以盖住布氏漏斗瓷板上的小孔B.用倾析法先转移溶液,待溶液快流尽时再转移沉淀C.洗涤沉淀时,加入少量水并开大水龙头,重复操作2~ 3 次D.用玻璃棒轻轻刮下抽滤得到的固体,晾干后保存在试剂瓶中(5)使用图 2 所示装置抽滤,中途需停止抽滤时,最佳操作为_____。
(6)产品出厂前需测定活性氧的质量分数,现将0.1000g 某厂的产品(所含杂质均不参与反应)溶于水配成溶液,加入10.00mL1.000mol ?L﹣1的稀硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量_____,用 0.1000mol ?L﹣1的 Na2 2 3标准溶液滴定,若该S O产品的活性氧质量分数为13.60%,则达到滴定终点时共消耗标准液的体积为_____mL。
2020-2021高考化学 化学反应原理综合考查综合试题含详细答案
2020-2021高考化学化学反应原理综合考查综合试题含详细答案一、化学反应原理综合考查1.(11分)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。
下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。
已知:P204[二(2−乙基己基)磷酸酯]常用于萃取锰,P507(2−乙基己基膦酸−2−乙基己酯)和Cyanex272[二(2,4,4)−三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式__________________________________。
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:加入NaOH溶液调pH=5可除去图中的________(填金属离子符号)杂质;写出除去金属离子的离子方程式________________________(一种即可)。
噲?MR n(Org)+n H+(aq),且随着(3)已知P507萃取金属离子的原理为n HR(Org)+M n+(aq)垐?萃取过程中pH降低,萃取效率下降。
萃取前先用NaOH对萃取剂进行皂化处理,皂化萃噲?MR n(Org)+n Na+(aq)。
对萃取剂进行皂取剂萃取金属离子的反应为n NaR(Org)+M n+(aq)垐?化处理的原因为________________。
(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。
■—Co(Cyanex272);●—Ni(Cyanex272);▲—Co(P507);▼—Ni(P507)由图可知,钴、镍的萃取率随萃取剂浓度增大而_________(填“增大”或“减小”);两种萃取剂中___________(填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为__________mol·L−1;若选Cyanex272萃取剂,则最适宜的萃取剂浓度大约为___________mol·L−1。
2020-2021高考化学化学反应原理综合考查的综合题试题附答案
2020-2021高考化学化学反应原理综合考查的综合题试题附答案一、化学反应原理综合考查1.Cr、S等元素的化合物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)还原沉淀法是处理含铬(Cr2O72−和CrO42−)工业废水的常用方法,过程如下:①已知:常温下,初始浓度为1.0 mol·L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。
则上述流程中CrO42-转化为Cr2O72-的离子方程式为______________________。
②还原过程中氧化剂与还原剂的物质的量之比为__________。
③Cr3+与Al3+的化学性质相似,对CrCl3溶液蒸干并灼烧,最终得到的固体的化学式为____________。
④常温下,Ksp[Cr(OH)3]=1.0×10-32,欲使处理后废水中的c(Cr3+)降至1.0×10-5mol·L−1(即沉淀完全),应调节至溶液的pH=_____。
(2)“亚硫酸盐法”吸收烟中的SO2①将烟气通入1.0mol/L 的Na2SO3溶液,当Na2SO3恰好完全反应时,溶液pH约为3,此时,溶液中各种离子浓度由大到小的顺序为_________(用离子浓度符号和“>”号表示)。
②室温下,将烟道气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。
已知部分弱电解质的电离常数(25℃)如下:电解质电离常数H2SO3K a1=1.54×10-2 K a2=1.02×10-7NH 3·H 2O K b =1.74×10-5(i )(NH 4)2SO 3溶液呈____(填“酸”、“碱”或“中”)性,其原因是_________________。
(ii )图中b 点时溶液pH=7,则n(NH 4+):n(HSO 3- )=_________。
2020-2021高考化学复习《化学反应原理综合考查》专项综合练习及详细答案
2020-2021高考化学复习《化学反应原理综合考查》专项综合练习及详细答案一、化学反应原理综合考查1.铝及其合金可用作材料、铝热剂等,在环境修复等方面也有着巨大的应用潜力。
(1)铝的冶炼、提纯的方法很多。
①高温碳热歧化氯化法冶铝包含的反应之一为:Al 2O 3(s)+AlCl 3(g)+3C(s)3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
②碳热还原Al 2O 3冶铝的部分反应如下:Ⅰ.2Al 2O 3(s)+9C(s)=Al 4C 3(s)+6CO(g) △H 1=akJ/molⅡ. 4Al 2O 3(s)+Al 4C 3(s)=3Al 4O 4C(s) △H 2=bkJ/molⅢ. Al 4O 4C(s)+Al 4C 3(s)=8Al(g)+4CO(g) △H 3=ckJ/mol反应Al 2O 3(s)+3C(s)=2Al(g)+3CO(g)的△H =__________kJ/mol③用离子液体AICb-BMIC(阳离子为EMIM +、阴离子为AlCl 4-、Al 2Cl 7-)作电解质,可实现电解精炼铝。
粗铝与外电源的_____________极(填“正”或“负")相连;工作时,阴极的电极反应式为_______________。
(2)真空条件及1173K 时,可用铝热还原Li 5AlO 4制备金属锂(气态),写出该反应的化学方程式:__________________________。
(3)用Al 、Fe 或Al-Fe 合金还原脱除水体中的硝态氮(NO 3--N),在45℃,起始c (KNO 3-N)为50mg·L -1、维持溶液呈中性并通入Ar 等条件下进行脱除实验。
结果如图所示(c 0为起始浓度、c 为剩余浓度):①纯Al 在0~3h 时,NO 3-几乎没有被脱除,其原因是_______________________;写出3h 后NO 3-被还原为N 2的离子方程式:____________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应原理综合题1.氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的化学方程式是___________________________________________________________ ________________________________________________________________________。
②已知反应器中还存在如下反应:i.CH4(g)+H2O(g)===CO(g)+3H2(g)ΔH1ii.CO(g)+H2O(g)===CO2(g)+H2(g)ΔH2iii.CH4(g)===C(s)+2H2(g)ΔH3……iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用________________________________反应的ΔH。
③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是________(填字母)。
a.促进CH4转化b.促进CO转化为CO2c.减少积炭生成④用CaO可以去除CO2。
H2体积分数和CaO消耗率随时间变化关系如图所示。
从t1时开始,H2体积分数显著降低,单位时间CaO消耗率_______(填“升高”“降低”或“不变”)。
此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因:______________________________________________。
(2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。
通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接________。
产生H2的电极反应式是________________________________________________________________________。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:_________________________________________________________________________________________________。
2.研究氮氧化物的反应机理,对于消除环境污染有重要意义。
(1)氮氧化物(NO x)可在催化剂作用下与氨反应生成无污染的物质,该反应的化学方程式为______________________________________________________________。
(2)对于一般的化学反应:a A+b B===c C+d D存在反应速率方程v=kc m(A)c n(B),利用反应速率方程可求出化学反应瞬时速率。
m+n为反应级数,当m+n分别等于0、1、2…时分别称为零级反应、一级反应、二级反应……;k为反应速率常数,k与温度、活化能有关,与浓度无关,温度升高,k增大。
在600 K下反应2NO(g)+O2(g)2NO2(g)的初始浓度与初始速率如表所示:初始浓度/(mol/L)初始速率/[mol/(L·s)]c(NO)c(O2)0.0100.010 2.5×10-30.0100.020 5.0×10-30.0300.02045×10-3通过分析表中实验数据,得出该反应的速率方程为v=__________,为______级反应,当c(NO)=0.015 mol/L、c(O2)=0.025 mol/L时的初始速率为______(保留两位有效数字)。
(3)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)2NO2(g)的反应速率却随着温度的升高而减小。
某化学小组为探究该特殊现象的原因,查阅资料知其反应历程分两步:a.2NO(g)N2O2(g)ΔH1<0快速平衡v1正=k1正c2(NO)v1逆=k1逆c(N2O2)b.N2O2(g)+O2(g)2NO2(g)ΔH2慢反应v2正=k2正c(N2O2)c(O2)v2逆=k2逆c 2(NO 2)①反应2NO(g)+O 2(g)2NO 2(g) ΔH =______(用含ΔH 1和ΔH 2的式子表示)。
②反应______为整个反应的速控反应,用k 1正、k 1逆、k 2正、k 2逆表示2NO(g)+O 2(g)2NO 2(g)的平衡常数K =________________。
③反应a 的活化能E 1与反应b 的活化能E 2的大小关系为E 1______E 2(填“>”“<”或“=”)。
若2NO(g)+O 2(g)2NO 2(g)的反应速率方程v =k 1正k 1逆×k 2正×c 2(NO)×c (O 2),分析升高温度该反应速率减小的原因可能是_________________________________________________________________________________________________________________________。
④对反应a 和b ,下列表述正确的是______(填字母)。
A .v (第一步的逆反应)>v (第二步反应)B .反应的中间产物为N 2O 2C .反应b 中N 2O 2与O 2的碰撞仅部分有效3.采用H 2或CO 催化还原NO 能达到消除污染的目的,在氮氧化物尾气处理领域有着广泛应用。
回答下列问题:(1)用CO 处理NO 时产生两种无毒、无害的气体,该反应的氧化产物为________。
(2)已知:氢气的燃烧热为285.8 kJ/mol2NO(g)===N 2(g)+O 2(g) ΔH 1=-180.5 kJ/molH 2O(g)===H 2O(l) ΔH 2=-44 kJ/mol写出用H 2处理NO 生成水蒸气和1 mol N 2的热化学方程式:_______________________。
(3)针对上述用H 2处理NO 生成水蒸气和1 mol N 2的反应,回答下列问题:①研究表明,上述反应中,反应速率v =k ·c 2(NO)·c 2(H 2),其中k 为速率常数,只与温度有关。
t 1时刻, v =v 1,若此刻保持温度不变,将c (NO)增大到原来的2倍时,c (H 2)减小为原来的12(此时v =v 2)。
则有v 1______v 2(填“>”“<”或“=”)。
②在温度T 时,向容积固定的密闭容器中充入3 mol NO 和2 mol H 2发生上述反应,起始压强为p 0,一段时间后,反应达到平衡,此时压强p =0.9p 0,则NO 的平衡转化率α(NO)=________(结果保留三位有效数字),该反应的平衡常数K p =________(用含p 的代数式表示,K p 为以分压表示的平衡常数,且某气体的分压=总压×该气体的物质的量分数)。
(4)实验室常用NaOH 溶液吸收法处理NO x ,反应的化学方程式如下:(已知NO 不能与NaOH 溶液反应)NO+NO2+2NaOH===2NaNO2+H2O2NO2+2NaOH===NaNO2+NaNO3+H2O①若NO x(此处为NO和NO2的混合气体)能被NaOH溶液完全吸收,则x的取值范围为________。
②1 mol NO2和溶质物质的量为1 mol的NaOH溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序为______________________________________________。
(5)一氧化氮空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如图所示,写出放电过程中负极的电极反应式:________________________,若过程中产生2 mol HNO3,则消耗标准状况下O2的体积为________L。
4.某硫酸工厂的废水中含有较多的H+、Cu2+、Fe2+、SO2-4、AsO3-4、HAsO2-4、H2AsO-4等需要处理的杂质离子,其中一种处理流程如图1所示。
已知:Ⅰ.常温下lg c(M)(M表示Cu2+或Fe2+等)随pH的沉淀溶解平衡曲线如图2所示(已知10-5.7≈2×10-6)。
Ⅱ.常温下H3AsO4水溶液中含砷元素的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图3所示。
回答下列问题:(1)沉淀A的主要成分的化学式是______________。
(2)常温下pH=7的溶液中Cu2+的物质的量浓度为________,请判断此时Fe2+是否沉淀完全:________(填“是”或“否”)。
(3)若氧化过程中生成了某种胶体,用离子方程式解释氧化过程中溶液pH降低的原因:________________________________________________________________________________________________________________________________________________。
(4)①研究H3AsO4水溶液,分析废水中的砷的去除率:以酚酞为指示剂(pH变色范围为8.2~10.0),将NaOH溶液逐滴加入H3AsO4溶液中,当溶液由无色变为浅红色时停止滴加。
该过程中主要反应的离子方程式为________________________________________。
②H3AsO4第一步电离方程式H3AsO4H2AsO-4+H+的电离常数为K a1,则p K a1=________(p K a1=-lg K a1)。
③最后一次调节pH时,pH过低或过高砷的去除率都会明显降低,pH过低时可能的原因是_________________;pH过高时可能的原因是______________(从沉淀转化的角度分析)。
参考答案1.答案:(1)①CH 4+2H 2O=====催化剂4H 2+CO 2②C(s)+2H 2O(g)===CO 2(g)+2H 2(g)或C(s)+CO 2(g)===2CO(g)③abc ④降低 CaO +CO 2===CaCO 3,CaCO 3覆盖在CaO 表面,减少了CO 2与CaO 的接触面积(2)①K 1 2H 2O +2e -===H 2↑+2OH -③制H 2时,电极3发生反应:Ni(OH)2+OH --e -===NiOOH +H 2O 。
制O 2时,上述电极反应逆向进行,使电极3得以循环使用2.答案:(1)6NO x +4x NH 3=====催化剂(3+2x )N 2+6x H 2O(2)2.5×103c 2(NO)c (O 2) 三 1.4×10-2mol/(L·s)(3)①ΔH 1+ΔH 2 ②b k 1正k 1逆×k 2正k 2逆 ③< 反应a 的ΔH 1<0,升高温度时平衡逆向移动,K 1=k 1正k 1逆减小,k 2正随温度升高而增大,但增大的程度比k 1正k 1逆减小的程度小,故反应速率减小 ④ABC3.答案:(1)CO 2 (2)2H 2(g)+2NO(g)===N 2(g)+2H 2O(g)ΔH =-664.1 kJ/mol (3)①= ②33.3%916p (4)①1.5≤x <2 ②c (Na +)>c (NO -3 )>c (NO -2 )>c (OH -)>c (H +) (5)NO -3e -+2H 2O===NO -3+4H +33.64.答案:(1)CaSO 4 (2)2×10-6mol·L -1 否(3)4Fe 2++O 2+10H 2O===4Fe(OH)3(胶体)+8H +(4)①2OH -+H 3AsO 4===HAsO 2-4+2H 2O ②2.2 ③H +会抑制H 3AsO 4的电离,溶液中AsO 3-4浓度较小,不易与Fe 3+形成沉淀 FeAsO 4会转化为Fe(OH)3沉淀,AsO 3-4又进入水中。
