第二章热力学第一定律公式总结1
热力学第一定律总结

298 K时,H2(g)的∆cHmө = -285.83 kJ·mol-1, H2S(g)和 SO2(g)的∆fHmө分别为-20.63 kJ·mol-1和-296.83 kJ·mol-1。 求下列反应在498 K时的∆rUmө。已知水在373 K时的摩 尔蒸发焓∆vapHm (H2O, 373 K) = 40.668 kJ·mol-1. 2H2S (g) + 3O2 (g) = 2SO2 (g) + 2H2O(g)
其中,T2的值由理想气体绝热方程式(pVγ=C)求得。
3、Q的计算 、 的计算
• Q = ∆U – W • 如恒容,Q = ∆U • 如恒压,Q = ∆H
1. 绝热密闭体系里,以下过程的ΔU不等于零的是: A) 非理想气体混合 B) 白磷自燃 C) 乙醚挥发 D) 以上均为0 2.“爆竹声中一岁除,春风送暖入屠苏”。我国 春节有放鞭炮的习俗。在爆竹爆炸的过程中,以 下热力学量的符号表示正确的是(忽略点火时火柴 传递给引线的少量热量) ( ) A) Q<0,W<0,ΔU<0 B) Q<0,W=0,ΔU<0 C) Q=0,W<0,ΔU<0 D) Q=0,W=0,ΔU=0
nN2CV, m(N2)(T-T1) + nCuCV,误二: ∆U =∆UN2 + ∆UCu = 0
nN2CV, m(N2)*(T-T1) + nCuCV, m(Cu)*(T-T2) = 0
正确解法:
∆U =∆UN2 + ∆UCu = ∆UN2 + ∆HCu = 0 nN2CV, m(N2)*(T-T1) + nCuCp, m(Cu)*(T-T2) = 0
• 求火焰最高温度: Qp = 0, ΔH = 0 求火焰最高温度: • 求爆炸最高温度、最高压力:QV = 0, W = 0 求爆炸最高温度、最高压力: =0
大学物理化学公式总结(傅献彩_南京大学第五版)

热力学第一定律功:δW =δW e +δW f(1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1)等压热容:C p =δQ p /dT = (∂H/∂T )p (2)等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(∂U/∂V )T ](∂V/∂T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =H p T ⎪⎪⎭⎫⎝⎛∂∂=-()pT C p H ∂∂ 实际气体的ΔH 和ΔU :ΔU =dT T U V ⎪⎭⎫ ⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫⎝⎛∂∂+dp p H T ⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BAB A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式:(1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2)Maxwell 关系:T V S ⎪⎭⎫⎝⎛∂∂=VT p ⎪⎭⎫ ⎝⎛∂∂Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫ ⎝⎛∂∂ (3)热容与T 、S 、p 、V 的关系:C V =T V T S ⎪⎭⎫ ⎝⎛∂∂ C p =T pT S ⎪⎭⎫⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap ,fus ,sub 。
第二章热力学第一定律1
超临界流体: (1)定义: 温度在临界温度以上,压力 接近或超过临界压力的流体。 (2)特点:密度大,分子间力强,溶解 能力大,具有气体和液体的双重特性。 (3)应用:在萃取分离技术上有重要的 应用,超临界萃取分离工程是近几年发 展起来的技术。
10、热与功
能量交换的两种形式。 不是系统的性质,
不是状态函数。
V V dp 则体积的微分可写成:dV= dT T p p T
由状态1变到状态2的体积改变量为:
Δ=
dV V2 V1
V2 V1
状态函数沿闭合回路的积分为零:∮dV=0
状态性质的特点总结:
(1) 单值性。系统状态一定,各状态性质一定。
δ :ΔX = XⅠ - XⅠ = 0
△p=p2-p1 △V=V2-V1 △T=T2-T1 状态函数的增量=系统终态的函数值-系统始态的函数值
b.系统状态的微小变化所引起的状态函数的微小变化可以 用全微分表示,并且是可以积分的。 如封闭系统一定量某理想气体的体积是温度压力的函数 ,即V=f(T,p)
(2)功:热力学中除热之外系统与环境 之间一切其他方式传递的能量。 符号: W 单位:J 分类: a.体积功:由于体积变化而与环境交换的能 量,W b.非体积功:除体积功之外的其他功,如电 功、表面功, W '
正负号规定: 系统对环境作功 “-” 环境对系统作功 “+” 大小:取决于具体的变化过程,相同的 始、末态之间变化,途径不同交换的功 不同,是途径函数。 微小变化过程的功用δW 表示。
4、状态和状态函数
(1)状态: 系统的状态是系统所有性质(物理
性质、化学性质)的综合表现。
系统状态与性质之间存在单值对应关系。
第二章 热力学第一定律总结

② 力平衡 (force equilibrium)—系统各部分p 相同; ③ 相平衡 (phase equilibrium)—物质在各相分布不随时间变化; ④ 化学平衡(chemical equilibrium)—系统组成不随时间变化。
§2.1 热力学基本概念
注意 (1)W不是状态函数,只是途径函数 不能写作△W,只能写作W (2)只知始末态,不知过程的具体途径,不能 计算过程的W (3)对于凝聚系统,除非特别要求,因体积改 变很小,体积功很小,通常不予考虑
上一内容
下一内容
回主目录
返回
2019/1/22
§2.1 热力学基本概念
上一内容 下一内容 回主目录
返回
2019/1/22
§2.1 热力学基本概念
(3)恒容过程 过程中系统的体积始终保持不变,体积功W = 0 。 (4)绝热过程 系统与环境间无热交换的过程,过程热Q = 0 。 (5)循环过程
经历一系列变化后又回到始态的过程。
循环过程前后所有状态函数变化量均为零。
上一内容 下一内容 回主目录
返回
2019/1/22
§2.2 热力学第一定律
若系统发生微小变化,有
dU = δQ + δW
对 U Q W 的进一步说明 ① 内能U的绝对值虽无法确定, 但状态变化过程中内能的增量∆U可用过程中
§2.1 热力学基本概念
注意
(1)Q不是状态函数,只是途径函数 不能写作△Q,只能写作Q,微量热记为Q (2)只知始末态,不知过程的具体途径,不能计算 过程的Q
上一内容
下一内容
回主目录
返回
2019/1/22
第二章_热力学第一定律公式总结1

R
理想气体 任意单纯pVT过程
U
2
1 nCV ,mdT
(不限于恒容)
H
2
1 nCP,mdT
(不限于恒压)
理想气体绝热可逆过程的过程方程:
pV r 常数
V r-1T 常数
p1-rT r 常数
理想气体绝热过程(可逆与不可逆均可用):
W
U
nCV ,m (T2
T1)
)
r
H
m
(298.15K
)
T 298
BC
p,m
(
B)dT
B
rUm
(T
)
rU
m
(298.15K
)
T 298
BCV
,m
(
B)dT
B
pdV
1
2
QV=△U
Q U nC dT
V
1
V ,m
Qp= H
Qp H
T2 T1
nC
p
,mdT
H= U+ (pV) = U+(p2V2-p1V1)
公式运用条件
• 以下所列公式只适用于封闭体系和热力学平衡态。
(1)H=U+pV 是定义式,适用于任何处于热力学平衡
态的封闭体系。
• (2) H = QP 适用于不作非膨胀功的等压过程
• (3) U = QV 适用于不作非膨胀功的等容过程 • (4)H = CP dT 适用于不作非膨胀功、状态连续变
化的等压过程 • 适用于不作非膨胀功、理想气体的等温可逆过程。
第二章 热力学第一定律 主要公式及使用条件

第二章 热力学第一定律主要公式及使用条件1. 1. 热力学第一定律的数学表示式W Q U +=Δ或'amb δδδd δdU Q W Q p V W =+=−+规定系统吸热为正,放热为负。
系统得功为正,对环境作功为负。
式中 p amb 为环境的压力,W ’为非体积功。
上式适用于封闭体系的一切过程。
2. 2. 焓的定义式pVU H +=3. 3. 焓变(1) )(pV U H Δ+Δ=Δ式中为乘积的增量,只有在恒压下)(pV ΔpV )()(12V V p pV −=Δ在数值上等于体积功。
(2) 2,m 1d p H nC Δ=∫T 此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。
4. 4. 热力学能(又称内能)变此式适用于理想气体单纯pVT 变化的一切过程。
2,m 1d V U nC Δ=∫T5. 5. 恒容热和恒压热(d V Q U =Δ0,'0)V W ==p Q H =Δ(d 0,'0)p W ==6. 6. 热容的定义式(1)定压热容和定容热容δ/d (/)p p C Q T H T p ==∂∂δ/d (/)V V C Q T U T ==∂∂V p V R 3(2)摩尔定压热容和摩尔定容热容,m m /(/)p p C C n H T ==∂∂,m m /(/)V V C C n U T ==∂∂上式分别适用于无相变变化、无化学变化、非体积功为零的恒压和恒容过程。
(3)质量定压热容(比定压热容),m //p p p c C m C M==式中m 和M 分别为物质的质量和摩尔质量。
(4),m ,m p V C C −=此式只适用于理想气体。
(5)摩尔定压热容与温度的关系2,m p C a bT cT dT =+++式中a , b , c 及d 对指定气体皆为常数。
(6)平均摩尔定压热容21,m ,m 21d /()T p p T C T T T C =−∫7. 7. 摩尔蒸发焓与温度的关系21v ap m 2vap m 1v ap ,m ()()d T p T H T H T C T Δ=Δ+Δ∫或 vap m vap ,m (/)p p H T ∂Δ∂=ΔC d amb ∑−=−−=−−=式中 = C (g) —C (l),上式适用于恒压蒸发过程。
热力学公式总结
热力学公式总结
一、热力学第一定律
热力学第一定律,也被称为能量守恒定律,表明在一个封闭系统中,能量不能被创造或毁灭,只能从一种形式转化为另一种形式。
公式如下:
ΔU = Q + W
其中,ΔU表示系统内能的改变,Q表示系统吸收或释放的热量,W表示系统对外界所做的功。
二、热力学第二定律
热力学第二定律表明,热量不能自发地从低温物体传递到高温物体,而不引起其他变化。
公式如下:
dS/dt ≥ 0
其中,S表示系统的熵,dS/dt表示熵的变化率。
如果dS/dt大于0,则表
示熵增加,如果dS/dt等于0,则表示熵不变。
三、理想气体状态方程
理想气体状态方程表示理想气体的压力、体积和温度之间的关系。
公式如下:PV = nRT
其中,P表示气体的压力,V表示气体的体积,n表示气体的摩尔数,R表
示气体常数,T表示气体的温度(以开尔文为单位)。
四、热力学第三定律
热力学第三定律表明,绝对零度不能通过有限的降温过程达到。
公式如下:ΔS(T→0) = 0
其中,ΔS表示系统熵的变化,T表示温度。
这个公式表明在绝对零度时,
系统的熵为零。
第二章 热力学第一定律-1
系
δQ 环境
统
δW 环境
所 以:
dU体系热力学能量的增量 Q W
注 意:
Ⅰ. d 表示全微分, 表示非全微分。
Ⅱ. 凡是使体系(热力学)能量增加的功和热都取正值,反之取负值。
三、焦耳(Joule)实验
搅 拌 器 活塞
真空
实验前——左边容器空气,
右边容器真空;容器置于一
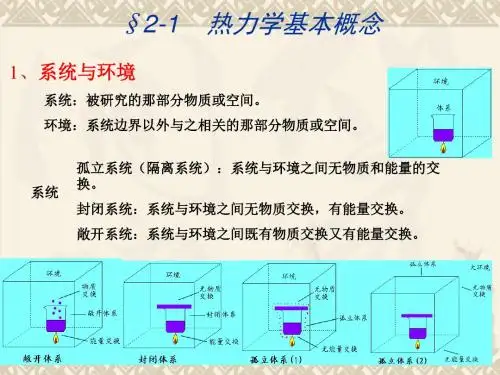
系统分类——根据系统与环境之间是否有物质和能量交换:
(1)封闭体系:无物质交换,有能量交换。 (2)敞开体系:既有物质交换,又有能量交换。 (3)隔离体系:既无物质交换,也无能量交换。
注意:系统与环境的区分具有相对性;系统的选择具有任意 性。
3. 系统的性质——广度性质与强度性质
(1) 广度性质(容量性质)——如果在没有任何其他变化的情况下,
二、热力学的基本概念和术语
• 1. 引言
高楼大厦是由沙石等基础元件构成的;同样的道理,任何一 个理论体系都是建立在一定的基础元件上的。例如:英语由26个 字母构筑而成;日语由50个片假名和平假名构成而成。热力学体 系也一样由它的基本概念和术语构筑而成。——所以先来讨论热 力学的基本概念和术语。
2. 系统与环境
C. 恒容过程—— V体系=Cons tan t
D. 绝热过程——体系与外界环境无热交换。
E. 循环过程——系统经历一系列具体途径后又回到原来的状态; 其特点是:状态函数的变化值为零,但体系与环境所交换的功 和热不一定为零。
★ 第二种分类方法(分类标准——按组成分类):
A.简单状态变化 ;B.相变 ;C.化学反应
0 0
8. 热力学能(旧称:内能)
(1)定义——系统内部所有粒子除整体动能和整体势能外的全部能量之和,用符
热力学第一定律总结
热一定律总结一、 通用公式ΔU = Q + W绝热: Q = 0,ΔU = W 恒容W ’=0:W = 0,ΔU = Q V恒压W ’=0:W =-p ΔV =-ΔpV ,ΔU = Q -ΔpV ΔH = Q p 恒容+绝热W ’=0 :ΔU = 0 恒压+绝热W ’=0 :ΔH = 0焓的定义式:H = U + pV ΔH = ΔU + ΔpV典型例题:思考题第3题,第4题;二、 理想气体的单纯pVT 变化恒温:ΔU = ΔH = 0变温: 或或如恒容,ΔU = Q ,否则不一定相等;如恒压,ΔH = Q ,否则不一定相等;C p , m – C V , m = R双原子理想气体:C p , m = 7R /2, C V , m = 5R /2 单原子理想气体:C p , m = 5R /2, C V , m = 3R /2典型例题:思考题第2,3,4题书、三、 凝聚态物质的ΔU 和ΔH 只和温度有关或 典型例题:书四、可逆相变一定温度T 和对应的p 下的相变,是恒压过程ΔU ≈ ΔH –ΔnRTΔn :气体摩尔数的变化量;如凝聚态物质之间相变,如熔化、凝固、转晶等,则Δn = 0,ΔU ≈ ΔH ;ΔU = n C V, m d T T 2T1 ∫ ΔH = n C p, md T T2 T1∫ ΔU = nC V, m T 2-T 1 ΔH = nC p, m T 2-T 1ΔU ≈ ΔH = n C p, m d TT 2T 1∫ΔU ≈ ΔH = nC p, m T 2-T 1ΔH = Q p = n Δ H m α βkPa 及其对应温度下的相变可以查表; 其它温度下的相变要设计状态函数不管是理想气体或凝聚态物质,ΔH 1和ΔH 3均仅为温度的函数,可以直接用C p,m 计算;或典型例题:作业题第3题 五、化学反应焓的计算其他温度:状态函数法ΔU 和ΔH 的关系:ΔU = ΔH –ΔnRT Δn :气体摩尔数的变化量;典型例题:思考题第2题典型例题:见本总结“十、状态函数法;典型例题第3题” 六、体积功的计算通式:δW = -p amb ·d V恒外压:W = -p amb ·V 2-V 1Δ H m T = ΔH 1 +Δ H m T 0 + ΔH 3α ββα Δ H m TαβΔH 1ΔH 3Δ H m T 0α β可逆相变K:ΔH = nC p, m T 2-T 1ΔH = n C p, m d T T 2T1∫恒温可逆可逆说明p amb = p :W = nRT ·ln p 2/p 1 = -nRT ·ln V 2/V 1 绝热可逆:pV γ= 常数γ = C p , m /C V , m ; 利用此式求出末态温度T 2,则W =ΔU = nC V , m T 2 – T 1或:W = p 2V 2 – p 1V 1/ γ–1典型例题: 书,作业第1题 七、p -V 图斜率大小:绝热可逆线 > 恒温线 典型例题:如图,A→B 和A→C 均为理想气体变化过程,若 B 、C 在同一条绝热线上,那么U AB 与U AC 的关系是: A U AB > U AC ; B U AB < U AC ; C U AB =U AC ; D 无法比较两者大小;八、可逆过程可逆膨胀,系统对环境做最大功因为膨胀意味着p amb ≤ p ,可逆时p amb 取到最大值p ;可逆压缩,环境对系统做最小功; 典型例题:1 mol 理想气体等温313 K 膨胀过程中从热源吸热600 J,所做的功仅是变到相同终态时最大功的1/10,则气体膨胀至终态时,体积是原来的___倍;九、求火焰最高温度: Q p = 0, ΔH = 0求爆炸最高温度、最高压力:Q V = 0, W = 0 ΔU = 0 典型例题:见本总结“十、状态函数法;典型例题第3题” 十、状态函数法重要设计途径计算系统由始态到终态,状态函数的变化量; 典型例题:1、 将及Θ的水汽100 dm 3,可逆恒温压缩到10 dm 3,试计算此过程的W,Q 和ΔU ;2、 1mol 理想气体由2atm 、10L 时恒容升温,使压力到20 atm;再恒压压缩至体积为1L;求整个过程的W 、Q 、ΔU 和ΔH ;3、 298K 时,1 mol H 2g 在10 mol O 2g 中燃烧H 2g + 10O 2g = H 2Og + g恒容过程恒压过程p 恒温过程绝热可逆过程p V已知水蒸气的生成热Δr H m H2O, g = kJ·mol-1, C p,m H2 = C p,m O2 = J·K-1·mol-1,C p,m H2O = J·K-1·mol-1.a)求298 K时燃烧反应的Δc U m;b)求498 K时燃烧反应的Δc H m;c)若反应起始温度为298 K,求在一个密封氧弹中绝热爆炸的最高温度;十、了解节流膨胀的过程并了解节流膨胀是绝热、恒焓过程典型例题:1、理想气体经过节流膨胀后,热力学能____升高,降低,不变2、非理想气体的节流膨胀过程中,下列哪一种描述是正确的:A Q = 0,H = 0,p < 0 ;B Q = 0,H < 0,p < 0 ;C Q > 0,H = 0,p < 0 ;D Q < 0,H = 0,p < 0 ;十一、其他重要概念如系统与环境,状态函数,平衡态,生成焓,燃烧焓,可逆过程等,无法一一列举典型例题:1、书2、体系内热力学能变化为零的过程有:A 等温等压下的可逆相变过程B 理想气体的绝热膨胀过程C 不同理想气体在等温等压下的混合过程D 恒容绝热体系的任何过程十二、本章重要英语单词system 系统surroundings 环境state function 状态函数equilibrium 平衡态open/closed/isolated system 开放/封闭/隔离系统work 功heat 热energy 能量expansion/non-expansion work 体积功/非体积功free expansion 自由膨胀vacuum 真空thermodynamic energy/internal energy 热力学/内能perpetual motion machine 永动机The First Law of Thermodynamics热力学第一定律heat supplied at constant volume/pressure 恒容热/恒压热adiabatic 绝热的diathermic 导热的exothermic/endothermic 放热的/吸热的isothermal 等温的isobaric 等压的heat capacity 热容heat capacity at constant volume/pressure 定容热容/定压热容enthalpy 焓condensed matter 凝聚态物质phase change 相变sublimation 升华vaporization 蒸发fusion 熔化reaction/formation/combustion enthalpy反应焓/生成焓/燃烧焓extent of reaction 反应进度Kirchhoff’s Law 基希霍夫公式reversible process 可逆过程Joule-Thomson expansion 焦耳-汤姆逊膨胀/节流膨胀isenthalpic 恒焓的。
热力学第一第二定律复习
热力学第二定律 一、重要概念 卡诺循环,热机效率,热力学第二定律,克劳修斯不等式 熵,规定熵,标准熵,标准摩尔反应熵,亥姆霍兹函数 ,吉布斯函数 二、主要公式与定义式 1. 可逆热机效率:η = -W / Q1 =(Q1+Q2)/ Q1 = 1 - T2 / T1 (T2 , T1 分别为低温,高温热源) 2.卡诺定理:任何循环的热温熵小于或等于0
(3) 对于凝聚相,状态函数通常近似认为只与温度有关, 而与压力或体积无关,即 d U≈d H= n Cp,m d T
(5) 相变过程 可逆相变:在温度T对应的饱和蒸气压下的相变,如水 在常压下的0℃ 结冰或冰溶解,100 ℃ 时的汽化或凝结等 过程。 由温度T1下的相变焓计算另一温度下的相变焓T T2 q q D Hm (T2)= D Hm (T1)+ D C dT
三、ΔS、ΔA、ΔG的计算 1.ΔS的计算(重点) 特例:恒温过程: ΔS = nRln(V2/V1) 恒容过程: ΔS =nCV,mln(T2/T1) 恒压过程: ΔS =nCp,mln(T2/T1) (2) 相变过程:可逆相变 ΔS =Δ H/T ; 非可逆相变 需设计路径计算 (3) 标准摩尔反应熵的计算 Δ rSmθ = ∑ vB Smθ (B,T) 2.Δ G的计算 (1) 平衡相变或反应达到平衡:Δ G=0 (2) 恒温过程:ΔG=Δ H-TΔS (3) 非恒温过程:Δ G=Δ H- ΔT S =Δ H -(T 2S2-T1S1) 注:题目若要计算Δ G,一般是恒温过程;若不是恒温, 题目必然会给出绝对熵。
(1) Δ S(隔离)>0,自发(不可逆); Δ S(隔离)=0,平衡(可逆)。 (2)恒T、恒p、W ’=0过程(最常用): dG<0,自发(不可逆);dG=0,平衡(可逆)。 (3) 恒T、恒V、W ’=0过程: dA<0,自发(不可逆); dA=0,平衡(可逆)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
r
1
1
(
p2V2
p1V1)
nR(T2 T1) r 1
1 V
( V T
)p
J
( T V
)U
1 V
( V p
)T
J -T
(
T p
)H
1 Cp
H
p
T
可逆相变热: Qp H n Hm (B)
不可逆相变热:设计过程,其中要包含可逆相变
pdV
1
2
QV=△U
Q U nC dT
V
1
V ,m
Qp= H
Qp H
T2 T1
nC
p
,mdT
H= U+ (pV) = U+(p2V2-p1V1)
以公下式所列运公用式条只件适用于封闭体系和热力学平衡态。
(1)H=U+pV 是定义式,适用于任何处于热力学平衡
rUV + RT ni.g rUV + RT i.g
规定 : Hm(稳定单质,298.15K)=0i
推论: fHm(稳定单质,T)=0 fHm(B,298.15K)=Hm(B,298.15K)
由基础热数据求rHm(298.15K):
r
H
nB ( ) nB (0) B
QV rU, Qp r H
r H p rUV + RT i.g
i
r Hm rUm RT i.g
以上两式推导过程如下,可以看出应i 用了两个近似: (1)忽略了凝聚相体积的变化(2)将气体视为理想气体。
r H p rUV + pV rUV + ( pV )g + ( pV )s.or.l
过程
W
Q
ig 自由膨胀
0
0
ig 等温可逆 -nRTlnV2/V1 =W
ig 等容可逆 ig 绝热可逆
0
Cv(T2-T1)
等T,p可逆相变 peV
CV dT
0
Qp
U
0 0
=Q
=W
Qp W
H
0 0
CpdT
CpdT
Qp
CV
QV
dT
(U ) T V
Cp
CV
(
U V
第一章 热力学第一定律
一·基本概念 热力学第一定律 恒容热·恒压热与焓 热容 相变焓 标准摩尔反应焓 化学反应中热·功·焓的计算 可逆过程与可逆体积功的计算 真实气体的节流膨胀
本章重要公式
体积功定义式: W=-pexdV
反抗恒外压:
W=-pex(V2-V1)
可逆过程:
2
2
W
1 pexdV
态的封闭体系。
(2) H = QP 适用于不作非膨胀功的等压过程
(3) U = QV 适用于不作非膨胀功的等容过程 (4)H = CP dT 适用于不作非膨胀功、状态连续变
化的等压过程 适用于不作非膨胀功、理想气体的等温可逆过程。
(5) W nRT ln V1 V2
总结不同过程中W,Q,U 和H 的计算。 第一定律为U = Q + W ,设不作非膨胀功。
)T
(
V T
)
p
p( V T
)p
Cp
Qp
dT
(
H T
)
p
或
Cp
CV
[
p
(
U V
)T
](
V T
)p
对理想气体: C p,m CV ,m R
对单原子分子理想气体:Cp,m
5 2
R,
CV ,m
3 2
R
对双原子分子理想气体:Cp,m
7 2
R,
CV ,m
5 2
BC
p,m
(
B)dT
B
rUm
(T
)
rU
m
(298.15K
)
T 298
BCV
,m
(
B)dT
B
Байду номын сангаас
R
理想气体 任意单纯pVT过程
U
2
1 nCV ,mdT
(不限于恒容)
H
2
1 nCP,mdT
(不限于恒压)
理想气体绝热可逆过程的过程方程:
pV r 常数
V r-1T 常数
p1-rT r 常数
理想气体绝热过程(可逆与不可逆均可用):
W
U
nCV ,m (T2
T1)
m
(298.15K
)
B
f
H
m
(
B,298.15K
)
B
Bc Hm (B,298.15K )
B
Bat Hm (B, 298.15K )
反应热与温度的关系——Kirchhoff定律:
r
Hm
(T
)
r
H
m
(298.15K
)
T 298
