第五章 工艺计算-热量衡算
物料衡算和能量衡算

2021/3/8
23
196#不饱和聚酯树脂配方设计
原材料名称 1、2-丙二醇 一缩二乙二醇
顺酐 苯酐 苯乙烯 对苯二酚 石蜡 环烷酸铜
规格 工业级 工业级 工业级 工业级 工业级 工业级 工业级 (8%Cu含量)
配比 0.965克分子 0.138克分子
0.5克分子 0.5克分子
33% 0.009% 0.018% 0.0118%
分批操作(间歇操作)的设备,当终点时,物料全 部排出则系统内物料积累为零,对于稳定连续操作, 系统物料累积量亦为零。在此情况下,上式可写成: ∑G进=∑G出+∑G损
2021/3/8
6
车间收率和阶段收率
➢ 在作整个车间的物料衡算时,常需要用车间 总收率、阶段收率这些基本概念。
车间收率和车间产品及原料消耗关系如下:
配料M-旁路物料R=反应物N
2021/3/8
22
物料衡算的基本要素
➢一个独立方程,可以解出一个未知 数。若已知配料M和反应物N,则可 求出旁路的物料量R。同样,可以把 配料、分离工序单独分割作为衡算 系统,若有必要,也可以把 B1C2C3B4包围的部分作为衡算范围。
➢对生产过程中一系列工序都要进行 物料衡算时,若绘成表格形式,则 可方便地进行计算。
3
➢物料衡算也是能量衡算、定型设备 选型、非定型设备工艺计算和其他 工艺计算的基础。通过物料衡算可 以算出各工段所处理的物料量(各组 分的成分、重量和体积),便可以定 出生产过程所需设备台数、容量和 主要尺寸以及计算管道尺寸等。所 以物料衡算是复合材料工艺计算的 重要部分。
2021/3/8
4
➢ 物料衡算可分操作型计算和设计型 计算。
2021/3/8
化工中物料衡算和热量衡算公式

物料衡算和热量衡算物料衡算根据质量守恒定律,以生产过程或生产单元设备为研究对象,对其进出口处进行定量计算,称为物料衡算。
通过物料衡算可以计算原料与产品间的定量转变关系,以及计算各种原料的消耗量,各种中间产品、副产品的产量、损耗量及组成。
物料衡算的基础物料衡算的基础是物质的质量守恒定律,即进入一个系统的全部物料量必等于离开系统的全部物料量,再加上过程中的损失量和在系统中的积累量。
∑G1=∑G2+∑G3+∑G4∑G2:——输人物料量总和;∑G3:——输出物料量总和;∑G4:——物料损失量总和;∑G5:——物料积累量总和。
当系统内物料积累量为零时,上式可以写成:∑G1=∑G2+∑G3物料衡算是所有工艺计算的基础,通过物料衡算可确定设备容积、台数、主要尺寸,同时可进行热量衡算、管路尺寸计算等。
物料衡算的基准(1)对于间歇式操作的过程,常采用一批原料为基准进行计算。
(2)对于连续式操作的过程,可以采用单位时间产品数量或原料量为基准进行计算。
物料衡算的结果应列成原材料消耗定额及消耗量表。
消耗定额是指每吨产品或以一定量的产品(如每千克针剂、每万片药片等)所消耗的原材料量;而消耗量是指以每年或每日等时间所消耗的原材料量。
制剂车间的消耗定额及消耗量计算时应把原料、辅料及主要包装材料一起算入。
热量衡算制药生产过程中包含有化学过程和物理过程,往往伴随着能量变化,因此必须进行能量衡算。
又因生产中一般无轴功存在或轴功相对来讲影响较小,因此能量衡算实质上是热量衡算。
生产过程中产生的热量或冷量会使物料温度上升或下降,为了保证生产过程在一定温度下进行,则外界须对生产系统有热量的加入或排除。
通过热量衡算,对需加热或冷却设备进行热量计算,可以确定加热或冷却介质的用量,以及设备所需传递的热量。
热量衡算的基础热量衡算按能量守恒定律“在无轴功条件下,进入系统的热量与离开热量应该平衡”,在实际中对传热设备的衡算可由下式表示Q 1+Q 2+Q 3=Q 4+Q 5+Q 6 (1—1)式中: Q 1—所处理的物料带入设备总的热量,KJ;Q 2—加热剂或冷却剂与设备和物料传递的热量(符号规定加热剂加入热量为“+”,冷却剂吸收热量为“-”),KJ;Q 3—过程的热效率,(符号规定过程放热为“+”;过程吸热为“-”)Q 4—反应终了时物料的焓(输出反应器的物料的焓)Q 5—设备部件所消耗的热量,KJ;Q 6—设备向四周散失的热量,又称热损失,KJ;热量衡算的基准可与物料衡算相同,即对间歇生产可以以每日或每批处理物料基准。
热量衡算

硫酸铝制备技术一、硫酸铝制备方法:目前,国内制备硫酸铝两种方法:铝土矿法+硫酸、氢氧化铝+硫酸第一种:有铁硫酸铝制备方法:用硫酸直接处理铝土矿(或粘土)的方法而制得硫酸铝,其化学反应式为: H2Al(SiO4)2·H2O+3H2SO4=Al2(SO4)3+2H4SiO4+H2O特点:原材料铝土矿便宜,但铁含量高,且不易脱除,目前,山东等铝土矿资源丰富的地方大量生产。
第二种:无铁硫酸铝制备方法:氢氧化铝+硫酸制备2Al(OH)3+3H2SO4 = Al2(SO4)3 + 6H2O + Q氢氧化铝粉出厂已脱铁,铁含量低,故硫酸铝铁含量低。
生产的硫酸铝有固体硫酸铝和液体硫酸铝。
固体硫酸铝的Al2O3含量15.8~17%,而氢氧化铝粉中Al2O3含量64~65%,运1吨氢氧化铝粉相当运4吨固体硫酸铝。
而本地浓硫酸价格相对便宜,所以,用氢氧化铝粉和浓硫酸反应生产成本低。
二、硫酸铝的反应形式- 1 -硫酸铝反应形式有两种:一种常压反应(老基地),一种带压反应(新基地)常压反应所用设备一般用玻璃钢反应釜,通蒸汽一般有两种:一种通过故泡器通蒸汽(催化剂长岭分公司),故泡器起到搅拌的作用;另一种直接通蒸汽,用工业风搅拌(齐鲁)。
带压反应所有设备一般有三种:搪瓷反应釜、搪铅通过胶泥贴耐酸瓷砖、锆反应釜(国内第一家,存在风险)。
带压反应的理论基础热量衡算:(1)、2Al(OH)3+3H2SO4 = Al2(SO4)3 + 6H2O + Q2 3 1 6 Q-1284kj/mol -194.5Kcal/mol -3435Kj/mol -285.83Kj/molQ=△RH=-285.83*6-3435+1284*2+3*194.5*4.18=-142.95kj/mol故此反应为放热反应整年反应的热量为Q反:Q反=-142.95*25000*50*3.353*1000/342=-1751869000Kj/年(2)对产物Al2(SO4)3 (1年的产量)从0℃升至140℃所需要的热量Q Al2(SO4)3Q Al2(SO4)3=CM△T 其中C=0.35Kcal/Kg.℃Q Al2(SO4)3=CM△T =0.35*4.2*25000*50*3.353*(140-0)=862559250kj/年对水的吸热(从0℃升至140℃)所需要的热量Qk100℃蒸汽r1=539Kcal/kg,H1=639.1Kcal/kg- 2 -140℃蒸汽r2=512.3Kcal/kg,H1=653Kcal/kgMH20=1324+10117=11441T故Q水=CM△T+R1*M+(H2-H1)*M=M*(4.2*100+539*4.2+13.9*4.2)=11441*4.2*(100+539+13.9)*1000=3.137*1010KJ(4)、浓硫酸稀释所放出的热量Q稀Q稀=(3677×103/98)*21021*4.2=3.313*1010KJ(5)对整个反应(时间为一年)需向反应釜提供的热量Q提Q提=Q放-Q吸=(3.313+0.175-0.086-3.137)×1010=0.265×1010KJ/年故反应无需向反应气补充蒸汽三、化工原材料性质及产品质量指标本项目原料主要有氢氧化铝粉浓硫酸,其规格及来源见下表。
热量衡算
化工计算中的能量衡算是根据热力学第一定律,即能量守恒与转化定律,对化工过程进行能量计算。
化工生产中消耗的能量形式有机械能,电能和热能等等,其中以热能为主要形式,因此化工过程中的能量衡算重点是热量衡算。
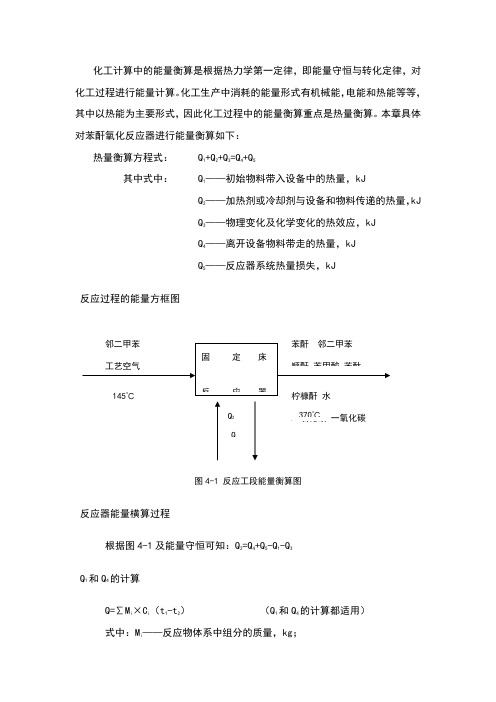
本章具体对苯酐氧化反应器进行能量衡算如下:热量衡算方程式: Q1+Q2+Q3=Q4+Q5其中式中: Q1——初始物料带入设备中的热量,kJQ2——加热剂或冷却剂与设备和物料传递的热量,kJQ3——物理变化及化学变化的热效应,kJQ4——离开设备物料带走的热量,kJQ5——反应器系统热量损失,kJ反应过程的能量方框图图4-1 反应工段能量衡算图反应器能量横算过程根据图4-1及能量守恒可知:Q2=Q4+Q5-Q1-Q3Q1和Q4的计算Q=∑Mi×Ci(t1-t2)(Q1和Q4的计算都适用)式中:Mi——反应物体系中组分的质量,kg;C i ——组分i 在0-T℃时的平均比热容,KJ/; t 1,t 2——反应物系在反应前后的温度,℃。
物料进入设备时的温度为145℃,热量衡算的基准为145℃,△T=0,则: Q 1=0查得各物项平均比热容数据: (kJ/kg.℃)表4-1 各物相平均比热容所以: ()21i i 4t C M Q t -=∑=××(370-145)+××225+××225+××225+××225+××225+××225+××225+××225+××225+××225=.4kJ 过程Q 3的计算过程热效率可以分为两类:一类是化学过程的热效率即化学反应速率;另一类是物理过程热效率。
物料化学变化过程,除化学反应外,往往伴随着物料状态变化热效率,但本工艺流程中物理过程热效率较低,可以忽略不计,该过程皆为放热反应,则过程热效率可以由下式计算:主反应:C 8H 10+3O 2→C 8H 4O 3+3H 2O + Q 3-1=×103×=×103kJ/h副反应:CH 3C 6H 4CH 3+→C 4H 2O 3(顺酐)+4CO 2+4H 2O + Q 3-2=×103×=×103kJ/hCH 3C 6H 4CH 3+3O 2→C 6H 5COOH (苯甲酸)+CO 2+2H 2O +Q3-3=×103×=×103kJ/hCH3C6H4CH3+2O2→C8H6O2(苯酞)+2H2O +Q3-4=×103×=×103kJ/hCH3C6H4CH3+→C5H5O3(柠槺酐)+3CO+3H2O +Q3-5=×103×=×103kJ/hCH3C6H4CH3+→8CO+5H2O +Q3-6=×103×=×103kJ/hCH3C6H4CH3+→8CO2+5H2O +Q3-7=×103×=×103kJ/h 继而得到:Q 3 = Q3-1+Q3-2+Q3-3+Q3-4+Q3-5+Q3-6+Q3-7 =×103kJ/hQ5的计算该反应中的热损失按5%计算,即:Q 5=5%×(Q1+Q3)=5%×(0+×103)=×103kJ/hQ2的计算Q2为熔岩移出反应器的热量,由反应器热量守恒可知:Q 2=Q4+Q5-Q1-Q3=.8kJ/h反应器能量衡算表根据以上计算列出氧化反应工段能量衡算表格如下:表4-2 反应工段能量衡算表(吸收热量为“+”,释放热量为“-”)。
第五章能量衡算

第五章能量衡算第一节概述第二节热量衡算第三节过程的热效应第四节热量衡算举例第五节加热剂、冷却剂及其其他能量消耗的计算5.1 概述5.1.1 能量衡算的目的和意义计算过程能耗指标进行方案比较,选定先进生产工艺。
能量衡算数据是设备选型和计算的依据;是组织、管理、生产、经济核算和最优化的基础5.1.2 能量衡算的的依据及必要条件依据为能量守恒定律条件:物料衡算的数据,相关热力学物性数据。
5.1.3 能量守恒的基本方程输出能量+消耗能量+积累能量=输入能量+生成能量5.1.4 能量衡算的分类单元设备的能量衡算和系统的能量衡算5.2 热量衡算5.2.1 热量平衡方程式Q —物料带入设备的热量,kJ ;Q2—加热剂或冷却剂传给设备及所处理物料的热量,kJ ;Q3 —过程的热效应,kJ;(注意符号规定)Q4—物料带出设备的热量,kJ ;Q5—加热或冷却设备所消耗的热量或冷量,kJ ;Q6 —设备向环境散失的热量,kJ。
注意各Q勺符号规定Q为设备的热负荷。
若Q为正值,需要向设备及所处理的物料提供热量; 反之,表明需要从设备及所处理的物料移走热量。
对间歇操作,按不同的时间段分别计算Q的值,并取其最大值作为设备热负荷的设计依据。
522 各项热量的计算1、计算基准一般情况下,可以0C和1.013 105Pa为计算基准有反应的过程,也常以25C和1.013 105Pa为计算基准。
2、Q或Q的计算无相变时物料的恒压热容与温度的函数关系常用多项式来表示:若知物料在所涉及温度范围内的平均恒压热容,贝心3、Q的计算过程的热效应由物理变化热Q和化学变化热Q两部分组成物理变化热是指物料的浓度或状态发生改变时所产生的热效应。
若过程为纯物理过程,无化学反应发生,如固体的溶解、硝化混酸的配制、液体混合物的精馏等,则Q C= 0 。
化学变化热是指组分之间发生化学反应时所产生的热效应,可根据物质的反应量和化学反应热计算。
4、Q的计算稳态操作过程Q 5= 0非稳态操作过程由下式求QQ=' GC (T2-T1)G-设备各部件的质量,kg;G—设备各部件材料的平均恒压热容,kJ kg-1「C-1;T1—设备各部件的初始温度,C;T2—设备各部件的最终温度,C。
化工原理第五章传热过程计算与换热器

5.4 传热效率和传热单元数
• 当传热系数K和比热cpc为常数时,积分上式可得
• 式中NTUc(Number of Transfer Unit)称为对冷流体而言的传热单 元数,Dtm为换热器的对数平均温差。
• 同理,以热流体为基准的传热单元数可表 示
• 在换热器中,传热单元数定义 为
5.4 传热效率和传热单元数
• 2.由选定的换热器型式计算传热系数K;
• 3.由规定的冷、热流体进出口温度计算参数e、CR; • 4.由计算的e、CR值确定NTU。由选定的流动排布型
式查取e—NTU算图。可能需由e—NTU关系反复计算 NTU;
• 5.计算所需的传热面积
。
5.5 换热器计算的设计型和操作型问题
• 例5-2 一列管式换热器中,苯在换热器的管内 流动,流量为1.25 kg/s,由80℃冷却至30℃; 冷却水在管间与苯呈逆流流动,冷却水进口温 度为20℃,出口温度不超过50℃。若已知换热 器的传热系数为470 W/(m2·℃),苯的平均 比热为1900 J/(kg·℃)。若忽略换热器的散 热损失,试分别采用对数平均温差法和传热效 率—传热单元数法计算所需要的传热面积。
• 如图5-4所示,按照冷、热流 体之间的相对流动方向,流体之 间作垂直交叉的流动,称为错流 ;如一流体只沿一个方向流动, 而另一流体反复地折流,使两侧 流体间并流和逆流交替出现,这
种情况称为简单折流。
•图 P2
•55
5.3 传热过程的平均温差计算
•通常采用图算法,分三步: •① 先按逆流计算对数平均温差Dtm逆; •② 求出平均温差校正系数φ;
•查图 φ
•③ 计算平均传热温差: • 平均温差校正系数 φ <1,这是由于在列管式换热器内增设了
高分子工程设计热量衡算
4 例1 间歇搅拌釜反应器恒温操作过程热量衡算 章
在一间歇操作旳反应器进行二级恒温变容反应过程,反应动力学方程如下:
热 量
rA (x)
dN A Vdt
kC
2 A
kC
2 A0
( 1 x 1 x
)2
(1)
dx
(1 x)2
rx (x)
dt
kCA0
(2) (1 x)
衡
算
式中:rA(x)—以反应物浓度变化表达旳反应速率、rx(x)—以反应物转化率变化表达旳
衡
理论根据
算
热平衡方程:
第
处理实际问题时,热平衡方程可写成: QT=Q1+Q2+Q3+Q4 或
4 章
qT=q1+q2+q3+q4
热 量 衡 算
第 §4.2 多种热量旳计算措施
4 章
q1或 Q1旳计算(显热)
① 恒容变化过程 热 量 衡 算
第
4
② 恒压变化过程
章
热 量 衡 算
③ 液体或固体
第 ④ 混合物料体系 4 章
算 ② 热量消耗旳计算及能源旳综合利用
热量消耗旳计算主要是为经济核实等提供根据,还需根据热量 衡算旳成果,处理能源合理应用问题。
第 ③ 为其他专业旳设计提供根据
4 章
提出传热介质旳种类、相态、使用温度范围、使用压力范围
、传热介质流量及用量、设备是否需要保温等设计条件,为公用
热 工程、自控仪表等旳设计提供根据。 量
CA0
k
0
1 x
( 1 x)2
dx
(3) 反 应 速 率 的 计 算
rA ( x)
k
第五章物料衡算,能量衡算及设备工艺计算与选择
补充说明1: 生化反应器工艺设计的要点 (a)反应器选型
确定反应器的结构类型、操作方式、 传递和流动方式等。
一般可根据酶或细胞中生化反应的动力学 特性来选择合适的反应器形式; 结合动力学和反应器两方面特性来确定操 作方式和优化的操作设计等。
反应器工艺设计的要点
(b)设计反应器的结构、确定各种结构参数。
由于分子在不停地做着无规则热运动而具有的内动能.它 与物体的温度有关(温度是分子平均动能的标志). 分子间存在相互作用力,分子间具有由它们的相对位置决 定的势能,这就是分子内势能.它和物体的体积有关.
补充说明:能量的形式和概念
4.热量(Q) 温度不同的两物体相接触或靠近,热量从热(温 度高)的物体向冷(温度低)的物体流动,这种 由于温度差而引起交换的能量,称为热量。
2.任务
参见P104 主要是确定车间内所有工艺设备的台数、型式和主 要尺寸。
(二)设备设计与选型的原则
物料衡算是设备选型的根据,而设备选型则要符 合工艺的要求。 设备选型是保证产品质量的关键和体现生产水平 的标准,又是工艺布置的基础,并且为动力配电, 水、汽用量计算提供依据。
选型原则 如下(P104书上为8点):
注意: 第一,热量是一种能量的形式,是传递过程中的 能量形式; 第二,一定要有温度差或温度梯度,才会有热量 的传递。
补充说明:能量的形式和概念
5.功(W) 功是力与位移的乘积。 在化工中常见的有体积功(体系体积变化 时,由于反抗外力作用而与环境交换的 功)、流动功(物系在流动过程中为推动 流体流动所需的功)以及旋转轴的机械功 等。
如:混合物分离过程(超滤)
说明
对于连续不稳定过程,由于该过程内物料 量及组成等随时间而变化,因此,物料衡 算式须写成以时间为自变量的微分方程, 表示体系内在某一瞬时的平衡。
能量衡算
能量衡算----读书笔记能量衡算能量消耗费用是复合材料制品的主要成本之一,合理利用能量可以降低成本。
因此,在复合材料的工艺设计中,能量衡算是十分重要的基本设计项目。
能量衡算的目的在于定量地表示出工艺过程各部分的能量变化,确定需要加入或可供利用的能量,确定过程及设备的工艺条件和热负荷。
能量衡算主要包括热能、动能、电能和化学能等。
在复合材料的生产中,一般无轴功存在或轴功相对来讲影响较小,可忽略不计。
热量是一种最主要的能量形式,能量衡算实际上是热量衡算,因此,在本节中主要讨论热量衡算。
热量衡算和系统热量衡算。
生产过程中所产生的化学反应热效应及物理状态变化热效应会使物料温度上升或下降,为了保证生产过程在一定温度条件下进行,则需环境对生产系统有热量的加入或放出,这便是热量衡算的目的。
对新车间设计,热量衡算是在物料衡算的基础上进行的。
通过热量衡算,可确定传热设备的热负荷,即在规定的时间中加入或移出的热量,从而确定传热剂的消耗量,选择合适的传热方式,计算传热面积。
热量衡算和物料衡算相结合,通过工艺计算,可确定设备工艺尺寸,如设备的台数、容积、传热面积等。
对已投产的生产车间或设备装置进行热量衡算,对合理利用热量、提高传热设备的热效率、回收余热、最大限度地降低产品的能耗有其重要意义。
能量衡算的主要任务如下:①确定各单元过程所需热量或冷量及传热速率,为其他工程,如供汽、给水等提供设计依据;②化学反应常伴有热效应,导致体系的温度变化,需确定为保持一定的反应温度所需的放热速率和传热速率;③通过能量衡算,分析工程设计和操作中热量利用是否经济合理,以提高热量利用水平;④确定泵、压缩机等输送机械和搅拌、过滤等操作机械所需功率。
在复合材料的工艺计算中,根据能量守恒原理:能量积累率=能量进入率一能量流出率+反应热生成率一反应热消耗率当过程没有化学反应时:能量积累率=能量进入率一能量流出率当过程没有化学反应,并处于稳态时:能量进入率=能量流出率复合材料生产一般在规定的压力、温度和时间等工艺条件下进行。
工艺设计第5章热量衡算
目录
• 热量衡算的基本概念 • 热量衡算的计算方法 • 热量衡算的应用 • 热量衡算的案例分析
01
热量衡算的基本概念
热量衡算的定义
热量衡算是工艺设计中对物料和能量 进行平衡计算的过程,旨在确定工艺 过程中所需热量和冷量,以及热量损 失和冷量损失。
它涉及到对工艺过程中各种物料和能 量的输入、输出、转换和利用进行详 细分析,以确保工艺过程的稳定、高 效和安全。
热量衡算的重要性
热量衡算是工艺设计中的重要环节,它有助于优化工艺过程,提高能源利用效率,降低能耗和减少环 境污染。
通过热量衡算,可以确定工艺过程中的热负荷和冷负荷,为设备的选型和工艺流程的优化提供依据, 同时也可以预测和控制工艺过程中的能源消耗和排放。
热量衡算的基本原理
热量衡算基于能量守恒定律,即能量不能凭空 产生或消失,只能从一种形式转化为另一种形 式。
计算热工设备的效率和能耗 时,需要了解设备的结构、 工作原理、操作参数等,以 便准确评估设备的性能和优 化设备的设计。
03
热量衡算的应用
工业过程的热量衡算
确定热量需求和供
应
通过热量衡算,可以计算出工业 过程中所需的热量和可用的热量, 确保生产过程的顺利进行。
提高能源利用效率
通过热量衡算,可以优化能源的 利用,减少能源浪费,提高能源 利用效率。
热力系统的故障诊断
通过热量衡算,可以检测热力系统的故障, 如泄漏、堵塞等,并及时进行修复。
热力设备的设计与优化
01
热力设备的选型
通过热量衡算,可以确定热力设 备的型号和规格,以满足生产过 程的需求。
02
热力设备的优化设 计
通过热量衡算,可以优化热力设 备的设计,提高设备的能源利用 效率和可靠性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.收集设计基础数据和有关物化常数 5.选定计算基准
温度基准:一般采用0 ℃ 物料基准:同物料衡算
(1)、单位时间产品量或原料量为基准。(连续生产) (2)、单位重量、体积、摩尔数的产品或原料为计算基准。(间歇生产) (3)、以加入设备的一批物料量为计算基准。(间歇生产)
第二节
热量平衡计算
二、计算实例
30000t/a啤酒厂糖化车间热量衡算
第二节
热量平衡计算
二、计算实例
1.流程示意图
第二节
热量平衡计算
一、热量衡算的依据、意义、方法和步骤
(三)、热量平衡计算的方法和步骤
1. 弄清题意和计算目的 2. 绘出单元设备物料流程示意图
标出主物料、并标出各种参数(流量、组成、温度、压力、pH值等)
3. 写出热量衡算方程式
Q = Q + Q
入 出
损
第二节
热量平衡计算
一、热量衡算的依据、意义、方法和步骤
第二节
热量平衡计算
一、热量衡算的依据、意义、方法和步骤
(三)、热量平衡计算的方法和步骤
6. 热量衡算
(1)、显热计算 (2)、过程热效应计算(生物合成热、搅拌热、状态热) (3)、加热设备耗热 (4)、气体或蒸汽带出热 (5)、设备散热 (6)、加热物料需要热量 (7)、加热介质传入的热量
注意事项:P69
第五章 工艺计算
第二节
热量平衡计算
第二节
热量平衡计算
一、热量衡算的依据、意义、方法和步骤
(一)、热量ቤተ መጻሕፍቲ ባይዱ衡计算的依据
能量守恒定律
第二节
热量平衡计算
一、热量衡算的依据、意义、方法和步骤
(二)、热量平衡计算的意义
1、得到耗能指标,比较设计方案,对比先进水平,寻找 存在的问题; 2、设备选型,确定尺寸的主要依据; 3、有利于组织管理,技术革新,降低能耗。
