AFLP分子标记技术及其应用2
AFLP分子标记的发展及应用

收稿 日期:0 0一 l 1 2 1 O -5 作者简介 : 静( 99 ) 女, 刘 1 一 , 硕士, 师。E— a :u r9 1 @13 CI 7 讲 m i l j ̄ 7 2 6 .O l ii n
京林业大学学报 , 0 0 2 ( ) 7 — 3 20 ,2 6 :9 8 .
[] 李 6
1 AL F P标记 的基本 原 理 、 操作 流程 及 技
术 关键
1 1 A IP 记的原 理 . FJ 标
AL F P标记 的原理是对基 因组 总 D A 酶切 N
后 经 P R进行选 择性扩 增 。先将 基 因组 D A用 c N 两 种限制 性 内切 酶 酶 切成 大 小 不 等 的 片段 , 与 并
不断改进和优化 , 由此衍生出多种相关技术 , 并 使其 在遗传多样 性、 种质 鉴定 、 遗传图谱构 建 、 因定位 等研 基 究 中得到广泛的应用。本文 即对 A L FP的原理、 衍生技术及其应用等进行了介绍 。
关键词 : 分子标记技术 ; F P 应用 AL ; 中图分类号 : 53 Q 0 文献标识号 : A 文章编号 :0 1 44 (00 0 - 0 0 0 10 - 9 2 2 1 ) 5 0 1 - 5
为第 二代分子标 记技术 , 是在 随机 扩增 多态性 ( a dm mpie oy op i D A,R P R n o A l dP l rh N i f m c A D)和
限制 性 片 段 长 度 多 态 性 ( etco r m n R sii Fa et r tn g
nt Pl o hs R L )技术上发展起来的 gI o m r i I y p m, F P D A多态性检测技术 , N 同时拥有 R L F P的高重复 性和 R P A D简便快捷的特点。同其他 以 P R为 C 基础 的标 记 技 术 相 比 , F P 技术 能 同 时 检 测 到 AL 大量 的位 点 和多态性 标记 , 具有覆 盖面广 、 高保 真 性、 高效性、 高分辨率、 N D A用量少、 事先勿需 知 道序列任何信息、 可在全基因组产生标记、 标记的 分离遵循孟德 尔遗传 规律等优点 , 19 自 95年 由 Zba V s aeu和 ou 创建以来 , 已在动物、 植物和微生
AFLP 技术的基本原理
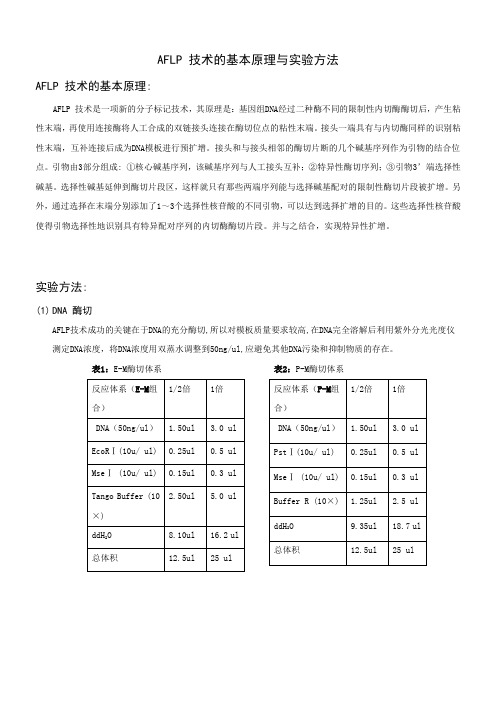
AFLP 技术的基本原理与实验方法AFLP 技术的基本原理:AFLP 技术是一项新的分子标记技术,其原理是:基因组DNA经过二种酶不同的限制性内切酶酶切后,产生粘性末端,再使用连接酶将人工合成的双链接头连接在酶切位点的粘性末端。
接头一端具有与内切酶同样的识别粘性末端,互补连接后成为DNA模板进行预扩增。
接头和与接头相邻的酶切片断的几个碱基序列作为引物的结合位点。
引物由3部分组成: ①核心碱基序列,该碱基序列与人工接头互补;②特异性酶切序列;③引物3’端选择性碱基。
选择性碱基延伸到酶切片段区,这样就只有那些两端序列能与选择碱基配对的限制性酶切片段被扩增。
另外,通过选择在末端分别添加了1~3个选择性核苷酸的不同引物,可以达到选择扩增的目的。
这些选择性核苷酸使得引物选择性地识别具有特异配对序列的内切酶酶切片段。
并与之结合,实现特异性扩增。
实验方法:(1)DNA 酶切AFLP技术成功的关键在于DNA的充分酶切,所以对模板质量要求较高,在DNA完全溶解后利用紫外分光光度仪测定DNA浓度,将DNA浓度用双蒸水调整到50ng/ul,应避免其他DNA污染和抑制物质的存在。
表1:E-M酶切体系表2:P-M酶切体系表3:P-T酶切体系表4:E-T酶切体系表5:M-S酶切体系表6:T-S酶切体系※先将模板吸入PCR板中,再将内切酶、Buffer、双蒸水配制为Mix(因内切酶用量很少或者因少数枪头质量问题,每次吸取内切酶时一定要注意观察吸取是否足量),将配制好的Mix 加入到模板中,最后在配好的反应体系中加入矿物油覆盖离心,放入PCR仪或水浴锅中37℃条件下5-6小时,然后立即转入65℃条件下1小时完全酶切。
一般做1/2倍体系即可。
目前本实验室拥有的内切酶有:EcoRⅠ;MseⅠ;PstⅠ;TaqⅠ;SacⅠ,以上内切酶均为Fermentas 公司生产。
(2)连接表8:连接体系※在连接的过程中不同的内切酶都有其对应的接头(表7),不同的酶切组合就用相应的接头组合。
AFLP分子标记技术在浙蒲2号种子纯度快速鉴定中的应用

Z e u N . a s bi e y a ay i o e y r e e ai h p o 2 w se t l h d b n ls ft i h b d g n r t n,p rnsa d a b e dn ieJ 9 a s s hr i o a e t n r e ig l 0 9.T o p i fp i r n w ar o r s me
《 植物 新 品种 保护 条 例》 有 关 育 种者 权 利 保 护 等 法规 的 颁 布 实施 , 保 护 品种 选 育 者 的 知识 产 为 权 , 少假 劣种 子 对农 户造 成 损失 , 用 分 子 标 减 应 记技 术进行 品种 真 实性 快 速 鉴定 技术 正 备 受 关
注 J 】 。在 众 多 的 D A分 子标 记 中 由于 R P N AD 技术 提供 的信 息 不够 全 面 , 复性 差 , 般 为 显 重 一
王玲 平 , 丹 丽 , 晓花 , 宝根 , 国景 戴 吴 汪 李
( 浙江省农业科学院 蔬菜研究所 , 浙江 杭州 302 ) 10 1
摘
要: 以瓠瓜杂种一代浙蒲 2号及其父 、 母本和品系 J9 O9为材料 , 建立 了利用 A L F P分子标记技术进行瓠瓜
杂种纯度鉴定技术体系 。从 6 引物组 合 中筛选 出了两对 稳定 扩增 、 4对 多态 性好 、 分辨 率高 的引物 组合 E . A C M C A和 EA C M— I 可有效区分父 、 和杂种一代 , C / —T — C J CT, 母本 适宜用 于浙蒲 2 号种子纯度快速鉴定。
统的依据 形 态学 进 行 品种 纯 度鉴 定 大 多依 靠 田 间种植 , 鉴定所需 时 间长 、 率低 , 效 常不能 满足 种
常用分子标记技术原理及应用

单链制备
通过加热或化学方法 将双链DNA变性为 单链。
凝胶电泳
将单链DNA在聚丙 烯酰胺凝胶上进行电 泳,并观察迁移率变 化。
结果分析
通过比较正常和突变 DNA的迁移率,确 定是否存在基因突变。
应用实例
遗传病诊断
SSCP技术可用于检测与遗传病相关的 基因突变,如囊性纤维化、镰状细胞 贫血等。
肿瘤研究
特点
高分辨率、高灵敏度、可重复性和可 靠性,能够检测出微小的基因组差异 ,广泛应用于遗传育种、生物多样性 保护、人类医学等领域。
分子标记技术的应用领域
遗传育种
通过分子标记技术对动植物进行遗传资源鉴定、品种纯度 鉴定、遗传连锁分析和基因定位等,提高育种效率和品质。
生物多样性保护
利用分子标记技术对物种进行遗传结构和亲缘关系分析, 评估物种的遗传多样性和濒危程度,为保护生物多样性提 供科学依据。
人类医学
分子标记技术在人类医学中用于疾病诊断、药物研发、个 体化医疗等方面,有助于提高疾病的预防、诊断和治疗水 平。
常用分子标记技术简介
RFLP(限制性片段长度多态性)
SSR(简单序列重复)
利用限制性内切酶对DNA进行切割,产生 不同长度的片段,通过电泳和染色检测多 态性。
利用串联重复的DNA序列多态性进行标记 ,通过PCR扩增和电泳检测多态性。
分子标记辅助育种
利用AFLP技术标记控制重要性状 的基因,辅助育种者快速筛选具 有优良性状的个体。
植物分子生态学研
究
利用AFLP技术分析植物种群遗传 结构、物种演化和生态适应性等 方面的研究。
04
SSR技术
原理
简单序列重复标记(SSR)是一种基于PCR的分子标记技 术,利用微卫星序列的重复单元进行扩增,通过检测等位 基因的长度多态性来识别基因组中的变异。
分子标记方法

分子标记方法:AFLP原理和操作步骤AFLP原理:AFLP也是通过限制性内切酶片段的不同长度检测DNA多态性的一种DNA分子标记技术。
但AFLP是通过PCR反应先把酶切片段扩增,然后把扩增的酶切片段在高分辨率的顺序分析胶上进行电泳,多态性即以扩增片段的长度不同被检测出来。
实验中酶切片段首先与含有与其共同粘末端的人工接头连接,连接后的粘末端顺序和接头顺序就作为以后PCR反应的引物结合位点。
实验中,根据需要通过选择在末端上分别填加了1~3个选择性核苷的不同引物,可以达到选择性扩增的目的。
这些选择性核苷酸使得引物能选择性地识别具有特异配对顺序的内切酶片段,进行结合,导致特异性扩增。
实验试剂Taq酶、EcoRI/ MseIEcoRI/ MseI接头、E+A引物M+C引物、T4DNALigaseE和M引物、琼脂、过硫酸胺、丙烯酰胺、尿素、硝酸银、甲酰胺、dNTPs、二甲苯青、冰醋酸、玻璃硅烷、50bpMark操作步骤(一)基因组DNA提取和纯化参考大量提取DNA实验方法提取基因组DNA。
DNA的纯化:用0.8%琼脂糖凝胶(含EB0.5μg/ml)电泳检测片段大小,取出其中的1/3已提取的基因组DNA进行纯化,首先用TE缓冲液补满至总体积50ul,再等体积苯酚/氯仿/异戊醇(25:24:1)、氯仿/异戊醇(24∶1)各抽提一次,离心吸上清液于Eppendorf 管中,加入1/10体积的NaAC和二倍体积预冷的无水乙醇,-20℃放置2h以上,10000g 离心10min,用70%的乙醇漂洗DNA沉淀2次,风干后溶于30μlTE缓冲液中,UV-2401PC 紫外分光光度计检测A260、A280值并定量,再用0.8%琼脂糖凝胶(含EB0.5μg/ml)电泳检测片段大小。
注:0.1-0.2g组织可用100ul溶液E溶,0.5g组织,溶液E可增加至300ul,此时DNA 浓度大约为100ng/ul。
(二)限制性酶切及连接在0.2ml离心管中加入:模板量约为250ng,2.5μl 10×酶切缓冲液,2.5μl 10×T4DNA 连接酶切缓冲液,5U EcoRⅠ,5U MseⅠ,2U T4连接酶,50pmol MseⅠ接头,双蒸水补至25μl。
AFLP的原理及其应用

基础理论 Basic researchA FLP的原理及其应用王 斌 翁曼丽(中国科学院遗传研究所 100101)提 要:AFLP是检测DNA多态性的一种新的分子标记技术。
对其起源、基本原理、技术程序和应用范围及前景进行了介绍和描述。
关键词:分子标记技术 AFLP 原理 应用1 分子标记技术的快速发展在过去10a中,分子标记技术得到了突飞猛进的发展,至今已有10余种分子标记技术相继出现,并在各个研究领域得到了应用。
其中在植物分子生物学领域中应用最广泛的是RF LP和RA PD。
R FL P 的结果稳定可靠,重复性好,特别适应于建立连锁图,例如水稻RF LP连锁图的建立〔1,2〕。
RF L P比较作图进一步揭示了在主要粮食作物中,R FL P标记在染色体上的排列具有类似的顺序〔3,4〕。
因此R FL P 自出现至今虽然已有10多a了,但它仍是当今应用最广泛的一种分子标记。
然而,R FL P必须经过滤膜转移和So uthern杂交,费时、费力、周期长。
另外, RF L P对DN A多态性检出的灵敏度不高,RF L P连锁图上还有很多大的空间区,这限制了它的进一步发展。
PCR对分子标记技术的发展产生了巨大的推动作用,迄今所用的分子标记技术尽管可以分为多种类型,其实除了以传统的Souther n杂交为基础的RF L P外,其它各类分子标记都涉及P CR。
R AP D就是以随机引物为模板通过P CR扩增进行DN A多态性研究的,与RF LP相比,它较便宜,方便易行,非常灵敏,DN A用量少,而且不需要同位素,安全性好。
继RF L P之后,RA PD是应用最广泛的,特别是在寻找与目的基因连锁的分子标记方面,近年来报道了大量的与各种目的基因连锁的R AP D标记。
近来西红柿P to基因和水稻Xa21基因的成功分离就是首先找到了与目的基因紧密连锁的RA PD标记,然后通过M BC(M ap based clo ning)方法克隆了目的基因〔5,6〕。
AFLP分子标记技术及其在药用植物研究中的应用
[] 晓 慧 , . 6 2谢 等 5 6咧 临床 药 物 咨 询 刚 顾 性 分 析 中 阑 药 房 .0 1 20 ,
1 ( ): 3 ~ 4 9 2 7 4 8 3
终 得 到 各 方 的 支 持 和 院方 的 资助 . 物 咨 询服 务 一 定 会 更 好 药
的 为 广大 患 者 服 务 。
2 Te c ig Ho pt lo h n o g U nv r i fTCM , in n 2 0 1 ) . a h n s ia fS a d n i e st o y J a 5 0 1
ABS TRACT : OBJ ECTI VE
A m p iid fa lfe r gm e tl n h p l m or s ( FIP) i e molc a a k r t c i e i e n e gt o y phim A s a n w e ulrm r e e hnqu nv n—
( 东中 医 药 大 学 , 东 济 南 20 5 ;.山 东省农 科 院 作物 所 , 东 济 南 2 0 0 ;.山 东 中 医药 大 学 附属 医院 , 东 济 南 2 0 1 ) 山 山 5351 山 5 10 2 山 50 1
摘 要 : 增 片段 长度 多 态性 ( mpi e rg n L n t oy o p i A L ) 一 种 在 P R技 术 和 R L 扩 A l i F a me t e gh P lm r hs fd m, F P 是 C F P标 记 技 术 基 础 上 发 明 的新 的分 子 标 记技 术 。本 文 简述 了 A L F P分 子 标记 技 术 的原 理 和 特 点 , 述 了其 在 药 用植 物 遗 传 连 锁 图 谱 的 构 建 综 遗 传 多样 性 研 究 、 质 资源 鉴 定 等 方 面 的 应 用 情 况 , 对 其 发 展 前 景进 行 了展 望 。 种 并
分子标记――AFLP原理和操作步骤
分子标记――AFLP原理和操作步骤一、原理AFLP也是通过限制性内切酶片段的不同长度检测DNA多态性的一种DNA 分子标记技术。
但AFLP是通过PCR反应先把酶切片段扩增,然后把扩增的酶切片段在高分辨率的顺序分析胶上进行电泳,多态性即以扩增片段的长度不同被检测出来。
实验中酶切片段首先与含有与其共同粘末端的人工接头连接,连接后的粘末端顺序和接头顺序就作为以后PCR反应的引物结合位点。
实验中,根据需要通过选择在末端上分别填加了1~3个选择性核苷的不同引物,可以达到选择性扩增的目的。
这些选择性核苷酸使得引物能选择性地识别具有特异配对顺序的内切酶片段,进行结合,导致特异性扩增。
二、实验试剂Taq酶 EcoRI/ MseIEcoRI/ MseI接头 E+A引物M+C引物T4DNALigaseE和M引物琼脂过硫酸胺丙烯酰胺尿素硝酸银甲酰胺 dNTPs 二甲苯青冰醋酸玻璃硅烷50bpMark三、操作步骤(一)基因组DNA提取和纯化A 、参考实验一的大量提取DNA实验方法,B、DNA的纯化:用0.8%琼脂糖凝胶(含EB0.5µg/ml)电泳检测片段大小,取出其中的1/3已提取的基因组DNA进行纯化,首先用TE缓冲液补满至总体积50ul,再等体积苯酚/氯仿/异戊醇(25:24:1)、氯仿/异戊醇(24∶1)各抽提一次, 离心吸上清液于Eppendorf管中,加入1/1 0体积的NaAC和二倍体积预冷的无水乙醇,-20℃放置2h以上,10000g 离心10min,用70%的乙醇漂洗DNA沉淀2次 ,风干后溶于30μlTE缓冲液中,UV-2401PC(岛津)紫外分光光度计检测A260、A280值并定量,再用0.8%琼脂糖凝胶(含EB0.5µg/ml)电泳检测片段大小。
注:0.1-0.2g组织可用100ul溶液E溶,0.5g组织,溶液E可增加至300u l,此时DNA浓度大约为100ng/ul。
(二)限制性酶切及连接在0.2ml离心管中加入:模板量约为250ng,2.5μl 10×酶切缓冲液, 2. 5μl 10×T4DNA连接酶切缓冲液,5U EcoRⅠ, 5U MseⅠ,2U T4连接酶,50pmol MseⅠ接头(序列见表2),双蒸水补至25μl。
AFLP标记技术及其在猪遗传育种中的应用
畜牧兽医科技信息2007.0714作者简介:任斌(1981~),男,硕士研究生,研究方向:动物分子数量遗传育种。
E-mail:renbin2050@yahoo.com.cn%通讯作者:黄生强(1968~),男,副教授,硕士生导师.研究方向:分子遗传与动物育种。
E-mail:hsq321@sina.com前言扩增片段长度多态性(AmplifiedFragmentLengthPoly-morphism,AFLP)技术是由Zabeau等1992年发明的,并于1993年获得欧洲专利局专利。
它是在RFLP和RAPD结合的基础上发展起来的,克服了两者各自的缺点,而集中了二者的优点,它既有RFLP的可靠性,又有RAPD的方便性。
AFLP被认为是迄今为止最为有效的分子标记,不管基因组DNA有多么复杂,理论上讲,用AFLP方法都可以检测出它们的多态性。
它不仅具备了多态性丰富、共显性表达、不受环境影响、无复等位效应的特点,而且还具带纹丰富、用样量少、灵敏度高、快速高效的特殊优点。
一个0.5mgDNA样品,可做4000个反应,获得8万个标记,650万条带纹。
通过实验验证,AFLP被认为是一种理想的有效的分子标记,已用于基因鉴定!基因作图!基因表达等方面。
目前,不仅在水稻、小麦和棉花等主要农作物上得以应用,还在羊、猪和狗等动物遗传育种中得到广泛应用。
本文将主要对AFLP标记技术在猪遗传育种中的应用加以综述。
1AFLP的发生发展!基本原理及其技术流程1.1AFLP的发生发展AFLP(AmplifiedFragmentLengthPolymorphism)是1992年由荷兰科学家Zabeau和Vos发展起来的一种检测DNA多态性的新方法。
至今正式发表的关于AFLP的论文还不多,可实际上做这方面研究的人已很多。
首先在棉花,水稻等农作物的遗传育种等方面得以快速应用,粟米群等[6]应用AFLP标记鉴定小豆栽培型种质遗传多样性认为AFLP是一种可靠又理想的遗传标记方法。
分子标记——AFLP原理和操作步骤
分子标记——AFLP原理和操作步骤一、原理AFLP也是通过限制性内切酶片段的不同长度检测DNA多态性的一种DNA分子标记技术。
但AFLP是通过P CR反应先把酶切片段扩增,然后把扩增的酶切片段在高分辨率的顺序分析胶上进行电泳,多态性即以扩增片段的长度不同被检测出来。
实验中酶切片段首先与含有与其共同粘末端的人工接头连接,连接后的粘末端顺序和接头顺序就作为以后PCR反应的引物结合位点。
实验中,根据需要通过选择在末端上分别填加了1~3个选择性核苷的不同引物,可以达到选择性扩增的目的。
这些选择性核苷酸使得引物能选择性地识别具有特异配对顺序的内切酶片段,进行结合,导致特异性扩增。
二、实验试剂Taq酶、EcoRI/ MseIEcoRI/ MseI接头、E+A引物M+C引物、T4DNALigaseE和M引物、琼脂、过硫酸胺、丙烯酰胺、尿素、硝酸银、甲酰胺、dNTPs、二甲苯青、冰醋酸、玻璃硅烷、50bpMark三、操作步骤(一)基因组DNA提取和纯化A、参考实验一的大量提取DNA实验方法,B、DNA的纯化:用0.8%琼脂糖凝胶(含EB0.5μg/ml)电泳检测片段大小,取出其中的1/3已提取的基因组D NA进行纯化,首先用TE缓冲液补满至总体积50ul,再等体积苯酚/氯仿/异戊醇(25:24:1)、氯仿/异戊醇(2 4∶1)各抽提一次,离心吸上清液于Eppendorf管中,加入1/10体积的NaAC和二倍体积预冷的无水乙醇,-20℃放置2h以上,10000g离心10min,用70%的乙醇漂洗DNA沉淀2次,风干后溶于30μlTE缓冲液中,U V-2401PC(岛津)紫外分光光度计检测A260、A280值并定量,再用0.8%琼脂糖凝胶(含EB0.5μg/ml)电泳检测片段大小。
注:0.1-0.2g组织可用100ul溶液E溶,0.5g组织,溶液E可增加至300ul,此时DNA浓度大约为100ng/ul。
(二)限制性酶切及连接在0.2ml离心管中加入:模板量约为250ng,2.5μl 10×酶切缓冲液, 2.5μl 10×T4DNA连接酶切缓冲液,5U EcoRⅠ,5U MseⅠ,2U T4连接酶,50pmol MseⅠ接头(序列见表2),双蒸水补至25μl。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
涪陵师范学院生命科学系 主讲人:江 波
AFLP分子标记技术及其应用
? 一、什么叫AFLP ? ? 二、AFLP 的基本原理是什么? ? 三、AFLP 的实验过程怎样? ? 四、AFLP 的应用研究如何? ? 五、对AFLP 的评价
我们都知道世界是多姿多彩的,可以说是 五彩斑斓,花样百出,无奇不有!从生物
?AFLP (Amplified Fragment Length Polymorphism,
扩增片断长度多态性) ? 事实上,还有很多分子标记术像SSR、ISSR、
SRAP(相关序列扩增多态性)另外,还有现在号称 为第三代分子标记的SNP( 单核苷酸多态性) 等
AFLP 的基本原理
? 基因组DNA经两种限制性内切酶酶切,形成分子 量大小不等的随机限制性酶切片段,将特定的人 工合成的短的双链接头连在这些片段的两端,形 成一个带接头的特异片段,通过接头序列和PCR 引物3ˊ端选择性碱基的识别,对特异性片段进行 预扩增和选择性扩增。最后只有那些两端序列能 与选择性碱基配对的限制性酶切片段才能被扩增; 最后将选择性扩增产物在高分辨率的变性聚丙烯 酰胺凝胶上电泳,寻找多态性扩增片段。
叫做扩增片断长度多 h.所得数据可在实验室之间交
态性。
流和比较
分子标记的历史:
? 第一代分子标记技术 RFLP (Restriction Fragment Length Polymorphism,限制性片段长度多态性)
? 第二代分子标记技术 RAPD(Random Amplified Polymorphic DNA,随机扩增多态性DNA )
a.多态性高;
b.共显性遗传,在二倍体的生 物中能区分纯合与杂合状态;
? (3)生化标记
c.在基因组中频繁出现,甚至
? (4)分子标记
贯穿分布于整个基因组;
我们这里讲的AFLP d.选择中性;
就是一种分子标记技 e.容易获得;
术。它是Amplified f.容易操作,自动化程度高;
Fragment Length Polymorphism 的简写,g.重复性好;
? 两种都是去污剂,它们都能破坏细胞膜 使膜蛋白变性沉淀,故而使核酸释放出 来,另外,它还能保护DNA不受内源核 酸酶的降解。
酶切
? 为了使酶切片段大小分布均匀,一般采用两个限制性内 切酶,一个用 6个碱基识别位点的限制性内切酶 (常用 EcoRI,、PstI或SacI ),另一个用 4个碱基识别位点的限制 性内切酶(常用MseI 、TaqI) 。采用双酶切的主要原因有: (1)多切点酶产生较小的 DNA片段,而切数点较少的酶 能够减少扩增片段的数目,因为扩增片段主要是多切点 酶和切点数较少的酶组合产生的酶切片段,这样就可以 减少选择扩增时所需要的选择碱基数。 (2)双酶切可以进 行单链标记,从而防止形成双链造成的干扰。 (3)双酶切 可以对扩增片段数进行灵活调节。 (4)通过少数引物可产 生许多不同的引物组合,从而产生大量的不同的 AFLP 指纹。这样,经过酶切后就形成了三种类型的酶切片段, 如EcoRI/MseI 酶切形成EcoRI一EcoRI片段、EcoRI一 MseI片段、Mse工一MseI片段,由于 AFLP技术革新成 功的关键在于 DNA的充分酶切,所以对模板质量要求很 高,要注意避免其它 DNA污染和抑制物质存在。
PCR扩增(PCR AMPLIFIED )
? 应用与接头相识别的引物进行扩增。 AFLP引物由三部 分组成:( 1)5′端的与人工接头序列互补的核心序列 (core sequence) (2)限制性内切酶特定识别序列 (enzyme-specific sequence) (3)3′端的带有选择性碱基 的粘性末端 (selective extension) ,其中AFLP接头的设计 (包括核心序列和酶特定序列 )是关键之处,常用的多为 EcoRI和MseI接头,接头和与接头相邻的酶切片段的碱 基序列是引物的结合位点,合成的寡核苷酸接头经过 94℃变性, 37℃退火, 4℃保存备用;理论上每增加一 个选择性碱基,将只扩增限制性片段的 1/4,而在两个 引物上都有三个选择性碱基的情况下,则仅获得 1/4096 的片段;也就是说,只有那些两端序列能与选择碱基配 对的限制酶切片段被扩增。所以选择性碱基是选择用于 扩增的特定的限制性片段的一种精确而有效的方法;
?扩增产物凝胶电泳
应用放射自显影、银染、荧 光测序仪等方法显示结果,
?结果分析
通过Gene-Scan, Gel-Compare 等软件进行数据分析。
DNA的提取(SDS法和CTAB 法)
? SDS是Sodium dodecyl sulfate的缩写称为 十二烷基磺酸钠,
? CTAB是Cetyl trimethyl ammonium bromide的缩写十六烷基三甲基溴化氨,
连接
? 酶切后的DNA片段在T4 DNA连接酶作用 下与两种内切酶相应的特定接头相连接, 形成带接头的特异性片段。接头为双链, 由两部分组成,一部分是核心序列,一部 分是酶特定序列(能与酶切片段粘端互补), 通常在酶特定序列中变换了一个内切酶识 别位点的碱基,保证了连接片段不能再被 酶切。只有遵循“引物扩增原则”设计的 接头才能得到满意的扩增结果。
AFLP的实验流程
? 模板制备
?DNA的提取(SDS法和CTAB 法)
? 酶切 ?连接
扩增片段通常用变性聚丙烯酰胺凝 胶电泳,根据扩增片段大小范围选 择应用4% 一10% 的凝胶电泳。
?PCR扩增(PCR AMPLIFIED )
?预扩增(Pre-amplified)
?选择性扩增(Elective amplified)
学这个角度来看,这到底是什么原因呢?
主? 要生物是的因多为样生性物主具要有包多括四样个性层!次!即:?遗?
传多样性、物种多样性、生态系统多样 性和景观多样性。
? 而遗传多样性是其它多样性的基础,也 可以说,生物多样性归根到底就是遗传 多样性。
? 那么大家知不知道遗传多样性是如何检 测的呢?
? (1)形态学标记 ? (2)细胞学标记
