第十一章羧酸及其衍生物
有机化学 第11章 羧酸

C O C
2.两个羧基相隔2~3个碳原子的二元酸,不需要任 何脱水剂,加热就能脱水生成五元或六元环酐。
O H H C C C OH C OH O 150℃ H H C C O C O C O + H2 O
(三)酯的生成
酯化是可逆反应。为了提高酯的产率,通常采用加 过量的酸或醇。
§11-1 羧酸的分类和命名法
分子中含有羧基 一、分类
按照与羧基所连的烃基: (—COOH)的化合物。 脂肪酸和芳香酸。 通式:RCOOH和 按照分子中所含羧基数目: ArCOOH表示。
一元羧酸和多元羧酸。
二、命名
(一)脂肪酸
CH3 CH3CHCH2COOH 3-甲基丁酸 β-甲基丁酸
_ H3 O+
CH3(CH2)3CHCHO CH2CH3
KMnO4,OHH 2O
CH3(CH2)3CHCOO CH2CH3
CH3(CH2)3CHCOOH CH2CH3 (78%)
二、腈水解
HOCH2CH2Cl NaCN HOCH2CH2CN (1)OH-,H2O (2)H3O
+
HOCH2CH2COOH
α-C有强吸电子基时容易脱羧,二元羧酸也较容易 发生脱羧反应。芳基作为拉电子基,使芳酸的脱羧 比脂肪酸容易。
COOH O2N NO2 NO2 ~100℃ H2O O2N NO2 NO2 + CO2
五、烃基上的反应
(一)α-H卤化 羧基与羰基类似,能使α-H活化。但羧基的致活作 用比羰基小得多,必须在碘、硫或红磷等催化剂存 在下α-H才能被卤原子取代。
有机化学-羧酸及其衍生物

O CH3OC
O
H+
COCH3 + 2HOCH2CH2OH -2CH3OH
酯交换
O
O
O HOCH2CH2 OC
O
CH3OC
COCH3
COCH2CH2OH
HOCH2CH2OH
酯交换
O
O
C
C OCH2CH2O n n=80100
( 涤纶 )
16
4、酰胺的反应
酰胺的反应活性更小,需在酸或碱催化下长时间
加热回流才能水解
O
或 其它试剂
R CH
醛
水解反应 醇解反应 胺解反应
还原反应
11
1、酰氯的取代反应
H—OH O
R—C—Cl + H—OR'
H—NH2
O
R—C—OH O
HCl 水解
R—C—OR' + HCl 醇解
O
R—C—NH2 NH4Cl 氨解
(酰氯活性大是个优良的酰基化试剂)
O CH3CCl + CH3CH2CH2OH
RCH2
O CX
O
O
RCH2 C O C R
O RCH2 C OR'CH C
H
有弱酸性
可加成至 饱和
L
可被亲核 试剂取代
L: 离去基团 (Leaving group)
9
一、羧酸衍生物的取代反应
这类反应是羧酸衍生物与羧酸、以及羧酸衍生物 之间的相互转化。
O RCL
HOH
R C OH
RCOOH
OO
O
RC O C R HOR'
R C OR' RCOOH
《有机化学》第十一章 羧酸及其衍生物的结构与性质

第十一章羧酸及其衍生物的结构与性质引言羧基()是羧酸的官能团,是由羰基和羟基组成的。
由于羰基的碳氧双键与羟基氧原子的共轭效应的作用,使羟基中氧原子电子向羰基转移,羟基的氢易离解而显酸性。
羧基中羟基也能被其它基团取代生成羧酸衍生物。
羧基是吸电子基,α-H具有活性,可以被卤代。
此外羧酸还能被还原和发生脱羧反应。
这里所讨论的羧酸衍生物主要是指羧基中羟基被取代后生成的酰卤(),酸酐(),酯(),酰胺()以及由酰胺脱水后生成的产物腈()。
在羧酸衍生物中羰基与卤素,酰胺基,烷氧基和氨基相连,由于卤素,氧原子和氮原子的负电性以及孤对电子的作用,使羰基碳上正电性不同,因此它们发生亲核反应性质也有差别。
羧酸衍生物还能发生还原反应。
11.1 羧酸的酸性羧酸是弱酸,能与强碱反应生成盐:羧酸酸性的强弱与所连的基团有关,连吸电子基团的羧酸酸性较强,而连供电子基团的酸性相对较弱。
如下列化合物酸性强弱顺序为:11.2 羧酸衍生物的生成羧基中的羟基被卤素、酰胺基、烷氧基和氨基取代形成酰卤、酸酐、酯和酰胺等羧酸衍生物。
1、酰卤的形成羧酸与SO2Cl,PCl5,PCl3等氯化剂直接反应生成酰卤:因为POCl3沸点低易除去,此法可制备高沸点的酰氯。
H3PO3沸点高,可制备低沸点的酰氯。
该法产生的SO2,HCl易除去,因此生成的酰氯纯度高,后处理容易。
2、酸酐的形成羧酸在脱水剂(如乙酰氯、乙酸酐)存在下加热,失去一分子水而生成酸酐。
二元酸可以分子内脱水生成二酸酐:3、酯化反应羧酸和醇在催化剂(H2SO4、HCl或苯磺酸等)作用下回流生成酯:酯化反应由多种机理,在大多数情况下,是羧酸中羟基与醇中羟基氢结合生成水,表观上看是一种亲核取代反应,实际上是一个亲核加成-消除反应的机理:决定反应速度的一步是亲核加成,因此羧基中碳的正电性以及羧基所连的基团大小核亲核试剂R'OH中R'体积大小都影响反应的速度,下列羧酸与甲醇酯化反应的相对速度的快慢顺序为:4、形成酰胺的反应羧酸与氨立即反应生成盐,在加热条件下,脱水生成酰胺,生成酰胺的反应是可逆的,如果把生成的水从反应体系中除去,反应可趋于完全。
羧酸及其衍生物ppt课件

RCOOR"+ R'MgCl
RCOR' (fast)
RCOR'
(1) R'MgCl (2) H2O
R' R C OH R'
酸酐与Grignard 试剂的反应在低温下也可得到酮。
2.2.3 还原
催化氢化或用LiAlH4作还原剂,酰卤、酸酐、酯可被还原成醇,酰胺 则被还原成胺。 2.2.4 酯的缩合反应 • Claisen缩合:
2.2 化学性质 2.2.1 亲核取代反应 (水解、醇解、氨解等)
O R C
L
O O
+
Nu
R
C Nu
L
RCNu
+
L
反应活性: RCOCl > (RCO)2O > RCOOR’ > RCONH2 > RCONR’2
水解: RCOCl (RCO)2O RCOOR’ RCONH2 醇解: RCOCl (RCO)2O + R’OH RCOOR’ + HCl RCOOR’ + RCOOH + H2O RCOOH + HCl 2 RCOOH (加热) (催化) (催化、回流) RCOOH + R’OH RCOOH + NH3
一元羧酸:
HCOOH 甲酸
CH3COOH 乙酸
CH3CHCH2COOH
COOH
CH3C CH3
CHCOOH
Cl
3-甲基-2-丁烯酸
3-(对-氯苯基)丁酸
苯甲酸
二元羧酸:
COOH
CHCOOH
HOOCCOOH
第十一、十二章 羧酸及其衍生物
2. 溶解性(solubility) 低级羧酸与水混溶;高级羧酸不溶;一般二元和 多元酸易溶。
第18页,共109页。
羧酸的物理性质
3.熔点(melting point)
有一定规律,随着分子中碳原子数目的增加呈锯齿状的 变化。
乙酸熔点16.6℃,当室温低于此温度时,立即凝成冰状 结晶,故纯乙酸又称为冰醋酸。
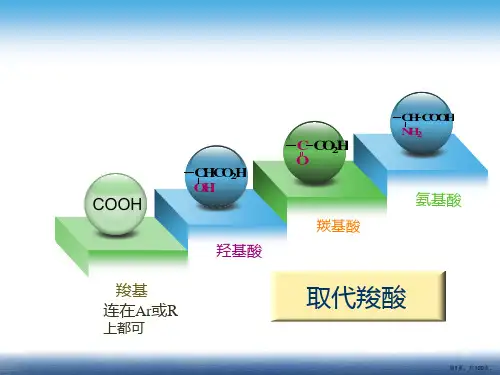
COOH
CHCO2H OH
羧基 连在Ar或R
上都可
羟基酸
C CO2H O
羰基酸
CH COOH NH2
氨基酸
取代羧酸
第1页,共109页。
羧酸分子中烃基上的氢被取代后的产物称取代羧酸。
R CH COOH X
R CH COOH OH
R C COOH O
R CH COOH NH2
取代羧酸
R
O
R
R C OH
R
R
O CX O C OCOR O C OR O C NH2
羧酸衍生物
第2页,共109页。
DHA怎么补?
DHA
DHA,二十二碳六烯酸(docosahexenoic acid ),俗称脑 黄金,是一种对人体非常重要的多不饱和脂肪酸,属于 Omega-3不饱和脂肪酸家族中的重要成员。DHA是神经系统
细胞生长及维持的一种主要元素,是大脑和视网膜的重要
136pm
O···· H
羰基和羟基通过 p-π共轭 构成一个整 体, 故羧基不是羰基和羟基的简单加合。
第15页,共109页。
123pm
127pm
R
136pm 游离羧酸分子中的 p-π 共轭
R
H
127pm 羧酸根负离子的 p-π 共轭
羧酸及其衍生物 ppt课件

K2SO4+2MnSO4+10CO2+ 8H2O
13.6.2 己二酸--合成纤维“尼龙-66”原料.
脱水脱羧 加热
O ‖
苯酚
环己醇
己二酸
ppt课件
环戊酮
33
环己烷
环己酮
◆二元酸加热后的变化规律----Blanc规则: 在可能成环时总是较易形成较稳定的五元或六元环状化合物。
HOOCCOOH HOOCCH2COOH
比较下列各组物质的酸性强弱:
①FCH2COOH; ClCH2COOH; BrCH2COOH; ICH2COOH;
CH3COOH
② HCOOH; CH3COOH; CH3CH2COOH; (CH3)3CCOOH
③ Cl3CCOOH; Cl2CHCOOH; ClCH2COOH
Cl Cl Cl ④ CH3CH2CHCOOH; CH3CHCH2COOH; CH2CH2CH2COOH; CH3CH2CHCOOH ⑤PhCOOH; CH3COOH; CH3CH2COOH
HCOOH
CO2 + H2
ppt课件 30
13.5.2 乙酸(醋酸) • 发酵法--食醋 • 工业制备(甲醇,乙醇,乙烯,乙炔或轻油氧化):
13.5.3 丙烯酸 丙烯酸的制备--丙烯气相氧化:
CH2=CH—CH3
O2,MoO3
280~360℃,0.2~0.3MPa
CH2=CH—COOH
• 丙烯酸具有羧酸和烯烃双重性质。双键易发生氧化
CH 2COOH
CH2COOH
CH=CHCOOH
苯乙酸
3-苯丙烯酸 (-苯丙烯酸,肉桂酸)
-萘乙酸
2. 羧基直接与苯环相连——苯甲酸作为母体, 环上其它基团作为取代基.
羧酸的衍生物
羧酸的衍生物
工业上,在合成纤维“涤纶”的生产中就利用了酯交换反应。 通过酯交换反应可以从廉价的低级醇来制备高级醇。例如: 酰胺的醇解反应是可逆的,需要过量的醇才能生成酯并释放出氨。
羧酸的衍生物
3. 溶解性
所有羧酸衍生物均能溶于乙醚、氯仿、丙酮、苯等有机 溶剂。酰卤和酸酐遇水就分解,酯在水中的溶解性很低,但 低级的酰胺(如N,N-二甲基甲酰胺)能与水混溶,是优良的 非质子极性溶剂。
部分羧酸衍生物的物理常数列于表11-4。
羧酸的衍生物
表11-4 部分羧酸衍生物的物理常数
羧酸的衍生物
羧酸的衍生物
(2)酸酐的命名
酸酐的名称是由两个羧酸的名称加上“酐”字来命名。相 同羧酸形成的酸酐称为单酐;不同羧酸形成的酸酐称为混酐。 混酐命名时,通常将简单的羧酸写在前面,复杂的羧酸写在 后面。例如:
羧酸的衍生物
(3)酯的命名
酯的名称是由相应的羧酸和醇中的烃基名称组合后加“酯” 字来命名的。例如:
羧酸的衍生物
4. 还原反应
(1)催化加氢
羧酸衍生物在催化加氢条件下都可以被还原,但一般具有制备意 义的是酰卤的选择性还原和酯的还原。
酰卤选择性加氢的催化体系是Pd/BaSO4-硫-喹啉(或硫脲),此 催化体系可使酰卤的加氢反应停止在生成醛的阶段,称为罗森门德 (Rosenmund)反应,这是一种制备醛的方法。
的杂原子(X、O、N)上都具有未共用电子对,它们所占据的p轨道
与羰基的π轨道形成p-π共轭体系,未共用电子对向羰基离域,使C-L
键具有部分双键的性质。因此,羧酸衍生物的C-L键较典型的单键C-L
有机化学羧酸及其衍生物PPT课件
脱羧反应
RCCOH
酸性
H
羧羟基被取代(加成.消除)的反应 (羧酸转化为其衍生物的反应)
α-H被取 代的反应
1、羧酸的酸性
RCO2H H2CO3
OH
ROH
pka ~5
6.4
10
16
RCO2H
RCOO- + H +
由于羧酸根负离子具有很好的稳定性而使羧羟基氢
易于离解使羧酸显酸性。
(1)取代基对羧酸酸性的影响
所以羧酸在水中的溶解度比相应的醇大。 甲酸、乙酸、丙酸、丁酸与水互溶。
而对于醇,从正丁醇起在水中的溶解度显著降低。
随着羧酸相对分子质量的增加,其疏水烃基的比例增大,在水
中的溶解度逐渐减小。
高级脂肪羧酸几乎不溶于水,而易溶于醇、醚等有机溶剂。
芳香羧酸在水中的溶解度都很小。
四、羧酸的化学性质
O
还原反应
丁二酸 (琥珀酸)
顺丁烯二酸(马来酸)
命名芳香族羧酸和脂环族羧酸时,通常将芳环或脂环作为脂肪族羧酸 的取代基来命名。
α-萘乙酸中的“α”是指萘环的α位,而不是乙酸的α-碳原子。
环戊基乙酸
邻苯二甲酸 α-萘乙酸
β-苯基丙烯酸 (肉桂酸)
命名下列化合物或写出结构式
(1)
CH2COOH (2)
COOH (3) CH CCH2COOH
3.54
2.74
c、诱导效应随着碳链的延长迅速减弱
O2NCH2COOH 1.08
CH3CH2CHCOOH Cl
pka 2.86
CH3CHCH2COOH Cl
4.05
CH2CH2CH2COOH Cl
4.52
15
有机化学羧酸及其衍生物讨论报告
一. 亲核加成消除反应机理 二.含活泼亚甲基化合物性质和应用
一. 亲核加成消除反应机理
• 羧酸中的羰基表现出与醛,酮中的羰基类似的反 应性;碳的亲核进攻和氢的亲电进攻。然而,羧 基结构中—OH基团的存在使得羧酸有着另一方面 的化学性质。如同在醇中一样,这个—OH可被转 变成离去基团。结果是,在羰基碳的亲核加成发 生后,离去基团离去,导致净的取代过程和新的 羰基化合物的生成。
二.含活泼亚甲基化合物性质和应用
1 . 什么是活泼亚甲基化合物
当一个饱和碳原子上连有硝基、羰基、氰基、酯基、苯基等吸电子基团时,与该碳 原子相连的氢原子就具有一定的酸性,也就是说这个碳原子被致活了,因此这类化合物 叫活泼亚甲基化合物。
2 . 常见的活泼亚甲基化合物
吸电子基及其活性次序 :活泼亚甲基化合物的酸性取 决于与之相连的吸电子集团的吸电效应。这种效应越强, 其a-氢的活性越高。 -NO2> -COR > -SO2R> -COOR> -CN > -C6H5> -CH=CH2
羰基碳受到亲核进攻
羰基碳是亲电性的,可能被亲核试剂进攻。在羧酸和羧酸衍生物(具有通式RCOL的底物,其 中L代表离去基团)中观察到了这类反应性。 羧酸衍生物 与醛和酮的加成产物不同,羧基碳上亲核进攻形成的中间体通过消除一个离去基团而分解。 总的结果是亲核剂通过所谓的加成消除过程而取代离去基团。在此转化中首先形成的物种含 有一个四面体的碳中心(与原料及产物不同),因此它被称为四面体中间体。羰基碳是亲电 性的,可能被亲核剂进攻。在羧酸和羧酸衍生物(具有通式RCOL的底物,其中L代表离去基团) 中观察到了这类反应性。 羧酸衍生物 与醛和酮的加成产物不同,羧基碳上亲核进攻形成的中间体通过消除一个离去基团而分解。 总的结果是亲核剂通过所谓的加成消除过程而取代离去基团。在此转化中首先形成的物种含 有一个四面体的碳中心(与原料及产物不同),因此它被称为四面体中间体。
《羧酸及其衍生物 》课件
沸点和熔点
羧酸通常具有较高的沸点和熔 点,这取决于分子间的氢键形 成。
酸性
羧酸在水中可与碱发生中和反 应,产生相应的盐。
羧酸的化学性质
酯化反应 氧化反应 酰化反应
羧酸与醇反应生成酯,常用于合成香料和涂料。
羧酸可以被氧化剂氧化为相应的醛、酮或羧酸。
羧酸与胺类化合物反应生成酰胺,常用于药物合 成。
羧酸衍生物的合成方法
农业工业
在食品工业中,羧酸及其盐被用作防腐剂和增味剂。
羧酸衍生物被广泛用于制备农药和肥料,以提高农 作物的产量和质量。
结论和总结
通过本课件,我们了解了羧酸及其衍生物的基本概念、结构与分类、物理性质、化学性质、合成方法以及应用 领域。希望这些内容对大家的学习和工作有所帮助。
1
卤代羧酸
通过将羧酸与卤化物反应,生成相应的卤代羧酸。
2
酸酐
通过羧酸与酸性还原剂反应,生成相应的酸酐。
3
酯化反应
通过羧酸与醇反应,生成相应的酯。
羧酸及其衍生物的应用领域
化学工业
羧酸及其衍生物广泛用于制备染料、塑料和涂料等 化学产品。
制药工业
羧酸衍生物被广泛应用于药物合成和药物交付系统 的设计。
食品工业
《羧酸及其衍生物》PPT 课件
本课件将介绍羧酸及其衍生物的基本概念、结构与分类、物理性质、化学性 质、合成方法以及应用领域,旨在通过生动的内容让大家更好地理解羧酸及 其衍生物。
羧酸的基本概念
羧酸是一类分子中含有羧基(-COOH)的有机化合物,具有酸性。它们在许多生物和化学过程中起着重要的作 用。
羧酸的结构与分类
脂肪酸
由长链烃基与羧基组成,常见于天然油脂和脂 肪中。
羧酸盐
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章羧酸及其衍生物【教学重点】羧酸及其衍生物的化学性质、丙二酸二乙酯和乙酰乙酸乙酯在合成上的应用。
【教学难点】诱导效应、酰基上的亲核取代反应机理。
【教学基本内容】羧酸的结构;羧酸的制备方法;羧酸及其衍生物的物理性质;羧酸的化学性质——羧酸的酸性及影响酸性强度的因素(诱导效应、共轭效应和场效应);羧酸衍生物的生成;羧基的还原反应;脱羧反应;α-氢原子的卤代反应。
羟基酸的制备方法(卤代酸水解、羟基腈水解、Refomatsky反应)、羟基酸的化学性质——酸性、脱水反应、α-羟基酸的分解。
羧酸衍生物的化学性质——酰基上的亲核取代反应(水解、醇解、氨解)及其反应机理;还原反应;与Grignard反应;酰胺氮原子上的反应(酰胺的酸碱性、脱水反应、Hofmann降解反应)。
乙酰乙酸乙酯的制备方法(Claisen酯缩合);乙酰乙酸乙酯的化学性质——酮式-烯醇式互变异构、酸式分解和酮式分解;乙酰乙酸乙酯在合成上的应用。
丙二酸二乙酯的制备及在合成上的应用。
Ⅰ目的要求羧酸是含有羧基(—COOH)的含氧有机化合物,我们平常所说的有机酸就是指的这类化合物。
所谓羧酸衍生物,包括的化合物种类很多,诸如羧酸盐类、酰卤类、酯类(包括内酯、交酯、聚酯等)、酸酐类、酰胺类(包括酰亚胺、内酰胺)等都是羧酸衍生物,有人甚至把腈类也包括在羧酸衍生物的范围之内。
其实,比较常见的而又比较重要的是酰卤、酸酐、酯和酰胺这四类化合物。
羧酸盐与一般无机酸盐在键价类型上没大区别,不作专门介绍。
至于腈类,将放在含氮化合物中加以介绍。
这四类化合物都是羧酸分子中,因酰基转移而产生的衍生物,所以又叫羧酸的酰基衍生物。
羧酸及其衍生物RCOL(L:-OH、-X、-OOCR′、-OR′、-NH2)在许多重要天然产物的构成以及在生物代谢过程中均占有重要地位。
本章将以饱和一元脂肪酸为重点,讨论羧酸及其衍生物的结构和性质。
鉴于乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的重要地位,本章作概括介绍。
希望学生在此基础上,探讨设计合成路线的一般方法。
本章学习的具体要求1、掌握羧酸的结构与性质之间的关系。
2、掌握羧酸衍生物的主要化学性质。
3、了解羧酸衍生物的亲核取代反应机理。
4、掌握羧酸与羧酸衍生物之间相互转变条件。
5、了解卤代酸、羟基酸的特性。
6、掌握乙酰乙酸乙酯和丙二酸二乙酯的制法、性质和在有机合成上的应用。
这也是本章的重点之一。
Ⅱ教学内容(一)羧酸一、概述羧酸往往有俗名,希望学生有所了解,尽可能记忆一些,脂肪酸的系统命名原则和醛相同。
芳香酸命名是把芳环视作取代基。
羧酸的沸点比分子量相近的其它有机物高,这是由于羧酸能以氢键缔合。
同时,即使在气态时,羧酸也是双分子缔合的,所以羧酸的沸点比分子量相近的醇还要高。
二、羧酸结构和化学性质1、酸性应用:①鉴别:与酚不同,与非酸性物质不同。
②分离提纯。
取代脂肪酸:Cl 2CH -COOH >ClCH 2-COOHCH 3CH(Cl)-COOH >ClCH 2CH 2-COOH ; FCH 2-COOH >ClCH 2-COOH H -COOH >CH 3-COOHHOOC -COOH >H -COOH >OOC -COOH取代芳酸:CH 3-CH -CH 2-COOHOHγ βα4 3 2 1α-H H + + R -C O O ‥ R -C OO‥R -C O O -H ‥ R -C O -Na ‥ R -C O O -H ‥ NaOH/Na 2CO 3/ NaHCO 3 H + H 2O + G GR -COOH >R -COOH >R -COOHCOOH > > > > > COOH NO 2COOH NO 2 NO 2 >2、羧基中羟基的置换反应(S N )酯化反应3、还原反应4、脱羧反应CH 3COONa + NaOH CH 4 + Na 2CO 3(CH 3COO)2Ca CH 3COCH 3 + CaCO 32RCOOH RCOR + CO 2 + H 2O取代芳酸,特别是邻对位有给电子基团存在或邻位有大的立体位阻基团存在时,易脱羧或羧基重排β位有双键时,也易脱羧。
因脱羧反应经过一个六元环过渡态,所以不能形成烯醇双键的β-羰基羧酸不能脱羧。
β,γ-双键脱羧后重排到α,β-位之间 R -CH 2CH =CHR ′O R -C -OH + Nu -E OR -C -Cl O R -C -NuPX 3,PX 5,SOCl 2 OR -C -OH O R -C -NH 2(NH 2R,NHR 2) O R --O --R OR -C -OH O Nu OR -C -OR ′ R ′OH NH 3(NH 2R,NHR 2) O R -C -O -H +10,20醇 酰氧键断裂OR -C -O -H + HO -CR 3 烷氧键断裂OR -C - (C =C ,C ≡C 不还原) -CH 2-OH CaO△△ThO 2 400-500℃O CH 2=CH -CH --OH (α-C 上连有重键时易脱羧) O HO --CH --OH (α-C 上连有强吸电子基时易脱羧)(NO 2,X,CO,CN 等) OCOOH R R R R R R △ OH COOK OHCOOK△ R =NO 2 NH 2HO O COOHOH O R R ′H O -CO 2△ × O R --CH 2R ′5、α-H 取代反应(Hell-V olhard-Zelins 反应)R -R -CHCOOH R -CHCOOH R -CHCOOH R -CH =CHCOOHR -CHCOOH R -C -COOH6、二元酸受热反应失羧 HOOC -COOH CO 2 + HCOOHHOOC -CH 2-COOH CO 2 + CH 3COOH失水(相应的铵盐受热300°C 发生分子内失水脱氨,生成五元或六元环状酰亚胺)失羧失水含八个碳原子以上的脂肪族二元羧酸在加热的情况下,得到的是分子间失水而成的酸酐。
取代二元酸和芳香二元酸也能进行上述反应。
7、羟基酸的受热反应α-: (交酯)β-:R -CH -CH 2-COOH R -CH =CH -COOHγ-:R -CH -CH 2CH 2-COOH (γ-内酯)δ-:R -CH -CH 2CH 2-COOH (δ-内酯)δ以远:nHO -(CH 2)m -COOH [-O -(CH 2)m -C -]n (聚酯) 大环内酯用作香料及合成(自学) 羟基酸遇氧化剂则分解脱羧。
Br 2 Br 2NH 2CN OH [O ] H + COOH O 160-180℃ 140-160℃C C O + H 2OOOC C O + H 2OOCH 2-COOH2-COOH 300℃ CH 2-COOH CH 2-COOH CH 2 CH 2-CH 2-COOH2-CH 2-COOHCH 2-CH 2-COOH CH 2-CH 2-COOHCH 2 300℃ 300℃ BaO =O =OR -CH -C CH -R O C -O HO -C CH -R OH -O R -CH C -OH O -H △△△CH 2-CH 2R -CH -COO △CH 2-CH 2R -CH -CCH 2 O O -nH 2OO三、羧酸制法1、有机物氧化 ⑴烃氧化⑵伯醇或醛氧化 2、水解反应⑴R -CN R -COOH⑵油脂 R -COOH + 甘油⑶3、R -MgX + CO 2 R -COOH4、酚酸合成5、三乙合成法6、丙二酸酯合成法四、重要羧酸1、甲酸甲酸是脂肪酸中唯一在羧基上连有氢原子的酸。
这个氢原子可以被氧化为羟基,因此甲酸为同系列中唯一有还原性的酸,它可以还原斐林试剂及托伦试剂。
2、草酸有还原性,使KMnO 4褪色。
3、苯二甲酸、邻苯二甲酸用于制造染料、树脂、药物和增塑剂等。
如邻苯二甲酸二丁酯和邻苯二甲酸二辛酯是常用的人造革及聚氯乙烯等的增塑剂。
对苯二甲酸是制造涤纶的主要原料之一。
4、 乳酸、柠檬酸、草酸均可以由淀粉制造。
它们在工业上广泛应用。
(二)羧酸衍生物一、概述(L :-OH 、-X 、-OOCR ′、-OR ′、-NH 2) 由分子量不太大的酸和醇形成的酯大多数具有好闻的水果香味。
酰氯、酸酐和酯由于失去酸性氢原子,因而分子间没有缔合作用;酰胺则由于分子间能通过氨基上的氢原子形成分子间氢键,因而可以缔合,所以沸点高。
酰胺一般多为固体,只有氨基上的氢原子被羟基取代的酰胺,由于失去缔合作用而为液体。
二、化学性质H 3+OH 2O高温,高压CCl 3 CH 3 COOHCl 2 光 H 2O,ZnCl 2 108-115℃ H 2OOR -C -L C α-H 反应三、β-二羧基化合物1、乙酰乙酸乙酯 ⑴制备 ⑵性质 ① ②互变异构 加HCN,NaHSO 3 Br 2/C 2H 5OH 褪色 H 2N -OH,C 6H 5-NH -NH 2 Na H 2↑ ……… FeCl 3 显色 被NaBH 4还原③分解反应(A)酮式分解(成酮分解) (B)酸式分解(成酸分解)⑶应用 合成酮类、酸、酮酸。
2、 丙二酸二乙酯 ⑴制备: ⑵性质:⑶应用: 合成羧酸(见补充说明) 3、活泼亚甲基化合物的其它反应 ⑴Knoevenagel 反应 ⑵Stobbe 反应 ⑶Michael 反应Ⅲ 补充说明一、羧酸及其衍生物的分析方法羧酸可根据其酸性来识别,能溶于NaOH 和NaHCO 3的水溶液,和NaHCO 3反应时,C 2H 5ONa△2CH 3COOC 2H 5 O OCH 3-C -CH 2-C -OC 2H 5O O3--CH --OC 2H 5 Na⊕ O CH 3-C =CH --OC 2H 5O -H ①氢键②共轭稳定 OCH 3--OHCl 2,PCH 2-COOH Cl NaOH CH 2-COONa Cl NaCN CH 2-COOH CNCOOC 2H 5 COOC 2H 5 CH 2 2CH 3CH 2OH,H 2SO 4(水解,酯化同时进行) COOC 2H 5 COOC 2H 5 CH 2 C 2H 5ONaCOOC 2H 5 COOC 2H 5 CHNa ⊕ H +,H 2O COOC 2H 5 COOC 2H 5 CH 2 COOH COOH CH 2△ CH 3COOH + CO 2 + H 2O O O --CH 2--、NC -CH 2-CN 、CH 3C -CH 2-CN 、O 2N -CH 2-CN 、O 2N -CH 2-NO 2等O1,4共轭加成①H 3+O α,β不饱和羰基化合物 + 活泼亚甲基化合物 ②△,H 2ONaOHα,β-不饱和羰基 (腈基,硝基)化合物物(醛、酮、腈、酯、酰胺、硝基化合物)物 1,5-二羰基化合物C 2H 5ONa ,季铵碱N有CO 2放出。
