11 第十一章 羧酸及其衍生物
11._羧酸及其衍生物
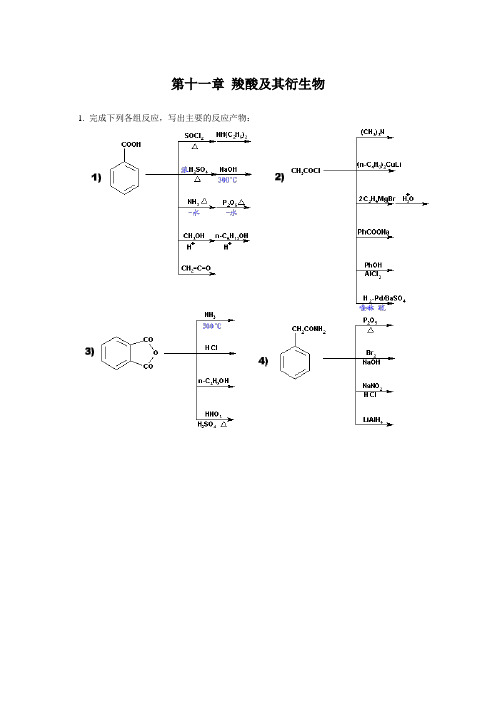
第十一章羧酸及其衍生物1. 完成下列各组反应,写出主要的反应产物:2. 写出下列反应的主产物:3. 两个什么样的化合物缩合后再酸化会得到下列各产物?4. 给下列反应式填入适当的试剂:5. 回答下列问题:1)比较下列各酯水解的反应相对活性:2)比较下列各个酯氨解反应的相对活性:3)比较化合物的酸性强弱顺序:3. 两个什么样的化合物缩合后再酸化会得到下列各产物?4. 给下列反应式填入适当的试剂:5. 回答下列问题:1)比较下列各酯水解的反应相对活性:2)比较下列各个酯氨解反应的相对活性:3)比较化合物的酸性强弱顺序:8. 某化合物(E) 的分子式为C5H6O3,(E)和乙醇作用得到两个互为异构体(F)和(G),将(F)和(G)分别与亚硫酰氯作用后,再与乙醇作用得到相同的化合物(H),试推测(E)(F)(G)(H)的构造式,并写出各步反应式。
9. 一个中性化合物C7H13O2Br,与羟氨和苯肼均没有反应。
IR 谱在2850-2950cm-1区域有吸收峰,而在3000cm-1以上区域没有吸收峰,另外一个较强的吸收峰在1740cm-1。
NMR 谱在δ=1.0(3H)三重峰;δ=1.3(6H)二重峰;δ=2.1(2H)多重峰;δ=4.2(1H) 三重峰;δ=4.6(1H) 多重峰。
请推测此化合物的结构。
10. 化合物A, 分子式为C9H10O3。
它不溶于水、稀HCl 及稀NaHCO3溶液,但能溶于NaOH 液。
A 与稀NaOH 共热后,冷却酸化得一沉淀B,分子式为C7H6O3,B 能溶于NaHCO3溶液并放出气体,B 与FeCl3 溶液作用给出紫色,B 在酸性介质中可以进行水蒸气蒸馏,写出A,B 的构造式及各步反应式。
11. 写出化合物的A-F 正确构造式。
12. 推测化合物A-F 的结构。
13. 化合物A的分子式为C10H22O2,与碱不起作用,但可被稀酸水解成B 和C。
C 的分子式为C3H8O,与金属钠作用有气体放出,能与NaIO 反应。
第十一章羧酸衍生物
三、酯的命名
一元醇与一元酸生成的酯称某酸某(醇
或酚)酯;多元醇酯称为某醇某酸酯;内酯 用希腊字母标明原羟基的位置,称某内酯。
O
COOCH3
CH2-O-Cll -CH3 l
COOH CH2-O-Cll-CH3
H3C
O
O
O
邻苯二甲酸甲酯 乙二醇二乙酸酯 γ-戊内酯
四、酰胺的命名
简单的酰胺是在酰基名称后加“胺”或
(三)酯缩合反应
具有α-H的酯,在醇钠的作用下能发生类 似醇醛缩合反应。——Claisen缩合反应
CH3COOCH2CH3CH3CH2ONa -CH2COOCH2CH3
OCH3C CH2COOCH2CH3
OCH2CH3
CH3CO CH2COOCH2CH3 + CH3CH2O-
COOC2H5 + CH3COOC2H5NaOC2H5 COCH2COOC2H5 + C2H5OH
第十一章 羧酸衍生物
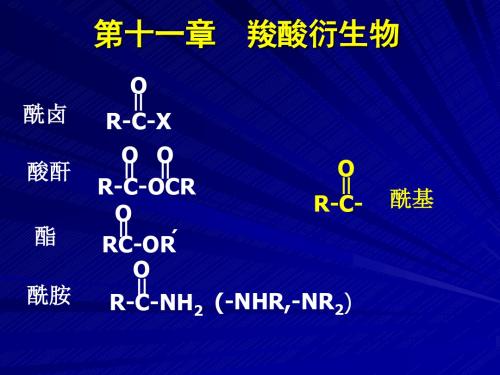
酰卤 酸酐 酯 酰胺
O ll R-C-X
R-OCll -OOlCl R O
RCll -ORˊ
O ll R-C-
O R-Cll -NH2 (-NHR,-NR2)
酰基
第一节 羧酸衍生物的命名
酰基的名称是将其羧酸的名称的“酸” 字改成“酰基”。
O
CH3C OH 乙酸
O
CH3C 乙酰基
交叉Claisen酯缩合反应
三、碳酸衍生物
氨基甲酸酯 脲(尿素) 胍 丙二酰脲
四、尼龙和聚酯
CH3CONH2 + NH2CH3 CH3CONHCH3 + NH3
(二)酰基亲核取代反应的机制
O R-lCl —L+:Nu
第十一章羧酸及其衍生物

第十章羧酸及其衍生物【教学重点】羧酸及其衍生物的化学性质、丙二酸二乙酯和乙酰乙酸乙酯在合成上的应用。
【教学难点】诱导效应、酰基上的亲核取代反应机理。
【教学基本内容】羧酸的结构;羧酸的制备方法;羧酸及其衍生物的物理性质;羧酸的化学性质——羧酸的酸性及影响酸性强度的因素(诱导效应、共轭效应和场效应);羧酸衍生物的生成;羧基的还原反应;脱羧反应;α-氢原子的卤代反应。
羟基酸的制备方法(卤代酸水解、羟基腈水解、Refomatsky反应)、羟基酸的化学性质——酸性、脱水反应、α-羟基酸的分解。
羧酸衍生物的化学性质——酰基上的亲核取代反应(水解、醇解、氨解)及其反应机理;还原反应;与Grignard反应;酰胺氮原子上的反应(酰胺的酸碱性、脱水反应、Hofmann降解反应)。
乙酰乙酸乙酯的制备方法(Claisen酯缩合);乙酰乙酸乙酯的化学性质——酮式-烯醇式互变异构、酸式分解和酮式分解;乙酰乙酸乙酯在合成上的应用。
丙二酸二乙酯的制备及在合成上的应用。
Ⅰ目的要求羧酸是含有羧基(—COOH)的含氧有机化合物,我们平常所说的有机酸就是指的这类化合物。
所谓羧酸衍生物,包括的化合物种类很多,诸如羧酸盐类、酰卤类、酯类(包括内酯、交酯、聚酯等)、酸酐类、酰胺类(包括酰亚胺、内酰胺)等都是羧酸衍生物,有人甚至把腈类也包括在羧酸衍生物的范围之内。
其实,比较常见的而又比较重要的是酰卤、酸酐、酯和酰胺这四类化合物。
羧酸盐与一般无机酸盐在键价类型上没大区别,不作专门介绍。
至于腈类,将放在含氮化合物中加以介绍。
这四类化合物都是羧酸分子中,因酰基转移而产生的衍生物,所以又叫羧酸的酰基衍生物。
羧酸及其衍生物RCOL(L:-OH、-X、-OOCR′、-OR′、-NH2)在许多重要天然产物的构成以及在生物代谢过程中均占有重要地位。
本章将以饱和一元脂肪酸为重点,讨论羧酸及其衍生物的结构和性质。
鉴于乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的重要地位,本章作概括介绍。
《有机化学》第十一章 羧酸及其衍生物的结构与性质

第十一章羧酸及其衍生物的结构与性质引言羧基()是羧酸的官能团,是由羰基和羟基组成的。
由于羰基的碳氧双键与羟基氧原子的共轭效应的作用,使羟基中氧原子电子向羰基转移,羟基的氢易离解而显酸性。
羧基中羟基也能被其它基团取代生成羧酸衍生物。
羧基是吸电子基,α-H具有活性,可以被卤代。
此外羧酸还能被还原和发生脱羧反应。
这里所讨论的羧酸衍生物主要是指羧基中羟基被取代后生成的酰卤(),酸酐(),酯(),酰胺()以及由酰胺脱水后生成的产物腈()。
在羧酸衍生物中羰基与卤素,酰胺基,烷氧基和氨基相连,由于卤素,氧原子和氮原子的负电性以及孤对电子的作用,使羰基碳上正电性不同,因此它们发生亲核反应性质也有差别。
羧酸衍生物还能发生还原反应。
11.1 羧酸的酸性羧酸是弱酸,能与强碱反应生成盐:羧酸酸性的强弱与所连的基团有关,连吸电子基团的羧酸酸性较强,而连供电子基团的酸性相对较弱。
如下列化合物酸性强弱顺序为:11.2 羧酸衍生物的生成羧基中的羟基被卤素、酰胺基、烷氧基和氨基取代形成酰卤、酸酐、酯和酰胺等羧酸衍生物。
1、酰卤的形成羧酸与SO2Cl,PCl5,PCl3等氯化剂直接反应生成酰卤:因为POCl3沸点低易除去,此法可制备高沸点的酰氯。
H3PO3沸点高,可制备低沸点的酰氯。
该法产生的SO2,HCl易除去,因此生成的酰氯纯度高,后处理容易。
2、酸酐的形成羧酸在脱水剂(如乙酰氯、乙酸酐)存在下加热,失去一分子水而生成酸酐。
二元酸可以分子内脱水生成二酸酐:3、酯化反应羧酸和醇在催化剂(H2SO4、HCl或苯磺酸等)作用下回流生成酯:酯化反应由多种机理,在大多数情况下,是羧酸中羟基与醇中羟基氢结合生成水,表观上看是一种亲核取代反应,实际上是一个亲核加成-消除反应的机理:决定反应速度的一步是亲核加成,因此羧基中碳的正电性以及羧基所连的基团大小核亲核试剂R'OH中R'体积大小都影响反应的速度,下列羧酸与甲醇酯化反应的相对速度的快慢顺序为:4、形成酰胺的反应羧酸与氨立即反应生成盐,在加热条件下,脱水生成酰胺,生成酰胺的反应是可逆的,如果把生成的水从反应体系中除去,反应可趋于完全。
第十一章 羧酸

R-COOH
憎水基团
亲水基团
亲水基团-羧基可以与水形成氢键。低级脂肪酸,如: 甲酸,乙酸等能与水混溶;随羧酸分子量所增大,憎水基- 烷基增大,导致其在水中的溶解度迅速减小,最后与烷烃的 溶解度相近。高级脂肪酸都不溶于水,而溶于有机溶剂。
10/45
5. 羧酸的结构及光谱性质
(ⅰ) 结构
羧基中的羟基氧原子上有孤对电子,可以与π 键形成
羧酸在一般条件下不易被还原剂还原,但如果使用强金属 氢化物,可使羧基还原成醇而得不到醛。
例1 :
O
O
HO-C-(CH2)8-C-OH
LiAlH4
例2 :
O
O
C-CH2-CH2C-OH
LiAlH4
β-苯甲酰丙酸 Mp:116
HO-CH2(CH2)8-CH2-OH 1,10-癸二醇 Mp:74
CHCH2CH2CH2OH OH γ- 羟基-苯基丁酸
第十一章 羧 酸
第十一章 羧 酸
第一节 羧酸的分类及命名 羧酸是含有羧基的含氧有机化合物。通常可以看作是烃
分子中的氢原子被羧基取代。
一: 分类
1.按烃基分类
a. 脂肪族羧酸 b. 芳香族羧酸
饱和羧酸
不饱和羧酸
R-COOH C2H5-COOH CH2=CH-COOH
Ar-COOH
COOH
2/45
2. 按羧基数目分类
6/45
2. 沸点
饱和一元羧酸的沸点随分子量的增加而增加。与分子量相 似的醇比较,羧酸的沸点较高。例如:
O
O
H-C-OH CH3CH2OH CH3-C-OH CH3CH2CH2OH
名称 甲酸
乙醇
乙酸
丙醇
11 章 思考题 习题答案

NaBH4
OH O CH3CH2CHCH COCH2CH3
CH3
HCN (5) HC CH
CH2 CHCN
H2O,H+
CH3OH H+
CH2
CHCOOCH3
O
(6)
CH3OH/H+ NaBH4 HO CO2H
CO2CH3
OH
(7)格式试剂与二氧化碳反应 CH3CHCH3 HBr
Mg/醚
1)CO2 CH3CHCOOH
COOC2H5 CH2=CHCH2-C-CH3
COOC2H5
(1) OH-,H2O (2) H3O+
CH2=CHCH2CHCOOH CH3
思考题 11-19 写出反应产物 O + NCCH2COOH CH3COONH4
答案:为活泼亚甲基与酮的 Knoevenagel 反应: O + NCCH2COOH CH3COONH4
CH3CCH3
CH3CHCH3
答案:β-二羰基的互变性。与 2,4-二硝基苯肼反应的为(a)、(b),(a)使 Br2/CCl4
褪色。
思考题 11-17 由乙酰乙酸乙酯合成
O -C-CH3
答案:为乙酰乙酸乙酯合成环状取代丙酮的方法:
OO
OO
CH3CCH2COC2H5
(1)C2H5ONa (2)Br(CH2)4Br
HOCH2CH2CH2CH2OH
思考题 11-15 由对羟基苯胺合成药物泰诺林的有效成分对乙酰氨基酚
答案:为酰胺的制备 HO-
OO -NH2 + CH3COCCH3 吡啶 HO-
O -NH-CCH3
3
思考题 11-16 用化学方法鉴别下列化合物
浙江大学有机化学课件讲义11
OH
CH3(CH2)14CO2H 棕榈酸
HO2CCH OH
CHCO2H OH
安息香酸
水杨酸
酒石酸
对于比较复杂的羧酸,常用系统命名法命名。选含有羧基的最长碳链为主链,从羧基碳
原子开始编号,称为“某酸”,如有取代基,将取代基的名称与位次放在前面。例如:
CH3CHCH2CHCH2CO2H CH3 CH2CH3
吸收在 1640 和 1600 cm-1 处,是伯酰胺的另一特征吸收。图 11-1、11-2、11-3 分别是乙酸乙
4
酯、苯甲酸、乙酸酐和 N, N-二甲基甲酰胺(DMF)的红外光谱图。 图 11-1 乙酸乙酯的红外光谱 图 11-2 苯甲酸的红外光谱
5
图 11-3 乙酸酐的红外光谱
图 11-4 N, N-二甲基甲酰胺的红外光谱 羧基上的质子因受羰基的去屏蔽作用以及氧电负性的影响,其化学位移出现在低场δ 10~12ppm 处。伯酰胺和仲酰胺氮上的质子在δ 5~8ppm(通常是一个宽峰)。羧酸及其衍生 物的α-位质子因受羰基的吸电子作用影响,化学位移稍向低场移动,一般在δ 2~3ppm 处。
H
CO2H
CH3
CH2CH3
5-甲基-3-乙基己酸
(E)-2-乙基-2-丁烯酸
环直接与羧基相连称为环烷酸,编号从羧基所连接的碳原子开始,例如:
CO2H
CO2H
CO2H H
CH3
H
CO2H
4-甲基环己烷甲酸
2-环戊烯甲酸
反-1, 3-环戊烷二甲酸
芳香酸则常用苯甲酸作为母体,加上取代基的名称与位置,例如:
酰胺是由酰基和“胺”组成其名称的,如果氮上有取代基,则在取代基名称前加“N”
标出,例如:
第 11 章 羧酸及衍生物
羧酸的制备 一: 以烃、醇、醛、甲基酮作原料 1:不饱和烃氧化 R-CH=CH-R’ 2: 伯醇,醛氧化法 CH3CH2CH2OH Na2Cr2O7 CH3CH2COOH H2SO4 65% ClCH2CH2CH2CHO HNO3 ClCH2CH2CH2COOH KMnO4/H+ R-COOH + R'COOH
α -C 连有强吸电子基时易脱羧: Cl3C-COOH O2NCH2COOH CHCl3 + CO2 O2NCH3 + CO2
羧酸银盐于 Br2 或 Cl2 中脱羧成卤代烃(少一碳) RCH2COOAg + Br2 CCl4 RCH2Br + AgBr + CO 2 酸 酸银 少一碳卤代烃 ------亨斯狄克反应 (H.E.Hunsdiecker)
四: 重要羧酸
(一般了解)
甲酸: 醛的性质(费林,托仑) 乙酸: 丙烯酸: CH2=CH-COOH 酸性> 乙酸 制替代有机玻璃, 烯烃性质. 乙二酸: 酸性强, 还原性,标定 KMnO4 (Na2C2O4) 己二酸:合成尼龙-66 (与己二胺缩合) 苯甲酸: 防腐剂 邻苯二甲酸: 合成增塑剂,聚酯树脂,标定 对苯二甲酸: 合成聚酯纤维
命名 : 根据来源,有俗名 HCOOH CH3CH2CH2COOH CH3-C=CHCOOH CH3 3-甲基-2-丁烯酸
CH3CH-CH2COOH CH3 3-甲基丁酸 (β )
CH3(CH2)7CH=CH-(CH2)7COOH 十八碳-9-烯酸 9十八碳烯酸 (油酸)
-CH2CH2COOH -COOH O
§ 13-5 羟基酸 ,羰基酸 重要取代酸: 羟基, 羰基, 卤素 , 氨基
一: 羟基酸分类,命名 CH3-CH-COOH 乳酸 OH (无沸点,强酸性)
第十一章羧酸和取代羧酸亲核加成-消除反应
其它能还原羧基的试剂
AlH3 O R C OH B2H6 H2O R CH2OH H2O
O
例: O2N
B2H6 OH
H2O O2 N CH2OH
C
-NO2未受影响 Organic Chem
合成上应用 —— 制备伯醇
O
1. LiAlH4 OH 2. H2O
R
C
R
CH2OH
1. LiAlH4 酯化 R O C OEt 2. H2O
O R CH X C OH
PBr3 R
O C Br
酰 (基 )溴
比较: 醇类的卤代
SOCl2 R R OH PBr3 R Cl Br
羧酸羟基的 卤代与醇类的卤 代有相似性
Organic Chem
2)、生成酸酐的反应:
O 2 RCH2 C OH P2O5 RCH2 O C O O C CH2R + H2O
强除水剂
酸酐
可能机理:
COOH
正常反应: 形成环状酸酐
加热反应即发生
Organic Chem
3)、酯化:
O R C OH + HOR' H+ R O C OR' + H2O
酯化反应特点: 反应需要 H+ 催化,无催化剂时反应很慢。 反应可逆(加大反应物用量或除去水使酯的产率提高) 酯化反应机理的讨论 机理须说明的问题: a. 反应可逆性 b. H+ 在反应中起什么的作用?先作用在哪? c. 酯中OR‘中氧的来自于酸还是醇?
呋喃甲酸
苯丙酸 3-苯基丙酸
O H3C
O OH
H2N CHCOOH CH2COOH
(末端) CH2(CH2)9COOH Br
第十一、十二章 羧酸及其衍生物
酸 + CO2
环酐 + H2O
己、庚二酸
环酮 + H2O+CO2
几种常见的羧酸
甲酸(formic acid) 草酸(dicarboxyl) 乙酸(acetic acid)
苯甲酸(benzoic acid)
O
甲酸的结构 H C OH
醛基
羧基
甲酸
甲酸既具有一般羧酸的通性,还具有还原 性。能和托伦试剂、高锰酸钾等试剂反应 HCOOH+KMnO4+H2SO4
H2C
CH2COOH CH2COOH
O O + H2O O
己二酸和庚二酸受热脱水和二氧化碳
CH2CH2COOH CH2CH2COOH
CH2CH2COOH CH2CH2COOH
O + CO2 + H 2O
H2C
O + CO2 + H 2O
小结:
二元羧酸热解产物与碳链长度有关:
乙、丙二酸
丁、戊二酸
CH2CH2CH2COOH Cl
CH3CH2CHCOOH Cl
CH3CHCH2COOH Cl
pKa
2.86
4.06
4.52
(二) 羧酸衍生物的生成
羧基中的 –OH 被其它原子或基团取代后生成的 化合物称羧酸衍生物(derivatives of carboxylic acid)。
O R C OH
离去基
O C O C O C O C
R
X OCOR OR NH 2
R
O C
R
OH
R R
羧酸衍生物
DHA怎么补?
DHA
DHA,二十二碳六烯酸(docosahexenoic acid ), 俗称脑黄金,是一种对人体非常重要的多不饱和脂肪 酸,属于Omega-3不饱和脂肪酸家族中的重要成员。 DHA是神经系统细胞生长及维持的一种主要元素,是 大脑和视网膜的重要构成成分,在人体大脑皮层中含 量高达20%,在眼睛视网膜中所占比例最大,约占 50%,因此,对胎婴儿智力和视力发育至关重要。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
p Ka 1 p Ka 2
1.27 4.27
2.85 5.70
4.21 5.64
4.43 5.41
pKa1<pKa2
pKa1和 pKa2差
3.0
2.85
1.43
0.92
两羧基距离近pKa1小;距离越远pKa1越大。pKa1和pKa2差随距离增大而减小。 丁烯二酸的两个异构体的pKa
H C HOOC C COOH H H HOOC C C COOH H
(2)比较邻位取代苯甲酸的酸性强弱:
COOH R R: NO2, CN, Cl, H, Ph, CH3, OCH3, OH
为什么邻位取代苯甲酸的酸性强呢? 3. 邻位效应
COOH X
PKa: 2.21, 3.44, 2.92, 4.17, 3.46, 3.91, 4.09, 2.98
邻位取代苯甲酸的酸性强于苯甲酸。没什么规律。
CO2H CO2H NO2 NO2
CO2H CO2H
二、羧酸及其衍生物的生成
(E) 甲酸
CO2H
(D)>(E)>(B) >(C)>(A)
*(一)羧酸的制备 (自学):
KMnO4
CO2H
2.
(A)
(B)
OMe
(C)
NO2
CO2H
(D)
Br
CO2H CO2H OH
(A)>(C)>(D) >(B)
1. 芳烃、烯、 炔、醇、醛、
用PCl5制备高沸点酰氯与芳酰氯;易分离出POCl3. 3. 与SOCl2反应制备酰氯 实验室常用
3. 二元酸分子内脱水制备酸酐:
O C C OH OH O
+
H 2O
SOCl2: 二氯亚砜、亚硫酰氯、氯化亚砜
H+催化;一种原料过量;除去产物或H2O。 酯化反应机理: 酰氧键断裂机理 烷氧键断裂机理
21
第3篇 有机含氧化合物
第11章 羧酸及其衍生物 第一节 羧酸的结构及分类
一、羧酸的结构 通式: R-COOH, 官能团:COOH
CH3
乙酸 的结构:
0.125 H2C H C . .. O. 0.131 .. O .. H
乙酸C-O, C=O 键长平均化 -COOH中C 为 sp2,羧基是四电子三中心 的共轭体系。
第11章 羧酸及其衍生物
第一节 羧酸的结构及分类 第二节 羧酸及其衍生物的物理性质 第三节 羧酸的化学性质 第四节 羧酸衍生物的化学性质 第五节 羟基酸、羰基酸及β-酮酸酯
1
用途:
COOH OCCH 3 (CH3)2CHCH2 CHCOOH O 布洛芬(消炎镇痛药) 阿司匹林(解热镇痛药)
羰基与α-H σ-π共轭 两种共轭: 羰基与 -OH p-π共轭 两种交叉共轭导致:电子密度平均化,键长平均化。 1. 羰基碳缺电性下降,亲核加成活性比醛酮低。 2. C—OH 变短,—OH 被亲核取代活性比醇小。 3. H 的酸性比醇强。 4. α-H 的活性比醛酮小。
COOH
(2-氨基丙酸)
偏苯三甲酸
均苯三甲酸
第二节 羧酸及其衍生物的物理性质 一 一般物理性质
1. 羧酸的性状 C0~2—COOH C3~8—COOH C >9—COOH 挥发性液体,刺激性气味 腐败味油状液体 石蜡状固体,气味小 二元羧酸及芳香族羧酸 白色结晶固体 沸点:双分子缔合形成氢键,沸点比相近分子量的醇高。
HCOOH CH3COOH CH3CH2COOH C6H5COOH C6H5CH2COOH
(3)二元羧酸酸性:
HO2C-CO2H HO2C-CH2-CO2H HO2C-CH2CH2-CO2H HO2C-(CH2)4-CO2H
pKa = 3~5 强无机酸(~1),羧酸(3-5),碳酸(6.38),苯酚( ~10) 羧酸的成盐反应: 分离、提纯、回收 RCOOH
Br, 2.85 3.81, 3.97
CN, 3.44 3.64 3.55
NO2 2.21 3.49 3,42
电子效应
COOH COOH
场效应
O C OH
立体效应
COOH CH3
氢键作用
O OO H C
一般规律:对位,间位取代苯甲酸,连给电子基,酸性减弱, 连吸电子基,酸性增强。(苯基,羟基及甲氧基在 间位显示吸电子性)。
CH3
H+ , H+
COOH
KMnO4 , OHH2O
HOOC(CH2)4COOH H+
3. 通过CO2制备羧酸 (1) 柯尔伯-施密特(Kolbe-Schmidt)反应
ONa + CO2 0.4—0.7MPa
125℃
3. (A)
(B)
OH
(C)
CH3
(D)
(E)
CH3
酮的氧化
CH3 C
制备羟基取代苯甲酸
溶于水 如何分离戊酸、苯酚和戊醇?
10
3.77
4.76
4.84
4.17
4.31
11
原因:顺式结构可形成氢键
12
2. 取代苯甲酸酸性强弱 (1)比较对位,间位取代苯甲酸的酸性强弱:
COOH R: NO2, CN, CF3, Cl, H, Ph, CH3, OCH3, OH PKa: 3.42, 3.55, 3.66, 3.97, 4.17, 4.21, 4.38, 4.47, 4.57 R COOH R: NO2, CN, CF3, Cl, H, Ph, CH3, OCH3, OH
CH3(CH2)16COOH
硬脂酸
COOH H3 C
OH OH OH CH3 CH COOH HOOC CH CH2COOH HOOCCH2 C CH2COOH COOH
丙酸
HOOC COOH
2-丁烯酸
HOOCCH2COOH
3-苯基丙烯酸(肉桂酸)
HOOC(CH2)4COOH
甲酸 (2)
醋酸
COOH
OH OR '
1
OH+ RC OH
+
控制步骤 .. HOR'
2
OH R C OH H + O R' O
OR'
3
烷氧键断裂机理:
' OH + H+ CR3
O
+ H+
22
CH3OH > 1oROH > 2oROH > 3oROH
' C + H2O R3
O + RC O H ' CR3 O RC ' O CR3
PKa COOH R
邻位 效应
PKa: 3.49, 3.64, 3.77, 3.86, 4.17, 4.14, 4.27, 4.09, 4.08 R
R
omp-
CH3, Ph, 3.91 3.46 4,27 4.14 4.38 4.21
OH, 2.98 4.08 4.57
Cl, 2.92 3.83 3.97
O RC O H+ H O R' H+ R O C O R' + H2O
酯化反应速率:
CH3COOH
不同的酸与甲醇反应相对速率:
(CH3)2CHCOOH (CH3)3CCOOH
CH3CH2COOH
1
0.84
0.33
0.037Leabharlann 伯醇、仲醇O RC OH + H-O-R'
18
O H+ R C O R'
18
23
+
空间位阻越大,越不利于酯化反应。
甲酸 分子量: 46 沸点: 101.5℃ 乙醇 46 78.5℃
二 光波谱性质 3. 羧酸衍生物以及物理性质
羧酸衍生物:羧酸中的羟基被卤素、酰氧基、烷氧基、氨基 取代所得的化合物称为羧酸衍生物。 1. 1H- NMR谱 : 2. IR谱 :
—COO—H
10~13 ppm 2.2~2.5 ppm
α-H
R COOH R COOH
18
5. (A)
(B)
CH3
(C)
CH3
(D)
I2, NaOH
50% HNO3
5. (D)>(A)>(C) >(B)
16
R Li
O
HOOC(CH2)4COOH
+ CO2
17
与CO2作用得到增加一个碳的羧酸。
(二)酰卤的生成
1. 与PCl3反应 制备酰氯
制备低沸点酰氯; 易蒸馏出产物。
乳酸
(2-羟基丙酸)
COOH OH HO OH
苹果酸
COOH OHC COOH OH
柠檬酸 (2) 二元酸
CH3COCH2COOH
脂环酸
COOH
乙二酸(草酸)
HOOC H COOH H
丙二酸
H HOOC COOH H
己二酸
环戊基甲酸
环己基甲酸
COOH
3-甲基环戊基甲酸
CH CHCOOH
(3) 不饱和酸
~120 0
食用醋:2%的乙酸水溶液。 食用油:羧酸甘油酯。
2
3
二、 羧酸的分类 1. 按碳架分类
(1)
H COOH
(5) 取代羧酸
CH3COOH
羟基酸、羰基酸、氨基酸等 (多用习惯命名)
2. 按-COOH 数目分类
(1) 一元酸
CH3CH2COOH CH3CH CHCOOH
CH CHCOOH
开链饱和脂肪酸
-COO—H ~ 3550 cm-1 (尖峰), 游离羧酸。 -COO—H 2500 ~ 3300 cm-1 (宽、强峰), 分子间缔合。
