第十三章 热力学基础习题课与讨论课(十三)
大学物理第十三章(热力学基础)部分习题及答案

第十三章热力学基础一、简答题:1、什么是准静态过程?答案:一热力学系统开始时处于某一平衡态,经过一系列状态变化后到达另一平衡态,若中间过程进行是无限缓慢的,每一个中间态都可近似看作是平衡态,那么系统的这个状态变化的过程称为准静态过程。
2、什么是可逆过程与不可逆过程答案:可逆过程:在系统状态变化过程中,如果逆过程能重复正过程的每一状态,而且不引起其它变化;不可逆过程:在系统状态变化过程中,如果逆过程能不重复正过程的每一状态,或者重复正过程时必然引起其它变化。
3、一系统能否吸收热量,仅使其内能变化? 一系统能否吸收热量,而不使其内能变化?答:可以吸热仅使其内能变化,只要不对外做功。
比如加热固体,吸收的热量全部转换为内能升高温度;4、简述热力学第二定律的两种表述。
答案:开尔文表述:不可能制成一种循环工作的热机,它只从单一热源吸收热量,并使其全部变为有用功而不引起其他变化。
克劳修斯表述:热量不可能自动地由低温物体传向高温物体而不引起其他变化。
5、什么是熵增加原理?答:一切不可逆绝热过程中的熵总是增加的,可逆绝热过程中的熵是不变的。
把这两种情况合并在一起就得到一个利用熵来判别过程是可逆还是不可逆的判据——熵增加原理。
6、什么是卡诺循环? 简述卡诺定理?答案:卡诺循环有4个准静态过程组成,其中两个是等温线,两个是绝热线。
卡诺提出在稳度为T1的热源和稳度为T2的热源之间工作的机器,遵守两条一下结论:(1)在相同的高温热源和低温热源之间工作的任意工作物质的可逆机,都具有相同的效率。
(2)工作在相同的高温热源和低温热源之间的一切不可逆机的效率都不可能大于可逆机的效率。
7、可逆过程必须同时满足哪些条件?答:系统的状态变化是无限缓慢进行的准静态过程,而且在过程进行中没有能量耗散效应。
二、选择题1、对于理想气体的内能,下列说法中正确的是( B ):( A ) 理想气体的内能可以直接测量的。
(B) 理想气体处于一定的状态,就有一定的内能。
第十三章 热力学基础 习题解答上课讲义

§13.1~13. 213.1 如图所示,当气缸中的活塞迅速向外移动从而使气体膨胀时,气体所经历的过程【C 】(A) 是准静态过程,它能用p ─V 图上的一条曲线表示(B) 不是准静态过程,但它能用p ─V 图上的一条曲线表示(C) 不是准静态过程,它不能用p ─V 图上的一条曲线表示(D) 是准静态过程,但它不能用p ─V 图上的一条曲线表示分析:从一个平衡态到另一平衡态所经过的每一中间状态均可近似当作平衡态(无限缓慢)的过程叫做准静态过程,此过程在p-V 图上表示一条曲线。
题目中活塞迅速移动,变换时间非常短,系统来不及恢复平衡,因此不是准静态过程,自然不能用p -V 图上的一条曲线表示。
13.2 设单原子理想气体由平衡状态A ,经一平衡过程变化到状态B ,如果变化过程不知道,但A 、B 两状态的压强,体积和温度都已知,那么就可以求出:【B 】(A ) 体膨胀所做的功; (B ) 气体内能的变化;(C ) 气体传递的热量; (D ) 气体的总质量。
分析:功、热量都是过程量,除了与系统的始末状态有关外,还跟做功或热传递的方式有关;而内能是状态量,只与始末状态有关,且是温度的单值函数。
因此在只知道始末两个状态的情况下,只能求出内能的变化。
对于答案D 而言,由物态方程RT PV ν=可以计算气体的物质的量,但是由于不知道气体的种类,所以无法计算气体总质量。
13.3 一定量的理想气体P 1、V 1、T 1,后为P 2、V 2、T 2, 已知V 2>V 1, T 2<T 1,以下说法哪种正确?【D 】(A ) 不论经历什么过程,气体对外净作功一定为正值;(B ) 不论经历什么过程,气体对外界净吸热一定为正值;(C ) 若是等压过程,气体吸的热量最少;(D ) 若不知什么过程,则W 、Q 的正负无法判断。
分析:功和热量都是过程量,他们除了与系统的始末状态有关外,还跟经历的过程方式有关,所以A 、B 选项不正确。
《大学物理》课程教学大纲
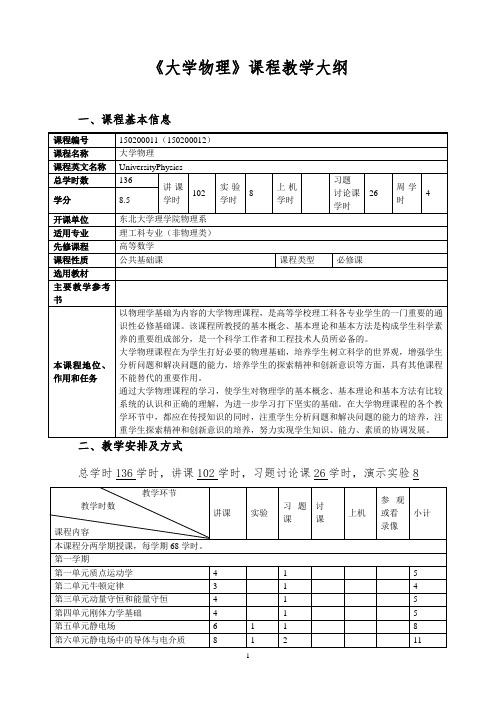
《大学物理》课程教学大纲一、课程基本信息总学时136学时,讲课102学时,习题讨论课26学时,演示实验8三、课程教学的有关说明1、本课程课内外学时比例:1:2;平均周学时:4。
2、本课程是公共基础课,分连续两个学期完成。
3、在教学中注意把传统教学手段和现代化教学手段相结合,充分利用现代化教学手段进行教学。
四、对于能力培养的基本要求通过大学物理课程教学,应注意培养学生以下能力:1.独立获取知识的能力——逐步掌握科学的学习方法,阅读并理解相当于大学物理水平的物理类教材、参考书和科技文献,不断地扩展知识面,增强独立思考的能力,更新知识结构;能够写出条理清晰的读书笔记、小结或小论文。
2.科学观察和思维的能力——运用物理学的基本理论和基本观点,通过观察、分析、综合、演绎、归纳、科学抽象、类比联想、实验等方法培养学生发现问题和提出问题的能力,并对所涉问题有一定深度的理解,判断研究结果的合理性。
3.分析问题和解决问题的能力——根据物理问题的特征、性质以及实际情况,抓住主要矛盾,进行合理的简化,建立相应的物理模型,并用物理语言和基本数学方法进行描述,运用所学的物理理论和研究方法进行分析、研究。
五、对于素质培养的基本要求通过大学物理课程教学,应注重培养学生以下素质:1.求实精神——通过大学物理课程教学,培养学生追求真理的勇气、严谨求实的科学态度和刻苦钻研的作风。
2.创新意识——通过学习物理学的研究方法、物理学的发展历史以及物理学家的成长经历等,引导学生树立科学的世界观,激发学生的求知热情、探索精神、创新欲望,以及敢于向旧观念挑战的精神。
3.科学美感——引导学生认识物理学所具有的明快简洁、均衡对称、奇异相对、和谐统一等美学特征,培养学生的科学审美观,使学生学会用美学的观点欣赏和发掘科学的内在规律,逐步增强认识和掌握自然科学规律的自主能力。
六、教学内容及基本要求模块1力学:第一单元质点运动学第一讲质点运动的描述,第二讲圆周运动与一般平面曲线运动,第三讲相对运动基本要求:1、质点运动的描述(1)掌握:位矢、位移、速度、加速度等物理量的定义及表达式,能够从已知的运动方程求导得到速度、加速度;同时能够从已知的速度或加速度积分得出运动方程。
第13章 热力学基础 之习题及参考答案

第十三章习题热力学第一定律及其应用1、如图所示,一定量理想气体从体积V1,膨胀到体积V2分别经历的过程是:A→B等压过程,A→C等温过程;A→D绝热过程,其中吸热量最多的过程。
2、一定量的理想气体,分别经历如图(1) 所示的abc过程,(图中虚线ac为等温线),和图(2) 所示的def过程(图中虚线df为绝热线).判断这两种过程是吸热还是放热.abc过程热,def过程热.3、如图所示,一绝热密闭的容器,用隔板分成相等的两部分,左边盛有一定量的理想气体,压强为p0,右边为真空.今将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压强是。
(=γC p/C V)4、一定量理想气体,从同一状态开始使其体积由V1膨胀到2V1,分别经历以下三种过程:(1) 等压过程;(2) 等温过程;(3)绝热过程.其中:__________过程气体对外作功最多;____________过程气体内能增加最多;__________过程气体吸收的热量最多.答案1、是A-B吸热最多。
2、abc过程吸热,def过程放热。
3、P0/2。
4、等压,等压,等压VV理想气体的功、内能、热量1、有两个相同的容器,容积固定不变,一个盛有氦气,另一个盛有氢气(看成刚性分子的理想气体),它们的压强和温度都相等,现将5J 的热量传给氢气,使氢气温度升高,如果使氦气也升高同样的温度,则应向氨气传递热量是 。
2、 一定量的理想气体经历acb 过程时吸热500 J .则经历acbda 过程时,吸热为 。
3、一气缸内贮有10 mol 的单原子分子理想气体,在压缩过程中外界作功209J ,气体升温1 K ,此过程中气体内能增量为 _____ ,外界传给气体的热量为___________________. (普适气体常量 R = 8.31 J/mol· K)4、一定量的某种理想气体在等压过程中对外作功为 200 J .若此种气体为单 原子分子气体,则该过程中需吸热_____________ J ;若为双原子分子气体,则 需吸热______________ J.5、 1 mol 双原子分子理想气体从状态A (p 1,V 1)沿p -V 图所示直线变化到状态B (p 2,V 2),试求: (1) 气体的内能增量. (2) 气体对外界所作的功. (3) 气体吸收的热量.(4) 此过程的摩尔热容.(摩尔热容C =T Q ∆∆/,其中Q ∆表示1 mol 物质在过程中升高温度T ∆时所吸收的热量.)p (×105 Pa)-3 m 3)p p p 126、如果一定量的理想气体,其体积和压强依照p a V /=的规律变化,其中a 为已知常量.试求: (1) 气体从体积V 1膨胀到V 2所作的功;(2) 气体体积为V 1时的温度T 1与体积为V 2时的温度T 2之比.7、 如图,器壁与活塞均绝热的容器中间被一隔板等分为两部分,其中左边贮有1摩尔处于标准状态的氦气(可视为理想气体),另一边为真空.现先把隔板拉开,待气体平衡后,再缓慢向左推动活塞,把气体压缩到原来的体积.求氦气的温度改变多少?答案1、3J2、-700J3、124.7 J ,-84.3 J4、500J ;700J5、解:(1) )(25)(112212V p V p T T C E V -=-=∆ (2) ))((211221V V p p W -+=, W 为梯形面积,根据相似三角形有p 1V 2= p 2V 1,则)(211122V p V p W -=. (3) Q =ΔE +W =3( p 2V 2-p 1V 1 ).(4) 以上计算对于A →B 过程中任一微小状态变化均成立,故过程中ΔQ =3Δ(pV ). 由状态方程得 Δ(pV ) =R ΔT , 故 ΔQ =3R ΔT ,摩尔热容 C =ΔQ /ΔT =3R .6、解:(1) d W = p d V = (a 2 /V 2 )d V)11()/(2122221V V a dV V a dW W V V -===⎰⎰(2) ∵ p 1V 1 /T 1 = p 2V 2 /T 2 ∴ T 1/ T 2 = p 1V 1 / (p 2V 2 ) 由 11/p a V =,22/p a V =得 p 1 / p 2= (V 2 /V 1 )2∴ T 1/ T 2 = (V 2 /V 1 )2 (V 1 /V 2) = V 2 /V 17、解:已知He 气开始时的状态为p 0、V 0、T 0、先向真空绝热膨胀:W = 0,Q = 0 → ∆E = 0 → ∆T = 0 ∴ T 1 = T 0,V 1 = 2V 0由 pV = RT 0121p p =5分 再作绝热压缩,气体状态由p 1、V 1、T 1,变为p 2、V 0、T 2 , γγγ)2(21001102V p V p V p == ∴ 0122p p -=γ 再由 000202//T V p T V p = 可得 0122T T -=γ 氦气 3/5=γ, 03/124T T =∴温度升高 03/102)14(T T T T -=-=∆T 0 = 273 K , ∆T = 160 K循环过程1、 如图表示的两个卡诺循环,第一个沿ABCDA 进行,第二个沿A D C AB ''进行,这两个循环的效率1η和2η的关系及这两个循环所作的净功W 1和W 2的关系是 η1 η2 ,W 1 W 22、 理想气体卡诺循环过程的两条绝热线下的面积大小(图中阴影部分)分别为S 1和S 2,则二者的大小关系是:3、如图,温度为T 0,2 T 0,3 T 0三条等温线与两条绝热线围成三个卡诺循环:(1) abcda ,(2) dcefd ,(3) abefa ,其效率分别为 η1_________,η2__________,η 3 __________.BAC DC 'D 'VppOV3T 02T 0T 0 fad b c e4、一卡诺热机(可逆的),低温热源的温度为27℃,热机效率为40%,其高温热源温度为_______ K .今欲将该热机效率提高到50%,若低温热源保持不变,则高温热源的温度应增加________ K .5、一卡诺热机(可逆的),当高温热源的温度为 127℃、低温热源温度为27℃时,其每次循环对外作净功8000 J .今维持低温热源的温度不变,提高高温热源温度,使其每次循环对外作净功 10000 J .若两个卡诺循环都工作在相同的两条绝热线之间,试求: (1) 第二个循环的热机效率;(2) 第二个循环的高温热源的温度.6、 1 mol 单原子分子理想气体的循环过程如T -V 图所示,其中c 点的温度为T c =600 K .试求:(1) ab 、bc 、c a 各个过程系统吸收的热量; (2) 经一循环系统所作的净功; (3) 循环的效率. (注:循环效率η=W /Q 1,W 为循环过程系统对外作的净功,Q 1为循环过程系统从外界吸收的热量ln2=0.693)答案 1、=;<2、S 1 = S 2.3、33.3% ; 50%; 66.7%4、500 ; 1005、解:(1) 1211211T T T Q Q Q Q W -=-==η 2111T T T W Q -= 且 1212T TQ Q =∴ Q 2 = T 2 Q 1 /T 1即 212122112T T T W T T T T T Q -=⋅-==24000 J 由于第二循环吸热 221Q W Q W Q +'='+'=' ( ∵ 22Q Q =') =''='1/Q W η29.4% (2) ='-='η121T T 425 K-3m 3)6、解:单原子分子的自由度i =3.从图可知,ab 是等压过程, V a /T a = V b /T b ,T a =T c =600 KT b = (V b /V a )T a =300 K (1) )()12()(c b c b p ab T T R i T T C Q -+=-= =-6.23×103 J (放热) )(2)(b c b c V bc T T R iT T C Q -=-= =3.74×103 J (吸热)Q ca =RT c ln(V a /V c ) =3.46×103 J (吸热) (2) W =( Q bc +Q ca )-|Q ab |=0.97×103 J (3) Q 1=Q bc +Q ca , η=W / Q 1=13.4%热力学第二定律0、关于可逆过程和不可逆过程的判断: (1) 可逆热力学过程一定是准静态过程. (2) 准静态过程一定是可逆过程. (3) 不可逆过程就是不能向相反方向进行的过程. (4) 凡有摩擦的过程,一定是不可逆过程. 以上四种判断,其中正确的是 。
高考物理一轮复习第十三章热学第1讲分子动理论热力学定律学案(2021年整理)

2019年高考物理一轮复习第十三章热学第1讲分子动理论热力学定律学案编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019年高考物理一轮复习第十三章热学第1讲分子动理论热力学定律学案)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019年高考物理一轮复习第十三章热学第1讲分子动理论热力学定律学案的全部内容。
第1讲分子动理论热力学定律微知识1 分子动理论的基本观点和实验依据阿伏加德罗常数1.物体是由大量分子组成的(1)分子很小①直径数量级为10-10 m.②质量数量级为10-26 kg。
(2)分子数目特别大阿伏加德罗常数N A=6。
02×1023 mol-1。
2.分子的热运动(1)布朗运动①永不停息、无规则运动。
②颗粒越小,运动越显著.③温度越高,运动越剧烈。
④运动轨迹不确定,只能用不同时刻的位置连线确定微粒做无规则运动。
⑤不能直接观察分子的无规则运动,而是用悬浮的固体小颗粒的无规则运动来反映液体分子的无规则运动.(2)热运动:物体分子永不停息地无规则运动,这种运动跟温度有关(填“有关"或“无关”)。
3.分子间的相互作用力(1)引力和斥力同时存在,都随分子间距离的增大而减小,随分子间距离的减小而增大,斥力比引力变化更快.(2)分子力的特点①r=r0时(r0的数量级为10-10 m),F引=F斥,分子力F=0。
②r〈r0时,F引<F斥,分子力F表现为斥力。
③r>r0时,F引>F斥,分子力F表现为引力。
④r〉10r0时,F引、F斥迅速减为零,分子力F=0。
(3)分子力随分子间距离的变化图象如图所示。
大学热力学基础习题答案

大学热力学基础习题答案【篇一:《物理学基本教程》课后答案第七章热力学基础】>7-1 假设火箭中的气体为单原子理想气体,温度为2000 k,当气体离开喷口时,温度为1000 k,(1)设气体原子质量为4个原子质量单位,求气体分子原来的方均根速率v2气体离开喷口时的流速(即分子定向运动速度)大小相等,均沿同一方向,求这速度的大小,已知气体总的能量不变.分析气体动理论的能量公式表明,气体的温度是气体分子平均平动动能的量度.当气体的内能转化为定向运动的动能时,即表现为平均平动动能的减少,也就是温度的降低.解(1)由气体动理论的能量公式mv2?2v2132kt,得?3ktm?3?1.38?10?23?2000?274?1.6605?10m/s?3530.7 m/s(2)气体总的能量不变,气体内能的减少应等于定向运动动能的增量,就气体分子而言,即分子的平均平动动能的减少应等于定向运动动能的增量.若分子定向运动速度为vd,则有12mvd?232kt1?32kt2vd?3k(t1?t2)m?3?1.38?10?23?(2000?1000)?274?1.6605?10m/s?2496.6 m/s7-2 单原子理想气体从状态a经过程abcd到状态d,如图7-2所示.已知pa?pd?1.013?10 pa55,pb?pc?2.026?10 pa,vb?1.5 l,va?1 l,vc?3 l,(1)试计算气体在abcd过程中作的功,内能的变化和吸收的热量;(2)如果气体从状态d保持压强不变到a状态,如图中虚线所示,问以上三项计算变成多少?(3)若过程沿曲线从a到c状态,已知该过程吸热257 cal,求该过程中气体所作的功.分析理想气体从体积v1膨胀到体积v2的过2v程中所作的功为?p(v)dv,其量值为p?v图上 0 1 1.53 4v/lv1过程曲线下的面积.如果过程曲线下是规则的几图7-2何图形,通常可以直接计算面积获得该过程中气体所作的功.解(1)气体在abcd过程中作的功应等于过程曲线下的面积,得wabcd?s14da?sadcb?1.013?10?3?10?531.8 pa5?3?12?1.013?10?(3?1.5)?105?3pa内能改变为ed?ea? ?mm32cv,m(td?ta)?53m2m?3r(td?ta)??1?10?332pa(vd?va)?1.013?10?(4?10) j?455.9 j应用热力学第一定律,系统吸热为q?wabcd?ed?ea?531.8 j?455.9 j?987.7 j(2)气体在等压过程da中作的功为wda?pa(va?vd)?1.013?10?(1?4)?105?3j?-303.9 j内能改变为 ed?ea??455. 9j系统吸热为q?wda?ea?ed??303.9 j-455.9 j??759.8 j (3)若沿过程曲线从a到c状态,内能改变为ec?ea? ?mm32cv,m(tc?ta)?3m2mr(tc?ta)?5?332(pcvc?pava)?(2?3?1?1)?1.013?10?10 j?759.8 j应用热力学第一定律,系统所作的功为wac?qac?ec?ea?257?4.18 j-759.8 j?314.5 j7-3 2 mol的氮气从标准状态加热到373 k,如果加热时(1)体积不变;(2)压强不变,问在这两种情况下气体吸热分别是多少?哪个过程吸热较多?为什么?分析根据热力学第一定律,系统从外界吸收的热量,一部分用于增加系统的内能,另一部分用于对外作功.理想气体的内能是温度的单值函数,在常温和常压下氮气可视为理想气体,无论经过什么样的准静态过程从标准状态加热到373 k,其内能的变化都相同.在等体过程中气体对外不作功,系统从外界吸收的热量,全部用于系统的内能的增加,而在等压过程中,除增加内能外,还要用于系统对外作功,因此吸热量要多些.解(1)氮气可视为双原子理想气体,i?5.在等体过程中,系统吸热为qv?mim2r(t2?t1)?2?52?8.31?(373?273) j?4155 j(2)在等压过程中,系统吸热为qp?mi?2m2r(t2?t1)?2?72?8.31?(373?273) j?5817 j分析气体在等压过程中吸收的热量为qp?mi?2m2r(t2?t1),其中t1已知,t2可以通过气体状态方程由已知的该状态的压强和体积求出.用同样的方法可以计算内能的变化.再应用热力学第一定律计算出系统所作的功.解(1)气体在等压过程中吸收的热量为qp? ?mi?2m722r(t2?t1)?5?3i?22?10(pv2?mmrt1)?(3?10?10?1032?8.31?283) j?7928 j(2)内能的变化为e2?e1? ?52mim2r(t2?t1)?5?3i2?(pv2?mmrt1)?(3?10?10?101032?8.31?283) j?5663 j(3)应用热力学第一定律,系统所作的功为w?q?e2?e1?7928 j-5663 j?2265 j7-5 双原子理想气体在等压膨胀过程中吸收了500 cal的热量,试求在这个过程中气体所作的功.解双原子理想气体在等压膨胀过程中吸热为qp?mi?2m2r(t2?t1)?i?22p(v2?v1)所作的功为wp?p(v2?v1)?2i?2qp?25?2?500?4.18 j?597 j分析在热力学中,应该学会充分利用p?v图分析和解题.从图7-6所示的p?v图 p可以看出,ac和db过程为等体过程,ad和cb过程为等压过程.理想气体的内能是温度的 p单值函数,在常温和常压下氧气可视为理想气体,只要始末状态相同,无论经过什么样的准静态过程,其内能的变化都相同.但是气体吸o v1 v2 v图7-6收的热量和完成的功则与过程有关,在等压过程中吸收的热量为qp?mi?2m2r(t2?t1),在等体过程中吸收的热量为qv?mim2r(t2?t1),其中温度值可以利用状态方程代换为已知的压强和体积参量.解(1)经acb过程,即经等体和等压过程,气体吸热为qacb?qv?qp? ? ?i?225?22p2v2?i25i2(pcvc?pava)?i?22(pbvb?pcvc)p1v1?p2v1?352?8.2?10?3?105?3?6?10?4.5?10 j? j?6?10?3?105?3j?1500 j所作的功为wacb?wcb?p2(v2?v1)?6?10?(4.5?3)?105?3j?900 j应用热力学第一定律,系统内能改变为eb?ea?qacb?wacb?1500 j-900 j?600 j(2)经adb过程,所作的功为wadb?wad?p1(v2?v1)?8.2?10?(4.5?3)?105?3j?1230 jj 系统内能改变为 eb?ea?600【篇二:大学物理气体动理论热力学基础复习题及答案详解】>一、填空题:轮胎内空气的压强是。
热力学基础习题课PPT学习教案
解:Q E W E 350130 220J Q 40 220 260J Q 60 220 280J
第11页/共20页
5.设在某一过程P中,系统由状态A变为状态B,如果 沿相反方 向进行,可以经过与原来一样的那些中间过程,而重新回到初 态,外界未发生任何变化,则过程P称为可逆过程;如果沿相 反方向进行,不能重复与原来一样的那些中间过程回到初态, 或回到初态而外界不能完全恢复,则过程P称为不可逆过程。 6. 一卡诺制冷机,低温热源的温度为300K,高温热源的温度 为450K,每一循环过程从低温热源吸热400J,则每一循环过
Wab
P(Vb
Va )
1.25105 5
(20) 103
2.5103
J
Qab CP (Tb Ta ) 2 8.31 (300) 6232.5 J
b c 等体过程
3 Wbc 0 Qbc CV (Tc Tb ) 2 8.31 300 3739.5 J
c a 等温过程
Wca
WQcWa aRbTlWnbVVacc
程外界必须做功为200 J 。
解: Q2 T2 W T1 T2
第12页/共20页
三、计算题
1. 一定质量的单原子分子理想气体,开始时处于状态a,体积 为1升,压强为3atm,先作等压膨胀至b态,体积为2升,再作 等温膨胀至c态,体积为3升,最后等体降压到1atm的压强, 求:(1)气体在全过程中内能的改变;(2)气体在全过程 中所作的功和吸收的热量。
J
Wadb Qadb 4.54103 J E 0
第16页/共20页
4.如图示,为1摩尔理想气体(其 )。ln 2 0.69
C p 5 )的循环过程(
高考物理大一轮复习第13章选考部分第3讲热力学定律学案新人教版(2021年整理)
2019年高考物理大一轮复习第13章选考部分第3讲热力学定律学案新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019年高考物理大一轮复习第13章选考部分第3讲热力学定律学案新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019年高考物理大一轮复习第13章选考部分第3讲热力学定律学案新人教版的全部内容。
第三讲热力学定律1.判断正误(1)自然界进行的涉及热现象的宏观过程都具有方向性,是不可逆的.()(2)功转变为热的实际宏观过程一定是可逆过程.( )(3)空调既能制热又能制冷,说明热传递不存在方向性.( )(4)不断改进工艺,热机的效率可能达到100%。
()(5)热量不可以自发地从低温物体传递到高温物体,是因为违背了热力学第一定律.()答案:(1)√(2)×(3)×(4)×(5)×2.一定质量的理想气体在某一过程中,外界对气体做功7.0×104 J,气体内能减少1.3×105 J,则此过程()A.气体从外界吸收热量2。
0×105 JB.气体向外界放出热量2.0×105 JC.气体从外界吸收热量6.0×104 JD.气体向外界放出热量6.0×104 J答案:B3.木箱静止于水平地面上,现在用一个80 N的水平推力推动木箱前进10 m,木箱受到的摩擦力为60 N,则转化为木箱与地面系统的内能U和转化为木箱的动能E k分别是()A.U=200 J,E k=600 JB.U=600 J,E k=200 JC.U=600 J,E k=800 JD.U=800 J,E k=200 J答案:B4.(人教版选修3-3P61第2题改编)(多选)下列现象中能够发生的是( )A.一杯热茶在打开杯盖后,茶会自动变得更热B.蒸汽机把蒸汽的内能全部转化成机械能C.桶中混浊的泥水在静置一段时间后,泥沙下沉,上面的水变清,泥、水自动分离D.电冰箱通电后把箱内低温物体的热量传到箱外高温物体答案:CD考点一热力学第一定律与能量守恒定律1.对公式符号W QΔU+外界对物体做功物体吸收热量内能增加-物体对外界做功物体放出热量内能减少2①若过程是绝热的,则Q=0,W=ΔU,外界对物体做的功等于物体内能的增加.②若过程中不做功,即W=0,则Q=ΔU,物体吸收的热量等于物体内能的增加.③若过程的始末状态物体的内能不变,即ΔU=0,则W+Q=0或W=-Q,外界对物体做的功等于物体放出的热量.1.(2015·北京卷)下列说法正确的是()A.物体放出热量,其内能一定减小B.物体对外做功,其内能一定减小C.物体吸收热量,同时对外做功,其内能可能增加D.物体放出热量,同时对外做功,其内能可能不变解析:选C 根据热力学第一定律ΔU=W+Q可知,若外界对物体做功,物体放出热量,内能可能增加,选项A错误;物体对外界做功,若同时吸收热量,内能可能增加,选项B错误,C正确;物体放出热量,同时对外做功,其内能一定减小,选项D错误.2.(2016·全国卷Ⅲ)(多选)关于气体的内能,下列说法正确的是( )A.质量和温度都相同的气体,内能一定相同B.气体温度不变,整体运动速度越大,其内能越大C.气体被压缩时,内能可能不变D.一定量的某种理想气体的内能只与温度有关E.一定量的某种理想气体在等压膨胀过程中,内能一定增加解析:选CDE 物体内大量分子做无规则运动具有的动能和分子势能的总和叫内能.质量和温度都相同的气体,内能不一定相同,其内能还与气体的体积和压强等有关,故选项A错误;气体内能的大小与气体的质量和温度等有关,而与气体的运动速度无关,故宏观速度增大,不会影响内能,选项B错误;气体被压缩时外界对气体做功,若在此过程中同时放出热量,根据ΔU =W+Q可知,内能可能不变,选项C正确;由于理想气体是理想化的物理模型,其内能只考虑分子动能,表现在宏观上只与温度有关,选项D正确;一定量的某种理想气体在等压膨胀过程中,温度一定升高,内能一定增加,选项E 正确.考点二热力学第二定律1(1)“自发地”指明了热传递等热力学宏观现象的方向性,不需要借助外界提供能量的帮助.(2)“不产生其他影响”的含义是发生的热力学宏观过程只在本系统内完成,对周围环境不产生热力学方面的影响.如吸热、放热、做功等2.热力学第二定律的实质热力学第二定律的每一种表述,都揭示了大量分子参与宏观过程的方向性,进而使人们认识到自然界中进行的涉及热现象的宏观过程都具有方向性.3.热力学过程方向性实例:①高温物体错误!低温物体②功错误!热③气体体积V1错误!气体体积V2(较大)④不同气体A和B错误!混合气体AB4.热力学第一、第二定律的比较热力学第一定律热力学第二定律定律揭示的问题它从能量守恒的角度揭示了功、热量和内能改变量三者的定量关系它指出自然界中出现的过程是有方向性的机械能和内能的转化当摩擦力做功时,机械能可以全部转化为内能内能不可能在不引起其他变化的情况下完全变成机械能表述形式只有一种表述形式有多种表述形式两定律的关系在热力学中,两者既相互独立,又互为补充,共同构成了热力学知识的理论基础3.(2018·辽宁锦州联考)(多选)下列叙述中正确的是( )A.热力学第二定律可描述为“不可能使热量由低温物体传递到高温物体”B.分子间的相互作用力随着分子间距离的增大,一定先减小后增大C.只要知道水的摩尔质量和水分子的质量,就可以计算出阿伏加德罗常数D.由于液体表面分子间距离大于液体内部分子间距离,液体表面分子间表现为引力,所以液体表面具有收缩的趋势E.用活塞压缩汽缸内的理想气体,对气体做了3。
高考物理大一轮复习 第十三章 热学教师用书(选修33)
第十三章热学(选修3-3)第69课时分子动理论内能(双基落实课)[命题者说] 本课时内容既是高考选考内容,又是热学最基本的知识,因此高考针对这些内容命题时,难度不会很大。
在复习这部分内容时,只需全面复习,不需要过深的挖掘。
1.(1)分子的大小①一般无机分子直径的数量级约为:10-10 m。
②一般无机分子质量的数量级约为:10-26 kg。
(2)阿伏加德罗常数:指1 mol的任何物质中含有相同的微粒个数,用符号N A表示,N A =6.02×1023 mol-1。
2.分子热运动:指分子永不停息的无规则运动(1)扩散现象:指相互接触的不同物质彼此进入对方的现象。
温度越高,扩散越快;扩散可在固体、液体、气体中进行。
(2)布朗运动:指悬浮在液体(或气体)中的微粒的无规则运动。
微粒越小,温度越高,布朗运动越显著。
3.分子间的相互作用力分子间同时存在引力和斥力,且都随分子间距离的增大而减小,随分子间距离的减小而增大,但总是斥力变化得较快,如图所示。
(1)当r=r0时,F引=F斥,F=0;(2)当r<r0时,F引和F斥都随距离的减小而增大,但F引<F斥,F表现为斥力;(3)当r>r0时,F引和F斥都随距离的增大而减小,但F引>F斥,F表现为引力;(4)当r>10r0(10-9 m)时,F引和F斥都已经十分微弱,可以认为分子间没有相互作用力(F=0)。
[小题练通]1.(2016·北京高考)雾霾天气是对大气中各种悬浮颗粒物含量超标的笼统表述,是特定气候条件与人类活动相互作用的结果。
雾霾中,各种悬浮颗粒物形状不规则,但可视为密度相同、直径不同的球体,并且PM10、PM2.5分别表示球体直径小于或等于10 μm、2.5 μm 的颗粒物(PM是颗粒物的英文缩写)。
某科研机构对北京地区的检测结果表明,在静稳的雾霾天气中,近地面高度百米的范围内,PM10的浓度随高度的增加略有减小,大于PM10的大悬浮颗粒物的浓度随高度的增加明显减小,且两种浓度分布基本不随时间变化。
大学物理第十三章课后习题答案
第十三章 热力学基础13 -1 如图所示,bca 为理想气体绝热过程,b1a 和b2a 是任意过程,则上述两过程中气体作功与吸收热量的情况是( )(A) b1a 过程放热,作负功;b2a 过程放热,作负功(B) b1a 过程吸热,作负功;b2a 过程放热,作负功(C) b1a 过程吸热,作正功;b2a 过程吸热,作负功(D) b1a 过程放热,作正功;b2a 过程吸热,作正功分析与解 bca ,b1a 和b2a 均是外界压缩系统,由⎰=V p W d 知系统经这三个过程均作负功,因而(C)、(D)不对.理想气体的内能是温度的单值函数,因此三个过程初末态内能变化相等,设为ΔE .对绝热过程bca ,由热力学第一定律知ΔE =-W bca .另外,由图可知:|W b2a |>|W bca |>|W b1a |,则W b2a <W bca <W b1a .对b1a 过程:Q =ΔE +W b1a >ΔE +W bca =0 是吸热过程.而对b2a 过程:Q =ΔE +W b2a <ΔE +W bca =0 是放热过程.可见(A)不对,正确的是(B).13 -2 如图,一定量的理想气体,由平衡态A 变到平衡态B ,且它们的压强相等,即p A =p B ,请问在状态A 和状态B 之间,气体无论经过的是什么过程,气体必然( )(A) 对外作正功 (B) 内能增加(C) 从外界吸热 (D) 向外界放热分析与解 由p -V 图可知,p A V A <p B V B ,即知T A <T B ,则对一定量理想气体必有E B >E A .即气体由状态A 变化到状态B,内能必增加.而作功、热传递是过程量,将与具体过程有关.所以(A)、(C)、(D)不是必然结果,只有(B)正确.13 -3 两个相同的刚性容器,一个盛有氢气,一个盛氦气(均视为刚性分子理想气体).开始时它们的压强和温度都相同,现将3J 热量传给氦气,使之升高到一定的温度.若使氢气也升高同样的温度,则应向氢气传递热量为( )(A) 6J (B) 3 J (C) 5 J (D) 10 J分析与解 当容器体积不变,即为等体过程时系统不作功,根据热力学第一定律Q =ΔE +W ,有Q =ΔE .而由理想气体内能公式T R i M m E Δ2Δ=,可知欲使氢气和氦气升高相同温度,须传递的热量 ⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛=e e e 222e 2H H H H H H H H /:i M m i M m Q Q .再由理想气体物态方程pV =mM RT ,初始时,氢气和氦气是具有相同的温度、压强和体积,因而物质的量相同,则3/5/:e 2e 2H H H H ==i i Q Q .因此正确答案为(C).13 -4 有人想像了四个理想气体的循环过程,则在理论上可以实现的为( )分析与解由绝热过程方程pVγ=常量,以及等温过程方程pV=常量,可知绝热线比等温线要陡,所以(A)过程不对,(B)、(C)过程中都有两条绝热线相交于一点,这是不可能的.而且(B)过程的循环表明系统从单一热源吸热且不引起外界变化,使之全部变成有用功,违反了热力学第二定律.因此只有(D)正确.13 -5一台工作于温度分别为327 ℃和27 ℃的高温热源与低温源之间的卡诺热机,每经历一个循环吸热2 000 J,则对外作功()(A) 2 000J(B) 1 000J(C) 4 000J(D) 500J分析与解热机循环效率η=W/Q吸,对卡诺机,其循环效率又可表为:η=1-T2 /T1,则由W /Q吸=1 -T2 /T1可求答案.正确答案为(B).13 -6根据热力学第二定律()(A) 自然界中的一切自发过程都是不可逆的(B) 不可逆过程就是不能向相反方向进行的过程(C) 热量可以从高温物体传到低温物体,但不能从低温物体传到高温物体(D) 任何过程总是沿着熵增加的方向进行分析与解 对选项(B):不可逆过程应是指在不引起其他变化的条件下,不能使逆过程重复正过程的每一状态,或者虽然重复但必然会引起其他变化的过程.对选项(C):应是热量不可能从低温物体自动传到高温物体而不引起外界的变化.对选项(D):缺少了在孤立系统中这一前提条件.只有选项(A)正确. 13 -7 位于委内瑞拉的安赫尔瀑布是世界上落差最大的瀑布,它高979m.如果在水下落的过程中,重力对它所作的功中有50%转换为热量使水温升高,求水由瀑布顶部落到底部而产生的温差.( 水的比热容c 为4.18×103 J·kg-1·K -1 ) 分析 取质量为m 的水作为研究对象,水从瀑布顶部下落到底部过程中重力作功W =mgh ,按题意,被水吸收的热量Q =0.5W ,则水吸收热量后升高的温度可由Q =mc ΔT 求得.解 由上述分析得mc ΔT =0.5mgh水下落后升高的温度ΔT =0.5gh /c =1.15K13 -8 如图所示,一定量的空气,开始在状态A ,其压强为2.0×105Pa ,体积为2.0 ×10-3m 3 ,沿直线AB 变化到状态B 后,压强变为1.0 ×105Pa ,体积变为3.0 ×10-3m 3 ,求此过程中气体所作的功.分析 理想气体作功的表达式为()⎰=V V p W d .功的数值就等于p -V 图中过程曲线下所对应的面积.解 S ABCD =1/2(BC +AD)×CD故 W =150 J13 -9 汽缸内储有2.0mol 的空气,温度为27 ℃,若维持压强不变,而使空气的体积膨胀到原体积的3s 倍,求空气膨胀时所作的功.分析 本题是等压膨胀过程,气体作功()1221d V V p V p W V V -==⎰,其中压强p 可通过物态方程求得.解 根据物态方程11RT pV v =,汽缸内气体的压强11/V RT p v = ,则作功为 ()()J 1097.92/31112112⨯==-=-=RT V V V RT V V p W v v13 -10 一定量的空气,吸收了1.71×103J 的热量,并保持在1.0 ×105Pa 下膨胀,体积从1.0×10-2m 3 增加到1.5×10-2m 3 ,问空气对外作了多少功? 它的内能改变了多少?分析 由于气体作等压膨胀,气体作功可直接由W =p (V 2 -V 1 )求得.取该空气为系统,根据热力学第一定律Q =ΔE +W 可确定它的内能变化.在计算过程中要注意热量、功、内能的正负取值.解 该空气等压膨胀,对外作功为W =p (V 2-V 1 )=5.0 ×102J其内能的改变为Q =ΔE +W =1.21 ×103J13 -11 0.1kg 的水蒸气自120 ℃加热升温到140℃,问(1) 在等体过程中;(2) 在等压过程中,各吸收了多少热量? 根据实验测定,已知水蒸气的摩尔定压热容C p,m =36.21J·mol -1·K -1,摩尔定容热容C V,m =27.82J·mol -1·K -1. 分析 由量热学知热量的计算公式为T C Q m Δv =.按热力学第一定律,在等体过程中,T C E Q ΔΔm V,V v ==;在等压过程中, T C E V p Q ΔΔd m p,p v =+=⎰.解 (1) 在等体过程中吸收的热量为J 101.3ΔΔ3m V,V ⨯===T C Mm E Q (2) 在等压过程中吸收的热量为 ()J 100.4Δd 312m p,p ⨯=-=+=⎰T T C M m E V p Q 13 -12 如图所示,在绝热壁的汽缸内盛有1mol 的氮气,活塞外为大气,氮气的压强为1.51 ×105 Pa ,活塞面积为0.02m 2 .从汽缸底部加热,使活塞缓慢上升了0.5m.问(1) 气体经历了什么过程? (2) 汽缸中的气体吸收了多少热量? (根据实验测定,已知氮气的摩尔定压热容C p ,m =29.12J·mol -1·K -1,摩尔定容热容C V,m =20.80J·mol -1·K -1 )分析 因活塞可以自由移动,活塞对气体的作用力始终为大气压力和活塞重力之和.容器内气体压强将保持不变.对等压过程,吸热T C Q Δm p,p v =.ΔT 可由理想气体物态方程求出.解 (1) 由分析可知气体经历了等压膨胀过程.(2) 吸热T C Q Δm p,p v =.其中ν =1 mol ,C p,m =29.12J·mol -1·K-1.由理想气体物态方程pV =νRT ,得ΔT =(p 2V 2 -p 1 V 1 )/R =p(V 2 -V 1 )/R =p· S· Δl /R则 J 105.293m p,p ⨯==pS ΔSΔl C Q13 -13 一压强为1.0 ×105Pa,体积为1.0×10-3m 3的氧气自0℃加热到100 ℃.问:(1) 当压强不变时,需要多少热量?当体积不变时,需要多少热量?(2) 在等压或等体过程中各作了多少功?分析 (1) 求Q p 和Q V 的方法与题13-11相同.(2) 求过程的作功通常有两个途径.① 利用公式()V V p W d ⎰=;② 利用热力学第一定律去求解.在本题中,热量Q 已求出,而内能变化可由()12m V,V ΔT T C E Q -==v 得到.从而可求得功W .解 根据题给初态条件得氧气的物质的量为mol 1041.4/2111-⨯===RT V p Mm v 氧气的摩尔定压热容R C 27m p,=,摩尔定容热容R C 25m V,=. (1) 求Q p 、Q V等压过程氧气(系统)吸热()J 1.128Δd 12m p,p =-=+=⎰T T C E V p Q v等体过程氧气(系统)吸热()J 5.91Δ12m V,V =-==T T C E Q v(2) 按分析中的两种方法求作功值解1 ① 利用公式()V V p W d ⎰=求解.在等压过程中,T R Mm V p W d d d ==,则得 J 6.36d d 21p ===⎰⎰T T T R Mm W W 而在等体过程中,因气体的体积不变,故作功为()0d V ==⎰V V p W② 利用热力学第一定律Q =ΔE +W 求解.氧气的内能变化为()J 5.91Δ12m V,V =-==T T C Mm E Q 由于在(1) 中已求出Q p 与Q V ,则由热力学第一定律可得在等压过程、等体过程中所作的功分别为J 6.36Δp p =-=E Q W0ΔV V =-=E Q W13 -14 如图所示,系统从状态A 沿ABC 变化到状态C 的过程中,外界有326J 的热量传递给系统,同时系统对外作功126J.当系统从状态C 沿另一曲线CA 返回到状态A 时,外界对系统作功为52J ,则此过程中系统是吸热还是放热?传递热量是多少?分析 已知系统从状态C 到状态A ,外界对系统作功为W CA ,如果再能知道此过程中内能的变化ΔE AC ,则由热力学第一定律即可求得该过程中系统传递的热量Q CA .由于理想气体的内能是状态(温度)的函数,利用题中给出的ABC 过程吸热、作功的情况,由热力学第一定律即可求得由A 至C 过程中系统内能的变化ΔE AC ,而ΔE AC =-ΔE AC ,故可求得Q CA .解 系统经ABC 过程所吸收的热量及对外所作的功分别为Q ABC =326J , W ABC =126J则由热力学第一定律可得由A 到C 过程中系统内能的增量ΔE AC =Q ABC -W ABC =200J由此可得从C 到A ,系统内能的增量为ΔE CA =-200J从C 到A ,系统所吸收的热量为Q CA =ΔE CA +W CA =-252J式中负号表示系统向外界放热252 J.这里要说明的是由于CA 是一未知过程,上述求出的放热是过程的总效果,而对其中每一微小过程来讲并不一定都是放热.13 -15 如图所示,一定量的理想气体经历ACB 过程时吸热700J ,则经历ACBDA 过程时吸热又为多少?分析 从图中可见ACBDA 过程是一个循环过程.由于理想气体系统经历一个循环的内能变化为零,故根据热力学第一定律,循环系统净吸热即为外界对系统所作的净功.为了求得该循环过程中所作的功,可将ACBDA 循环过程分成ACB 、BD 及DA 三个过程讨论.其中BD 及DA 分别为等体和等压过程,过程中所作的功按定义很容易求得;而ACB 过程中所作的功可根据上题同样的方法利用热力学第一定律去求.解 由图中数据有p A V A =p B V B ,则A 、B 两状态温度相同,故ACB 过程内能的变化ΔE CAB =0,由热力学第一定律可得系统对外界作功W CAB =Q CAB -ΔE CAB =Q CAB =700J在等体过程BD 及等压过程DA 中气体作功分别为()⎰==0d BD V V p W()⎰-=-==J 1200d 12A DA V V P V p W则在循环过程ACBDA 中系统所作的总功为J 500DA BD ACB -=++=W W W W负号表示外界对系统作功.由热力学第一定律可得,系统在循环中吸收的总热量为J 500-==W Q负号表示在此过程中,热量传递的总效果为放热.13 -16 在温度不是很低的情况下,许多物质的摩尔定压热容都可以用下式表示2m p,2--+=cT bT a C式中a 、b 和c 是常量,T 是热力学温度.求:(1) 在恒定压强下,1 mol 物质的温度从T 1升高到T 2时需要的热量;(2) 在温度T 1 和T 2 之间的平均摩尔热容;(3) 对镁这种物质来说,若C p ,m 的单位为J·mol -1·K -1,则a =25.7J·mol -1·K-1 ,b =3.13 ×10-3J·mol -1·K-2,c =3.27 ×105J·mol -1·K.计算镁在300K时的摩尔定压热容C p,m ,以及在200K和400K之间C p,m 的平均值. 分析 由题目知摩尔定压热容C p,m 随温度变化的函数关系,则根据积分式⎰=21d m p,p T T T C Q 即可求得在恒定压强下,1mol 物质从T 1 升高到T 2所吸收的热量Qp .故温度在T 1 至T 2之间的平均摩尔热容()12p m p,/T T Q C -=. 解 (1) 11 mol 物质从T 1 升高到T 2时吸热为()()()()11122122122m p,p d 2d 21----+-+-=-+==⎰⎰T T c T T b T T a T cT bT a T C Q T T (2) 在T 1 和T 2 间的平均摩尔热容为()()21212p m p,//T T c T T a T T Q C -+=-=(3) 镁在T =300 K 时的摩尔定压热容为-1-12m p,K mol J 9.232⋅⋅=-+=-cT bT a C镁在200 K 和400 K 之间C p ,m 的平均值为()-1-12112m p,K mol J 5.23/⋅⋅=-+=T T c T T a C13 -17 空气由压强为1.52×105 Pa ,体积为5.0×10-3m 3 ,等温膨胀到压强为1.01×105 Pa ,然后再经等压压缩到原来的体积.试计算空气所作的功. 解 空气在等温膨胀过程中所作的功为()()2111121T /ln /ln p p V p V V RT Mm W == 空气在等压压缩过程中所作的功为()⎰-==12d V V p V p W利用等温过程关系p 1 V 1 =p 2 V 2 ,则空气在整个过程中所作的功为()J 7.55/ln 11122111=-+=+=V p V p p p V p W W W T p13 -18 如图所示,使1mol 氧气(1) 由A 等温地变到B ;(2) 由A 等体地变到C ,再由C 等压地变到B.试分别计算氧气所作的功和吸收的热量.分析 从p -V 图(也称示功图)上可以看出,氧气在AB 与ACB 两个过程中所作的功是不同的,其大小可通过()V V p W d ⎰=求出.考虑到内能是状态的函数,其变化值与过程无关,所以这两个不同过程的内能变化是相同的,而且因初、末状态温度相同T A =T B ,故ΔE =0,利用热力学第一定律Q =W +ΔE ,可求出每一过程所吸收的热量.解 (1) 沿AB 作等温膨胀的过程中,系统作功()()J 1077.2/ln /ln 31⨯===A B B A A B AB V V V p V V RT Mm W 由分析可知在等温过程中,氧气吸收的热量为Q AB =W AB =2.77 ×103J (2) 沿A 到C 再到B 的过程中系统作功和吸热分别为W ACB =W AC +W CB =W CB =p C (V B -V C )=2.0×103JQ ACB =W A CB =2.0×103 J13 -19 将体积为1.0 ×10-4m 3 、压强为1.01×105Pa 的氢气绝热压缩,使其体积变为2.0 ×10-5 m 3 ,求压缩过程中气体所作的功.(氢气的摩尔定压热容与摩尔定容热容比值γ=1.41)分析 可采用题13-13 中气体作功的两种计算方法.(1) 气体作功可由积分V p W d ⎰=求解,其中函数p (V )可通过绝热过程方程pV C γ= 得出.(2)因为过程是绝热的,故Q =0,因此,有W =-ΔE ;而系统内能的变化可由系统的始末状态求出.解 根据上述分析,这里采用方法(1)求解,方法(2)留给读者试解.设p 、V 分别为绝热过程中任一状态的压强和体积,则由γγpV V p =11得 γγV V p p -=11氢气绝热压缩作功为J 0.231d d 121211121-=⎥⎦⎤⎢⎣⎡-⎥⎦⎤⎢⎣⎡-===⎰⎰-V V V V γp V V V p V p W V V γγ 13 -20 试验用的火炮炮筒长为3.66 m ,内膛直径为0.152 m ,炮弹质量为45.4kg ,击发后火药爆燃完全时炮弹已被推行0.98 m ,速度为311 m·s -1 ,这时膛内气体压强为2.43×108Pa.设此后膛内气体做绝热膨胀,直到炮弹出口.求(1) 在这一绝热膨胀过程中气体对炮弹作功多少?设摩尔定压热容与摩尔定容热容比值为 1.2γ=.(2) 炮弹的出口速度(忽略摩擦).分析 (1) 气体绝热膨胀作功可由公式1d 2211--==⎰γV p V p V p W 计算.由题中条件可知绝热膨胀前后气体的体积V 1和V 2,因此只要通过绝热过程方程γγV p V p 2211=求出绝热膨胀后气体的压强就可求出作功值.(2) 在忽略摩擦的情况下,可认为气体所作的功全部用来增加炮弹的动能.由此可得到炮弹速度.解 由题设l =3.66 m,D =0.152 m ,m =45.4 kg ,l 1=0.98 m ,v 1=311 m·s -1 ,p 1 =2.43×108Pa ,γ=1.2.(1) 炮弹出口时气体压强为()()Pa 1000.5//7112112⨯===γγl l p V V p p 气体作功J 1000.54π11d 6222112211⨯=--=--==⎰D γl p l p γV p V p V p W (2) 根据分析2122121v v m m W -=,则 -121s m 563⋅=+=v 2W/m v13 -21 1mol 氢气在温度为300K,体积为0.025m 3 的状态下,经过(1)等压膨胀,(2)等温膨胀,(3)绝热膨胀.气体的体积都变为原来的两倍.试分别计算这三种过程中氢气对外作的功以及吸收的热量.分析 这三个过程是教材中重点讨论的过程.在p -V 图上,它们的过程曲线如图所示.由图可知过程(1 ) 作功最多, 过程( 3 ) 作功最少.温度T B >T C >T D ,而过程(3) 是绝热过程,因此过程(1)和(2)均吸热,且过程(1)吸热多.具体计算时只需直接代有关公式即可.解 (1) 等压膨胀()()J 1049.23⨯==-=-=A A B AA AB A p RT V V V RT V V p W v()J 1073.8273,,⨯===-=+=A A m p A B m p p p T R T C T T C E ΔW Q v v (2) 等温膨胀 J 1073.12ln /3⨯===A A RT V W C T vRTlnV对等温过程ΔE =0,所以J 1073.13⨯==T T W Q(3) 绝热膨胀T D =T A (V A /V D )γ-1=300 ×(0.5)0.4=227.4K对绝热过程a 0Q =,则有 ()()J 1051.125Δ3,⨯=-=-=-=D A D A m V a T T R T T C E W v 13 -22 绝热汽缸被一不导热的隔板均分成体积相等的A 、B 两室,隔板可无摩擦地平移,如图所示.A 、B 中各有1mol 氮气,它们的温度都是T0 ,体积都是V0 .现用A 室中的电热丝对气体加热,平衡后A 室体积为B 室的两倍,试求(1) 此时A 、B 两室气体的温度;(2) A 中气体吸收的热量.分析 (1) B 室中气体经历的是一个绝热压缩过程,遵循绝热方程TVγ-1 =常数,由此可求出B 中气体的末态温度TB .又由于A 、B 两室中隔板可无摩擦平移,故A 、B 两室等压.则由物态方程pV A =νRT A 和pV B =νRT B 可知T A =2T B .(2) 欲求A 室中气体吸收的热量,我们可以有两种方法.方法一:视A 、B 为整体,那么系统(汽缸)对外不作功,吸收的热量等于系统内能的增量.即QA =ΔE A +ΔE B .方法二:A 室吸热一方面提高其内能ΔE A ,另外对“外界”B 室作功WA.而对B 室而言,由于是绝热的,“外界” 对它作的功就全部用于提高系统的内能ΔEB .因而在数值上W A =ΔE B .同样得到Q A =ΔE A +ΔE B . 解 设平衡后A 、B 中气体的温度、体积分别为T A ,T B 和V A ,V B .而由分析知压强p A =p B =p .由题已知⎩⎨⎧=+=022V V V V V B A B A ,得⎩⎨⎧==3/23/400V V V V B A (1) 根据分析,对B 室有B γB γT V T V 1010--=得 ()0010176.1/T T V V T γB B ==-;0353.2T T T B A ==(2) ()()0007.312525ΔΔT T T R T T R E E Q B A A A A =-+-=+= 13-23 0.32 kg 的氧气作如图所示的ABCDA 循环,V 2 =2V 1 ,T 1=300K,T 2=200K,求循环效率.分析 该循环是正循环.循环效率可根据定义式η=W /Q 来求出,其中W 表示一个循环过程系统作的净功,Q 为循环过程系统吸收的总热量.解 根据分析,因AB 、CD 为等温过程,循环过程中系统作的净功为()()()J 1076.5/ln /ln 32121211⨯=-==+=V V T T R M m V V RT Mm W W W CD AB由于吸热过程仅在等温膨胀(对应于AB 段)和等体升压(对应于DA 段)中发生,而等温过程中ΔE =0,则AB AB W Q =.等体升压过程中W =0,则DA DA E Q Δ=,所以,循环过程中系统吸热的总量为()()()()J 1081.325/ln /ln Δ42112121,121⨯=-+=-+=+=+=T T R M m V V RT Mm T T C M m V V RT Mm E W Q Q Q m V DAAB DA AB 由此得到该循环的效率为 %15/==Q W η13 -24 图(a)是某单原子理想气体循环过程的V -T 图,图中V C =2V A .试问:(1) 图中所示循环是代表制冷机还是热机? (2) 如是正循环(热机循环),求出其循环效率.分析 以正、逆循环来区分热机和制冷机是针对p -V 图中循环曲线行进方向而言的.因此,对图(a)中的循环进行分析时,一般要先将其转换为p -V 图.转换方法主要是通过找每一过程的特殊点,并利用理想气体物态方程来完成.由图(a)可以看出,BC 为等体降温过程,CA 为等温压缩过程;而对AB 过程的分析,可以依据图中直线过原点来判别.其直线方程为V =CT ,C 为常数.将其与理想气体物态方程pV =m/MRT 比较可知该过程为等压膨胀过程(注意:如果直线不过原点,就不是等压过程).这样,就可得出p -V 图中的过程曲线,并可判别是正循环(热机循环)还是逆循环(制冷机循环),再参考题13-23的方法求出循环效率.解 (1) 根据分析,将V -T 图转换为相应的p -V 图,如图(b)所示.图中曲线行进方向是正循环,即为热机循环.(2) 根据得到的p -V 图可知,AB 为等压膨胀过程,为吸热过程.BC 为等体降压过程,CA 为等温压缩过程,均为放热过程.故系统在循环过程中吸收和放出的热量分别为()A B m p T T C M m Q -=,1 ()()A C A A B m V V V RT Mm T T C M m Q /ln ,2+-= CA 为等温线,有T A =T C ;AB 为等压线,且因V C =2V A ,则有T A =T B /2.对单原子理想气体,其摩尔定压热容C p ,m =5R/2,摩尔定容热容C V ,m =3R/2.故循环效率为()()3/125/2ln 2312/5/2ln 321/112=+-=⎥⎦⎤⎢⎣⎡+-=-=A A A T T T Q Q η 13 -25 一卡诺热机的低温热源温度为7℃,效率为40%,若要将其效率提高到50%,问高温热源的温度需提高多少?解 设高温热源的温度分别为1T '、1T '',则有12/1T T η'-=', 12/1T T η''-=''其中T 2 为低温热源温度.由上述两式可得高温热源需提高的温度为K 3.931111Δ211=⎪⎪⎭⎫ ⎝⎛'--''-='-''=T ηηT T T 13 -26 一定量的理想气体,经历如图所示的循环过程.其中AB 和CD 是等压过程,BC 和DA 是绝热过程.已知B 点温度T B =T 1,C 点温度T C =T 2.(1) 证明该热机的效率η=1-T 2/T 1 ,(2) 这个循环是卡诺循环吗?分析 首先分析判断循环中各过程的吸热、放热情况.BC 和DA 是绝热过程,故Q BC 、Q DA 均为零;而AB 为等压膨胀过程(吸热)、CD 为等压压缩过程(放热),这两个过程所吸收和放出的热量均可由相关的温度表示.再利用绝热和等压的过程方程,建立四点温度之间的联系,最终可得到求证的形式. 证 (1) 根据分析可知 ()()⎪⎪⎭⎫ ⎝⎛-⎪⎪⎭⎫ ⎝⎛--=---=---=-=B A C D B C A B D CA B m p C D m p AB CD T T T T T T T T T T T T C MT T C M m Q Q η1/11111,, (1) 与求证的结果比较,只需证得BA C D T T T T = .为此,对AB 、CD 、BC 、DA 分别列出过程方程如下V A /T A =V B /T B (2)V C /T C =V D /T D (3) C γC B γB T V T V 11--= (4)A γA D γD T V T V 11--= (5)联立求解上述各式,可证得η=1-T C /T B =1-T 2/T 1(2) 虽然该循环效率的表达式与卡诺循环相似,但并不是卡诺循环.其原因是:① 卡诺循环是由两条绝热线和两条等温线构成,而这个循环则与卡诺循环不同;② 式中T 1、T 2的含意不同,本题中T 1、T 2只是温度变化中两特定点的温度,不是两等温热源的恒定温度.13 -27 一小型热电厂内,一台利用地热发电的热机工作于温度为227℃的地下热源和温度为27℃的地表之间.假定该热机每小时能从地下热源获取1.8 ×1011J的热量.试从理论上计算其最大功率为多少?分析 热机必须工作在最高的循环效率时,才能获取最大的功率.由卡诺定理可知,在高温热源T 1和低温热源T 2之间工作的可逆卡诺热机的效率最高,其效率为η=1-T 2/T 1 .由于已知热机在确定的时间内吸取的热量,故由效率与功率的关系式Q pt Q W η//==,可得此条件下的最大功率.解 根据分析,热机获得的最大功率为()-1712s J 100.2//1/⋅⨯=-==t Q T T t Q ηp13 -28 有一以理想气体为工作物质的热机,其循环如图所示,试证明热()()1/1/12121---=p p V V γη 分析 该热机由三个过程组成,图中AB 是绝热过程,BC 是等压压缩过程,CA 是等体升压过程.其中CA 过程系统吸热,BC 过程系统放热.本题可从效率定义CA BC Q Q Q Q η/1/112-=-=出发,利用热力学第一定律和等体、等压方程以及γ=C p,m 桙C V,m 的关系来证明.证 该热机循环的效率为CA BC Q Q Q Q η/1/112-=-=其中Q BC =m /M C p,m (T C -T B ),Q CA =m/M C V,m (T A -T C ),则上式可写为1/1/11---=---=C A CB C A B C T T T T γT T T T γη 在等压过程BC 和等体过程CA 中分别有T B /V 1 =T C /V 2,T A /P 1 =T C /P 2,代入上式得()()1/1/12121---=p p V V γη 13 -29 如图所示为理想的狄赛尔(Diesel)内燃机循环过程,它由两绝热线AB 、CD 和等压线BC 及等体线DA 组成.试证此内燃机的效率为()()()1//1/12312123---=-V V V V γV V ηγγ证 求证方法与题13-28相似.由于该循环仅在DA 过程中放热、BC 过程中吸热,则热机效率为 ()()BC AD B C m p A D m V BCDA T T T T γT T C M T T C M m Q Q η---=---=-=111/1,, (1) 在绝热过程AB 中,有1211--=γB γA V T V T ,即()121//-=γA B V V T T (2)在等压过程BC 中,有23//V T V T B C =,即23//V V T T B C = (3)再利用绝热过程CD,得1311--=γC γD V T V T (4)解上述各式,可证得()()()1//1/12312123---=-V V V V γV V ηγγ 13 -30 如图所示,将两部卡诺热机连接起来,使从一个热机输出的热量,输入到另一个热机中去.设第一个热机工作在温度为T 1和T 2的两热源之间,其效率为η1 ,而第二个热机工作在温度为T 2 和T 3 的两热源之间,其效率为η2.如组合热机的总效率以η=(W 1 +W 2 )/Q 1 表示.试证总效率表达式为η=(1 -η1 )η2 +η1 或 η=1 -T 3/T 1分析 按效率定义,两热机单独的效率分别为η1=W 1 /Q 1和η2=W 2 /Q 2,其中W 1 =Q 1-Q 2 ,W 2 =Q 2-Q 3 .第一个等式的证明可采用两种方法:(1) 从等式右侧出发,将η1 、η2 的上述表达式代入,即可得证.读者可以一试.(2) 从等式左侧的组合热机效率η=(W 1 +W 2 )/Q 1出发,利用η1、η2的表达式,即可证明.由于卡诺热机的效率只取决于两热源的温度,故只需分别将两个卡诺热机的效率表达式η1=1-T 2 /T 1 和η2=1-T 3 /T 2 代入第一个等式,即可得到第二个等式.证 按分析中所述方法(2) 求证.因η1=W 1 /Q 1 、η2=W 2 /Q 2 ,则组合热机效率12211211121Q Q ηηQ W Q W Q W W η+=+=+= (1) 以Q 2 =Q 1-W 1 代入式(1) ,可证得η=η1 +η2 (1-η1 ) (2) 将η1=1-T 2 /T 1 和η2=1-T 3 /T 2代入式(2),亦可证得η=1-T 2 /T 1 +(1-T 3 /T 2 )T 2 /T 1 =1-T 3 /T 113 -31 在夏季,假定室外温度恒定为37℃,启动空调使室内温度始终保持在17 ℃.如果每天有2.51 ×108 J 的热量通过热传导等方式自室外流入室内,则空调一天耗电多少? (设该空调制冷机的制冷系数为同条件下的卡诺制冷机制冷系数的60%)分析 耗电量的单位为kW·h ,1kW·h =3.6 ×106J.图示是空调的工作过程示意图.因为卡诺制冷机的制冷系数为212T T T e k -=,其中T 1为高温热源温度(室外环境温度),T 2为低温热源温度(室内温度).所以,空调的制冷系数为e =e k · 60% =0.6 T 2/( T 1 -T 2 )另一方面,由制冷系数的定义,有e =Q 2 /(Q 1 -Q 2 )其中Q 1为空调传递给高温热源的热量,即空调向室外排放的总热量;Q 2是空调从房间内吸取的总热量.若Q ′为室外传进室内的热量,则在热平衡时Q 2=Q ′.由此,就可以求出空调的耗电作功总值W =Q 1-Q 2 .解 根据上述分析,空调的制冷系数为7.8%60212=-=T T T e在室内温度恒定时,有Q 2=Q ′.由e =Q 2 /(Q 1-Q 2 )可得空调运行一天所耗电功W =Q 1-Q 2=Q 2/e =Q ′/e =2.89×107=8.0 kW·h13 -32 一定量的理想气体进行如图所示的逆向斯特林循环(回热式制冷机中的工作循环),其中1→2为等温(T 1 )压缩过程,3→4为等温(T 2 )膨胀过程,其他两过程为等体过程.求证此循环的制冷系数和逆向卡诺循环制冷系数相等.(这一循环是回热式制冷机中的工作循环,具有较好的制冷效果.4→1过程从热库吸收的热量在2→3过程中又放回给了热库,故均不计入循环系数计算.)证明 1→2 过程气体放热2111lnV V RT Q v = 3→4 过程气体吸热 2122ln V V RT Q v = 则制冷系数 e =Q 2 /(Q 1-Q 2 )= T 2/( T 1-T 2 ).与逆向卡诺循环的制冷系数相同.13 -33 物质的量为ν的理想气体,其摩尔定容热容C V,m =3R/2,从状态A(p A ,V A ,T A )分别经如图所示的ADB 过程和ACB 过程,到达状态B(p B ,V B ,T B ).试问在这两个过程中气体的熵变各为多少? 图中AD 为等温线.分析 熵是热力学的状态函数,状态A 与B 之间的熵变ΔSAB 不会因路径的不同而改变.此外,ADB 与ACB 过程均由两个子过程组成.总的熵变应等于各子过程熵变之和,即DB AD AB S S S ΔΔΔ+=或CB AC AB S S S ΔΔΔ+=.解 (1) ADB 过程的熵变为()()D B p,m A D B D D A T BD P D A T DBAD AB T T C V V T T C T W T Q T Q S S S /ln /ln /d /d /d /d ΔΔΔm p,v vR v +=+=+=+=⎰⎰⎰⎰ (1)在等温过程AD 中,有T D =T A ;等压过程DB 中,有V B /T B =V D /T D ;而C p ,m =C V ,m +R ,故式(1)可改写为()()()()A B A B A B p,m A B B D ADB V T V V V T C V T V T S /ln 23/ln /ln /ln ΔvR vR v vR +=+=(2) ACB 过程的熵变为()()C B V,m A C p,m CB AC BA ACB T TC V T C S S Q/T S /ln /ln ΔΔd Δv v +=+==⎰ (2)利用V C =V B 、p C =p A 、T C /V C =T A /V A 及T B /p B =T C /p C ,则式(2)可写为()()()()()()()A B A B A A B B V,m A B A B A B V,m ACB V T V V V p V p C V V p p V V R C S /ln 23/ln /ln /ln /ln /ln ΔvR vR v vR v v +=+=++=通过上述计算可看出,虽然ADB 及ACB 两过程不同,但熵变相同.因此,在计算熵变时,可选取比较容易计算的途径进行.13 -34 有一体积为2.0 ×10-2m 3的绝热容器,用一隔板将其分为两部分,如图所示.开始时在左边(体积V 1 =5.0 ×10-3m 3)一侧充有1mol 理想气体,右边一侧为真空.现打开隔板让气体自由膨胀而充满整个容器,求熵变.分析 在求解本题时,要注意⎰=BA T Q S d Δ 的适用条件.在绝热自由膨胀过程中,d Q =0,若仍运用上式计算熵变,必然有ΔS =0.显然,这是错误的结果.由于熵是状态的单值函数,当初态与末态不同时,熵变不应为零.出现上述错误的原因就是忽视了公式的适用条件. ⎰=BA T Q S d Δ 只适用于可逆过程,而自由膨胀过程是不可逆的.因此,在求解不可逆过程的熵变时,通常需要在初态与末态之间设计一个可逆过程,然后再按可逆过程熵变的积分式进行计算.在选取可逆过程时,尽量使其积分便于计算.解 根据上述分析,在本题中因初末态时气体的体积V 1 、V 2 均已知,且温度相同,故可选一可逆等温过程.在等温过程中,d Q =d W =p d V ,而VRT M m p =,则熵变为 ()1-12K J 52.11/ln d 1d d Δ12⋅=====⎰⎰⎰V V R M m V V R M m T V p T Q S V V。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
QABC 326 J , W ABC 126 J
系统从状态A沿ABC变
化到状态C内能增量为:
V
8
E AC QABC - W ABC 200 J
系统从状态C返回到A的过程中系统内能的增量ECA和
对外作的功WCA为:
ECA -E AC -200 J WCA -52 J
第十三章 热力学基础习题课及讨论课
1
13-1
如图所示,bca为理想气体绝热过程,b1a和b2a
是任意过程, 则上述两过程中气体作功与吸热的情况是 B
( ) (A) b1a过程放热,作负功; b2a过程放热,作负功。
(B) b1a过程吸热,作负功;
b2a过程放热,作负功。 (C) b1a过程吸热,作正功; b2a过程吸热,作负功。 (D) b1a过程放热,作正功; b2a过程吸热,作正功。
O V
3
A
B
13-3 两个相同的刚性容器,一个盛有氢气,一个盛
有氦气 (均视为刚性分子理想气体 ),开始时它们的压强
和温度都相同,现将3J热量传给氦气,使之升高到一定
的温度。若使氢气也升高同样的温度,则应向氢气传递 热量为( C )
(A) 6J;(B) 3J; (C) 5J; (D) 10J。
m QV E CV,m T2 - T1 CV,m T2 - T1 M 5 3 QH 2 : QH e CV, m H : CV, m He : 5 : 3 2 2 2 QH 2 5 J
4
有人想象了四个理想气体的循环过程,则在理 13-4 论上可以实现的为( D )
p 绝热 等温 o p p
等体
A V 绝热 C V
pA d p VA d V T
o p
等温 绝热
绝热
B V
等压
绝热 等温
等体
绝热 o
pA d p - VA dV a
o
D
V
5
系统从状态C返回到A的过程中
系统吸收的热量QCA为:
p
B C
A O
QCA ECA WCA -252 J
V
系统从状态C返回到A的过程中系统放出热量。
QABC 326 J , W ABC 126 J
9
13-15
如图所示,一定量的理想气体经历ACB过程
p/ 105 Pa
吸热200J,则经历ACBDA过程时吸热又是多少?
解: (1) pAVA pBVB
TA TB E ACB
WACB QACB 200 J
4 0 3 2 1
A
C
D
(2) WBD 0
VA VD
B
1 2
3
V/ 10-3 m 3
W DA p dV p A V A - VB -1200 J
O
4
WACBDA WACB WBD WDA -1000 J QACBDA WACBDA -1000 J
13-5 一台工作于温度分别为327oC和27oC的高温热源
和低温源之间的卡诺热机, 每经历一个循环吸热2000J, 则对外作功( B ) (A) 2000J (C) 4000J (B) 1000J (D) 500J
T2 1 T1
300 W Q1 2000 1 1000 J 600
T1 300 K
B
等 体
D
T2 200 K
V1
C
V2
V
W Q1
11
A→B为等温膨胀过程吸收热量为 :
QAB W AB
D→A为等体升压过程吸收热量为 :
p
A
等 体
T1 300 K
E CV, m T1 - T2
总的吸收热量为 :
QDA E DA
B
等 体
D
T2 200 K
p
a
2
c
1
b
V
2
O
如图,一定量的理想气体由平衡态A变到平衡 13-2 态B,且它们的压强相等,则在状态A和状态B之间,气
体无论经过的是什么过程,气体必然( B ) (A)对外作正功; (B)内能增加;
p
(C)从外界吸热;
(D)向外界放热。
TA TB E A EB E EB - E A 0
10 整个循环过程是放热的。
0.32kg的氧气作如图所示的ABCDA循环,设 13-23 V2=2V1, T1=300K, T2=200K, 求循环效率。 Q1: 循环过程中系统吸收的总热量; W: 整个循环系统对外作的净功。 p
A
等 体
W W AB WCD
V2 W AB RT1 ln V1 V1 WCD RT2 ln O V2 V2 W RT1 - T2 ln 5.76 103 J V1
C
Q1 QAB QDA WAB E DA
O
V1
V2
V
W V2 15 % RT1 ln CV,m T1 - T2 Q1 V1 m V2 m 5 4 RT1 ln RT1 - T2 3.81 10 J M V1 M 2
12
6
13-6
根据热力学第二定律( A )
(A) 自然界中的一切自发过程都是不可逆的;
(B)不可逆过程就是不能向相反方向进行的过程;
(C) 热量可以从高温物体传到低温物体,但不能从低温
物体传到高温物体;
(D)任何过程总是沿着熵增加的方向进行。
7
13-14 如图所示,系统从状态 A 沿 ABC 变化到状态 C 的过程中,外界有326J的热量传递给系统,同时系统对 外做功 126J。当系统从状态 C沿另一曲线 CA返回到状态 A时,外界对系统作功为 52J。则此过程中系统是吸热还 是放热?传递热量是多少? 解: 系统从状态A沿ABC变化到状 态C的过程中吸收的热量QABC和 对外作的功WABC为:
