彩叶植物红叶形状RAPD标记及查尔酮合酶(CHS)基因的cDNA分离与克隆
不同植物查尔酮合成酶CHS基因的生物信息学分析(1)

Bioinformatics Analysis of Chalcone Synzyme ( CHS) Genes in Different Plants
ZHANG Tao ( College of Life Science,Qingdao Agricultural University,Qingdao 266109,China) Abstract: In this paper,the nucleic acid sequences and the conjectural amino acid sequences of chalcone synthase ( CHS) genes registered in GenBank in 10 plant species were analyzed by using bioinformatics method. Several parameters of these sequences,including physicochemical property,signal peptide,transmembrane regions,hydrophobicity or hydrophilicity,functional domains and secondary structures,were detailedly analyzed,and the phylogenetic tree was constructed for CHS amino acid sequences. The results showed that the full - length of ORF of 10 CHS genes was about 1. 2 kb and encoded 399 amino acids. All amino acid sequences of CHS in different plant species contained 1 potential N - glycosylation site ( 32NMSS) ,4 protein kinase c phosphorylation sites ( 69TIR,158SVK,202TFR,359SAK) and 1 chalcone synthase active position ( 161RLMMYQQGCFAGGTVLR) . All the amino acid sequences were hydrophobicity protein,without signal peptide and transmembrane regions. Key words: Chalcone synzyme; Bioinformatics; Function analysis; Structure prediction
樱桃查尔酮合成酶
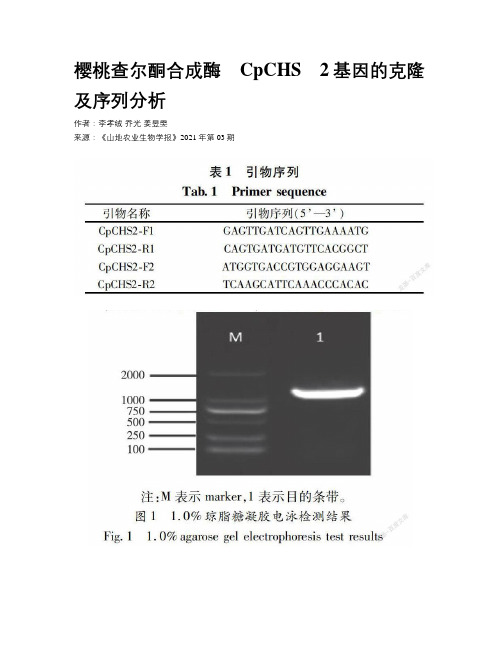
樱桃查尔酮合成酶CpCHS2基因的克隆及序列分析作者:李孝绒乔光姜昱雯来源:《山地农业生物学报》2021年第03期摘要:查尔酮合成酶基因是类黄酮生物合成的关键基因,本文通过巢氏PCR,从‘玛瑙红’樱桃的根系组织中克隆获得一个1176 bp的查尔酮合成酶基因的cDNA序列,编码391个氨基酸,命名为CpCHS2 (基因登录号:MT112906)。
该基因编码的蛋白分子量为42.68 kD,等电点为5.76,属疏水性蛋白且不具有跨膜区,主要定位在细胞质中,二级结构中α-螺旋、β-折叠为蛋白质最大量的结构原件。
系统进化树分析表明,CpCHS2和同属蔷薇科的红叶李及碧桃的亲缘关系最近,并在进化上高度保守。
关键词:樱桃;CpCHS2;基因克隆;生物信息学分析中图分类号:S662.5文献标识码:A文章编号:1008-0457(2021)03-0001-06国际DOI编码:10.15958/ki.sdnyswxb.2021.03.001Cloning and Sequence Analysis of CpCHS2 Gene in Cerasus PseudocerasusLI Xiaorong,QIAO Guang*,JIANG Yuwen(College of Life Science,Guizhou University/Institute of Agro-bioengineering/Key Laboratory of Plant Resources Conservation and Germplasm Innovation in Mountainous Region Ministry of Education,Guiyang,Guizhou 550025,China)Abstract:Chalcone synthetase gene is the key gene for flavonoid biosynthesis.In this paper,a full-length cDNA of the CHS gene was obtained by Nested PCR from the root tissue of Cerasus pseudocerasus ‘Manaohong’,whose complete cDNA was 1,176 bp,encoding 319 amino acids,and being designated as CpCHS2 (Gene accession number is MT112906).The protein encoded by the gene has a molecular weight of 42.68 kD and an isoelectric point of 5.76.It was a hydrophobic protein and did not have a transmembrane region,which was mainly located in the cytoplasm.In the secondary structure,α -helix and β -sheet were the largest structural elements of the protein.The phylogenetic tree analysis showed that the CpCHS2 and Prunus cerasifera and Amygdalus persica of the same genus Rosaceae were closely related and highly conserved in evolution.Keywords:Cerasus pseudocerasus;CpCHS2;gene cloning;bioinformatic analysis類黄酮是一类具有强烈生物活性的多酚类次生代谢产物,它广泛存在于植物中,除影响植物的生长发育,还在与环境相互作用方面起非常重要的作用[1- 2]。
植物查尔酮合成酶分子生物学研究进展

植物查尔酮合成酶分子生物学研究进展河南农业科学植物查尔酮合成酶分子生物学研究进展王燕,许锋,程水源(1,长江大学园艺园林学院,湖北荆州434025;2,黄冈师范学院生命科学与工程学院,湖北黄冈438000)摘要:查尔酮合成酶(chalconesynthase,CHS,EC2.3.1.74),是植物类黄酮物质合成途径中的第一个酶,也是植物次生代谢途径中的关键酶之一,对植物具有非常重要的生理意义.为此,综述了查尔酮合成酶基因结构,基因进化,表达调控机理以及诱导因子,概述了查尔酮合成酶基因工程在植物生理方面的研究,并进一步对查尔酮合成酶的分子生物学研究做了展望.关键词:植物;查尔酮合成酶;分子生物学;基因工程中图分类号:943.2文献标识码:A文章编号:1004—3268(2007)08—0005—05查尔酮合成酶(chalconesynthase,CHS,EC2.3.1.74)是植物类黄酮物质合成途径中的第一个酶.它催化该途径的第一步,即3个分子的丙二酰一CoA和1个分子的对香豆酰一CoA结合形成第一个具有C15架的黄酮类化合物一查尔酮.该产物进一步衍生转化构成了各类黄酮化合物l1].此中间物的异构化和功能基团的进一步取代都能导致黄酮,异黄酮和花色素苷的合成.这些化合物为自然界提供了颜色,并参与了植物的多种生理过程,包括防紫外线辐射,抗病,生长素运输,花粉的育性等,.现已对许多植物查尔酮合成酶基因进行了分离克隆和测序,很多学者通过转基因方法成功地将外源查尔酮合成酶基因导入植物,提高了转基因植物查尔酮合成酶活性,并且这些植物都表现出了目的生理性状.而且查尔酮合成酶在植物中是普遍存在的,它的分子进化存在多种途径,也有许多查尔酮合.成酶基因的分子进化途径的研究报道.在此基础上对国内外植物查尔酮合成酶分子生物学及基因工程的研究进展进行了综述.1查尔酮合成酶基因结构自从第一个荷兰芹的chs序列在l983年发表以来,到目前为止,已从多种双子叶,单子叶和裸子植物中克隆了s基因,例如,玉米,高粱,兰花,矮牵牛引,拟南芥,金鱼草l.],豆类~.和松树|l等.所有报道的chs基因都属于多基因家族,chs基因在结构上非常保守,除金鱼草的1个chs基因AMCHS含有2个内含子外[1o2.其余的chs 均只包含1个内含子和2个外显子.而且这个内含子的位置在已发现的序列中均相同,即位于第65位(以欧洲赤松PinusSylvestris的PSCHS为标准)的半胱氨酸密码子内第一和第二位碱基之间,其长度从几十碱基对到几千碱基对不等.外显子l较短,只编码约60个氨基酸,且长度变异较大;外显子2编码约340个氨基酸,在进化中较保守,易于排序,提供的进化信息较多|1.王金玲等的研究也表明,可用CHS基因外显子2代表全基因进行研究口. Koes等研究矮牵牛的CHS基因家族包括8~l0个成员,在植物正常发育中仅CHs—A和CHs—J在花中表达,前者转录mRNA占CHS总mRNA的90[8l2查尔酮合成酶基因进化CHS在植物中是普遍存在的,现认为最早在陆生植物中出现,例如,轮藻纲和苔藓植物『2.有资料显示,CHS是从脂肪酸代谢途径中的一个酶进化而来.越来越多的证据显示,在进化的过程中,CHS的功能有过多次转变,例如,不断重复地转变成芪合成酶(stilbenesynthase,STS).Tropf等收稿日期:2007—03—14基金项目:湖北省自然科学基金(2002AB094);湖北省青年杰出人才基金(2003AB014);教育部新世纪优秀人才计划(NCET一04—0746);湖北省教育厅重大科技项目(Z200627002)作者简介:王燕(1967一),女,江苏南通人,吾0教授,主要从事银杏次生代谢分子生物学方面的研究.通讯作者:程水源(1965一).男,湖北天门人,教授,博士生导师,主要从事银杏次生代谢方面的研究.5?2007年第8期通过CHS和STS的进化指出,在进化的历史中,STS曾经几次从CHS独立地进化出来.Lanz等指出,CHS在植物的不同类群中是很保守的,已有数据表明,CHS基因是一个较大的基因家族,其编码区比较保守,长约1.2kb,科之间的氨基酸同源性在7O~90[243.Ursula等首次尝试用CHS基因编码区的DNA序列来研究物种的进化关系引,当时他们只分析了7个种8个序列;王金玲等于2000年共分析了19个科的83个序列_1川.基于最筒约法对所研究的CHS基因外显子2部分DNA序列构建的系统进行自展分析的结果表明:各科序列在分支图上的分布情况不同,对于大部分分科,同一科的序列都形成一组,只有少数科的序列分布在相距很远的分支中,在CHS基因的进化中,经常发生基因重复一分歧(duplication—divergence). 攀枝花苏铁的2个克隆CPA1和CPA5分布在相距很远的分支中,说明CHS基因的重复在裸子植物就已经发生.杨俊波等的研究表明l2:山茶属CHS基因家族在进化过程中已分化为A,B,C3个家族,包括A1,A2,A3,B1,B2,C等6类不同的基因成员.其中只有A2类成员为全部被研究的5种植物所共有,而其他类成员只在部分被研究的植物中发现.所有这些CHS成员具有很高的同源性,在核苷酸水平上同一亚家族内基本上高于9O,不同亚家族间也在78%以上.从推测的氨基酸组成看,山茶属内CHS基因的功能一旦发生了分化,各类成员的碱基替代率会有较大差异.进一步分析认为,该属CHS基因的分化直到近期还在活跃地进行.Ferrerd等也指出不同种的进化式样有一定的差别,这种不同的进化式样可能是物种形成后受不同环境因素影响而形成的.近几年来的研究结果表明,CHS只是植物聚酮化合物合成酶家族中的一个成员.通过功能和序列鉴定这个家族的其他成员包括:STS,ACS,2PS,这些蛋白与CHS的序列同源性在65~75之间. Durbin等指出,CHS非常适合于基因复制的研究和基因家族起源的调查引.但是,目前还没有从假定的早期陆生植物中或者其可能的祖先植物中分离得到CHS及其相关的基因,关于这些植物中CHS 相关蛋白合成的次生代谢产物也没有研究.3CHS基因表达的调控研究3.1CHS表达的调控机理CHS是类黄酮生物合成过程中第一个关键酶,6CHS基因的表达受多种内外因素的调控.将CHS基因的启动子片段与GU5报告基因连接,导入植物细胞,通过转基因,原生质体瞬时表达,定点专一突变等手段对CHS基因的启动子进行研究,在CHS 基因启动子区找到了一些作用元件.正是这些元件以及他们与转录因子之间的相互作用,决定了CHS 基因的表达方式受发育和内外因素的复杂调控【2. 与查尔酮基因表达相关的顺式作用元件与反式作用因子已陆续被发现川,如ACE元件(ACGele—ment)『3l,.,H区(H—box)_33],富含AT元件(A T —richelement)_34I.,沉默子(Silencer)[.,P区(BoxP)[37J,工区和Ⅱ区(BoxI和BoxⅡ)_3.3.2CHS表达的诱导因子查尔酮合成酶往往受不同的发育调控和组织特异性调控,对不同外界刺激的敏感程度也不同. Senebier在18世纪末最早发现类黄酮的生物合成受光的调控,在一些植物中,花色素苷只有在光照下才会产生.Arthur也认为,刺激花色素苷合成最有效的光是蓝光/UV—A和UV—B.CHS的表达产生mRNA受到蓝光,紫外光的调节.在香菜细胞培养中,CHS表达产生最大量mRNA同时需要蓝光和紫外光.在自芥和香菜中,暗生长的幼苗CHS表达产生mRNA受光敏色素调节,而成熟叶片中, UV—B和uV—A/蓝光受体介导CHS表达产生mRNA.拟南芥中,紫外光和蓝光控制幼苗CHS表达产生mRNA和成熟叶组织的CHS表达.光敏色素对幼苗的CHS表达起作用[3.除了受光诱导外,CHS的表达还受病原微生物侵染和机械损伤等各种外界因子所诱导c4¨.4CHS基因工程与植物生理代谢4.1CHS转基因在植物花色的影响方面研究截至目前,大多数花卉新品种都是通过传统育种方法来获得的[4.而传统的方法存在着很多的局限性.遗传工程技术的发展给观赏植物产业的发展开辟了一条新的途径,在大多数植物种类中,类黄酮化合物是最重要的花色素.类黄酮生物合成基因的克隆,为遗传工程手段改变花色奠定了基础.目前,遗传工程技术可以从两个方面来改变花的颜色. 第一:抑制类黄酮生物合成基因的活性,导致中间产物的积累和花色的改变;第二,引入新基因来补充某些品种缺乏合成某些颜色的能力【l4.抑制类黄酮生物合成基因的活性有2种方法:一是通过反义RNA技术将目的基因的反义链连接河南农业科学在启动子后面,并转化植物,使目的基因的表达受到抑制;二是通过向植物中引入额外数量的目的基因拷贝,以共抑制技术方式,使目的基因的表达受到抑制[4.CHS基因的反义抑制和共抑制技术已经在牵牛,天竺葵,菊花和玫瑰中取得了成功].用遗传工程技术改变花色的另一条途径是通过转基因技术.例如,牵牛中的二氢黄酮醇4~还原酶不能把二氢黄酮醇(dihydrokaempfero1)转化为合成花葵素糖苷的中间产物,用传统的方法很难培育出橘红色的牵牛花.Meyer等利用遗传工程技术,将玉米的dfr基因转化进入开白花的牵牛中,使该DFR基因在牵牛中表达,产生的dIr酶能使二氢黄酮醇转化为相应的中间产物,进一步合成花葵素糖苷,培育出了橘红色的牵牛花[4.4.2CHS基因工程在植物育性方面的研究类黄酮与植物的育性有密切的关系.它在花粉中主要的合成部位是绒毡层,然后运输到子囊腔并最后进入花粉粒的外壁,成为组成外壁的一个重要的成分.因此,类黄酮在花粉粒的形成中起着非常重要的作用.研究认为,chs—a转基因植物雄性不育现象的产生可能是由于chs在花药中的转录.邵莉等人将正向chs—a基因转入矮牵牛中,在成功地改变了花的颜色的同时还发现了转基因植物也出现了雄性不育的现象.在玉米中,人们早就发现由于CHS突变(C2, Whp)而产生的不育的白色花粉粒.与此同时,水稻中类CHS基因的异常表达也可能导致花粉粒败育l_4.张毅等研究证明了在水稻花药中特异表达的类查尔酮合成酶基因D5mRNA的积累在四分体时期达到高峰并持续到小孢子时期,而这一时期与外壁的形成密切相关,而且有报道表明,拟南芥的雄性不育突变体msl2即为花粉外壁形成的缺陷型.4.3CHS基因工程在植物防御反应中的研究对于chs在植物防御反应中的调控方式的研究正在两个方向上进行:一是观察植物受到病原微生物侵染后的各种生理变化;另一个是研究与CHS表达相关的调控因子及其基因的调控方式.在病原微生物与植物相互作用的过程中,各种激发因子和抑制因子大都存在于细胞之外,而CHS 及其他与真菌有关的基因的表达均发生在细胞内, 细胞外的信号如何传递到细胞内,是一个引人注目的问题.目前已确证与CHS表达有关的信号传递过程是磷酸肌醇(PI)途径.不少研究结果显示.植物在遭受病原微生物侵染后,CHS活性显着增强,chs活跃转录,这些结果表明,由CHS调控的苯丙烷代谢反应很可能是植物抵抗病原物侵染的重要防卫反应之一[5.齐放军等用水稻抗白叶枯病近等基因系材料及转基因系材料,研究了水稻白叶枯病菌互作中,水稻防卫基因chs的转录特征[5.Northern检测结果显示,在与白叶枯病菌非亲和性互作中,水稻chs基因的转录均不受到诱导或只是受到很微蜀弓的诱导. 表明由chs基因调控的苯丙烷核心反应的启动和产物的合成,有助于增强水稻对白叶桔病菌的抗性.试验结果显示:互作中水稻chs基因是否受到白叶枯病菌的诱导,不仅与水稻中抗病基因有关,而且还与抗病基因的种类有关.表明水稻chs基因在互作中是否受到诱导转录,取决于其水稻功能性抗病基因产物对白叶枯病菌的专化性识别[5.从植物受到病原微生物侵染开始,到chS被诱导表达一系列调控过程至今还缺乏一个完整的认识.相信随着chs这一模式基因在植物防御机制中的作用研究的不断深入,人类不但将进一步认清植物基因调控的机理,而且可以通过利用它们的调控途径来改变某些基因的表达效应,从而为改良作物品种,提高作物抗病能力开辟一条崭新的途径.5展望迄今,有关学者至少对1o余种植物查尔酮合成酶基因进行了转化研究,如烟草,核桃,芸香,水稻,玫瑰,百合,矮牵牛,黄瓜,玉米等,尤其是在观赏植物花色的转基因研究方面最为深入.在未来农业中,开展CHS基因的克隆,结构特点,表达部位和时空表达模式的研究.以便有目的的用之于转化植物,使之在转基因植物中大量,持久地表达,提高目的次生代谢产物的含量,使植物查尔酮合成酶转基因应用进入产业化具有重要意义.参考文献:[1]程水源,颐曼如,束怀瑞.银杏叶黄酮研究进展[J].林业科学,2000,36(6):110一l15.[2]KoesRE,FrancescaQ,JosephNM.Theflavonoid biosyntheticpathwayinplants:functionandevolution 口].Bioessays,l994,16:123—132.[3]MartinCR.Structure,function,andregulationofthe chalconesynthase[C]//.InternationReviewofCytolo gy,l993,147:233—284.[4]ReimoldU,KroegerM,KreuzalerF,eta1.Coding72007年第8期E5J[6]E7]E8][9][io3[11][12][13][14][15]and3noncodingnucleotide thasemessengerRNAandsequenceoftheenzyme[J].18O6.sequenceofchalconesyn—assignmentofaminoacidEMBOJ,1983,2:1801一FrankenP,NiesbachKU.WeydemannU,eta1.The duplicatedchalconesynthasegenesC2andWhp(white pollen)ofZeamaysareindependentlyregulated;evi—dencefortranslationalcontrolofWhpexpressionby theanthocyaninintensifyinggene[J].EMBOJ,1991,10:2605—2612.LoC,CoolbaughRC.NicholsonRI.Molecular characterizationandinsilicoexpressionanalysisof chalconesynthasegenefamilyinsorghumbicolor[J]. PhysiolMolPlantPathol,2002,61:179—188. LiewCF,GohCJ,LohCS,eta1.Cloningandchar—acterizationoffull——lengthcDNAclonesencodingchal—conesynthasefromtheorchidBromheadiafinlaysoni—ana[J].PlantPhysiolBiochem.1998,9:647—655. HohonTA,BruglleraF,TanakaY.Cloningandex—pressionofehalconesynthasefrompetuniahybrida[J]. PlantJ,1993,4:1003—1010.SaslowskyDE,DanaCD,WinkelSB.Anallelicse—riesforthechalconesynthaselocusinArabidopsis[J]. Gene,2000,225:127—138.SommerH,SaedlerH.Structureofthechalcone synthasegeneofAntirrhinummajus[J].MolGen Genet,1986,202:429—434.AkadaS,KungS,DubeSK.Nueleotidesequenceof asoybeanchalconesynthasegenewithapossiblerole inultraviolet--Bsensitivity,gmcbs6[J].PlantPhysi~ol,1993,102:699—702.ArioliT,HowlesPA,WeinmanJJ,eta1.Trifoli- umsubterraneumchalconesynthaseisencodedbya multigenefamily[J].Gene,1994,138:79—86. MckhammHI,HirschAM.Isolationofchalcone synthaseandchalconeisomerasecDNAfromalfalfa (MedicagosativaL.):highesttranscriptlevelsoc~curinyoungrootsandroottips[J2.PlantMolBiol, 1994,24:767—777.SchroderJ,RaiberS,BergerT,eta1.Plant polyketidesynthases:achalconesynthase-typeen~zymewhichperformsacondensationreactionwith methylmalonyl—CoAinthebiosynthesisofC—meth~ylatedchalcones[J].Biochemistry,1998,23:8417—8425.FliegmannJ,SchroderG,SchanzS,eta1.Molecularanalysisofchalconeanddihydropinosylvinsynthase fromScotspine(pinussylvestris),anddifferential regulationoftheseandrelatedenzymeactivitiesin stressedplants[J].PlantMolBiol,1992,3:489—5O3.8?[16][17][18][19][2O][21][22][23][24][25][26][27][283Y angJ,HuangJ,GuH,eta1.Duplicationanda—daptiveevolutionofthechalconesynthasegenesof Dendranthema(Asteraceae)[J].MolBiolEvol, 2002,19:1752—1759.王金玲,瞿礼嘉,陈军,等.cHS基因外显子2的进化规律及其用于植物分子系统学研究的可行性[J].科学通报,2000,45(9):942—950.KoesRE,SpeltceG,V anderE.Clonigandmolecu—larcharacterizationofthechalconesynthasemulti—genefamilyofRetuniohybrida[J].Gene,1989,81:245—157.StaffordHA.Flavonoidevolution:anenzymicap—proaeh[J].PlantPhysiol,1991,96:680—685. KubitzkiK.Phenylpropanoidmetabolisminrelation tolandplantoriginanddiversification[J].Plant Physiol,1987,131:17—24.MarkhamKR.Distributionofflavonoidsinthelower plantsanditsevolutionarysignificance.intheFla—vonoids(JBHarborne,ed)[M].ChapmanandHall, London.1988:427—468.MarkhamKR.Bryophyteflavonoids,theirstruc—tures,distribution,andevolutionarysignificance IN]∥.BrophytesTheirChemistryandChemical Taxonomy(H.D.ZinsmeisterandR.Mues,eds.) OxfordClarendonPress,1990:143—161. TropfS,KarcherB,SchroderG,etaZ.Reaction mechanismsofhomodimericplantpolyketidesyn—thase(stilbenceandchalconesynthase).asingleac—tivesiteforthecondensingreactionissufficientfor synthesisofstilbenes,chalconee,and6~de—oxychalcones[J].JBiolChem,1995,270:7922—7928.LanzT,TropfS,MarnerFJ,eta1.Theroleofcys—teinesinpolyketidesynthasesitedirectetedmutagen—esisofresveratrolandchalconesynthase,twoen—zymesindifferentplant—specificpathways[J].JBiol Chem,1991,266:9971—9976.UrsulaNK,BarzenEB.Chalconesynthasegenein plants:atooltostudyevolutionaryrelationships[J].JMolEvol,1987,26:213—225.Y angJB,TianX,LiDZ,eta1.Molecularcomposi—tionandevolutionofthechalconesynthase(CHS) genefamilyinfivespeciesofcamellia(Theaceae)[J]. ActaBotanicaSinica,2003,45(6):659~666.FerrerJI,JezJM,BowmanME,eta1.Structure ofchalconesynthaseandthemolecularbasisofplant polyketidebiosynthesis[J].Nature,1999,6(8):775—840.DurbinML,McCaigB,CleggMT.Molecularevo—lutionofchaleonesynthasemultigenefamilyinthe morningglorygenome[J2.PlantMolBiol,2000,42:河南农业科学79—92.r29]AkiraNakatsuka,Y okoI,MasumiY.Spatialand temporalexpressionofchalconesynthaseanddi—hydroflavonol4~reductasegenesintheasiatichy—bridlily[J].PlantScience,2003,165(4):759—767.[3O]廖靖军,安成才,吴思,等.查尔酮合成酶基因在植物防御反应中的调控作用[J].北京大学,2000,36 (4):569—571.r3门WeisshaarB,ArmstrongGA,BlockA.Lightinduc—ibleandconstituivelyexpressedDNAbindingproteins recognizingaplantpromoterelementwithfunctional relevanceinlightresponsiveness[J].EMBOJ,1991,10(7):1777—1786.r32]AustinM,NoelJ.Thechalconesythasesuperfamily oftype,polyketidesynthases[J].NatProdRep,2003,20:79—110.[33]YuLM,LambCJ,DixonRA.Purificationand biochemcalcharacterizationofproteinswhichbindto theHboxciselementimplicatedintranscriptionalac—tivationofplantdefensegenes[J].PlantJ,1993,3(6):805—810.[34]KibaA,ToyodaK,IchinoseY.Specificinhibitionof cellwallboundATPasebyfungalsuppressiorfrom mycosphaerellapiodes[J].PlantCellPhysiology, 1995,36:809—817.r35]LawtonMA,DeanSM,DronM,eta1.Silencerre—gionofachalconesynthasepromotercontainsmulti—piebindingsitesforfactor,SBF1,closelyrelatedtoGT[J].PlantMolBiol,1991,16(2):235—249.[36]DaCE,KleinL,SchmelzerE.BPF1,apathogenin—ducedDNAbindingproteininvolvedintheplantde—fenseresponse[J].PlantJ,1993,4:125—135.[37]Y oshiyukiI,HikaruS,KazuhiroT,eta1.Contrary operationsofBox-Ielementofpeaphenylalanineam—monia-lyasegene1promoterfororgan-specificex'' pression[J].PlantPhysiologyandBiochemistry,2001,39(5):355—362.[38]Y amadaT,SriprasertsakP,KatoH.Functionalas—nalysiosofthepromotersofphenylalanineammonial—yasegenesinpeaEJ].PlantCellPhysiol,1994,35:93——104.[39]王曼,王小菁.蓝光,紫外光的受体及其对CHS表达诱导的研究[J].植物学通报,2002,19(3):265一[4O][42][43][44][45][46][473[48][49][5O][51][52]271.DanglJI,HahlborockK,SchellJ.Regulationand StructureofChalconeSynthaseGenes[M]//.NewY ork:AcademicPress,1989:155—173.V anderM,StuitjeAR,MolNJ.Regulationof GeneralPhenylpropanoidandFlavonoidGeneEx—pression[M].CRCPress,BocaRaton,1993:125—155.赵昶灵,郭传明,陈俊愉.植物花色呈现的生物化学, 分子生物学机制及其基因工程改良[J].西北植物学报,2003,23(6):1024—1035.邵莉,李毅,杨美珠,等.查尔酮合酶基因对转基因植物花色和育性的影响[J].植物,1996,38(7): 517—524.V anderM,StamME,TunenA,eta1.Antisense inhibitionofflavonoidbiosynthesisinpetuniaanthers resultsinmalesterility[J].PlantCell,1992,4:253262.ElidaG,FadiC,HamdanF.Cloningofthechapero—nint—complexpolypeptide1genefromSchistosoma mansoniandstudiesofitsexpressionlevels[J].Para—sitolRes,2000,86:253—258.赵云鹏,陈发棣,郭维明.观赏植物花色基因工程研究进展[J].植物通报,2003,20(】):51—58. MeyerP,HeidmannI,ForkmannG.Anewpetunia flowercolourgeneratedbytransformationofamutant withamaizegeneEJ].Nature,1987,330:677~688.郑宏红,瞿礼嘉,刘美华.花药特异性表达的类查尔酮合酶基因D5与水稻花粉发育相关[J].科学通报, 2000,45(11):1132—1138.张毅,瞿礼嘉,刘美华,等.对一个在水稻雄蕊中大量表达的cNDA的结构和表达分析[J].科学通报, 1998,43(4):607~611.TaylarPE,GloverJA,LavithisM.Geneticcontrol ofmalefertilityinArabidopsisthaliana:structuralan—alysesofpostmeioticdevelopmentmutants[J].Plan—ta,1998,2O5:492—505.WannerIA,IiGQ,ThePhenylalanineammonia—lyasegenefamilyinArabidoposisthaliana[J].Plant MolBio,1995,27:328—335.齐放军,高学文,王金生,等.携带不同抗白叶枯病基因的水稻防卫基因pal和chs的转录特征[J].农业生物技术,2000,8(4):337—340.9'。
植物黄酮次生代谢中CHS、CHI基因的相关研究报告

植物黄酮次生代中CHS、CHI基因的相关研究摘要:黄酮类化合物是一类植物的次生代产物,有抗炎、抗病毒、利胆、强心、镇静和镇痛等作用外,还具有抗氧化、抗衰老、免疫调节和抗肿瘤等效果,因此,黄酮类化合物在医药、食品、保健品等方面的应用十分广泛。
在生物合成黄酮途径中,查尔酮合成酶和查尔酮异构酶是关键酶和限速酶。
本文介绍了生物合成黄酮类化合物途径中的CHS、CHI两个基因及其作用机制,简述了研究人员从第一次研究CHS、CHI基因到现今以来对这两个酶的研究进展,通过总结得出,CHS的开放阅读框在1.2kb左右,大约编码399个氨基酸,CHI基因家族的开放阅读框长为600-15000bp,编码200-400个碱基,两个基因的保守性都比较强。
此外,目前的研究还不能完全揭示各种因子对黄酮类化合物代关键酶的转录、表达及活性的影响,还需要在这方面作进一步的研究。
关键词:黄酮类化合物;CHS;CHIThe research of the CHS and CHI genes in Plant secondarymetabolism of flavonoidsYANG Huo-LiCollege of life and environment science,Minzu University of ChinaBeiJing 10081Abstract:Flavones compounds are a class of important secondary metabolites in plants,Having the effect of anti-inflammatory, antiviral, cholagogue function, cardiac, sedation and analgesia, also having theeffect of anti-oxidation, anti-aging, immunomodulatory and antitumor .it is really popular inMedicine, food, health care products.In the biosynthesis of flavonoids way,Synthetase and chalcone isomerase chalcone is the key enzyme and speed limiting enzyme.This article describes the mechanismof CHS andCHIinthe biosynthesis of flavonoids way.thisarticaldescribesKeywords: Flavones compounds ;CHS ;CHI.前言黄酮类化合物是一类在高等植物量存在的重要次生代产物,是植物在长期的生态适应过程中为抵御恶劣生态条件、动物和微生物等攻击具而形成的。
金荞麦查尔酮合成酶基因CHS的克隆及序列分析

1 材 料 与 方 法
1 1 试 验 材 料 及 菌 种 .
金荞 麦 2 0 0 9年 7月采 自四川 雅 安老板 山 , I 大肠杆 菌 ( sh rc i oiDH5 E c ei acl) h a由本实验 室保存 。
1 2 试 剂 .
质粒 D NA 小 量 提 取 试 剂 盒 、 回 收试 剂 盒 购 自 Ome a公 司 ; T q 胶 g r a DNA 聚 合 酶 、 隆 载 体 p 1 一 克 MD 8T、
1 62— 16 9
草 业
学
报
第 1 9卷
第 3期
2l O O年 6月
A CT A PRA TA CU ITU R AE N I S1 CA
Vo _ 9, . l 1 N0 3
金 荞 麦查 尔酮 合成 酶基 因 C HS的 克 隆 及 序 列 分 析
蒙华 , 成 磊 , 李 吴琦 , 继 荣 , 邵 陈惠
( 四川 农 业 大 学 生 命科 学 与理 学 院 , 川 雅 安 6 5 1 ) 四 20 4
摘 要 : 用 同源 克 隆 的 方 法 获 得 金 荞 麦 查 尔 酮 合 成 酶 基 因 ( HS 的保 守 片 段 5 4b , 一 步 采 用 染 色 体 步 移 法 采 C ) 5 p 进
根含 有 的一 类原 花色素 苷的 缩 合 性单 宁混 合 物 如 表 儿茶 素 , 矢 车 菊 素 B 2等 不 仅 能够 抑 制 某 些 肿瘤 细胞 生 原 一 长[ , = 还能祛 痰抗炎 、 2 ] 抑制 血小板 聚集 , 降低还 原 反应和 增强 巨噬细胞 的吞 噬_ 。 3 ] 金荞 麦作 为栽 培荞 麦 的野生近缘 种 , 子粒 营养成 分含 量丰 富 , 其 具有 很高 的营养 价值 。张政 和林 汝法L 的研 4 究 表 明, 荞麦子 粒高 达 1 . 的蛋 白质含量 , 金 26 已达 到优 质 禾 谷类 粮食 的标 准 , 且微 量 元 素 、 生 素 的含 量也 很 维
查尔酮合酶基因的克隆,全序列分析及在大肠杆菌中的高效表达

查尔酮合酶基因的克隆,全序列分析及在大肠杆菌中的高效表
达
邵莉;陈敏
【期刊名称】《生物工程学报》
【年(卷),期】1995(011)002
【摘要】类黄酮是植物中的一种重要的次级代谢产物,它与植物的花色形成有关。
查尔酮合酶是类黄酮合成途径中的一个关键酶,在植物体内,CHS表达量的增加或减少都可能改变花的。
从矮牵牛花瓣的cDNA中克隆到了CHS-A基因,进行了全序列分析,并与国外已报道的CHS-A-序列进行了同源性比较。
【总页数】5页(P145-149)
【作者】邵莉;陈敏
【作者单位】不详;不详
【正文语种】中文
【中图分类】Q559.9
【相关文献】
1.油橄榄查尔酮合酶与查尔酮异构酶基因全长的克隆及序列分析 [J], 陈文拴;黄乾明;陈华萍;杨泽身;王安逸;苏光灿
2.甜荞查尔酮合酶基因Chs的克隆及序列分析 [J], 李成磊;张晓伟;吴琦;赵海霞;陈惠;邵继荣
3.非洲菊查尔酮合酶基因的克隆、序列分析及在大肠杆菌中的表达 [J], 谢修志;陈
兆平;王小菁
4.乌拉尔甘草查尔酮合酶基因的克隆及序列分析 [J], 周姗;马永生;胡婷;张晓冬;尹彦超;高智强;刘颖
5.查尔酮异构酶基因的克隆序列分析及在大肠杆菌中的表达 [J], 颜华;李翊云因版权原因,仅展示原文概要,查看原文内容请购买。
百合查尔酮合成酶(chs)基因的cDNA克隆与分析

Ab ta t sr c :The s e ii 5 i e ss n he ie c o d n O c s r e e on e ore p c fc 1rm r y t sz d a c r i g t on e v d r gi s ofr p t d CH S e e g n we e u e O a qu r r s d t c ie ̄H S DNA c by RT— PCR. fa A r gme t o bo 0bp wa bt i d a h n fa ut87 s o a ne nd t e
文 章 编 号 : 0 4 2 8 2 1 ) 1 0 2 —0 1 0 —3 6 (0 1 0 — 1 4 3
Cln n n q e cn fCh lo e S n h s n DNA n lu o i g a d Se u n i g o ac n y t a e Ge ec iLii m
河 南农 业 科 学 , 0 1 4 ( ) 1 4 1 6 2 1 ,0 1 :2 —2
J u n l fHe a rc l r l ce c s o r a n n Ag iut a in e o u S
百 合 查 尔酮 合成 酶 (h ) 因的 c NA克 隆与 分析 c s基 D
s q ncn e uls s ow e h t he f a m e t l n h w a 7 p a d is s qu n e w a v r 91 e ue i g r s t h d t a :t r g n e gt s 8 3b n t e e c s o e
统 育 种 的 重 要 补 充 。RNA 于 扰 技 术 目 前 是 转 基 因
育种 的研究热 点 , 本研 究 根据 百合 C 基 因的保 守 HS
基因克隆论文植物反义表达载体论文:香石竹查尔酮合酶基因的克隆与植物反义表达载体的构建

基因克隆论文植物反义表达载体论文:香石竹查尔酮合酶基因的克隆与植物反义表达载体的构建【摘要】根据已发表的查尔酮合酶(chs)基因的序列,设计一对引物,以香石竹品种 master 的总cdna为模板,扩增出香石竹查尔酮合酶基因全阅读框架序列,以pgem-t为中间载体,序列检测的结果显示同henkel,j.等在ncbi的基因库中发表的从香石竹品种“clove pink”花瓣中提取的chs基因全开放阅读框序列一致。
将序列反义克隆到双元载体pbi-121上,并导入农杆菌中,经pcr及酶切分析鉴定,结果表明该片段的反义序列已克隆于载体中。
【关键词】查尔酮合酶植物反义表达载体基因克隆花色的形成与植物体内一类次级代谢产物类黄酮有关。
在花色形成中起最主要作用的是花色素。
花色素在花瓣中含量的增高或降低都可能改变花的颜色[1]。
查尔酮合酶(chalcone synthase,chs)是花色素合成中的一个关键酶,它催化丙二酰辅酶a的3个乙酸基和对羟基苯丙烯酰辅酶a的一个乙酸基的缩合,产生柚配基查尔酮[2]。
反义rna(antisense rna )技术是通过人工导入反义rna,调控细胞内某些基因的表达,从而定向控制某些生物性状。
该项技术在基因功能研究、恶性生长控制、人工免疫及植物基本功能等方面的作用日渐显著。
反义rna技术可以专一性地调节某一基因的活动,进一步了解这个基因的作用,这对研究未知基因的功能和表达情况提供了思路和途径,也为人类控制基因活动提供了方法。
由于反义rna主要作用于转录水平,所以它可以避免二倍体生物同源基因互补而产生的困难。
此外,反义rna对基因的调节不会改变目的基因的结构,在应用上更为安全。
为此,近年来利用反义rna技术在花卉的品质改良上取得了很有价值的成果[3]。
在植物中,chs组成了一个多基因家族,具有8—10个成员,位于两个不同染色体上[4],并且其正常表达主要集中于花组织中(花冠和花药)[5]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
彩叶植物红叶形状RAPD标记及查尔酮合酶(CHS)基因的cDNA分离与克隆作者:高华北孟佳欣贾艳晶李彦慧来源:《智富时代》2016年第10期【摘要】在分子评价的基础上,利用李属植物中具有红叶形状的材料,以及绿叶材料构建DNA池,利用分子手段,寻找与李树叶片红色性状的RAPD分子标记;并构建红叶×绿叶的杂交F1代,通过对F1群体各个植株的RAPD分析,计算该标记与基因的遗传距离,为李目的基因的克隆,分子遗传图谱的构建提供依据。
结合国内外研究,参照花卉及农作物上已克隆的CHS基因,利用同源克隆的方法,对李属植物中的几种材料特别是紫叶矮樱的查尔酮合酶基因进行克隆。
为实现植物体彩色化,为园林植物丰富彩叶树种。
【关键词】李属;叶色;红叶形状;RAPD色彩是观赏植物最重要的特征之一。
传统的绿化树种相对单调,景观色彩比较缺乏,已远远不能满足人们的需要。
彩叶植物,尤其是红色叶树种,以其绚丽的叶色,极大丰富了城市的景观层次,成为目前园林绿化、美化的新宠。
紫红色叶树种,其叶片呈红色主要是受遗传因素、环境因素和色素变化等方面的影响所致。
植物遗传多样性是红色叶树种叶片显红色的基础,如红叶李、红花木、紫叶矮樱等,其叶片红色受其遗传物质——基因的控制。
植物颜色的形成与植物体内一类次级代谢产物类黄酮有关。
其中,起最主要作用的是花色素。
花色素含量的增高或降低都可能改变植物的颜色。
查尔酮合酶(chalconesynthase,CHS)是花色素合成中的一个关键酶,它催化丙二酰辅酶A的3个乙酸基和对羟基苯丙烯酰辅酶A的一个乙酸基的缩合,产生柚配基查尔酮。
查尔酮合酶在植物中表达量的改变可能影响植物的颜色。
近年来利用蛋白质纯化、转座子标签、PCR及鉴别筛选等手段从玉米、金鱼草、矮牵牛等植物中分离和克隆了部分与花青素生物合成的结构基因与调节基因,并应用于花卉育种,这是目前花青素研究的热点。
邵莉、李艳、黄胤怡分别从矮牵牛,中国水仙上成功克隆出查尔酮合酶基因。
通过外源结构基因导入,利用反义基因法和共抑制原理等技术调控花青素等类黄酮物质合成,从而改变植物花色、果色与叶色已经取得了许多成果。
反义RNA的抑制和共抑技术,已被成功地用来抑制CHS基因的活性,在CHS基因反义链转基因的植物中,CHS的mRNA活性都有所降低,从而造成CHS无色底物的积累,使花颜色变浅或成白色。
Meyer等将玉米(ZeamaysL.)的DFR基因导入白色矮牵牛植株中,单拷贝的转基因矮牵牛的花色表现为红色,而多拷贝的转基因矮牵牛的花色表现为白色。
Lloyd等[39]将玉米调节基因C1和R导入烟草和拟南芥之后,使两个物种的白色花冠都不同程度地着色变粉。
Quattrocchio等将一系列花青素代谢的调节基因转入矮牵牛之后,得到红色的愈伤组织、粉红色花冠。
包满珠等将C1和Lc基因转入矮牵牛之后,部分转基因植株的花冠筒由白色变为粉色。
1988年荷兰自由大学在世界上首先采用此法获得了矮牵牛花色变异新品种。
他们将编码CHS的结构基因反向导入矮牵牛植株之后,使转基因植株表现出不同程式的花色变异。
Courtney Gutterson等采用此法使菊花园艺品种花色得到一定程度变异。
Elomaa等将反义CHS 导入非洲菊之后,也使非洲菊的花瓣不能正常着色。
1990年美国和荷兰的科学家发现,当植物体内导入的结构基因不止一个拷贝时,往往引起转基因植株内源基因的抑制。
Napoli等、Jorgenson及VanBlokland等的研究表明,当CHS有多拷贝导入植物体内时,植株的内源CHS 便局部或全部不能表达,从而形成白色花或图案变化十分丰富的彩瓣花。
以上研究现状与成果表明,与花青素生物合成的结构基因与调节基因,已在农作物,花卉上有了较为深入的研究,特别是利用生物学技术调控花青素等类黄酮物质合成,从而改变植物花色、果色与叶色已经取得了许多成果。
花青素代谢调控基因表达的结果使植物细胞内花色素积累,在外观上表现出色彩的变化。
调节基因的导入不但使花冠色彩发生变化,而且使幼叶及其它组织也发生色彩变化,为植物的叶色、果色甚至枝条色彩的改变提供了方法、技术可行性。
在综合运用结构基因和调节基因的基础上,选用具有器官特异性的启动子,完全可能在未来实现植物体彩色化。
因此,克隆与植物叶片或花色相关基因,并将红叶性状的基因转入绿叶植物材料中,从而在分子水平上改变树种的叶片颜色,丰富园林彩叶树种资源,提高城市绿化景观效果等具有重要的理论和现实意义。
一、材料与方法(一)材料试材为李属植物以李属(Prunus)植物中的几个红叶材料红叶李(Prunus cerasifera var. atropurea Jaiq.)的叶片为试材。
紫叶李(Prunus cerasifera‘Atropurpurea ’)紫叶矮樱(Prunus cistena‘Pissardii’ ),黑杆樱李(Prunus ;wrasifers ‘ Nigra ’ ),美人梅(Prunus mume ‘Beauty mei’),四树种生长相对一致的两年生扦插苗(砧木为毛桃)为试材。
(二)方法1.李红叶形状的RAPD标记标记目标性状基因,利用分离群体分组分析(BSA,Bulk segregant analysis)。
具体做法是:采取混合样品法,尽可能地把所有的红叶品种的DNA等量混合,作为一个基因池;把十几份的绿叶品种的DNA等量混合,作为一个基因池,对两个基因池的DNA多态性进行分析,寻找可能与该性状相关的DNA片段。
(1)DNA的提取:采样时均采取幼叶,液氮速冻后置于-80℃冰箱保存。
基因组DNA提取采用Murray 和 Thompson的方法进行。
取0.1g左右速冻叶片于1.5ml Eppendorf管中,加液氮用特制研棒研磨至粉状,加提取缓冲液(2%CTAB,1.4m NaCl ,100mM Tris-HCl,20 mM EDTA ,2%β-ME, 1%PVP)650μl ,混匀后65℃水浴40min,中间轻晃几次;取出冰浴5 min,然后加等体积氯仿:异戊醇(24:1),混匀后12000rpm下4℃离心15 min进行抽提 ;取上清加2μl的10mg/μl的RNase,混匀后37℃水浴30min;取出加等体积的氯仿:异戊醇(24:1)再抽提一次;取上清加2倍体积冰乙醇使DNA絮状沉淀生成,用枪头挑出沉淀,70%乙醇洗涤3次,凉干后溶于100μl无菌水中,4℃冰箱保存待用。
(2)DNA质量检测:DNA的质量和浓度检测在紫外分光光度计上进行。
用1%的琼脂糖凝胶电泳检测DNA提取质量,观察是否降解。
基因组DNA统一稀释至20ng/μl备用。
(3)PCR反应体系及反应热循环程序: PCR反应参照Martins的方法:总体积20μl,10×buffer 2μl,DNA模板20ng,引物浓度0.2μM,dNTP 200μM,TaqDNA聚合酶为1U,Mg2+ 2.0mM。
反应热循环程序:预变性94℃,5min;变性94℃,1min;退火36℃,1min;延伸72℃,2min;循环45次;后延伸72℃7min。
PCR产物用1%琼脂糖凝胶电泳分析。
2.查尔酮合酶(CHS)基因的克隆根据Genbank中注册金鱼草(AntirrhinummajusL.)和矮牵牛(PetuniahybridaVilm)等物种的CHS基因分析其保守序列,根据保守序列设计简并引物,以上边合成的第一链cDNA为模板,PCR扩增CHS的片段,将PCR扩增得到的目的基因片段回收后连接于pGEM-T载体上,连接产物转化大肠杆菌DH5α,筛选阳性克隆,送测序公司测序。
参照BD SMARTTM RACE cDNA Amplification Kit User Manual的方法,用上述的反转录产物cDNA 为模板,下游引物采用试剂盒提供的引物,下游引物根据所得到CHS序列的测序结果设计,利用3’RACE 法克隆CHS 的C-末端序列,根据前面克隆到的CHS 的cDNA 的3’-端序列设计引物,通过5’RACE 法克隆CHS 的N 端序列。
将得到的目的基因回收,连接,转化,并挑选阳性克隆测序,推测其蛋白质序列,进行同源性分析,构建该基因的蛋白质分子进化树。
设计上游引物和下游引物,对红叶李植物紫叶矮樱进行基因克隆。
逆转录反应完成后,向反应体系中加入下列成分:TaKaRa LATaqTM(5U/μl)1.0μl,10×LAPCR Buffer 10μl,4μmol/L上游引物6μl,4μmol/L下游引物6μl,灭菌双蒸水57μl。
总体积为100μl。
PCR反应参数为94℃预变性5min,随后94℃1min,62℃1min,72℃4min,32个循环后,72℃再延伸10min。
目的片段回收,参照Promega公司的回收试剂盒进行。
PCR产物纯化后,直接与pUCm-TVector连接,采用热激法转化大肠杆菌DH5α感受态细胞。
取200μl菌液涂布于含X-gal和IPTG的筛选培养基(含Amp)平板上,37℃培养16h后,随机挑取4个白色菌落,分别接种于加有Amp50mg/L的LB液体培养基中,37℃培养过夜。
按碱裂解法少量提取质粒。
以质粒DNA为模板进行PCR鉴定,委托上海博亚生物技术有限公司测定DNA序列,进行序列分析。
二、结果与分析(一)DNA的纯度及完整性检测采用CTAB法来进行DNA的检测,CTAB是一种阳离子去污剂,具有从低离子强度溶液中沉淀核酸与酸性多聚糖的特性.在高离子强度的溶液中(>0.7mol/L NaCl),CTAB与蛋白质和多聚糖形成复合物,只是不能沉淀核酸.通过有机溶剂抽提,去除蛋白,多糖,酚类等杂质后加入乙醇沉淀即可使核酸分离出来。
(二)李属植物叶片红色性状相关的RAPD标记进行RAPD标记,技术简单,检测速度快,成本低,并且RAPD分析只需少量DNA样品,不依赖于种属特异性和基因组结构,一套引物可用于不同生物基因组分析。
利用随机引物通过PCR反应非定点扩增DNA片段,然后用凝胶电泳分析扩增产物DNA片段的多态性。
扩增片段多态性便反映了基因组相应区域的DNA多态性。
这些多态性片段会出现在红叶的基因池中。
三、讨论提取高质量的DNA是分子生物学研究的基础,李属彩叶植物与其他多年生木本植物一样,提取基因组DNA过程中常常会出现氧化褐化现象,一些褐色非可溶性物质与DNA结合在一起,使DNA沉淀难溶,严重影响DNA提取的质量。
为解决这一问题,通常采用提取缓冲液中加入PVP和β-巯基乙醇以去除材料中富含的酚类物质,或在春季取刚刚萌发的嫩叶,这些材料中多糖和酚类物质等次生物质积累较少,有利于提取高质量DNA,也可采用统一提取缓冲液,分次提取DNA。
