无机及分析化学08 第八章 氧化还原平衡与氧化还原滴定法
《无机化学》课件—08氧化还原平衡和氧化还原滴定法

E =+ -
(8-1)
上页 下页 返回 帮助
第8章 氧化还原平衡和氧化还原滴定法
式中 E——原电池的电动势,V; + ——原电池正的平衡电势,V; - ——原电池负的平衡电势,V。 在标准状态下测得的电动势称为标准电动势(Eɵ)。
标准状态是指电池反应中的液体或固体都是纯净物, 溶液中各离子浓度为1.0 mol/L,气体的分压为100KPa。 知识窗 用电池装置把化学能直接转化为电能,从理论 上讲是完全可能的。日常用的干电池、蓄电池就属于 这一类装置,不过商业电池均不用盐桥,外壳锌皮是
SO32-
SO42-
⑶将两个半反应式配平 首先配平原子数,然后在半反应
的左边或右边加上适当电子数来配平电荷数。
上页 下页 返回 帮助
第8章 氧化还原平衡和氧化还原滴定法
MnO4- + 8H+ +5e-O32- + H2O
SO42- + 2H+ + 2e-
⑷找出两个半反应方程式得失电子数目的最小公倍数 将
2. 氧化剂与还原剂
在氧化还原反应中,元素氧化数的变化是电子得失的结 果。失去电子氧化数升高的物质称为还原剂,获得电子氧化数 降低的物质称为氧化剂。氧化剂与还原剂在反应中既相互对 立,又相互依存。
物质的氧化还原性质是相对的。有时,同一物质和强氧 化剂作用,表现出还原性;而和强还原剂作用,又表现出氧 化性。例如,二氧化硫和氯气在水中的反应:
第8章 氧化还原平衡和氧化还原滴定法 8.1.1 氧化还原反应
1.氧化还原反应的概念
氧化还原反应是一类物质间有电子转移(电子得失或共用 电子对偏移)的反应。其基本特征是反应前后元素的氧化数发 生了变化。
无机及分析化学-氧化还原平衡和氧化还原滴定

例 用离子-电子法配平下列氧化还原反应:
K2Cr2O7 +KI+H2SO4 K2SO4 +Cr2 (SO4 )3+I2 +H2O
解:先写成离子反应式: Cr2O72 +I +H+ Cr3+ +I2 +H2O
将离子反应式分成两个半反应:
I I2 Cr2O72 +H+ Cr3+ +H2O
= Eθ(Ox1/Red1)- Eθ(Ox2/Red2) > 0 反应正向进行 非标准状态下,即:
ε =E (+)-E (-)> 0 反应正向进行
27
rGm ZF 或 rGm ZF
Z:氧化还原反应中转移的电子数 F:Faraday常数=96485C·mol-1 ,即J·V-1·mol-1 据此,可用电动势判断反应方向:
电子由还原剂向氧化剂转移 分类:自身氧化还原反应: 2KClO3 = 2KCl + 3O2
(同一物质不同元素) 歧化反应:水溶液 2Cu+ = Cu + Cu2+
(同一物质同一元素) 反歧化反应: 2Fe3+ + Fe = 3Fe2+
3
二、氧化数
指某元素的一个原子的表观(或形式)电荷数,假定把每个化 学键中的电子指定给电负性较大的原子而求得的.
CMn2 / C CMnO4 / C CH / C
8
Example
O2+2H2O+4e- == 4OH-
Solution
EO2 / OH
E O2 / OH
0.0592 lg Q 4
( ( ))
无机及分析化学第8章 习题答案
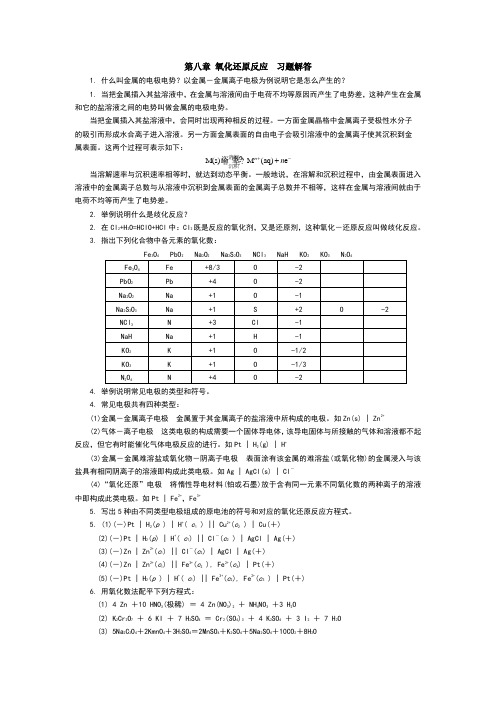
第八章 氧化还原反应 习题解答1. 什么叫金属的电极电势?以金属-金属离子电极为例说明它是怎么产生的?1. 当把金属插入其盐溶液中,在金属与溶液间由于电荷不均等原因而产生了电势差,这种产生在金属和它的盐溶液之间的电势叫做金属的电极电势。
当把金属插入其盐溶液中,会同时出现两种相反的过程。
一方面金属晶格中金属离子受极性水分子的吸引而形成水合离子进入溶液。
另一方面金属表面的自由电子会吸引溶液中的金属离子使其沉积到金属表面。
这两个过程可表示如下:M(s)M (aq)e n n +-+垐垐?噲垐?溶解沉积当溶解速率与沉积速率相等时,就达到动态平衡。
一般地说,在溶解和沉积过程中,由金属表面进入溶液中的金属离子总数与从溶液中沉积到金属表面的金属离子总数并不相等,这样在金属与溶液间就由于电荷不均等而产生了电势差。
2. 举例说明什么是歧化反应?2. 在Cl 2+H 2O=HClO+HCl 中:Cl 2既是反应的氧化剂,又是还原剂,这种氧化-还原反应叫做歧化反应。
3. 指出下列化合物中各元素的氧化数:4. 举例说明常见电极的类型和符号。
4. 常见电极共有四种类型:(1)金属-金属离子电极 金属置于其金属离子的盐溶液中所构成的电极。
如Zn(s) | Zn2+(2)气体-离子电极 这类电极的构成需要一个固体导电体,该导电固体与所接触的气体和溶液都不起反应,但它有时能催化气体电极反应的进行。
如Pt | H 2(g) | H +(3)金属-金属难溶盐或氧化物-阴离子电极 表面涂有该金属的难溶盐(或氧化物)的金属浸入与该盐具有相同阴离子的溶液即构成此类电极。
如Ag | AgCl(s) | Cl-(4)“氧化还原”电极 将惰性导电材料(铂或石墨)放于含有同一元素不同氧化数的两种离子的溶液中即构成此类电极。
如Pt | Fe 2+,Fe 3+5. 写出5种由不同类型电极组成的原电池的符号和对应的氧化还原反应方程式。
5. (1)(-)Pt | H 2(p ) | H +( c 1 ) || Cu 2+(c 2 ) | Cu(+) (2)(-)Pt | H 2(p ) | H +( c 1) || Cl -(c 2 ) | AgCl | Ag(+) (3)(-)Zn | Zn 2+(c 1) || Cl -(c 2) | AgCl | Ag(+) (4)(-)Zn | Zn 2+(c 1) || Fe 3+(c 2 ), Fe 2+(c 3) | Pt(+) (5)(-)Pt | H 2(p ) | H +( c 1) || Fe 3+(c 2), Fe 2+(c 3 ) | Pt(+) 6. 用氧化数法配平下列方程式:(1) 4 Zn +10 HNO 3(极稀) = 4 Zn(NO 3)2 + NH 4NO 3 +3 H 2O(2) K 2Cr 2O 7 + 6 KI + 7 H 2SO 4 = Cr 2(SO 4)3 + 4 K 2SO 4 + 3 I 2 + 7 H 2O (3) 5Na 2C 2O 4+2KmnO 4+3H 2SO 4=2MnSO 4+K 2SO 4+5Na 2SO 4+10CO 2+8H 2O(4) 3H 2O 2 + Cr 2(S O 4)3 + 10KOH = 2K 2CrO 4 +3 K 2SO 4 +8 H 2O (5) 2Na 2S 2O 3 + I 2 = Na 2S 4O 6 +2NaI(6) 5K 2S 2O 8 + 2MnSO 4 + 8H 2O = 8H 2SO 4 + 2KmnO 4 +4K 2SO 47. 用离子-电子法配平下列反应方程式[(1)~(5)为酸性介质,(6)~(10)为碱性介质]。
无机及分析化学08_第八章_氧化还原平衡与氧化还原滴定法

M(s)
沉积
Mz+(aq)+ze-
Chapter Eight
31
2.意义
金属越活泼 失电子趋势越大 电极表面积累 的负电荷越多 E(O/R)值越小 故还原态物质 的还原能力越强
Chapter Eight
金属越不活泼
得电子趋势越大 电极表面积累 的正电荷越多 E(O/R)值越大
故氧化态物质 的氧化能力越强
2. 原则
把每个化学键中的电子指定给电负
性更大的原子而求得。
Chapter Eight
5
3. 确定
在单质中,元素的氧化数为零; 在中性分子中所有原子氧化数代数和
应等于零;
除金属氢化物(如NaH)外,化合物
中氢的氧化数均为+1;
Chapter Eight
6
通常,在化合物中,氧的氧化数为-2;
成原电池,用电池图解式表示。
解:电对 氧化反应 还原反应
Fe3+/Fe2+ Fe2+(aq) Ag+ (aq) +e-
Ag+/Ag Fe3+ (aq) +e- (-) Ag (s) (+)
Fe2+(c1) | Fe3+(c2) || Ag+(c3) | Ag (-) Pt | Fe2+(c1),Fe3+(c2) || Ag+(c3) | Ag (+)
Chapter Eight
21
4、基本术语
Zn(s) Zn2+(aq) + 2eCu(s) Cu2+(aq) + 2e(1)半电池(电极)
进行氧化反应和还原反应的两个不同的区域,也 称电极。 Zn-ZnSO4 组成锌电极, Cu-CuSO4 组成铜电极。
考研,分析化学,氧化还原平衡与氧化还原滴定0.解析

0.059 n2
lg cO2 cR2
sp后:以滴定剂电对计算体系电位
E
=
E1 =
E1
+
0.059 n1
lg
cO1 cR1
O1 + n1e = R1 E1 O2 + n2e = R2 E2
E1=E1
+
0.059 n1
lg
cO1 cR1
E2=E2
+
0.059 n2
lg cO2 cR2
反应达到 平衡时:
如果 E1>E2 n2O1 + n1R2 = n2R1 + n1O2
lg K p(E1 E2 ) 0.059
n2 n1
二、氧化还原滴定法
1、氧化还原滴定指示剂
(1)自身指示剂 KMnO4:2×10-6mol·L-1 呈粉红色
(2)特殊指示剂(显色或吸附指示剂)
淀粉:与1×10-5mol/L I2生成深蓝色化合物(碘量法专用)
(3)氧化还原指示剂(本身发生氧化还原反应)
InO + ne = InR
EInO / InR
E1= E1+
0.059 n1
lg
cO1 cR1
E2=
E2+
0.059 n2
lg cO2 cR2
Esp
n1E1 n1
n2
E 2
n2
E1=E2=Esp
二、氧化还原滴定法
2、滴定过程中电位的求算
滴定反应为: n2O1 + n1R2 = n2R1 + n1O2
sp前:以被测物电对计算体系电位
E = E2 = E2 +
氧化还原平衡与氧化还原滴定
无机及分析化学教案

无机及分析化学教案一、教学目标1. 知识与技能:(1)掌握无机化学的基本概念、原理和常见元素化合物的性质;(2)了解分析化学的基本原理和方法,具备一定的实验操作能力。
2. 过程与方法:(1)通过实验和理论教学相结合,培养学生的观察能力、思维能力和解决问题的能力;(2)学会运用化学知识分析和解决实际问题。
3. 情感态度与价值观:(1)培养学生对化学学科的兴趣和热爱;(2)增强学生的创新意识,培养学生的团队合作精神。
二、教学内容1. 第一章:无机化学基本概念(1)物质的组成与结构(2)化学反应的基本类型(3)溶液及其性质2. 第二章:元素周期律与元素周期表(1)元素周期律的实质(2)元素周期表的结构与特点(3)常见元素的原子结构与性质关系3. 第三章:非金属元素及其化合物(1)氢、氧、氮、卤族元素的基本性质(2)碳族元素及其化合物的性质(3)常见非金属化合物的制备与用途4. 第四章:金属元素及其化合物(1)碱金属与碱土金属的基本性质(2)过渡金属元素的基本性质(3)常见金属化合物的制备与用途5. 第五章:分析化学基本方法(1)滴定分析法(2)重量分析法(3)光谱分析法与色谱分析法三、教学重点与难点1. 教学重点:(1)无机化学基本概念、原理及元素化合物的性质;(2)分析化学的基本方法及其应用。
2. 教学难点:(1)复杂化学反应机理的理解;(2)分析化学方法的原理与操作技巧。
四、教学方法与手段1. 教学方法:(1)采用实验与理论相结合的教学方式;(2)运用案例分析、问题驱动、小组讨论等教学方法;(3)注重启发式教学,培养学生的独立思考能力。
2. 教学手段:(1)利用多媒体课件、网络资源进行教学;(2)实验室实践教学;(3)发放相关教材、辅导资料。
五、教学评价1. 过程性评价:(1)课堂提问、讨论、实验操作;(2)课后作业、小测验;(3)实验报告、课程论文。
2. 终结性评价:(1)期末考试;(2)综合素质评价。
无机及分析化学---氧化还原反应与氧化还原滴定法
常用氧化还原滴定法
(1)高锰酸钾法 酸性介质: MnO4- + 5e- +8H+ = Mn2+ + 4H2O
ө MnO4
Mn2
1.51V
10
中性、弱酸性、弱碱性介质: MnO4- + 3e- +2H2O = MnO2↓+ 4OH-
ө MnO4
MnO2
0.595V
强碱性介质: MnO4- + e- = MnO42-
0.0592 n
lg COx CRe d
5
使用能斯特方 程注意事项
⑴ 公式里溶液的离子浓度为相对浓度(即COx / C ө或 CRed / C ө) 气体则为相对分压(即 pOx / p ө或 pRed / p ө );
例如: 2H+ + 2e- = H2
2H
H2
ө
2H
H2
0.0592 lg 2
电极电势是电极与溶液界面形成扩散双电层而测得的一个相对值。
在250C时,若电极中参加反应的离子浓度为1mol·L-1,参加反应的气体压力为 100KPa,则此条件下测得的电极电势称为电极的标准电极电势。
使用标准电极 电势注意事项
(1)电极反应常表示为:氧化态 + ne- = 还原态,电极电势
书写为
MnO4 Mn2
ө
MnO4
Mn2
0.0592 5
lg
C C8
MnO4
H
CMn2
6
四、电极电势的应用
1、判断氧化还原反应进行的方向
电池的电动势 E
(1)当 E 0 时,即 ,反应正向自发进行; (2)当 E 0 时,即 ,反应逆向自发进行; (3)当 E 0 时,即 ,反应处于平衡状态;
分析化学氧化还原滴定法PPT精选文档
16
氧化还原反应进行的程度
当 1( 2 无副或 反 1'应 2 ( ')有副反应
p2Ox1 + p1Red2
p1Ox2 + p2Red1
平衡常 K数 aaR pO p22ed1x1
lgKlgaaRpO p22ed1x1
p1
aO2x ap1
Red2
n(1 2)(无副反应
0.059
1 ' 0.n 015lg9 C C R Od 11 ex2 ' 0.n 025lg9 C C R Od 2e 2x
lgK'lgC CR p O p22d1e1xC CR p O p11d2 e2x
14
氧化还原反应平衡
H H3 AA sO 24 s [O [ HH [ H]] 3 ]K[ aH ]2K a 1 [ [H H ] ]2 3 K a 1 K a 2 K a 1 K a 2 K a 3
当 [ H ] 5 m /L o H '3 A l4s H O 2 A 0 . 6 s V O 0 I 3 /I
C ‘ 4 e C 3 e 0 .0l5 g C C C C 9 3 4 e e 1 .4 4 0 .0l5 1 g 9 3 0 1 .2V 6
CF2e 0.1
F '3 e F 2 e 0 .0l5g C C F F 9 2 3 e e 0 .6 8 0 .0l5 1 g3 9 0 0 .8V 6
26
氧化还原滴定曲线及终点确定
S时 P C F 3 e : C C 3 e , C F 2 e C C 4 e
第八章氧化还原平衡与氧化还原滴定
基础化学
第八章 氧化还原平衡与氧化还原滴定
二、离子-电子法配平氧化还原反应方程式
实例分析:配平下列化学反应式
M 4 C 2 O n 2 4 O H M 2 C 2 n H O 2 O
基础化学
第八章 氧化还原平衡与氧化还原滴定
解: ① 氧化半反应 还原半反应
C2O24 2CO 2 M 4 n 8 H O M 2 4 n H 2 O
注意:
1. 的代数值与半反应中的系数无关,即与
得失电子数多少无关。
例如: Cu2+ + 2e
Cu
2Cu2+ + 4e
2Cu
其 Cu2+/Cu值都是0.34V。
基础化学
第八章 氧化还原平衡与氧化还原滴定
2.附录五中列出了298K时一些常用电对的标准电极电势,查表 时要注意溶液的酸碱性,电极在不同的介质中值一般不同。
MnO4- + H+ + Fe2+ Mn2+ + Fe3+ 如将此反应设计为原电池,写出正、负极的反应,电池反应和电池符号。
解:电极为离子电极,即将一金属铂片插入到含有Fe2+、 Fe3+溶液中, 另一铂片插入到含有MnO4- 、Mn2+ 及H+ 的溶液中,分别组成负极和正极:
负极反应: Fe2+ = Fe3+ + e 正极反应: MnO4- + 8H+ + 5e = Mn2+ + 4H2O 电池反应: MnO4- + 8H+ + 5Fe2+ = Mn2+ + 5Fe3+ + 4H2O 电池符号: (-)Pt|Fe2+(c1),Fe3+(c2)||MnO4-(c3),H+(c4),Mn2+(c5)|Pt (+)
氧化还原平衡与氧化还原滴定法
= -42.89kJ.mol-1
ΔrG
θ m
nFE θ
-42.89×103 = -2×96485 ×[jθ(AgCl/Ag)-0 ]
jθ(AgCl/Ag) =0.222V
OH-
9.3 电极电势
1. 原电池( galvanic cell)
利用自身的氧化还原反映将 化学能转化为电能的装置。 由两个半电池组成: (一)锌极═铜极(+) 低电位 高电位 失去电子 得到电子 还原剂 氧化剂
1) 电极反应与电池反应
电极反应: 负极:Zn-2e=Zn2+ 正极: Cu2++2e=Cu
用“氧化型/还原型”表示。
例:Cl2/Cl-,I2/I 氧化还原电对的书写形式与反应式有关。
半反应
电对
MnO4-+8H++5e=Mn2++4H2O MnO4-/Mn2+ MnO4-+2H2O+3e=MnO2+4OH-
MnO4-/Mn2O
❖ 在氧化还原电对中,氧化型的氧化 能力越强,则其共轭还原型的还原 能力越弱;反之,还原型的还原能 力越强,则其共轭氧化型的氧化能 力越弱。氧化还原反应是两个氧化
的能力
数值
0,正负整 数。正负
0、正、负整数
正
整
数
分
数
实例 C CH3CI C I
H
-2 -1 +1
+1价 - 1价
4
2. 氧化与还原
0
-1
-1 0
Cl2 2K I 2K Cl I2
氧化:在氧化和还原反应中,元素 氧化数升高的过程称为氧化。
还原:在氧化和还原反应中,元素 氧化数降低的过程称为还原。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在超氧化物中(KO2),氧的氧化数 为 -1/2 ;
在氧的氟化物(OF2,O2F2)中,氧的氧化数 分别为+2和+1。
在所有的氟化物中氟的氧化数为-1。
Chapter Eight
7
例: SiO2: Si的氧化数为+4;
Cr2O72-:Cr的氧化数为+6; Fe3O4: Fe的氧化数为 8 ; S2O32-: S的氧化数为+2; S4O62-: S的氧化数为2.5;
第八章 氧化还原反应与氧化还原滴定法
Chapter Eight
1
氧化还原反应 原电池及电极电势 电极电势的应用 氧化还原滴定法 常用氧化还原滴定法 重点:氧化还原方程式的配平;电极电势的应用 和有关计算;能斯特方程;氧化还原滴定的主要 方法、滴定条件;氧化还原滴定法计算。 难点:各种因素对电极电势影响的定量计算;氧 化还原滴定法中的计算
Chapter Eight
25
例:已知下列电池图解: Zn(s)|Zn2+(c1)||H+(c2)|H2(p ) | Pt 写出原电池的电极反应和电池反应。 解:负极,氧化反应
Zn(s)
Zn2+(aq)+2e-
正极,还原反应
2H+(aq)+2e氧化还原反应 Zn(s)+2H+(aq)
H2(g)
Zn2+(aq)+H2(g)
21
Chapter Eight
(5) 正负极
•
电子的流出极叫负极:Zn极
•
电子的流入极叫正极:Cu极
(6) 阴阳极
•
阳极(Positive Electrode): 凡是进行氧化反应的电极叫阳极。
•
阴极(Negative Electrode): 凡是进行还原反应的电极叫阴极。
Chapter Eight
Chapter Eight
金属越不活泼
得电子趋势越大 电极表面积累 的正电荷越多 E(O/R)值越大
故氧化态物质 的氧化能力越强
31
3. 原电池的电动势
(1)表示 正负电极之间的平衡电势差
ε= E +- E - 如 ε= E(Cu2+/Cu)- E(Zn2+/Zn) 标态 ε = E+ - E 如 ε = E (Cu2+/Cu) – E (Zn2+/Zn)
Chapter Eight
氧化反应 还原反应
20
(3) 氧化还原电对 两个半反应中氧化态和相应的还原态
物质构成的两个氧化还原电对。 氧化态/还原态: Zn2+/Zn Cu2+/Cu
(4)电池反应
两个半反应组成的氧化还原总反应叫 电池反应。
Zn(s) + CuSO4(aq)
ZnSO4(aq) + Cu(s)
Chapter Eight
2
§8.1 基本概念及氧化还原方程式配平 8.1.1 氧化与还原定义
1. 与氧结合的过程叫氧化, 除去氧的过程叫还原。 局限性:覆盖范围小 。 如 Mg(s)+Cl2(g) MgCl2(s)
Chapter Eight
3
2. 失去电子的过程叫氧化,得到电子的 过程叫还原。
22
5、 原电池表示方法
(-)Zn ZnSO4
—电池图解式,电池符号
(1) 负极写左边,正极写右边
CuSO4 Cu(+)
(2) 半电池中两相界面用“|”表示
两种溶液间用“,”,两种固体间 也用“|”,纯溶液和气体写在惰性电极 一边,用“,”隔开。
Zn|ZnSO4 Pt|Fe2+,Fe3+
CuSO4|Cu Fe3+,Fe2+|Pt
3
Chapter Eight
8
8.1.3 氧化还原反应式的配平
1. 配平原则
电荷守恒
——离子电子法
反应中氧化剂得到的电子总数必须等 于还原剂所失去的电子总数。
质量守恒
根据质量守恒定律,方程式两边各种
元素的原子总数必须各自相等,各物种的
电荷数的代数和必须相等。
Chapter Eight
9
2. 配平步骤
23
Chapter Eight
(3) 两半电池之间用“||”表示
Zn|ZnSO4 || CuSO4|Cu (4) 注明溶液的浓度(气体注明分 压) 、相态 Zn(s)|ZnSO4(c1)||CuSO4(c2)|Cu(s)
Chapter Eight
24
例:将Fe2+(aq)+Ag+(aq)
Fe3+(aq)+Ag组
Pt|H2(100kPa)|H+(1mol· -1) L
2H+(aq) + 2eH+/H2 E (H+/H2)=0.000V
Chapter Eight
16
盐桥(Salt Bridge)的功效 构造:将饱和KCl中加入琼脂加热后,装 入U 形管中,冷却后成为凝胶。有 可自由移动的K+,Cl-。 作用:构成电的通路。
Chapter Eight
17
结论:装置2使氧化反应和还原反应分在两个 不同的区域进行;电子转移通过外电 路实现,于是有了电子的定向流动, 从而产生电流,实现了化学能向电能
成原电池,用电池图解式表示。
解:电对 氧化反应 还原反应
Fe3+/Fe2+ Fe2+(aq) Ag+ (aq) +e-
Ag+/Ag Fe3+ (aq) +e- (-) Ag (s) (+)
Fe2+(c1) | Fe3+(c2) || Ag+(c3) | Ag Pt | Fe2+(c1),Fe3+(c2) || Ag+(c3) | Ag
2OH-(aq) Pt | O2(p)|OH-(c)
金属-难 AgCl(s) +e溶盐电极
Ag(s) +Cl-(aq) Ag|AgCl|ClChapter Eight
27
8.2.2 电极电势
1. 电极电势的产生
M M
溶解
Mn+ + ne-
金属越活泼,溶液越稀, 这种倾向越大。 同时
Mn+ + Mn+
Cu
Chapter Eight
14
装置2: Zn片插入ZnSO4溶液中,Cu片插入CuSO4 溶液中,两烧杯用一倒置的U形管连通— —盐桥。两金属用导线相连,中间连一个 检流计。 检流计
e盐 桥 KCl (aq) Zn Cu
e-
原电池
ZnSO4(aq)
1.0mol· L -1
CuSO4(aq)
1.0mol· L -1
Chapter Eight
13
装置1: 将Zn片直接插入CuSO4溶液中
现象:Zn片溶解,Cu析出。 解释: Zn(s)+CuSO4(aq) ZnSO4(aq)+Cu(s)
Zn
Zn直接和CuSO4溶液接触, Zn失去的电子直接给Cu2+, 电子流动无序,Zn片溶解, Cu析出,温度升高。 结论:化学能转变为热能。
Chapter Eight
15
现象: (1)检流计指针偏转:Zn是负极,Cu是正极; (2)Zn片溶解,Cu片上有Cu析出; (3)取出盐桥,指针回零,放入盐桥,指针偏 转,说明盐桥构成了电的通路。 解释: Zn(s) Zn2+(aq)+2e- (负极) Cu2+(aq)+2eCu(s) (正极) Zn(s)+CuSO4(aq) ZnSO4(aq)+ Cu(s)
解: I II III
MnO4- + SO32-
SO42- + Mn2+ ①
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O
SO32- + H2O = SO42- + 2H+ + 2e② ①×2+②×5得: 2MnO4- + 16H+ + 10e- = 2Mn2+ + 8H2O
+) 5SO32- + 5H2O = 5SO42- + 10H+ + 10e2MnO4- + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
Chapter Eight
19
4、基本术语
Zn(s) Zn2+(aq) + 2eCu(s) Cu2+(aq) + 2e(1)半电池(电极)
进行氧化反应和还原反应的两个不同的区域,也 称电极。 Zn-ZnSO4 组成锌电极, Cu-CuSO4 组成铜电极。
(2)半反应(电极反应)
两个半电池中进行的氧化和还原反应就是两 个半反应。 Zn(s) Zn2+(aq)+2eCu2+(aq)+2eCu(s)
Chapter Eight
33
(2) 标准氢电极
H2,100kPa
H+
1mol· -1 L
Pt电极
标准氢电极构造示意图
Chapter Eight
34
结构
镀疏松铂黑的 Pt 丝,插入
c(H+)=1mol· -1的硫酸溶液, L 不断通入p(H2) =100kPa纯H2
