硫酸盐酸性质比较
一、浓盐酸、浓硫酸、浓硝酸的性质比较

碱溶液中NaOH溶液与NH3·H2O溶液硫酸盐溶液中CuSO4溶液与Na2SO4溶液固体药品中NaOH固体与NaCl固体气味颜色溶解时放热情况1、多种试剂分步鉴别法分组法物理方法色、味、溶解性等2、再根据物质的特性选择合适的试剂. 化学方法1、先用酸碱指示剂分成酸性、中性、碱性几组例鉴别NaOH、Na2CO3、H2O、HCl、H2SO4五种溶液。
滴加紫色石蕊试液紫色红色蓝色H2O 无现象白色沉淀无现象冒气泡HCl H2SO4 NaOH Na2CO3 HCl H2SO4 NaOH Na2CO3 BaCl2溶液稀盐酸NaOH Na2CO3 H2O HCl H2SO4 1、紫色石蕊---变蓝2、无色酚酞---变红3、可溶性铜盐---蓝色沉淀4、可溶性铁盐---红褐色沉淀HCl NaOH 例鉴别NaOH、H2O、HCl、H2SO4四种溶液。
2、用一种试剂鉴别用一种试剂鉴别多种物质通常有以下几种类型用紫色石蕊试液鉴别酸性、中性、碱性溶液1、多种试剂分步鉴别法分组法物理方法色、味、溶解性等2、再根据物质的特性选择合适的试剂. 化学方法1、先用酸碱指示剂分成酸性、中性、碱性几组2、用一种试剂鉴别用一种试剂鉴别多种物质通常有以下几种类型用紫色石蕊试液鉴别酸性、中性、碱性溶液1、多种试剂分步鉴别法分组法例:用一种试剂鉴别HCl、NaCl、NaOH 三种无色溶液HCl NaCl NaOH 滴加紫色石蕊试液紫色红色蓝色HCl NaCl NaOH 例:用一种试剂鉴别HCl、NaCl、NaOH 三种无色溶液HCl NaCl NaOH 滴加紫色石蕊试液紫色红色蓝色HCl NaCl NaOH 加一种试剂与各待测物可出现不同现象而加以鉴别例:用一种试剂鉴别NaCl BaCl2 NaOH三种无色溶液NaCl BaCl2 NaOH 可溶性Cu盐SO4 CO3 可溶性Ag盐可溶性Fe盐Cu SO4 Fe2 SO43 例:用一种试剂鉴别NaCl、BaCl2 、NaOH三种无色溶液NaCl BaCl2 NaOH 可溶性铜盐SO4 CO3 可溶性Ag盐可溶性铁盐Cu SO4 Fe2 SO43 NaCl BaCl2 NaOH 滴加Cu SO4 白色沉淀无现象蓝色沉淀NaCl BaCl2 NaOH 2、用一种试剂鉴别用一种试剂鉴?鸲嘀治镏释ǔS幸韵录钢掷嘈?用紫色石蕊试液鉴别酸性、中性、碱性溶液. 加一种试剂与各待测物可出现不同现象而加以鉴别. 1、多种试剂分步鉴别法分组法3、不用其他试剂鉴别不用任何试剂可根据待测物质的物理性质如颜色、气味、溶解性先鉴别出其中的一种物质再利用该物质鉴别其他物质。
盐酸、硫酸的性质比较

(1)碳酸钠溶液显碱性,能使无色酚酞溶液变红 (2)碳酸钠能与稀盐酸反应,生成CO2气体。 (3)碳酸钠溶液能与氢氧化钙溶液(石灰水)反应,生成CaCO3沉淀。
10、粗盐提纯 (1)需要的仪器有:______________________ (2)操作步骤有______、________、________。 (3)玻璃棒在每步操作中的用途_____________。 (4)经两次过滤后滤液仍浑浊的可能原因_________。
练习:设计实验证明鸡蛋壳里含有碳酸根离子。
6、用石灰石、水、纯碱为原料制取少量烧碱。
(写化学方程式并判断反应类型)(三个)
7、食盐作调味剂、消雪剂、碳酸钠生产洗涤剂、
碳酸氢钠焙制糕点、治疗胃酸过多、
碳酸钙用作补钙剂、大理石或石灰石用作建筑材料。
8、复分解反应发生的条件。
(背诵P109溶解性表并记住常见的沉淀)
CuO+H2SO4=CuSO4+H2O
现象:黑色固体逐渐 消失,溶液变为蓝色.
1.在稀释浓硫酸时,一定要把 浓硫酸沿器壁慢慢注入 水 里,并不断搅拌。若将水倒入浓硫酸里,硫酸液滴 会向四周飞溅,因为水的密度较小,浮在浓硫酸上 面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向 四周飞溅。
2.胃液中含有 盐酸 ,帮助消化。 盐酸和硫酸都可以用于 除锈 。 浓硫酸具有 吸水性 ,所以可用作某些气体的 干燥剂 。
取氢氧化钠溶液少量于试管中,滴加无色酚 酞试液,振荡,溶液变红;然后向试管中滴 加稀盐酸,边滴边振荡,至溶液恰好变成无 色,证明氢氧化钠溶液与稀盐酸能发生反应。
中和反应:酸和碱作用生成盐和水的反应
2NaOH + H2SO4 == Na2SO4 + 2H2O Ca(OH)2 + 2HCl == CaCl2 +2 H2O
已知常用的强酸

已知常用的强酸强酸是指在水溶液中能够完全电离产生大量H+离子的酸。
它们通常具有强烈的腐蚀性和刺激性,常被用于工业生产、化学实验、清洗和腐蚀等领域。
在本文中,将介绍几种已知常用的强酸,包括硫酸、盐酸和硝酸。
1. 硫酸(H2SO4)硫酸无疑是目前应用最广泛的强酸之一。
它具有强烈的腐蚀性和氧化性,常见的浓硫酸可与有机物发生剧烈的反应,释放出大量热量。
硫酸广泛应用于化学实验、工业制造、石油炼制等领域。
在工业生产中,硫酸常被用于制造肥料、造纸、染料和洗涤剂等。
此外,硫酸还可用于冶金行业和炮火工程。
2. 盐酸(HCl)盐酸是另一种常用的强酸,化学式为HCl。
它是一种无色透明的液体,具有强烈的刺激性和腐蚀性。
盐酸可溶于水,并能与水快速反应产生大量氯离子和H+离子。
由于其腐蚀性较强,盐酸常被用于工业清洗、金属腐蚀以及酸洗等领域。
在化学实验中,盐酸常被用作溶液的酸性调节剂,还可以用于水质检测和PH调节。
3. 硝酸(HNO3)硝酸是一种无机强酸,具有强氧化性和腐蚀性。
它的常见浓度为65%至68%,具有无色或微黄色的液体。
硝酸可与大部分金属及其氧化物、碱等产生反应,是用来腐蚀和清洗金属的重要物质。
此外,硝酸还被广泛应用于农业、化学实验和爆炸物制造等领域。
除了以上三种常用的强酸,还有一些其他的强酸也值得注意,例如:磷酸、溴酸和氢氟酸。
磷酸具有强氧化性,可用于制造肥料和饮料添加剂等;溴酸是一种无机酸,可用于制造染料、药物和火药等;氢氟酸是一种无色液体,具有极强的腐蚀性,在工业生产中用于制造氟化物和玻璃蚀刻等。
需要注意的是,由于强酸具有强烈的腐蚀性,使用和储存时必须注意安全。
在实验室或工作场所中使用强酸时,必须戴上防护眼镜、手套和防护服,避免接触皮肤和眼睛。
另外,强酸应存放在专门的容器中,并远离易燃和易爆物品。
总结一下,已知常用的强酸包括硫酸、盐酸和硝酸等。
它们在工业生产、化学实验、清洗和腐蚀等领域发挥重要作用。
然而,由于其强烈的腐蚀性,使用时必须谨慎,并采取有效的安全措施,以确保人员和环境的安全。
盐酸和硫酸的性质比较

盐酸和硫酸的性质比较盐酸(HCl)和硫酸(H2SO4)是两种常见的无机酸,它们在化学实验室和工业生产中广泛应用。
尽管它们都是酸,但它们在性质上有一些明显的区别。
本文将比较盐酸和硫酸的性质,从而更好地了解它们的应用和特点。
一、化学结构盐酸的分子式为HCl,是一种单质化合物。
它由氢原子和氯原子组成,其中氯原子与氢原子形成共价键。
硫酸的分子式为H2SO4,是一种复合化合物。
它由氢原子、硫原子和氧原子组成,其中硫原子与氢原子形成离子键,氧原子与硫原子形成共价键。
二、物理性质1. 盐酸是一种无色无味的液体,有强烈刺激性气味。
它可以溶于水并迅速与水反应,放出大量热量。
2. 硫酸是一种无色至浅黄色的液体,有浓烈的刺激性气味。
它也可以溶于水,并且与水反应,释放出大量热量。
三、酸性1. 盐酸是一种强酸,可以完全解离成H+离子和Cl-离子。
溶液的pH值通常小于1,是一种较为浓烈的酸性溶液。
2. 硫酸也是一种强酸,可以完全解离成2H+离子和SO4^2-离子。
溶液的pH值通常小于1,也是一种较为浓烈的酸性溶液。
四、化学反应1. 盐酸与碱反应会产生盐和水,例如与氢氧化钠反应生成氯化钠和水。
反应示意为:HCl + NaOH -> NaCl + H2O。
2. 硫酸与碱反应也会产生盐和水,例如与氢氧化钠反应生成硫酸钠和水。
反应示意为:H2SO4 + 2NaOH -> Na2SO4 + 2H2O。
五、腐蚀性1. 盐酸具有较强的腐蚀性,能够腐蚀金属并与许多物质反应。
因此在使用和储存时需要格外小心。
2. 硫酸的腐蚀性更强,可以腐蚀许多有机物和无机物,包括金属。
与盐酸相比,硫酸在储存和使用时需要更加谨慎。
综上所述,盐酸和硫酸在化学结构、物理性质、酸性、化学反应以及腐蚀性等方面存在一些差异。
了解这些差异有助于我们更好地理解它们的特点和应用。
在实验室和工业上使用这两种酸时,必须谨慎操作,遵守安全操作规程,以免对身体和环境造成危害。
浓盐酸和浓硫酸在物理性质方面有哪

我探究:浓盐酸和浓硫酸的物理性质
浓盐酸
浓硫酸
溶质的化学式及质量分数 HCl 37%~38% H2SO4 98%
颜色
无色
无色
状态
液体Leabharlann 粘稠、油状液体气味 密度 打开瓶口的现象 其他
刺激性气味
无气味
1.18g/mL 有白雾 挥发性
1.84g/mL 无现象 吸水性 腐蚀性
氢气和水蒸气 的混合气体
代表水分子 代表氢分子
氢气
浓硫酸
浓硫酸可做某些气体的干燥剂
如果不慎将浓硫酸沾到皮肤上,
应立即用大量的水冲洗,然后涂3%∼5%的碳 酸氢钠溶液,以防灼伤皮肤。
浓硫酸溶于水,放出大量的热, 并且密度比水大。
猜想:如何用水稀释浓硫酸,为什么?
稀释浓硫酸
稀释浓硫酸的视频
物质的分类
纯净物
物质
混合物
单质 化合物
产生无色气体、放热
铁锈逐渐消失、溶液变为黄色
铁钉表面有气泡生成
产生无色气体
氯化铜溶液
无可见现象
如果把上述实验中的稀盐 酸换成稀硫酸,是否出现类似 的现象?原因呢?
会. 不同的酸溶液都含有H+
迁移应用
右图所示已平衡的天平
两端放着两个分别盛有
浓盐酸和浓硫酸的敞口
烧杯,过一段时间后,
天平会 ( B )。
实验探究
浓盐酸和浓硫酸在物理性 质方面有哪些异同?
酸的性质
认识浓盐酸和浓硫酸
浓盐酸 (37~38%) Hydrochloric acid
500ml (1.18g/mL) 化学式HCl 相对分子质量36.5 有腐蚀性!
符合 GB622-89
硫酸与盐酸的性质对比
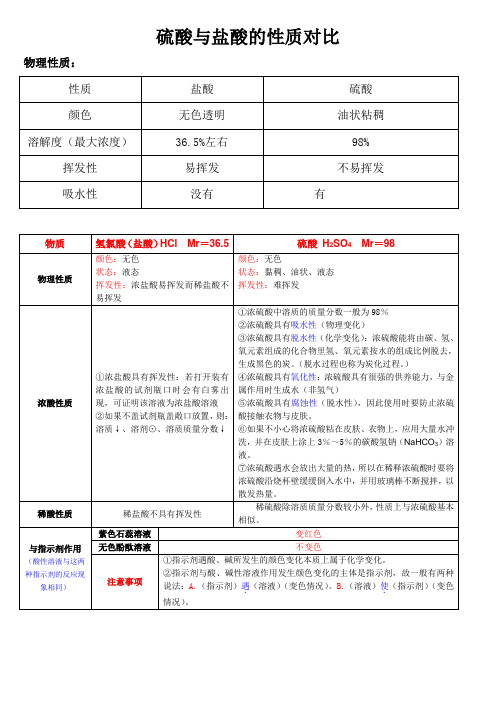
硫酸与盐酸的性质对比物理性质:42HCl化学性质:1.稀盐酸,稀硫酸具有酸的通性:①能和指示剂反应。
(使紫色石蕊试液变红,使酚酞不变色)②能和活泼金属反应(排在H前的金属,如铁,锌,镁,铝)对应训练1:实验室制取氢气,为什么一般选用锌和稀盐酸(或稀硫酸),而不用铁,也不用铝?③能和碱反应,生成盐和水。
(即中和反应)注意:生成盐和水的反应不一定都是中和反应。
例如:2NaOH+CO2 = Na2CO3+H2O④能和碱性氧化反应。
例如:CaO+2HCl = CaCl2+H2O⑤能和某些盐反应。
如:H2SO4+BaCl2 =BaSO4↓+2HCl(注意:该反应是复分解反应,反应物要可溶,生成物要有沉淀,气体或水,这三种物质中的其中一种)2.浓硫酸的浓度最高可达98%,所以此时浓硫酸具有它独特的性质。
①强氧化性。
②脱水性。
如何稀释浓硫酸?为什么不能将水倒入浓硫酸中?为什么要用玻璃棒不断搅拌呢?1.下列说法不正确的是()A.稀硫酸能和铁反应B.稀硫酸具有挥发性C.稀盐酸不能使酚酞试剂变红色D.浓盐酸放在空气中浓度会变低2.下列化学方程式书写正确的是()A. 2Fe +3 H2SO4 = Fe2(SO4)3 +3H2↑B. 2HCl + BaO =BaCl2 +H2OC. HCl + AgNO3 =AgCl +HNO3D.NaOH + CaCl2 =Ca(OH)2+ NaCl3.我们已经学过,实验室制取二氧化碳用石灰石和稀硫酸反应。
实验的反应方程式为:CaCO3+ 2HCl = CaCl2+ H20+ CO2↑请问:(1)能否用浓盐酸代替稀盐酸?————————————————————————————(2)请问稀硫酸能和石灰石反应吗?若能,写出化学方程式,若不能,请说明理由。
———————————————————(3)请问能用稀硫酸和石灰石制取二氧化碳吗?。
盐酸和硫酸的比较(见右图)
酸和碱1、盐酸和硫酸的比较(见右图)2、在金属活动性顺序中,位于H前面的金属能置换出酸中的氢,浓硫酸、硝酸不能制取氢气。
3、氢氧化钠和氢氧化钙的比较4、溶液酸碱度的表示方法。
溶液的酸碱性用酸碱指示剂区别,酸碱度常用pH来表示。
pH值越小酸性越强,pH值越大碱性越强。
pH的测定测定方法是使用pH试纸。
1、下列说法正确的是(B)(只有可溶性的碱才能使酚酞试液变红。
正常雨水由于含有二氧化碳也显酸性,酸雨通常指pH值小于5.6的雨水。
PH=7的溶液才是中性。
)A、碱类物质一定能使酚酞试液变红B、有盐和水生成的反应不一定是中和反应C、呈酸性的雨水就是酸雨D、pH=0的溶液即不显酸性,也不显碱性,呈中性2、X是氧化物,能与酸反应生成盐和水,能与水反应生成碱,则X是(B)(金属氧化物能与酸反应,能与水反应说明又是可溶性的。
)A、SO2B、K2OC、CuOD、CO23、下列说法中正确的是(B)(酸与盐反应不能叫中和反应。
浓硫酸质量能增加但不会变质。
锌与盐酸反应产生无色气体氢气,不是CO2。
)A、面粉发酵生成有机酸,在做面食前要根据中和反应原理,用纯碱去中和有机酸B、服用胃舒平(含Al(OH)3)去中和过多的胃酸C、浓硫酸、固体烧碱在空气中露置一段时间,质量会增加而且会变质D、某固体中加入稀盐酸,产生了无色气体,证明该固体一定含有CO32-4、下列干燥气体的方法正确的是(C)(干燥剂除了能吸收水份外,还不与被干燥物发生化学反应。
如固体烧碱能与非金属氧化物CO2反应。
)A、用固体烧碱干燥CO2B、用碱石灰(生石灰与火碱的混合物)干燥SO2C、用无水氯化钙干燥H2D、用浓硫酸干燥NH35、现有铁、盐酸、氧化铁、氧化铜溶液、氢氧化钠溶液、氯化钾六种物质,两两混合能发生反应的总数有(B)A、4种B、5种C、6种D、7种6、在一定条件下,同一反应进行的快慢与反应物的溶质质量分数成正比。
现用100g溶质质量分数为30%的硫酸溶液与过量的镁粉反应,为了使反应慢点而不影响生成氢气的总量,可向该溶液中加入适量的(BC)(加入的物质必须满足两个条件,一是不与硫酸发生化学反应,二是只能起稀释的作用)A、氢氧化钠B、水C、碳酸钾溶液D、碳酸钠溶液7、将下列试剂分别滴入硝酸铜溶液、碳酸钠溶液和氢氧化钾溶液中,能观察到三种不同现象的是(C)(蓝色沉淀、白色沉淀、无反应)A、稀盐酸B、氯化钠溶液C、氢氧化钙溶液D、氯化钾溶液8、欲将含有盐酸的CaCl2溶液中和至中性,在不用指示剂的条件下,应加入的试剂是(B)(除杂质的原则是不能引入新杂质,同时要把杂质除尽,所加试剂必须过量,且要求溶液为中性。
盐酸和硫酸的比较
盐酸和硫酸的比较盐酸(Hydrochloric acid)和硫酸(Sulfuric acid)作为常见的无机酸,在实际应用中具有广泛的用途。
本文将对盐酸和硫酸的性质、用途及其比较进行论述。
一、性质比较盐酸和硫酸都是无色透明液体,在常温下呈强酸性。
它们的酸性是由于溶解在水中后释放出H+(氢离子)所致。
1. 盐酸:盐酸的化学式为HCl,在水中充分离解,并释放出氯离子(Cl-)。
盐酸具有刺激性气味,可溶于水和一些有机溶剂。
它具有较强的酸性和腐蚀性,可以与金属反应生成相应的盐和释放出氢气。
2. 硫酸:硫酸的化学式为H2SO4,它是一种具有很强酸性的无机酸。
在水中可以完全解离,产生两个H+(氢离子)和一个SO4^-2(硫酸根离子)。
硫酸是一种无色的油状液体,具有高黏度和吸湿性。
二、用途比较1. 盐酸的用途:盐酸作为一种重要的化学原料和试剂,在许多领域具有广泛的用途。
它可用于金属表面的清洗、废水的中和处理、皮革加工、食品工业、医药行业以及矿物冶金方面的应用。
盐酸还可以被用作实验室中的试剂和酸碱滴定的指示剂。
2. 硫酸的用途:硫酸是一种常用的化工原料,在工业生产和实验室中被广泛使用。
它可以用于制造肥料、染料、炸药、合成橡胶、玻璃纤维等化学产品。
此外,硫酸还可用作蓄电池的电解液和金属表面的腐蚀防护。
三、盐酸与硫酸的比较1. 酸性强度:硫酸比盐酸酸性更强,这是因为硫酸的离子解离程度更高。
在酸解离常数的比较中,硫酸的酸解离常数高于盐酸。
2. 腐蚀性:硫酸的腐蚀性较盐酸更强。
硫酸具有强烈的腐蚀性,可以与许多金属发生反应,甚至可以溶解一些金属。
而盐酸的腐蚀性相对较弱,对大部分金属并不具有明显的腐蚀作用。
3. 用量和价格:由于硫酸的酸性更强,相对来说使用硫酸所需的用量会少于盐酸。
然而,硫酸的制备成本较高,所以在市场价格上通常会比盐酸更昂贵。
总结:综合来看,盐酸和硫酸都是重要的无机酸,具有广泛的应用。
盐酸在实际应用中主要用于清洗、中和、皮革加工等领域,而硫酸则更常用于肥料、染料、炸药等化工生产中。
初三化学浓硫酸和浓盐酸性质
你已经知道哪些酸和碱?了解它们的性质吗?它们在生产、生活中有哪些应用? 讨论: 人的胃液里含有什么酸? 汽车电瓶里含有什么酸? 食醋里含有什么酸?
人的胃液里含有盐酸; 汽车电瓶里含有硫酸; 食醋里含有醋酸,也叫乙酸;
浓硫酸和浓盐酸的物理性质
注意:闻气体的方法 观察浓硫酸和浓盐酸的状态、颜色,打开瓶塞,观察发生的现象;闻一闻是否有气味?
气味
密度(与水比较)
敞开试剂瓶口发生的现象
挥发性
粘稠状液体
液体
无气味
强烈刺激性气味
比水大
比水大
无现象
有白雾生成
无
有
浓硫酸的三大特性
吸水性 脱水性 腐蚀性 可干燥的气体:H2,O2,N2,CO2,CO CH4等,不可干燥NH3 使有机物碳化
可做干燥剂
Cl2 Cl2 Cl2 Cl2 Cl2
H2O
阳离子全部是氢离子(H+)的化合物
酸:
分析: 碱: KOH NH3·H2O
==== Na+ + OH-
NaOH
1
Ca(OH)2
阴离子全部是氢氧根离子(OH-)的化合物 ==== Ca2++ 2OH- ==== K+ + OH- ==== NH4+ + OH-
2
Na2CO3 NH4NO3 分析: 盐: 金属离子 酸根离子
NaCl
==== Na+ + Cl-
K2SO4
==== 2K+ + SO42- ==== 2Na+ + CO32- ==== NH4+ + NO3- 由金属离子(或铵根离子)和酸根离子形成的化合物
盐酸、硫酸的性质比较
1、 2、
生锈铁钉消失的原因 Fe2O3+6HCl == 2FeCl3+ 3H2O Fe + 2HCl ==FeCl2 + H2↑
铁锈溶解铁溶解Fra bibliotek溶解完全
教育名言:犯错是学生的权利,宽容是 教师的美德,教育则是教师的天职。
教育名言:人生的目标在于不断追求, 人生的价值在于奉献。
教育名言:知教育者,与其守成法,毋宁尚 自然;与其求化一,毋宁展个性. ——蔡元 培
教育名言:语言播种,用汗水浇灌,用 心血滋润,让教学因爱而充满生命力。
盐酸、硫酸的 性质比较
盐酸、硫酸的性质比较
盐酸 无色刺激性 气味的液 物理 体,有挥发性 ,在空 性质 气中形成 白雾 . 化 指示 1.使石蕊试液变 红色. 学 剂 2.使酚酞试液变 无色. 性 金属 Zn+2HCl= ZnCl2+H2 质 金属氧 Fe2O3+ 6 HCl = 2FeCl3+ 3H2O 化物 NaOH+HCl= 碱 NaCl+H2O 盐 AgNO3+HCl= AgCl +HNO3 硫酸 无色 无 味的 油 状液体, 脱水性和 有强 吸水性、 腐蚀性,溶于水中 放热. 1.使石蕊试液变 红色. 2.使酚酞试液变 无色. Zn+ H2SO4= ZnSO4+H2 CuO+ H2SO4= CuSO4+H2O 2NaOH+H2SO4= Na2SO4+2H2O BaCl2+H2SO4= BaSO4 +2HCl
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氯化氢是无色而有刺激性气味的气体。
纯盐酸为无色液体,在空气中冒雾(由于盐酸有强挥发性),有刺鼻酸味。
粗盐酸因含杂质氯化铁而带黄色。
氯化氢的水溶液呈酸性,叫做氯化酸,习惯上叫盐酸。
盐酸为氯化氢的水溶液,是无色或微黄色的液体。
硫酸,分子式为H2SO4。
是一种无色无味油状液体,是一种高沸点难挥发的强酸,易溶于水,能以任意比与水混溶。
浓硫酸物理性质:浓硫酸溶解时放出大量的热,因此浓硫酸稀释时应该“酸入水,沿器壁,慢慢倒,不断搅。
”浓硫酸化学性质:脱水性、强氧化性、难挥发性(高沸点)。
氯化氢是无色而有刺激性气味的气体。
纯盐酸为无色液体,在空气中冒雾(由于盐酸有强挥发性),有刺鼻酸味。
粗盐酸因含杂质氯化铁而带黄色。
氯化氢的水溶液呈酸性,叫做氯化酸,习惯上叫盐酸。
盐酸为氯化氢的水溶液,是无色或微黄色的液体。
硫酸,分子式为H2SO4。
是一种无色无味油状液体,是一种高沸点难挥发的强酸,易溶于水,能以任意比与水混溶。
浓硫酸物理性质:浓硫酸溶解时放出大量的热,因此浓硫酸稀释时应该“酸入水,沿器壁,慢慢倒,不断搅。
”浓硫酸化学性质:脱水性、强氧化性、难挥发性(高沸点)。
