炔烃的芳氨基双官能团化反应-TheZhouGroup@WHU
第二章 烃化反应

(H3C)3 CX
欲制备:
B-
(H3C)3 C+
CH3
H3C C
O
H3C A B
CH3 C CH2 CH3
C2H5
A: (CH3)3CX+C2H5OH
B: (CH3)3COH + C2H5X
一 、醇的O-烃化
1 卤代烷为烃化剂 2 磺酸酯作烃化剂 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
1.卤代烃为烃化剂 (1)反应通式
ArOH RX OH Ar O R X H2O
(3)应用
① 芳香脂肪醚的制备 镇痛药邻乙氧基苯甲酰胺的合成
CONH2 OH
EtBr/NaOH 80~100
CONH2 (75%)
OEt
镇痛药苄达明的合成
O Na
N N
Cl(CH2)3N(CH3)2/Xyl 125~128 ,7h
温-80。
(m、n、p均约为20)
一 、醇的O-烃化
1 卤代烷为烃化剂 2 磺酸酯作烃化剂 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
4. 烯烃为烃化剂
醇可与烯烃双键进行加成反应生成醚, 但对烯烃双键旁边没有吸电子基团存在时,反应
不易进行。 只有当双键的位有羰基、氰基、酯基、羧基等存
② 酚的O-烃化反应
由于酚的酸性比醇强,所以反应更容易 进行,需要的碱相对醇的反应也较弱。
反应通常是通过SN2机理完成
2.碳负离子的亲核取代反应
碳负离子带有负电荷,具有很强的碱性 和亲核能力,可以和卤代烃等烃化试剂 发生取代反应,延长碳链。
其中碳负离子可以是炔基负离子,格氏 试剂中的烷基负离子及活泼亚甲基在碱 作用形成次甲基负离子。
buchwald-hartwig 芳胺化反应

buchwald-hartwig 芳胺化反应
Buchwald-Hartwig芳胺化反应是一种官能团转移反应,通常用于合成芳香胺化合物。
在该反应中,苯胺与卤代芳烃在存在钯催化剂的情况下结合,生成相应的芳香胺。
反应机理包括以下步骤:
1. 钯催化剂与配体结合形成活性的钯催化剂。
2. 芳烃中的卤素离子发生还原消除,生成亲电芳香基。
3. 亲电芳香基与苯胺发生配位形成中间体。
4. 中间体中的钯催化剂被还原,同时胺离子发生消除还原,生成芳香胺产物。
Buchwald-Hartwig芳胺化反应的优点包括高选择性、宽广的反应底物适应性、高收率和易于实施。
该反应在有机合成中被广泛应用,并被认为是一种绿色合成方法。
另外,该反应还可以用于合成其他含氮杂环化合物,并且可以进行多步反应,扩展其反应适用范围。
(完整word版)金属有机化学中的钯催化的反应讲解

XXXX大学研究生学位课程论文(2012 ——-— 2013 学年第一学期)学院(中心、所):化学化工学院专业名称:应用化学课程名称:高等有机化学论文题目:金属有机化学中的钯催化的反应授课教师(职称) XXXX(教授)研究生姓名: XXXX年级: 2012级学号: XXXXXXXXX成绩:评阅日期:XXXX大学研究生学院2012年 12 月 25 日金属有机化学中的钯催化的反应XXXXXX(XXXX大学化学化工学院,山西,太原,030006)摘要:过渡金属钯在金属有机化学方面具有丰富的反应性,在各类有机化学反应中如氢化、氧化脱氢、偶联、环加成等反应中,钯是优良的催化剂,或是催化剂的重要组分之一。
本文在查阅大量近几年文献资料的基础上,综述了钯催化的反应,同时综述了钯催化反应的机理以及钯催化反应的研究现状。
关键词:钯,催化剂,反应机理,研究进展1钯催化的反应类型及反应机理在现今炼油、石油化工等工业催化反应中,有很多的钯催化反应,尤其是氢化反应中的选择加氢,以及氧化反应中选择氧化生产乙醛、醋酸乙烯、甲基丙烯酸甲酯,均广泛采用和开发钯催化剂.对石油重整反应,钯也是常选取的催化剂组分之一。
1.1氢化反应钯催化剂具有很大的活性和极优良的选择性,部分氢化选择性高,常用作烯烃选择性氢化催化剂。
1。
1。
1反应式及反应机理反应底物首先和氢气分子分别被吸附到催化剂上,然后和催化剂的活性中心形成配位键,最后完成氢的转移,氢和反应底物形成σ—键.1。
1。
2反应方程式举例1.2氧化反应烯烃和炔烃是十分常见并且重要的有机化合物,选择性地氧化这类不饱和碳氢化合物一直是化学工业和学术界的重要研究目标之一。
1.2。
1分子氧参与的钯催化烯烃的氧化反应根据亲核试剂的不同,如氧、氮和碳等亲核试剂,把催化烯烃的氧化反应可以形成C-O、 C—N和C-C 键。
1。
2.1。
1反应机理钯催化烯烃的氧化反应都经过三个过程:首先,把插入烯烃形成新的C—Pd键;接着,有机钯中间体进行β—H消除产生Pd(0);最后,Pd(0)被重新氧化为Pd(П)。
大学有机化学复习总结

有机化学复习总结一、有机化合物的命名命名是学习有机化学的“语言”,因此,要求学习者必须掌握。
有机合物的命名包括俗名、习惯命名、系统命名等方法,要求能对常见有机化合物写出正确的名称或根据名称写出结构式或构型式。
1、俗名及缩写:要求掌握一些常用俗名所代表的化合物的结构式,如:木醇、甘醇、甘油、石炭酸、蚁酸、水杨醛、水杨酸、氯仿、草酸、苦味酸、肉桂酸、苯酐、甘氨酸、丙氨酸、谷氨酸、巴豆醛、葡萄糖、果糖等。
还应熟悉一些常见的缩写及商品名称所代表的化合物,如:RNA、DNA、阿司匹林、福尔马林、尼古丁等。
2、习惯命名法:要求掌握“正、异、新”、“伯、仲、叔、季”等字头的含义及用法,掌握常见烃基的结构,如:烯丙基、丙烯基、正丙基、异丙基、异丁基、叔丁基、苄基等。
3、系统命名法:系统命名法是有机化合物命名的重点,必须熟练掌握各类化合物的命名原则。
其中烃类的命名是基础,几何异构体、光学异构体和多官能团化合物的命名是难点,应引起重视。
要牢记命名中所遵循的“次序规则”。
4、次序规则:次序规则是各种取代基按照优先顺序排列的规则(1)原子:原子序数大的排在前面,同位素质量数大的优先。
几种常见原子的优先次序为:I>Br>Cl>S>P>O>N>C>H(2)饱和基团:如果第一个原子序数相同,则比较第二个原子的原子序数,依次类推。
常见的烃基优先次序为:(CH3)3C->(CH3)2CH->CH3CH2->CH3- (3)不饱和基团:可看作是与两个或三个相同的原子相连。
不饱和烃基的优先次序为: -C≡CH>-CH=CH2>(CH3)2CH-次序规则主要应用于烷烃的系统命名和烯烃中几何异构体的命名烷烃的系统命名:如果在主链上连有几个不同的取代基,则取代基按照“次序规则”一次列出,优先基团后列出。
按照次序规则,烷基的优先次序为:叔丁基>异丁基>异丙基>丁基>丙基>乙基>甲基。
有机合成化学:第六章 缩合反应
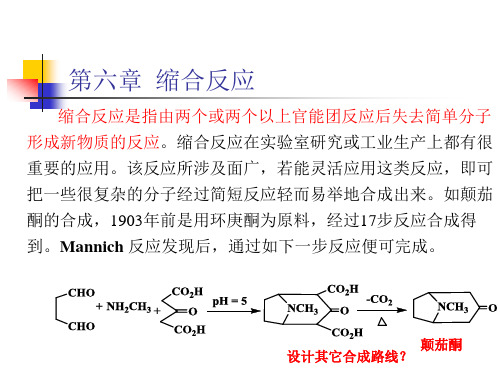
第六章 缩合反应
上例是由于选择不同的起始原料,而选择不同的合成路线,使 产品成本大大降低。如果没有很好的路线选择时,可以通过优化 反应条件,提高产物的收率,降低成本。从产品收率上讲,能提 高1-5%。我们可能认为没什么意义,可对企业讲,产品成本会降 低2-8%左右。如果一个产品产值上亿时,可估算一下其价值了。 所以,一个化工产品刚上市时价格较高,随着生产时间延长,价 格逐渐降低,很大可能是由于生产工艺和生产条件的改变所致。
-CO2
CH3CH CH2CO2H
H3C
O O O
60~76%
CH3NO2 + H3CCH
C H
CO2C2H5
NaOC2H5 CH3CH CH2CO2C2H5
55%
CH2NO2
第六章 缩合反应 CH3
CN
PhCH CO2C2H5 + H2C
C H
CN
KOH 83%
CN
PhC CH2CH2CN CO2C2H5
LDA
H3C
CH3
第六章 缩合反应
羰基化合物烷基化最大负反应是O-烷基化产物。如:
副产物
第六章 缩合反应
LDA CH3(CH2)3CO2CH3 BrCH2CH
CH2
CH3CH2CH2CH CO2CH3 CH2CH CH2
LDA
CH2CH3
C2H5Br CH3CH2Байду номын сангаас CO2CH3
可以分步引入
90%
5. Knoevenagel反应:
这类反应的特点是一个亚甲基上连接两个吸电子基团,使
得其氢活性明显提高,反应较易进行。一般使用弱碱 (有机胺)
芳环上的取代反应

k p − R 6k C6 H 5 R % para fp = ( )( ) kH k C6 H 6 100
分速度因素可用竞争法测定。例如,将等mole的苯和甲苯与少 量硝酸在乙酐溶液中, 30ºC下反应,生成产物用色谱分析,所得 硝基苯与硝基甲苯mole数之比为1:27,硝基甲苯中邻、间、对 异构体分别占58.1、3.7和38.2%。而甲苯和苯的反应速度比实际 上与它们的产物量有关: 27 k
1
=
C6 H 5 R
k C6 H 6
把上述数据代入(4)、(5)、(6)式,即可求出各分速度因子:
6 × 27 38.2 6 × 27 58.1 )( ) = 62 fo = ( ) = 47 f p = ( )( 1 100 2 × 1 100 6 × 27 3.7 fm = ( )( )=3 2 × 1 100
对氯三氟甲基苯在消除步骤只能生成4三氟甲基苯炔由于三氟甲基距离较远对加成步骤的影响很小因此生成两种可能的加成产物的混合物其分量接近相等在消除加成机理中甲氧基的影响表现在氧原子吸引电子的能力上因此氯代苯甲醚与氨基钠反应的产物与氯代三氟甲基苯相似
第九章 芳环上的取代反应
§ 25.1 芳环上的亲电取代 在没有取代基的情况下,芳香族化合物可以起亲电取代反应(H 被取代)。这类反应使芳烃成为各种衍生物,在合成上有广泛的 用途,对于它们的机理也进行了比较全面的研究。大多数亲电 取代反应是照下列模式进行的,即亲电试剂进攻芳环,生成σ络合物,然后离去基团(H)以正离子形式离去。
k C6 H 5 R = 2k o − R + 2k m − R + k p − R
苯起同一反应的速度常数为: k
C6 H 6
= 6k H
1 k H = k C6 H 6 6
氨基化指的是氨与有机化合物发生复分解而生成伯胺的反

第十章氨基化10.1概述氨基化指的是氨与有机化合物发生复分解而生成伯胺的反应,它包括氨解和胺化,氨解反应的通式可简单表示如下:R-Y+NH3一R-NH2+HY式中R可以是脂基或芳基,Y可以是羟基、卤基、磺基或硝基等。
胺化是指氨与双键加成生成胺的反应则只能叫胺化。
广义上,氨基化还包括所生成的伯胺进一步反应生成仲胺和叔胺的反应。
脂肪族伯胺的制备主要采用氨解和胺化法。
其中最重要的是醇羟基的氨解,其次是羰基化合物的胺化氢化法,有时也用到脂链上的卤基氨解法。
另外,脂胺也可以用脂羧酰胺或脂腈的加氢法来制备。
芳伯胺的制备主要采用硝化-还原法。
但是,如果用硝化.还原法不能将氨基引入到芳环上的指定位置或收率很低时,则需要采用芳环上取代基的氨解法。
其中最重要的是卤基的氨解,其次是酚羟基的氨解,有时也用到磺基~或硝基的氨解。
氨基化剂所用的反应剂主要是液氨和氨水。
有时也用到气态氨或含氨基的化合物,例如尿素、碳酸氢胺和羟胺等。
气态氨只用于气.固相接触催化氨基化。
含氨基的化合物只用于个别氨基化反应。
下面介绍液氨和氨水的物理性质和使用情况。
①液氨液氨主要用于需要避免水解副反应的氨基化过程。
用液氨进行氨基化的缺点是:操作压力高,过量的液氨较难再以液态氨的形式回收。
②氨水对于液相氨基化过程,氨水是最广泛使用的氨基化剂。
它的优点是操作方面,过量的氨可用水吸收,回收的氨水可循环使用,适用面广。
另外,氨水还能溶解芳磺酸盐以及氯蒽醌氨解时所用的催化剂(铜盐或亚铜盐)和还原抑制剂(氯酸钠、间硝基苯磺酸钠)。
氨水的缺点是对某些芳香族被氨解物溶解度小,水的存在特别是升高温度时会引起水解副反应。
因此,生产上往往采用较浓的氨水作氨解剂,并适当降低反应温度。
用氨水进行的氨基化过程,应该解释为是由NH3引起的,因为水是很弱的“酸”,它和N地的氢键缔合作用不很稳定。
由于OH-的存在,在某些氨解反应中会同时发生水解副反应。
10.2卤素的氨解10.2.1芳环上卤基的氨解10.2.1.1反应历程卤基氨解属于亲核取代反应。
2019年第十一章氨基化及芳胺基化--精品PPT课件.ppt

1
• 该反应是可逆反应。其羟基被置换的难易符合以 下规律:
• (1)当羟基处于1位时,2位和3位的磺基对氨解 反应起阻碍作用,而4位上存在的磺基则使反应 容易进行;
• (2)当羟基处于2位时,3位和4位的磺基对氨解 起阻碍作用,而1位的磺基则能使氨解反应容易 进行;
• (3)当羟基与磺基不在同一环上时,磺基对羟 基的氨解影响很小。
对于间歇设备都要求安装有效的搅拌装置连续管式反应器则要求控制流速使反应物料呈湍流状由于脂肪胺的碱性大于氨反应生成的胺容易与卤烷继续反应所以用此方法合成脂肪胺时产物常为混合物
第十一章 氨基化及芳胺基化
1
第一节 概述
• 一、氨解反应及其重要性
• 氨解指的是氨与有机物发生复分解反应而生成伯 胺的反应。
• 合成胺类化合物目的: • 胺类化合物是一类重要的有机化工产品,具有广
CH3COCH3 + [CH2O ]n + (C2H5)2NH HCl/CH3OH
CH3COCH2CH2N(C2H5)2
62%~70%
3
• ★4.通过分子重排制胺
• 霍夫曼重排:当羧酰胺与次溴酸钠(或 NaOH+Br2)作用时,首先生成异氰酸酯,不经 分离进一步水解得到伯胺。
NaOBr
RCONH2
-X-
*
* + NH2-
* NH2 NH3
NH2 + NH2-
1
• 2. 氨基置换羟基
• 羟基被置换成氨基的难易程度与羟基转化成酮式 (即醇式转化成酮式)的难易程度有关。一般来 说,转化成酮式的倾向性越大,则氨解反应越容 易发生。
• 例如:苯酚与环己酮的混合物,在Pd-C催化剂存 在下,与氨水反应,可以得到较高收率的苯胺。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
15/10/2017 Ying Yang
炔烃的芳氨基双官能团化反应
Graphic Abstract:
图1. 分子间芳基氨基化反应
炔烃的双官能团化反应是区域选择性合成三取代/四取代烯烃的主要方法之一。
随着过渡金属催化反应方法学的发展,现今已经可以较高的收率构建含有C-
C/C-X杂原子键的多取代烯烃(图1A)。
对于合成含有N-取代的烯烃,目前主要通过炔烃的氢胺化反应实现。
该方法已经广泛的应用于天然产物、药物分子和聚合物的合成中。
但是通过炔烃和芳香胺的加成一步得到芳基氨基双官能团化的反应至今仍然是一个难以解决的问题(图1B)。
最近,来自英国曼彻斯特大学的Michael F. Greaney课题组报道了无金属催化的炔烃分子间芳基氨基双官能团化反应。
关于炔烃双官能团化的反应,陆熙炎院士和刘桂霞博士等人曾经报道了Rh 催化的N-苯氧基乙酰胺对炔的加成反应(图2);李燕博士等人报道过Cu催化的N-氟代磺酰亚胺对炔丙醇的自由基加成反应(图3);Tonks等人发展了Ti催化的炔烃、烯烃和偶氮苯的反应,然而这些反应都不具有良好的底物普适性。
图2. Rh催化的N-苯氧基乙酰胺对炔的加成反应
图3. Cu催化剂催化的N-氟代磺酰亚胺对炔丙醇的自由基加成反应
图4. Ti催化剂催化的炔烃、烯烃和偶氮苯的反应
本文作者设计使用芳香磺酰胺作为氨基和芳基的来源对炔烃进行双官能团
化。
磺酰胺广泛的应用于药物和农用化学品中,具有良好的理化性质和稳定性。
作者设想反应由芳香磺酰胺中的SO2离去引发,分别得到亲核性的氨基和亲电性的芳基,通过这种加成-取代-SO2离去的反应循环得到双官能团化产物(图1C)。
之前已经发现类似的途径可以发生在活性较高的苯炔中间体中,经过加成-重排反应得到联芳基化合物。
因此,他们希望将此途径拓展到普通炔烃分子中,通过新型的氨基来源一步得到多种取代的烯胺化合物,并且Csp2-Csp2键的形成不需要过渡金属的参与。
图5. 底物拓展
他们首先尝试4-硝基苯磺酰胺4a与不同缺电子炔烃(2)的反应,发现以DMF为溶剂在70 ℃的条件下,仅需要加入K2CO3就能够以理想的收率得到烯胺化合物(图5)。
作者通过3d和3g的单晶结构,可以确认氨基与芳基处于反式位置,这可能与分子内氢键有关。
虽然磺酰胺4a亲核性较弱,但是多种含有不同取代基(如直链/支链烷基、芳基、芳香杂环等基团)的炔烃,都可以和4a 反应得到烯胺(3a-3e,3k);给电子和吸电子取代基的炔烃参与反应同样具有良好的收率(3g-3i),且位阻对反应的影响较大(3f)。
乙氧基丙炔酸甲酯也可以发生反应得到N,O-缩醛3j;羰基取代的炔烃同样适用于该反应(3l)。
当改变磺酰胺的取代基时(图5),通过反应机理可知,Smiles重排反应的关键中间体Meisenheimer中间体(图1, 6)需要有吸电子取代基加以稳定。
因此,当芳环上含有硝基、羰基、氰基、多个卤素基团或者是其他含氮芳香杂环时,反应都能以中等到良好的收率得到目标产物(3m-3t)。
此外,二级磺酰胺也能够在标准条件下得到相应的产物(3u-3x),并且3u可以做到克级规模放大生产。
图6. 产物的衍生化与拓展
最后,作者对产物的衍生化进行了研究(图6)。
产物烯胺可以通过不同的高价碘试剂氧化得到吲哚环7或者氮杂环丙烯8;3u通过Adams催化剂还原可以得到β-氨基酸衍生物9,该化合物可以作为合成多种治疗心血管疾病药物的关键中间体。
此外,4a与联烯10反应可以以3.5:1的比例得到化合物11a与11b。
总结全文,Greaney课题组发展了一种通过炔烃的氨基芳基化反应,一步合成四取代烯胺的方法。
该反应具有良好的底物普适性,并且不需要过渡金属催化剂的参与。
产物烯胺可以作为合成生物活性分子的关键中间体,具有良好的应用价值。
