制药化工原理:第六章第三节传质机理与吸收速率
化工原理 第六章 吸收

不同的溶质在同一个溶剂中的溶解度不同,溶解度很大的
气体称为易溶气体,溶解度很小的气体称为难溶气体;同
一个物系,在相同温度下,分压越高,则溶解度越大;而
分压一定,温度越低,则溶解度越大。这表明较高的分压
和较低的温度有利于吸收操作。在实际吸收操作过程中,
溶质在气相中的组成是一定的,可以借助于提高操作压力
.
第二节 吸收中的气液相平衡
相平衡关系随物系的性质、温度和压力而异,通常由
实验确定。图6-3是由实验得到的SO2和NH3在水中的溶解度
曲线,也称为相平衡曲线。图中横坐标为溶质组分(SO2、
NH3)在液相中的摩尔分数
x
,纵坐标为溶质组分在气相中
A
的分压 p A 。从图中可见:在相同的温度和分压条件下,
体,该值很小。
2.2注意事项
①亨利定律只适用于稀溶液,如常压下难溶或少溶气体的吸收, 否则就有偏差;
②只适用于与溶剂不发生化学反应的气体的吸收;
③溶解度系数随温度升高而降低,即T↑,H↓;
④应用于较高压强时,如5atm以上,分压应以逸度代替;
⑤为了使用方便,亨利定律可以改写成以下形式:
pA ExA, yA mxA,
图6-4 吸收平衡线
.
第二节 吸收中的气液相平衡
2.相平衡线在吸收过程中的应用 2.1判断吸收能否进行。由于溶解平衡是吸收进行的极限,所以, 在一定温度下,吸收若能进行,则气相中溶质的实际组成 Y A 必须大 于 则与过液程相反中向溶进质行含,量为成解平吸衡操时作的。组图成6-4Y中A ,的即A点YA 为 Y实A。 际若操出作现点Y,A 若 AY 点A 时位, 于平衡线的上方,则 YA为吸Y A 收过程;若A点在平衡线上,YA=YA*,体 系达平衡,吸收过程停止;当A点位于平衡线的下方时,则YA<YA*,为解 吸过程。 2.2 确定吸收推动力。显然,YA>YA*是吸收进行的必要条件,而差 值 △YA=YA-YA* 则是吸收过程的推动力,差值△YA越大,则吸收速率必 然越大。 2.3同理,若以液相为研究对象,在一定条件下,要让吸收过程能进 行,则液相中溶质的实际组成XA必须小于与实际气相中溶质含量YA成平 衡时的液相组成XA*,即XA<XA*,差值△XA=XA* -XA即为吸收过程的推动力, 该值越大,吸收速率也就越大。否则,过程必为解吸操作。
9.3 吸收过程的机理及传质速率方程

K y 1 1 k y m kx KY 1 1 kY M k X
相内或同基准的传质系数换算
相际或不同基准传质系数换算
k y PkG
k x cmkL
kY k y
K y PKG
K x cm K L
1 Y 1 Yi k X k x 1 X 1 X i KY K y 1 Y 1 Ye K X K x 1 X 1 X e
总传质阻力1/Ky等于气相传质阻力1/ky与液相传质阻力m/kx之和。
因为总阻力1/Ky以气相为基准,所以液相阻力1/kx需乘以换算系数m。
气、液传质总推动力为两相的相内传质推动力之和。
第三节 吸收过程的机理及传质速率方程
N A Kx ( xe x)
1 1 1 K x k x m ky
吸收传质速率方程的几种形式
相平衡方程 吸收传质速率 方程
y mx b
N A k y y yi k x xi x K y y ye K x xe x
Y MX b
N A kY Y Yi kX X i X KY Y Ye K X X e X
e
的总传质速率方程
传质速率方程式可以写为: N A Kx ( xe x)
第三节 吸收过程的机理及传质速率方程
讨论:
N A K y y ye
1 1 m K y k y kx
1/Ky为气、液两相总传质阻力。
以y-ye为总推动力 的总传质速率方程
Ky是以(y-ye)为推动力的总传质系数,单位为 kmol/(m2 s)
相中,而界面阻力可忽略不计的概念,在传质过程的计算中得到了
化工原理第六章吸收习题答案解析

由于 y*A yA ,所以将发生吸收过程。推动力为
示意图见题 6-3 图。
y 0.03 0.0189 0.0111
题 6-3 图
分析 体会通过改变温度和总压来实现气液之间传质方向的改变 ,即吸收和解 吸。
6-4 氨-空气混合气中含氨(摩尔分数),在常压和 25℃下用水吸收,过程中不 断移走热量以使吸收在等温下进行。进气量为 1000 m3 ,出口气体中含氨(摩尔 分数)。试求被吸收的氨量(kg)和出口气体的体积(m3) 。
①
p* CO2
cCO2 H CO2
0.01 3.347 104
29.9kPa
推动力
p 20.1kPa(吸收)
②
p* CO2
cCO2 H CO2
0.05 3.347 104
149.4kPa
推动力
p 99.4kPa(解吸)
或者 , 用摩尔分数差表示时
①
由
xCO2
0.01 1000
1.8104
NA
DP RTZ
pA1 pA2 ln pB2 pB1 pB2 pB1
查教材附录水的物理性质得,20℃时水的蒸汽压为。已知条件为:
pA1 101.3kPa, pA2 0kPa, pB2 101.3kPa, pB1 101.3 2.3346 98.97kPa, P pA2 pB2 101.3kPa,
试求这两种情况下 CO2 的传质方向与推动力。 解: 由亨利定律得到
pCO2 50kPa ExC*O2 根据《 化工原理》 教材中表 8-1 查出
ECO2 25℃ 1.66105 kPa
所以可以得到
又因为
x* CO2
3.01104
HCO2 25℃
化工原理传质

; DAB——组分A在B组分中的扩散系数,m2/s。
负号:表示扩散方向与浓度梯度方向相反,扩散沿
着浓度降低的方向进行
对于气体扩散:
dC A N A J A D dZ D dp A NA RT dZ
nA pA C A V RT
mA wA m
摩尔分率:在混合物中某组分的摩尔数 占混合物总摩尔数的分率。
气相:
nA 液相: x A n
nA yA n
yA yB y N 1
xA xB x N 1
质量分率与摩尔分率的关系:
nA mwA / M A xA n mwA / M A mwB / M B mwN / M N wA /M A wA /M A wB /M B wN /M N
JA NMcA/c
到界面溶解于溶剂中,造
成界面与主体的微小压差
NA
,
使得混合物向界面处的流 动。 (2)总体流动的特点:
总体流 动NM NMcB/c
JB
1
2
1)因分子本身扩散引起的宏观流动。 2)A、B在总体流动中方向相同,流动速度正比于摩尔 分率。
N MA
cA NM c
N MB
cB NM c
p Bm
——漂流因数,无因次
Sm
漂流因数意义:其大小反映了总体流动对传质速率的影 响程度,其值为总体流动使传质速率较单纯分子
扩
散增大的倍数。 漂流因数的影响因素:
p p Bm 1
c cSm
1
浓度高,漂流因数大,总体流动的影响大。
化工原理第六章第三节

称为“气相总传质单元高度” ,用
表示
HOG
HOG
V KY a
NOG
Y1
Y2
Y
dY Y*
——气相总传质单元数
Z HOGNOG
2020/10/10
Z HOLNOL
—液相总传质单元高度,m ;
HOL
—液相总传质单元数,无因次 ;
NOL
依此类推,可以写出通式:
HOL
L K xa
NOL
X1
X2
X
dX *
X
dX *
X
KY a, KX a
气相总体积吸收系数及液相总体积吸收系数
物理意义 在:推动力为一个单位的情况下,单位时间单 位体积填料层内吸收的溶质量。
2、传质单元高度与传质单元数
1)传质单元高度与传质单元数的概念
2020/10/10
V 的单位
[kmol / s]
KY a
[kmol /(m2 s)][m2 / m3 ][m2 ] [m]
X
填料层高度=传质单元高度×传质单元数
试写出用膜系数及相应的推动力表示的填料层高度的计算式。
2020/10/10
Z HG NG
HG
V k y a
—气膜传质单元高度,m
NG
Y1
Y2
Y
dY Yi
—气膜传质单元数
Z HL NL
HL
L k x a
—液膜传质单元高度,m
NL
X1
X2
dX Xi X
3)每小时用水量
L 2Lmin 2 25.8 51.6kmol/ h 928.8kg / h
三、塔径的计算 D 4VS
u
—空塔气速
第三节 传质机理与吸收速率
中南林业科技大学化工原理
2.3.7.2 液膜吸收速率方程式 以液膜推动力(cAi-c)表示的吸收速率方程 D c NA (c Ai c A ) k L (c Ai c A ) z L cSm kL为与液膜推动力(cAi-cA)相应的液膜吸收系数。 以液相推动力(xAi-xA)表示吸收速率方程
4.36105 T ( D
1 3 3 2
1 1 ) MA MB
1 3
1 2
P (v A v B )
中南林业科技大学化工原理
2.3.5 对流传质
对流传质通常指流体与某一界面(例如气体吸收过程 中的气液两相界面)之间的传质。对流传质包括分子 扩散和湍流扩散(也称涡流扩散)。 2.3.5.1 涡流扩散 涡流起着混合作用,使主体内物质的浓度随湍动程度 增加而更趋于均一。涡流扩散的强度>>分子扩散的 强度。
中南林业科技大学化工原理
D p NA ( p A p A i ) kG ( p A p A i ) RTzG pBm
D kG RTZG
气膜吸收系数
1 k G :表示吸收质通过气膜的传质阻力
p pi NA 1 kG
气膜推动力(yA-yAi)相对应吸收速率方程
N A k y ( yA yAi )
N A J A DAB
z
D N A dz 0 RT
dc A D dp A dz RT dz
pA2
p A1
dp A
中南林业科技大学化工原理
D NA ( p A1 p A2 ) RTz
在等分子反方向扩散的传质过程中传递速率=扩散
化工原理 第六章 吸收
由 y * mx得,
Y* mX 1 Y * 1 X
*
mX Y 1 (1 m)X
当溶液浓度很低时,X≈0, 分母约等于1. 上式简化为:
Y mX
*
亨利定律的几种表达形式也可改写为
P * x , c HP E y Y * ℃ 下 , 测 得 氨 在 水 中 的 平 衡 数 据 为 : 0.5gNH3/100gH2O浓度为的稀氨水上方的平衡分压为400Pa, 在该浓度范围下相平衡关系可用亨利定律表示,试求亨利系
——逆流吸收塔操作线方程
在m—n截面与塔顶截面之间作组分A的衡算
VY LX 2 VY2 LX
L L Y X (Y2 X 2 ) V V
——逆流吸收塔操作线方程
表明 : 塔内任一截面的气相浓度Y与液相浓度X之间成直线 关系,直线的斜率为L/V。
吸收操作线总是位于平衡线的上方,
s
EM s
1000 7.32 104 kmol / m3 Pa 7.59 10 4 18
E 7.59 10 4 m 3 0.749 P 101.33 10
三、用气液平衡关系分析吸收过程
1、判断过程的方向
例:在101.3kPa,20℃下,稀氨水的气液相平衡关系为 :
L L Y1 X 1 Y2 X 2 V V
吸收率 A 混合气中溶质A 被吸收的百分率
Y2 Y1 (1 A )
2、吸收塔的操作线方程式与操作线
在 m—n截面与塔底截面之间作组分A的衡算
VY LX1 VY1 LX
L L Y X (Y1 X 1 ) V V
操作线位于平衡线下方,则应进行脱吸过程。
并流吸收塔的操作线:
化工原理第六章吸收
吸收
§1 §2 §3 §4 §5
气体吸收的相平衡关系 传质机理与吸收速率 吸收塔的计算 吸收系数 脱吸及其他条件下的吸收
概述
1、定义 吸收:利用混合气体各组分在液体中溶解度 差异,使某些易溶组分进入液相形成 溶液,不溶或难溶组分仍留在气相, 实现混合气体分离。 解吸:也称为脱吸,与吸收相反的过程,即 溶质从液利。
2.1.2 亨利定律
体系:单组分、低浓、恒温、物理吸收。 总压P<5×105Pa,一定温度下溶质在液相中 的溶解度(平衡)与其在气相中的分压成正比。
亨利系数(E): (单位与分压单位一致) ① 理想溶液:P不高,T恒定,亨利定律 与拉乌尔定律一致,即:E=p0
② 非理想溶液: E≠p0,但在一定浓度范 围内(低浓),E=const. E=f(T)。
混合气中某些组分在气液相界面溶解、在气相和液
相内由浓度差推动的传质过程。
分离
气相 1.定义:
液相
气相 NH3 + 空气 水 NH3
2.依据:溶解度不同
吸 收
NH3: 气相
液相
٭吸收质(溶质):A ٭惰性组分(载体):B
٭吸收剂:S ٭吸收液:S+A
٭尾气:B+(A)
2、吸收分离操作的目的与任务 制取液体产品:如盐酸、硝酸,碳化氨水吸收CO2 制碳酸氢氨等。 分离混合气体吸收获得某些组分:如用液态烃吸收 裂解气中的乙烯、丙烯等。 气体净化除去混合气体中杂质:如合成氨原料气脱 CO2等; 尾气处理和废气净化:脱SO2、NOx等 分离基础:各组分溶解度的差异
例2: 已知20℃时,1atm下氨在水中的溶 解度数据(p85)。绘制p*~x及Y*~X曲 线,计算E、m,并指出服从亨利定律的范围。
化工原理下3吸收速率方程式-2022年学习资料
二、总吸收速率方程式-对于易溶气体,H值很大-1-Ka-Hky-ka-≈-KG-液膜阻力-气膜阻力-Pi膜阻力控-制整个吸收-控制-Ci-过程的速率-气膜控制示意图-示例:水吸收氨-PA-PA≈PA-PAi-1
二、总吸收速率方程式-2.以c*-C表示总推动力的吸收速率方程式-K与k、k关系-设吸收系统服从亨利定律或 衡关系在过程-所涉及的浓度范围内为直线,则-PA-H-根据双膜模型,相界面上两相互成平衡,则-CAi-PA =-13
二、总吸收速率方程式-由此得-NA=kL.CAi-CA=kI.HPAi-PA-整理得-箭-NA=kGPAA→-NA=PA-PA)-相加得-品-10
二、总吸收速率方程式-1-反-十-H.-总阻力-液膜阻力-气膜阻力-则-NA=KoPA-PA-气相总吸收中:K。一气相总吸收系数,kmo/m2.skPa。-11
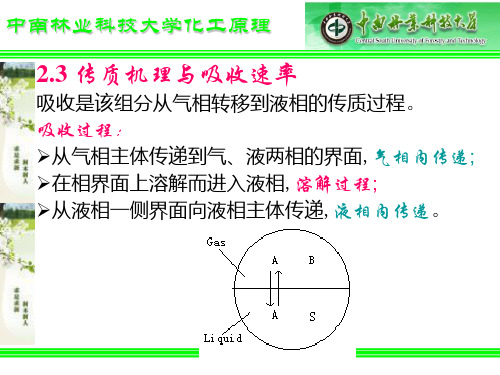
吸收过程-用液体吸收剂吸收气体中某一组分,是该组分-从气相转移到液相的传质过程。它包括三个过程-骤:-1该 分从气相主体传递到气、液两相的界面;-2在相界面上溶解而进入液相;-3再从液相一侧界面向液相主体传递;
2.2.6吸收过程机理-一、双膜理论-1.气液两相间存在稳定的相界面,界面两侧-各有一层有效膜,溶质以分子 散的传质方式-由气相主体进入液相主体。-2.在相界面处,气液两相达到平衡。-3.在气液两相主体中,溶质浓度 匀。-二、溶质渗透理论-三、表面更新理论
1.液膜分吸收速率方程-令-D C-kL=-液膜分传质(吸收)系数,-31.Csm-kmol/m2.s-k ol/m3。-则-NA=kLCAi-CA-仿效上式,-得-NA=kxXAi-xA-NA=kxXAi-XA
VA=kCA-CA)-NA =kXAi-xA-N,--1/k-XAI-XA-1/kx-液膜阻力-由-CA CXA-CAi CXAL-NA=KLCAi-CA=kLCXAi-CXA=kLCXAi-XA-比较得-ky cki-6
《化工原理》吸收
《化⼯原理》吸收第六章吸收§ 1 概述⼀、化学⼯业或⾷品⼯业中的传质过程1、⽓体—液体系统1)吸收:物质由⽓相转移到液相。
2)脱吸(解吸):物质由液相转移到⽓相。
3)⽓体增湿;湿分由液相转移到⽓相。
4)⽓体减湿;湿分由⽓相转移到液相。
⽔果储藏温度为4o C,相对湿度为85%。
2、蒸汽—液体系统精馏3、液体—液体系统液—液萃取:物质由某⼀液相转移到互不相溶的另⼀液相。
4、液体—固体系统1)结晶:物质由液相向固相转移。
2)液—固萃取(浸取):物质由液相向固相转移。
3)液体吸附:物质由液相转移到固相表⾯。
5、⽓体—固体系统1)⼲燥:液体物质由固相表⾯或内部转移到⽓相。
2)⽓体吸附:物质由⽓相转移到固相表⾯。
⼆、相组成的表⽰⽅法1、质量分率a与摩尔分率x1) 质量分率a :某组分的质量占总质量的百分率。
2) 摩尔分率x :某组分的摩尔量占总摩尔量的百分率。
3)质量分率a 与摩尔分率x 的换算BB A A A A A M x M x M x a ?+??= BB A A A AA M a M a M a x += 2、质量⽐a 和摩尔⽐X Y1)质量⽐a : BA m m a = 2)摩尔⽐X ;Y : BA n n X =3、质量浓度与摩尔浓度 1)质量浓度:单位体积均相混合物中某组分的质量。
单位:kg / m 32) 摩尔浓度:单位体积均相混合物中某组分的摩尔量。
单位:kmol / m 3三、吸收概念吸收尾⽓混合⽓体吸收液A+S吸收质或溶质A:混合⽓体中能够溶解的组分。
惰性组分或载体B:混合⽓体中不能被溶解的组分。
四、吸收操作的分类1、单组分吸收与多组分吸收2、物理吸收与化学吸收3、等温吸收与⾮等温吸收五、吸收剂的选择1、溶解度2、易脱吸3、选择性4、粘性5、挥发性6、其他§2 扩散现象⼀、概念1、扩散:当系统内部存在浓度差时,物质总要由⾼浓度区向低浓度区转移,这种现象称为扩散。
2、分⼦扩散和涡流扩散分⼦扩散:只依靠微观的分⼦运动,⽽⽆宏观的混合作⽤。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020/11/10
2)流动界面 气液两相和液液两相间的界面
2020/11/10
对于等摩尔反方向扩散
NA
DAB ZG RT
(PA1
PA2 )
对于单向扩散
NA
DAB ZG RT
P PBm
(PA1
PA2
)
2020/11/10
五、吸收机理——双膜理论
1、双膜理论 •相互接触的气液两相间有一个稳定的界面,界面上没有传 质阻力,气液两相处于平衡状态。 •界面两侧分别存在着两层膜,气膜和液膜。气相一侧叫气 膜,液相一侧叫液膜 ,这两层膜均很薄,膜内的流体是滞 流流动,溶质以分子扩散的方式进行传质。 •膜外的气液相主体中,流体流动的非常剧烈,溶质的浓度 很均匀,传质的阻力可以忽略不计,传质阻力集中在两层 膜内。
pA pA1 pA pA2
2020/11/10
NA
0z dz
D RT
PA 2
pA1
dp A
NAz
D RT
( pA2
p A1 )
传质速率为:
NA
D zRT
( pA2
p A1 )
2、一组分通过另一停滞组分的扩散
1)一组分通过另一停滞组分的扩散
2020/11/10
例如吸收
2)传递速率 设总体流动通量为N,其中物质A的通量为:
2020/11/10
2020/11/10
六、吸收速率方程式
吸收速率:单位面积,单位时间内吸收的溶质A的摩尔数, 用NA表示,单位通常用kmol/m2.s。
吸收传质速率方程:吸收速率与吸收推动力之间关系的数学式 吸收速率=传质系数×推动力
1、气膜吸收速率方程式
2020/11/10
NA
DAB ZG RT
当气相组成以摩尔比浓度表示时
N A kY (Y Yi )
kY —以 Y 表示推动力的气膜吸收系数,kmol/(m2.s)。
2020/11/10
2、液膜吸收速率方程式
NA
DC z L c sm
(ci
c)
令
DC Z Lcsm
kL
N A kL (ci c)
或
NA
ci
1
c
——液膜吸收速率方程
kL
浓度有关。
对于很稀的非电解溶液,物质在液体中的扩散系数
DAB
7.4 1012
(aM )1/ 2 T
0.6
m2
/
s
2020/11/10
四、对流传质
1、涡流扩散
凭籍流体质点的流动和旋涡来传递物质的现象。
扩散通量 :
J
(D
DE
)
dc A dz
2、对流传质
流动流体与两相界面之间的传质
1)固定界面
气固两相或液固两相间的界面
kL —以 c 为推动力的液膜吸收系数,m/s;
dcA dz
若扩散在气相中进行,则:
cA
pA RT
C P RT
2020/11/10
NA
D RT
P P pA
dpA dz
即
NA
DP RT
dp A p B dz
分离变量后积分
2020/11/10
N A 0zdz
DP RT
pB2
pB1
dpB pB
NA
DP zRT
ln
pB2 pB1
pA1 pB1 pA2 pB2 pA1 pA2 pB2 pB1
分子扩散 单相内物质传递的机理
对流传质
2020/11/10
一、分子扩散与菲克定律
1、分子扩散:一相内部有浓度差异的条件下,由于分子
的无规则热运动而造成的物质传递现象。
A
B
2.菲克定律
1)扩散通量 :单位面积上单位时间内扩散传递的物质量 , 单位:kmol/(m2.s) 。
2020/11/10
2)菲克定律
2020/11/10
二、气相中的稳定分子扩散
1.等摩尔反向扩散 1)等摩尔反向扩散
例如精馏过程
2020/11/10
2)传递速率 在任一固定的空间位置上,单位时间通过单位面积的A
物质量,称为A的传递速率,以NA表示。
NA
JA
D
dcA dz
D dpA RT dz
分离变量并进行积分,积分限为:
z1 0 z2 z
2020/11/10
NyA
N
cA C
总体流动中物质B向右传递的通量为
NyB
N
cB C
NA
J
A
N
cA C
NB
JB
N
cB C
而
NB 0
JB
N
cB C
即
J
A
N
cB C
2020/11/10
NA
N
cB C
N
cA C
N NA
将
JA
DAB
dc A dz
和
N NA 代入
NA
JA
N
cA C
NA
DC C cA
P PBm
(
p
pi
)
令
DABP ZG RTPBm
kG
N A kG ( p pi )
—— 气膜吸收速率方程式
kG ——气膜吸收系数, kmol/(m2.s.kPa)。
也可写成:
NA
p pi 1
kG
2020/11/10
当气相的组成以摩尔分率表示时
N A k y (y yi )
k y —以 y 表示的气膜吸收系数,knoll/(m2.s)。
1、物质在气体中的扩散系数
气体A在气体B中(或B在A中)的扩散系数,可按马 克斯韦尔—吉利兰(Maxwell-Gilliland)公式进行估算
2020/11/10
3
4.36 105T 2 (
1
1
1
)2
D
MA MB
1
P(vA 3
vB
1 3
)
2
2、物质在液体中的扩散系数
物质在液体中的散系数与组分的性质、温度、粘度以及
第六章 吸收
第三节 传质机理与吸收速率
一、分子扩散与菲克定律 二、气相中的稳定分子扩散 三、扩散系数 四、对流传质 五、吸收机理——双膜理论 六、吸收速率方程式
2020/11/10
吸收过程涉及两相间的物质传递,包括三个步骤: •溶质由气相主体传递到两相界面,即气相内的物质传递; •溶质在相界面上的溶解,由气相转入液相,即界面上发生 的溶解过程; •溶质自界面被传递至液相主体,即液相内的物质传递。
NA
DP zRT
ln
pB2 pB1
( pA1 pA2 ) pB2 pB1
D RTz
P pBm
(
因数,无因次。反映总体流动对传质速率的
pBm
影响。
因P>pBm,所以漂流因数
P pBm
1
2020/11/10
三、扩散系数
分子扩散系数简称扩散系数,它是物质的特性常数之 一。同一物质的扩散系数随介质的种类、温度、压强及浓 度的不同而变化。物质在不同条件下的扩散系数一般需要 通过实验测定。
JA
DAB
dC A dz
试分析与傅立叶定律以及牛顿粘性定律的区别及 联系。
3)分子扩散系数间的关系
对于双组分物系: cT
cA
cB
常数
P RT
2020/11/10
dcA dcB dz dz
JA JB
根据菲克定律:
JA
DAB
dc A dz
DBA
dcB dz
DAB DBA
由A、B两种气体所构成的混合物中,A与B的扩散系数相等。
