氯化钠的晶胞结构
2020江苏高考化学二轮专题强化训练:5 题型五 物质结构与性质(选考) Word版含解析

[专题强化训练]1.(经典题)ⅠA、ⅦA族元素及其化合物在生活、生产中有广泛应用。
回答下列问题:(1)基态钠原子的核外电子排布式为_________________________________________;ⅠA族元素的基态原子的价电子的电子云轮廓图的形状为____________。
(2)与H2F+互为等电子体的分子是____________(填一种即可)。
H2分子中原子轨道的重叠方式是________(填字母)。
A.ss B.s-pC.p-p(3)OF2和O2F都是氧元素的氟化物,其中,OF2分子中氧原子的杂化类型是________;氯的某含氧酸的分子式为HClO x,其对应的含氧酸根离子的立体构型是三角锥形,则x=________。
(4)碱金属单质的熔点随原子序数增大而降低,原因是________________________________________________________________________;而卤素单质的熔、沸点随原子序数增大而升高,原因是________________________________________________________________________。
(5)金属钠、钾的晶胞结构如图1所示,其中金属原子的堆积模式为________。
(6)氯化钠的晶胞结构如图2所示(白球代表Cl-,黑球代表Na+)。
则氯化钠晶胞中Cl-的配位数为________。
解析:(1)基态钠原子的电子排布式为1s22s22p63s1或[Ne]3s1。
ⅠA族元素的价电子排布式为n s1,s轨道的电子云轮廓图的形状为球形。
(2)与H2F+互为等电子体的分子有H2O、H2S、H2Se、H2Te。
基态氢原子只在1s轨道上有电子,H2分子中的两个氢原子成键时,两个s轨道“头碰头”重叠,故选A。
(3)OF2中氧原子的价层电子对数为4,氧原子的杂化类型是sp3。
氯化钠晶体密度计算

氯化钠晶体密度计算
氯化钠晶体的密度是由它的原子量和单位体积的原子或分子的数目
共同决定的。
氯化钠是一种常见的工业盐,由单质氯和单质钠构成。
体积中每个分子的质量为23克/摩尔(二元分子的分子式:NaCl)。
氯化钠晶体的密度可以用公式:ρ=MW/V(克/立方厘米)计算,其中
MW为分子质量,V是体积。
因此,氯化钠晶体的密度计算结果为每
立方厘米约有2.17克。
氯化钠晶体由NaCl分子构成,其中每个NaCl分子重量为58.44克/摩尔,而该晶体的密度则可以用下面的公式计算出来:ρ=均重/体积,其中,均重为NaCl分子重量,也就是58.44克/摩尔,而体积则涉及到晶
体结构。
从固溶体学的角度考虑,氯化钠晶体由Na+和Cl-离子构成,形成八面体晶格,且有双列晶体结构,其晶胞体积为V = (19.2)^3Å^3 (Å为牛顿),所以氯化钠晶体密度计算结果为每立方厘米约有2.16克。
此外,氯化钠晶体可以在高温环境中显示出不同的性质。
当温度升高
到1000℃或更高时,当它处于液体状态时,晶体的体积会减小,从而
使其密度急剧升高。
基于热力学的规律,当温度升高至1000℃时,每
立方厘米的密度可能会增加至2.19克或更高。
因此,氯化钠晶体的密度既取决于 NaCl分子重量,又受体积和温度的
影响。
从上述可以看出,晶体的密度一般比液体高出许多,可以达到
2.17-2.19克/立方厘米。
nacl晶胞中的原子个数

nacl晶胞中的原子个数NaCl晶胞中的原子个数NaCl是一种常见的盐类化合物,其晶体结构由钠离子(Na+)和氯离子(Cl-)组成。
在NaCl晶胞中,每个钠离子和氯离子都占据特定的位置,形成了一个紧密排列的结构。
本文将详细介绍NaCl晶胞中的原子个数及其相关性质。
NaCl晶胞是一个立方晶系的晶胞,其中包含一个钠离子和一个氯离子。
钠离子和氯离子的数目相等,即每个晶胞中含有一个钠离子和一个氯离子,因此NaCl晶胞的原子个数为2。
钠离子和氯离子在NaCl晶胞中呈现离子键结构。
每个钠离子都被6个氯离子包围,形成一个八面体的配位结构;而每个氯离子也被6个钠离子包围,同样形成八面体的配位结构。
由于钠离子和氯离子具有相同的电荷且数目相等,因此它们之间的相互作用力是等量的,从而保持了晶体的稳定性。
NaCl晶体的结构可以用晶胞参数来描述。
晶胞参数包括晶胞的边长和晶胞的角度。
对于NaCl晶体而言,其晶胞参数为边长a和角度α。
在NaCl晶胞中,钠离子和氯离子的排列方式使得晶胞的边长a 等于两个离子的离子半径之和,即a = r(Na+) + r(Cl-)。
晶胞的角度α为90度,即NaCl晶胞是一个立方晶系的晶胞。
除了晶胞参数,NaCl晶胞还具有其他重要的性质。
其中之一是晶格常数,它是指晶胞中的离子之间的距离。
对于NaCl晶体而言,晶格常数是晶胞边长a的一半,即d = a/2。
NaCl晶胞中钠离子和氯离子之间的距离即为晶格常数。
NaCl晶胞中的原子个数及其结构对其物理和化学性质产生了重要影响。
由于NaCl晶胞中钠离子和氯离子的紧密排列,NaCl晶体具有高熔点和良好的溶解性。
NaCl晶体在固态下具有离子键的特性,而在溶液中则可离解成钠离子和氯离子。
这使得NaCl成为了一种重要的电解质,在化学和生物学实验中广泛应用。
总结起来,NaCl晶胞中的原子个数为2,其中包含一个钠离子和一个氯离子。
NaCl晶胞的结构紧密有序,具有高熔点和良好的溶解性。
氯化钠的晶胞结构.ppt

不同类型的晶体
晶体概念
分子晶体
晶体判断
基本类型
原子晶体
课堂练习
离子晶体
知识归纳
晶体的概念
什么叫晶体?
Some substance have a characteristic shape of smooth , flat sides with shar edges and corners .
人造金刚石就是依据在5-7万大气压,1200℃-1800℃温度的条件下,
碳元素就会结晶成为金刚石这个原理用合金片作触媒使外加的压力
和温度降低,达到将碳转为金刚石的目的.
用途:金刚石的用途十分广泛,用量较大的是矿山、地质、煤田 勘探,公路建设、建材、国防等行业及高精尖科研领域。
液晶材料主要是脂肪族 、芳香族、硬脂酸等有 机物。液晶也存在于生 物结构中。日常生活中 ,适当浓度的肥皂水溶 液就是一种液晶。目前 已经发现或人工合成的 液晶材料已达五千多中 液晶显示器(liquid crystal)。
金属阳离子和自由电子
金属阳离子和自由电子以金属键结合形成金属晶体Metallic crystals
离子晶体
什么叫离子晶体?
离子间通过离子键结合而成的晶体。
离子晶体的特点?
无单个分子存在;NaCl不表示分子式。 熔沸点较高,硬度较大。 水溶液或者熔融状态下均导电。
哪些物质属于离子晶体?
强碱、部分金属氧化物、部分盐类。
例4、实现下列变化时,需克服相同类型作用力
的是
()
(A)水晶和干冰的熔化 (B)食盐和冰醋酸熔化
C)液溴和液汞的气化(D)纯碱和烧碱的熔化
氯化钠(Table salt Sodium Chloride) 的晶体结构
氢剑:三维虚拟技术下的氯化钠晶胞

氢剑:三维虚拟技术下的氯化钠晶胞孩⼦、家长都需要的⼼理测试:情商测试、专业⼼理健康测评、专注⼒评估、学⽣考试⼼理健康测试、家长胜任能⼒测试等12项。
点击下图即可进⼊测试,测试结果可以发到您的微信,为您的决策提供帮助!教师简介黄剑芳,笔名氢剑,在福建省福州第⼀中学任教⾼中化学,中学⾼级教师,教学基本功扎实,有较强的学科整合能⼒,上课、说课、课件⽐赛均获过全国⼀等奖,多篇论⽂在《化学教育》、《化学教学》等刊物上发表,近年专注三维技术应⽤于物质结构的教学研究。
兴趣⼴泛,喜爱登⼭、徒步、摄影、旅游,知识⾯⼴,授课风趣幽默,待⼈真诚,深受⼴⼤师⽣欢迎。
微课视频及讲解⽂字说明氯化钠晶胞本⽂微视频时长9分钟39秒,结合三维虚拟模型演绎三个问题:第⼀,从⽴⽅最密堆积出发,通过填隙获得NaCl晶胞,分析了NaCl晶胞基本结构;第⼆,举例说明晶体结构数据分析的意义;第三,⽤三维虚拟技术动态表达了从NaCl晶胞到CaC2晶胞的拉伸过程。
演⽰直观形象,讲解简明扼要,富有启发性。
⼀、从⽴⽅最密堆积到NaCl晶胞许多⾦属(例如铜等)的晶体结构可看着等径圆球进⾏⽴⽅最密堆积形成,这种结构称为⾯⼼⽴⽅。
在⽴⽅最密堆积结构中,有两种空隙:四⾯体空隙和⼋⾯体空隙。
四⾯体空隙由⼀个顶⾓原⼦与三个⾯⼼原⼦围成,空隙数⽬为8,是⾯⼼⽴⽅原⼦数4的2倍;⽽⼋⾯体空隙由六个⾯⼼原⼦围成,空隙数⽬为4,与⾯⼼⽴⽅原⼦数4相同。
NaCl的结构可看着⼤的Cl-离⼦按⽴⽅最密堆积排列,⼩的Na 填在⼋⾯体的空隙之中。
这就不难理解晶胞中Na 数⽬就是⼋⾯体的空隙数,即4个,⽽Cl-数⽬即为⾯⼼⽴⽅原⼦数⽬,亦为4个,每个NaCl晶胞拥有4个“NaCl”微粒。
与Na 紧邻的Cl-有6个,与Cl-紧邻的Na 有6个,即NaCl晶体的配位数为6,⽽与每个Cl-最近邻的Cl-为12个(观看虚拟模型的演⽰)。
图1 氯化钠晶胞图2 氯化钠晶格⼆、晶体结构数据分析的意义NaCl型的结构具有⼴泛性,已知有400多种组成⽐为1∶1的化合物采⽤这种结构型式,例如,碱⾦属卤化物与氢化物,碱⼟⾦属氧化物和硫化物等。
氯化钠(NaCl)晶体的晶胞解析
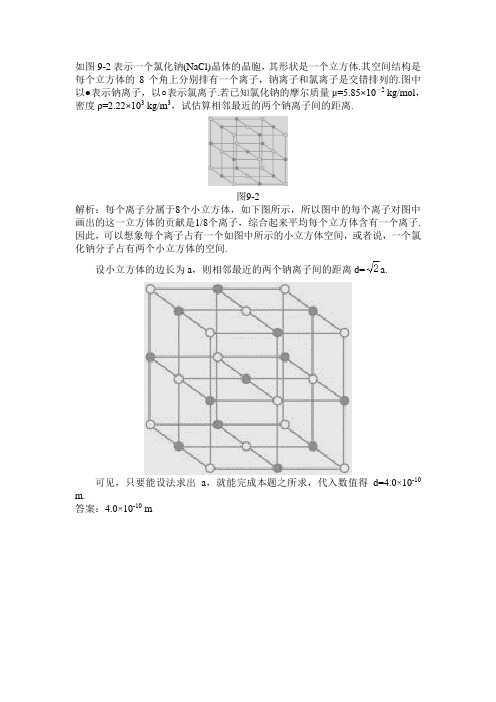
如图9-2表示一个氯化钠(NaCl)晶体的晶胞,其形状是一个立方体.其空间结构是每个立方体的8个角上分别排有一个离子,钠离子和氯离子是交错排列的.图中以●表示钠离子,以○表示氯离子.若已知氯化钠的摩尔质量μ=5.85×10-2 kg/mol,密度ρ=2.22×103 kg/m3,试估算相邻最近的两个钠离子间的距离.
图9-2
解析:每个离子分属于8个小立方体,如下图所示,所以图中的每个离子对图中画出的这一立方体的贡献是1/8个离子,综合起来平均每个立方体含有一个离子.因此,可以想象每个离子占有一个如图中所示的小立方体空间,或者说,一个氯化钠分子占有两个小立方体的空间.
设小立方体的边长为a,则相邻最近的两个钠离子间的距离d= a.
可见,只要能设法求出a,就能完成本题之所求,代入数值得d=4.0×10-10 m.
答案:4.0×10-10 m。
nacl第一布里渊区形状

nacl第一布里渊区形状
NaCl(氯化钠)是一种典型的离子晶体,其第一布里渊区形状是由倒格子空间中离原点最近的四个倒格点的垂直平分线围成的区域。
布里渊区是倒格子空间的一部分,是由倒格点位置矢量$K_h$垂直平分面所划分的区域,其中最靠近原点的平面所围成的区域称为第一布里渊区。
在NaCl 晶体中,钠离子和氯离子以面心立方的方式堆积在一起。
因此,其倒格子也是面心立方结构。
第一布里渊区是一个十四面体,由八个正六边形和六个正四边形组成。
NaCl 晶体的第一布里渊区形状对于理解其晶体结构和物理性质具有重要意义。
例如,在晶体的能带结构中,第一布里渊区的边界对应着能带的能带带隙,而能带带隙的大小和形状则决定了晶体的电子学性质。
此外,布里渊区还具有周期性,每个布里渊区经过平移适当的倒格矢$K_h$之后,都能够与另一个布里渊区重合。
这种周期性使得我们可以通过对第一布里渊区的研究来了解整个晶体的性质。
总之,NaCl 晶体的第一布里渊区形状是一个由八个正六边形和六个正四边形组成的十四面体,它对于理解晶体的结构和物理性质具有重要意义。
nacl晶胞的配位数

NaCl晶胞的配位数一、引言NaCl(氯化钠)是一种常见的离子化合物,具有岩盐的晶体结构。
在NaCl的晶体结构中,钠离子(Na+)和氯离子(Cl-)以离子键的方式结合,形成一个正负电荷相互平衡的晶胞结构。
配位数是指离子或原子周围邻近的其他离子或原子的数目。
本文将对NaCl晶胞的配位数进行探讨。
二、NaCl的晶胞结构NaCl的晶胞结构是典型的面心立方(FCC)结构。
每个钠离子都被6个氯离子所包围,而每个氯离子也被6个钠离子所包围。
这种排列方式使得正负电荷之间达到了最佳平衡,保持了晶体的稳定性。
三、NaCl晶胞的配位数NaCl晶胞中,每个离子或原子周围都有特定的邻近离子或原子。
下面将分别探讨钠离子和氯离子的配位数。
3.1 钠离子的配位数钠离子(Na+)的配位数为6。
具体而言,每个钠离子都被6个氯离子所包围。
这是因为在NaCl晶胞中,每个钠离子位于一个八面体的中心,而这个八面体的六个顶点分别和六个氯离子相接触。
3.2 氯离子的配位数氯离子(Cl-)的配位数也为6。
与钠离子类似,每个氯离子都被6个钠离子所包围。
在NaCl晶胞中,每个氯离子位于一个八面体的中心,而这个八面体的六个顶点分别和六个钠离子相接触。
四、NaCl晶胞的稳定性NaCl晶胞的配位数对于晶体的稳定性起着重要作用。
在NaCl晶胞中,钠离子和氯离子的配位数均为6,这种配位数的方式使得每个离子周围的邻近离子与其之间的电荷平衡最佳,从而保持晶体的稳定性。
五、其他晶胞的配位数除了NaCl晶胞外,还存在许多其他晶体结构,它们的配位数也各不相同。
例如,对于六方最密堆积(HCP)结构,每个原子的配位数为12;对于面心立方(FCC)结构,每个原子的配位数为12;对于体心立方(BCC)结构,每个原子的配位数为8。
六、总结NaCl晶胞的配位数是指周围邻近的其他离子或原子的数目。
在NaCl晶体中,钠离子和氯离子的配位数均为6,这种排列方式使得正负电荷之间达到了最佳平衡,保持了晶体的稳定性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属阳离子和自由电子
金属阳离子和自由电子以金属键结合形成金属晶体Metallic crystals
分子晶体
原子晶体
离子晶体
什么叫离子晶体?
离子间通过离子键结合而成的晶体。
离子晶体的特点?
无单个分子存在;NaCl不表示分子式。 熔沸点较高,硬度较大。 水溶液或者熔融状态下均导电。
哪些物质属于离子晶体?
类型
离子晶体 原子晶体 分子晶体
原子
金属晶 体
金属阳离子 和自由电子
构成微 阴阳离子 粒 微粒间 离子键 作用力 硬度 熔沸点 举例 较硬
分子
共价键 很硬 高 分子间 作用力 较小 较低
金属 键
一般较大 部分小
较高
拓展
石墨 —混合型晶体
石墨为什么很软?
石墨为层状结构,各层之间是范德华力结合,容易滑动,所 以石墨很软。
熔点 干冰1 干冰2
离子晶体
分子晶体
原子晶体
什么叫原子晶体?
原子间通过共价键结合成的具有空间网 状结构的晶体。
熔沸点很高,硬度很大。
原子晶体的特点?
哪些物质属于原子晶体?
金刚石、单晶硅、碳化硅、二氧化硅等。
金刚石 熔点 硬度
石墨
金属晶体
构成晶体的微粒 微粒间作用力 金属晶体类别 金属阳离子和自由电子 金属键 金属单质或合金 如:钠、钾、铜 物理性质:有金属光泽导电导热延展性
具有规则几何外形的固体叫晶体。 晶体中的微粒按一定的规则排列。
构成晶体的基本微粒和作用力
阴阳离子
阴阳离子间以离子键结合,形成离子晶体Ionic crystals 。
分子
分子间以分子间作用力(又称范德华力)结合,形成 分子晶体 Molecular crystals 。
原子
原子间以共价键结合,形成原子晶体Atomic crystals 。
晶体判断
课堂练习题
例3、下列晶体熔化时,不需要破坏化学键的是 ( ) A、金刚石 B、干冰 C、食盐 D、晶体硅 例4、实现下列变化时,需克服相同类型作用力 的是 ( ) (A)水晶和干冰的熔化 (B)食盐和冰醋酸熔化 C)液溴和液汞的气化பைடு நூலகம்D)纯碱和烧碱的熔化
氯化钠(Table salt Sodium Chloride) 的晶体结构
从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体; 低:分子晶体) 熔融状态的导电性。(导电:离子晶体)
课堂训练
课堂练习题
例1、 下列各组物质的晶体中,化学键类型相同、 晶体类型也相同的是 ( ) A.SO2和SiO2 B.CO2和H2O C.NaCl和HCl l4和KCl 例2、下列物质的晶体中,不存在分子的是 ( ) (A)二氧化碳 (B)二氧化硫 (C)二氧化硅 (D)二硫化碳
石墨的熔沸点为什么很高?
石墨各层均为平面网状结构,碳原子之间存在很强的共价键 ,故熔沸点很高。 所以,石墨称为混合型晶体。
石墨结构
用途
晶体硅是良好的半导体材料
光导纤维 主要成份:二氧化硅
人造金刚石切割锯片 人造金刚石 人造金刚石就是依据在5-7万大气压,1200℃-1800℃温度的条件下, 碳元素就会结晶成为金刚石这个原理用合金片作触媒使外加的压力 和温度降低,达到将碳转为金刚石的目的. 用途:金刚石的用途十分广泛,用量较大的是矿山、地质、煤田 勘探,公路建设、建材、国防等行业及高精尖科研领域。
六出飞花入户时,坐看青竹变琼枝。 ——唐●高骈《对雪诗》
不同类型的晶体
晶体概念 基本类型 离子晶体 分子晶体 原子晶体 知识归纳 晶体判断 课堂练习
晶体的概念
什么叫晶体? Some substance have a characteristic shape of smooth , flat sides with shar edges and corners .
回离子晶体
氯化铯(Cesium Chloride) 的晶体结构
回离子晶体
干冰(Dry Ice)的晶体结 构图
回分子晶体
金刚石(Diamond) 的晶体 结构
回原子晶体
石墨(Graphite)的晶体结 构
返回石墨
三种晶体的熔点
Diamond
Table salt
返回
Dry Ice
结束
晶体的硬度
Diamond
返回原处
Table salt
结束
强碱、部分金属氧化物、部分盐类。
Na Cl
Cs Cl
离子晶体
原子晶体
分子晶体
什么叫分子晶体?
分子间通过分子间作用力结合成的晶体。
分子晶体的特点?
有单个分子存在;化学式就是分子式。 熔沸点较低,硬度较小。
哪些物质可以形成分子晶体?
卤素、氧气、氢气等多数非金属单质、稀有气体、非金属氢化 物、多数非金属氧化物等。
液晶材料主要是脂肪族 、芳香族、硬脂酸等有 机物。液晶也存在于生 物结构中。日常生活中 ,适当浓度的肥皂水溶 液就是一种液晶。目前 已经发现或人工合成的 液晶材料已达五千多中 。 液晶显示器(liquid crystal)
晶体类型的判断
从组成上判断(仅限于中学范围): 金属单质:金属晶体
有无金属离子?(有:离子晶体) 是否属于“四种原子晶体”? 以上皆否定,则多数是分子晶体。
