电极制备及测试
实验十一--电极制备及电池电动势的测定

实验数据处理
测定下列五组电池的电池电动势:
(1) Zn(s)│ZnSO4(0.1000mol·dm-3)‖CuSO4(0.1000mol·dm-3)│Cu(s) (2) Zn(s)│ZnSO4(0.1000mol·dm-3)‖CuSO4(0.01000mol·dm-3)│Cu(s) (3) Cu (s)│CuSO4(0.01000mol·dm-3)‖CuSO4(0.1000mol·dm-3)│Cu(s)
半电池
原电池电动势测定实验流程
接线
调节光电 检流计
计算实验室温下 标准电池电动势
待测电池 电动势测定
标定工作电流
实验步骤
1、制备锌电极: 先用稀硫酸溶液洗去锌电极表面的氧化物,再用蒸 馏水淋洗干净,浸入饱和硝酸亚汞溶液中约5s,表面上即生成一层光 亮的汞齐,用蒸馏水冲洗晾干后,插入0.1000mol·L-1 ZnSO4中待用。 2.制备铜电极: 将纯铜电极用稀硝酸溶液洗,再用蒸馏水淋洗干净 后作阴极,粗铜作阳极,放入镀铜溶液中,通电15—20分钟,电流 密度为25mA•cm-2, 电镀得表面呈红色的Cu电极,蒸馏水冲洗晾干 后放入0.1000mol·L-1 CuSO4中备用。
无电流或极小电流通过原电池 坡根多夫对消法
原电池两极的电势差
原电池电动势
坡根多夫对消法原理
工作电池
RP
A
I→
HC
B
EN
I= E N
R AH
I=0 检流计
Ex =IRAC
Ex
?
C点 可调电阻 AB H点来自电键 K双向开关
可调电阻Rp
光电检流计工作原理
实验仪器
UJ-25 电位差计
光点式检流计
韦斯顿标准电池 甲电池
电极材料的制备及应用

电极材料的制备及应用电极是电池中最重要的部分之一,它与电解液之间的物理和化学变化可以控制电池的性能。
电极材料可以是金属、氧化物、硫化物等,其制备和性质对电池的能量密度、循环寿命和稳定性等都有着至关重要的影响。
一、电极材料的制备方法1. 溶胶-凝胶法溶胶-凝胶法是一种常用的制备氧化物电极材料的方法,其基本步骤如下:1)将金属醇盐和复合碱作为前驱体,溶于有机溶剂中。
2)经过一系列化学反应,生成透明的溶胶状物质。
3)将溶胶状物质挥发至凝胶状物质。
4)将凝胶状物质进行煅烧,生成氧化物电极材料。
2. 真空蒸发法真空蒸发法是制备金属电极材料的方法,如锂、铝等。
其基本步骤如下:1)将金属样品置于真空蒸发器中。
2)加热金属样品,使其蒸发。
3)在清洁的基板上收集蒸发的金属。
4)将蒸发的金属冷却并获得光滑的金属电极材料。
3. 激光法激光法是一种新兴的制备电极材料的方法,可以制备纳米材料和二维材料。
其基本步骤如下:1)将前驱体悬浮液涂覆在基板上。
2)通过激光刻蚀或激光聚合作用,制备具有特定形状和尺寸的电极材料。
3)通过调节激光功率、脉冲数、扫描速度等参数,可以控制电极材料的形貌和微观结构。
二、电极材料的应用1. 锂离子电池锂离子电池具有高的能量密度和循环寿命,可以作为电动汽车、便携式电子设备和储能系统等的电源。
其电极材料主要包括石墨、锰酸锂、钴酸锂、磷酸铁锂等。
2. 钠离子电池钠离子电池是一种新型的高能量密度电池,可以作为智能电网和大规模储能系统的可靠电源。
其电极材料主要包括硅、磷酸钠铁、硫化钒等。
3. 超级电容器超级电容器具有高速充放电、长循环寿命和低温效应等特点,是传统电池无法替代的高性能储能器件。
其电极材料主要包括碳电极材料和金属氧化物电极材料。
总之,电极材料的制备和应用在能源领域具有重要的意义,可以提高电池的能量密度、循环寿命和稳定性,推动新能源技术的发展。
随着科学技术的不断进步,新的电极材料和制备方法的出现将进一步改善电池的性能和应用价值。
实验九 电极制备及电池电动势的测定

实验九电极制备及电池电动势的测定一. 目的1.学会铜电极,锌电极和甘汞电极的制备和处理方法;2.掌握电势差计得测量原理3.掌握测定电池电动势的方法4.加深原电池,电极电势等概念的理解二. 基本原理1.电池电动势是两个电极电势的差值.E=ϕ+-ϕ_以铜锌电池为例1)电池符号: -)Zn︱ZnSO4(a1)‖CuSO4(a2)︱Cu(+阳极 a1、a2为离子活度阴极原电池符号中负极(阳极)在前,正极(阴极)在后2)原电池的电极反应:负极: Zn→Zn2++2e Zn失电子正极: Cu2++2e→Cu Cu2+得电子3) 电极电势:ϕZn 2+/Zn=ϕΘZn2+/Zn-RT/2F㏑aZn/aZn2+ϕCu 2+/Cu=ϕΘCu2+/Cu-RT/2F㏑aCu/aCu2+4)电池电动势:E=ϕCu 2+/Cu-ϕZn2+/Zn=ϕΘCu2+/Cu-ϕΘZn2+/Zn-RT/2F㏑aCUaZn2+/aCu2+aZn=EΘ-RT/2F㏑a Cu aZn2+/aCu2+aZn(aZn=aCu)=EΘ-RT/2F㏑aZn 2+/aCu2+2、在一定温度下,电极电势的大小决定于电极的性质和溶液中有关离子的活度。
电极电势绝对值无法确定。
3、将标准氢电极的电极点势定为零。
电极电定即假设电极与标氢电极组成电池,标氢为负极,测量的电极电动势值即条件要求的。
4、可用参考电极,如甘汞电极,银—卤化银电极,其标氢电极的电极电势已精确测定。
5、电池电动势不能用伏特计直接测量。
(1)电池放电过程中,电池中溶液浓度不断改变,电动势值也在发生变化,伏特计无法读出电势值。
(2)电池存在内阻,伏特计只能两极的电势降,不能量出电池电动势。
只有在无电流通过时的才是电池的电动势。
(3)电势差计利用对消法原理进行电势差测定,电池内无电流通过。
6、两种不同电极电解质接触时,液体接面上产生液体接界电势,用盐桥能使接界电势降到毫伏级以下。
常用盐桥为KCl (3mol./L 或饱和),KNO3,NH4NO3等溶液。
电极制备及电池电动势的测定

0.2707 -0.8327 1.1034
原电池: 电池反应:
Zn(s) | ZnSO4 (a1) | KCl (饱和) |Hg2Cl2, Hg Zn ( s) +Hg2Cl2 (s) → Zn2- (b1)+ 2Hg(s) + 2Cl. -3
b 1= 0.01 mol dm T= 291.15 K
Hg2Cl2, Hg |KCl (饱和) | CuSO4 (a2) | Cu(s) Hg ( s) +Cu2+ + 2Cl- (饱和) →Hg2Cl2 (s) + 2Cu(s) r+ = 0.4 z= 2 0.2707 0.2483 0.0224
b 2 = 0.01 mol.dm- 3 T= 291.15 K
电池反应: Hg ( s) +Cu2+ + 2Cl- (饱和) →Hg2Cl2 (s) + 2Cu(s) b2= 0.1 mol.dm- 3 T= 291.15 K
正极 负极
理论计算值: 实验测定值:
E+ = E+⊙-(RT/zF )ln(1/aCu2+) = E= E+ - E- = E'= 0.05148
E+ = (查表4-3不同温度甘汞电极电位 0.2438 E- = E-⊙-(RT/zF)ln(1/aZn2+) = E= E+ - E- = E'= 1.51867 Er= 43.34% -0.8157 1.0595
原电池:
Hg2Cl2, Hg |KCl (饱和) | CuSO4 (a2) | Cu(s) r+ =0.16 z= 2 0.2881 0.0443
电极制备及电动势的测定实验报告

电极制备及电动势的测定实验报告示例文章篇一:《电极制备及电动势的测定实验报告》哇塞!今天我们做了一个超级有趣的实验——电极制备及电动势的测定!实验开始前,老师就像一个神奇的魔法师,在讲台上给我们介绍各种实验器材和步骤,我那小脑袋瓜呀,充满了好奇和期待,心里不停地念叨着:“这会是一场怎样的神奇之旅呢?”我们小组几个人围在实验桌前,眼睛都瞪得大大的。
我拿起那些亮晶晶的金属片,就好像拿着宝贝一样,小心翼翼的。
旁边的小明也不闲着,一边看着实验手册,一边嘴里嘟囔着:“这可不能出错呀!”制备电极的时候,那感觉就像是在搭建一座小小的城堡。
我们得把金属片打磨得光滑无比,这可不容易呢!我费了好大的劲,手都酸了,忍不住问:“这啥时候才能打磨好呀?”好不容易打磨好了,接下来就是关键的一步——电镀。
这时候,小红着急地说:“哎呀,可别弄砸了!”我心里也紧张得要命,心都提到嗓子眼儿了,就怕出啥差错。
当我们把制备好的电极放入溶液中,眼睛一眨不眨地盯着,那紧张的劲儿,就好像在等待一场超级重要的比赛结果。
你说,这等待的过程咋就这么难熬呢?终于到了测定电动势的时候啦!看着仪表上的数字不停地跳动,我的心也跟着七上八下的。
“这数字到底准不准呀?”我心里直犯嘀咕。
这实验过程中,我们遇到了不少难题。
比如说,溶液的浓度没控制好,仪器的连接出了点小差错。
哎呀,这可把我们急坏了!就像热锅上的蚂蚁,团团转。
不过,我们可没有轻易放弃!大家一起想办法,互相帮忙,就像一群团结的小蚂蚁,共同努力搬着一块大蛋糕。
经过一番折腾,我们终于完成了实验!你能想象到我们那兴奋的样子吗?简直比考了满分还高兴!通过这次实验,我深深地明白了,做实验可不能马虎,要细心、耐心,还要团结协作。
这不就像我们的生活一样吗?遇到困难不能退缩,要勇往直前,和小伙伴们一起努力,才能战胜困难,取得成功!这就是我们这次精彩又充满挑战的电极制备及电动势的测定实验,真是让人难忘啊!示例文章篇二:《电极制备及电动势的测定实验报告》嘿,同学们!今天我要跟你们讲讲我做的电极制备及电动势测定的实验,那可真是太有趣啦!实验开始前,老师给我们准备了好多材料和仪器,就像要给我们打开一个神秘的科学宝藏一样。
22实验十七电极制备及电动势的测定

136实验17 电极制备及电动势和化学反应的热力学函数变化值的测定【实验目的】1.学会铜电极、锌电极和甘汞电极的制备和处理方法。
2.掌握电势差计的测量原理和测定电池电动势的方法。
3.加深对原电池、电极电势等概念的理解。
4.通过测定不同温度下的电池的电动势计算有关热力学常数。
【实验原理】 (一)电动势的测定电池由正、负两个电极组成,电池的电动势等于两个电极电势的差值。
-+-=ϕϕE (3-118)式中ϕ+是正极的电极电势;ϕ-是负极的电极电势。
以Cu -Zn 电池为例,电池符号负极反应正极反应电池中总的反应为Zn 电极的电极电势+++-=222ln 20//Zn Zn ZnZn ZnZna a F RTϕϕ (3-119) Cu 电极的电极电势+++-=222ln 20//Cu Cu CuCu CuCua a F RTϕϕ (3-120) 所以Cu -Zn 电池的电池电动势为ZnCu Zn Cu ZnCu Zn Cu ZnZn CuCu ZnZn Cu Cu a a a a F RT E a a a a F RT E ++++++++-=--=-=22222222ln2ln 200/0///ϕϕϕϕ (3-121)137纯固体的活度为1所以++-=22ln20Cu Zn a a F RT E E (3-122) 在一定温度下电极电势的大小决定于电极的性质和溶液中有关离子的活度。
由于电极电势的绝对值不能测量,在电化学中,通常将标准氢电极的电极电势定为零,其他电极的电极电势值是与标准氢电极比较而得到的相对值。
由于使用标准氢电极条件要求苛刻,而实际中常用电势稳定的可逆电极作为参比电极来代替,如甘汞电极、银一氯化银电极等。
这些电极的标准电极电势值已精确测出,在物理化学手册中可以查到。
电池电动势不能用伏特计直接测量。
因为当把伏特计与电池接通后,由于电池放电,不断发生化学变化,电池中溶液的浓度将不断改变,因而电动势值也会发生变化。
电极制备及测试

电极制备过程:一、泡沫镍清洗:1.泡沫镍大小大约6mm*5cm2.用无水乙醇浸泡,超声震荡1~2h ,取出干燥4~5h,注意:无水乙醇可以回收再用,如果要用冷却后称重。
3.用密封袋装好备用。
二、制片(一)混样1. 活性物质:乙炔黑:粘结剂(例如聚四氟乙烯)=85:10:5(参考文献)注意:聚四氟乙烯的质量分数配置为8%,加入0.2mg活性炭,按比例算出聚四氟乙烯的量后再除以8%。
2.加入少量的乙醇(作为分散剂)使混合物成糊状3.用玛瑙研钵研磨半个小时。
使用前用无水乙醇洗清洗。
(二)擀片1.先称好清洗过得泡沫镍的质量,在称之前可在用黑笔在泡沫镍的一端表上编号方便辨认,做好记录,哪个批次对应哪些编号在制成电极前的质量。
最好同一批次做三四个样备用。
2.用玻璃棒擀成“布状”用镊子夹起把另外一面擀一擀,像割豆腐块一样的方法,用刀片割取面积大约为3mm*3mm大小(尺子量),用镊子夹取到洗涤好的泡沫镍上。
注意: 要事先在泡沫镍上滴酒精,这样活性炭能黏在泡沫镍上。
3.压片,调节对辊机左右两边压力为10mpa(参考文献),干燥2~3h,冷却后记录质量,即算出附在泡沫镍上混合物质量电极测试过程一、循环伏安(三电极体系)a电解液中性酸性用饱和甘汞电极作参比电极,碱性用氧化汞电极作参比电极。
注意:不要混用,混用易损坏电极,例如碱性电解液用饱和甘汞电极。
b用铂电极作对电极c工作电极为要被测试电极注意:铂电极与工作电极面对面。
设置→实验技术→循环伏安→设置电压→扫描速度→扫描段数设置10→灵敏度设置1.e-002→确定注意: a.扫描电压设置值为,通过能斯特方程计算析氢析氧电压范围。
b.扫描速度从小到大数据导出:文件→转换文本→打开→刷新文件夹,即可看到文本文件如果不行可以试试:打开→要转换的文件→文件→转换文本→打开→右键黏贴如果在实验室电脑不行转换把软件和数据考回去可以试试。
二、交流阻抗设置→实验技术→交流阻抗→低频改为0.01其他不变。
电极制备及电池电动势的测定
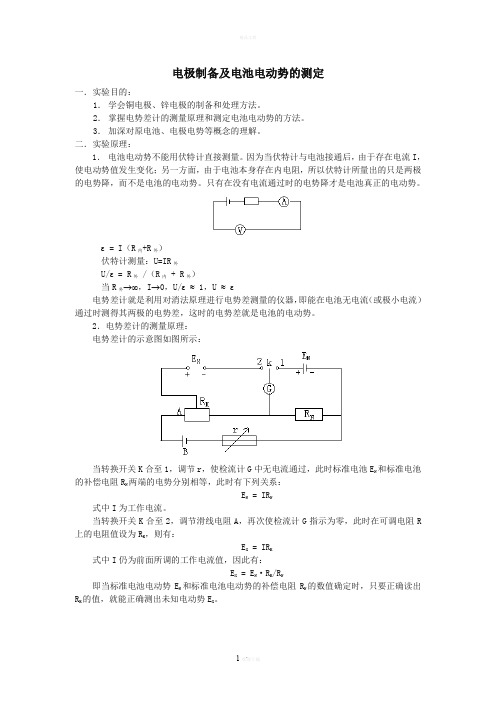
电极制备及电池电动势的测定一.实验目的:1.学会铜电极、锌电极的制备和处理方法。
2.掌握电势差计的测量原理和测定电池电动势的方法。
3.加深对原电池、电极电势等概念的理解。
二.实验原理:1.电池电动势不能用伏特计直接测量。
因为当伏特计与电池接通后,由于存在电流I,使电动势值发生变化;另一方面,由于电池本身存在内电阻,所以伏特计所量出的只是两极的电势降,而不是电池的电动势。
只有在没有电流通过时的电势降才是电池真正的电动势。
ε = I(R内+R外)伏特计测量:U=IR外U/ε = R外 /(R内 + R外)当R外→∞,I→0,U/ε≈ 1,U ≈ε电势差计就是利用对消法原理进行电势差测量的仪器,即能在电池无电流(或极小电流)通过时测得其两极的电势差,这时的电势差就是电池的电动势。
2.电势差计的测量原理:电势差计的示意图如图所示:当转换开关K合至1,调节r,使检流计G中无电流通过,此时标准电池E N和标准电池的补偿电阻R N两端的电势分别相等,此时有下列关系:E N = IR N式中I为工作电流。
当转换开关K合至2,调节滑线电阻A,再次使检流计G指示为零,此时在可调电阻R 上的电阻值设为R K,则有:E X = IR K式中I仍为前面所调的工作电流值,因此有:E X = E N·R K/R N即当标准电池电动势E N和标准电池电动势的补偿电阻R N的数值确定时,只要正确读出R K的值,就能正确测出未知电动势E X。
三.实验装置图:四.实验步骤:1.电极和盐桥制备(1)锌电极:先用稀硫酸洗净锌电极表面的氧化物,再用蒸馏水淋洗,然后用0.1M 的ZnSO4溶液淋洗,放入0.1M的ZnSO4溶液中,即制成了锌电极。
(2)铜电极:由于铜较锌不活泼,所以先用稀硝酸洗净铜电极表面的氧化物,再用蒸馏水淋洗,然后把它作为阴极,另取一块纯铜片作为阳极,在镀铜溶液(配制方法见试剂)内进行电镀,电镀时,电流密度控制在25mA·cm-2左右,电镀时间20~30分钟,使铜电极表面有一层均匀的新鲜铜。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电极制备过程:
一、泡沫镍清洗:
1.泡沫镍大小大约6mm*5cm
2.用无水乙醇浸泡,超声震荡1~2h ,取出干燥4~5h,
注意:无水乙醇可以回收再用,如果要用冷却后称重。
3.用密封袋装好备用。
二、制片
(一)混样
1. 活性物质:乙炔黑:粘结剂(例如聚四氟乙烯)=85:10:5(参考文献)
注意:聚四氟乙烯的质量分数配置为8%,加入0.2mg活性炭,按比例算出聚四氟乙烯的量后再除以8%。
2.加入少量的乙醇(作为分散剂)使混合物成糊状
3.用玛瑙研钵研磨半个小时。
使用前用无水乙醇洗清洗。
(二)擀片
1.先称好清洗过得泡沫镍的质量,在称之前可在用黑笔在泡沫镍的一端表上编号
方便辨认,做好记录,哪个批次对应哪些编号在制成电极前的质量。
最好同一批次做三四个样备用。
2.用玻璃棒擀成“布状”用镊子夹起把另外一面擀一擀,像割豆腐块一样的方法,用刀片割取面积大约为3mm*3mm大小(尺子量),用镊子夹取到洗涤好的泡沫镍上。
注意: 要事先在泡沫镍上滴酒精,这样活性炭能黏在泡沫镍上。
3.压片,调节对辊机左右两边压力为10mpa(参考文献),干燥2~3h,冷却后记录质量,即算出附在泡沫镍上混合物质量
电极测试过程
一、循环伏安(三电极体系)
a电解液中性酸性用饱和甘汞电极作参比电极,碱性用氧化汞电极作参比电极。
注意:不要混用,混用易损坏电极,例如碱性电解液用饱和甘汞电极。
b用铂电极作对电极
c工作电极为要被测试电极
注意:铂电极与工作电极面对面。
设置→实验技术→循环伏安→设置电压→扫描速度→扫描段数设置10→灵敏度设置1.e-002→确定
注意: a.扫描电压设置值为,通过能斯特方程计算析氢析氧电压范围。
b.扫描速度从小到大
数据导出:文件→转换文本→打开→刷新文件夹,即可看到文本文件
如果不行可以试试:打开→要转换的文件→文件→转换文本→打开→
右键黏贴
如果在实验室电脑不行转换把软件和数据考回去可以试试。
二、交流阻抗
设置→实验技术→交流阻抗→低频改为0.01其他不变。
数据导出同上
三、恒流充放电(三电极体系)
a甘汞电极或氧化汞电极作参比电极
b清洗干燥过的泡沫镍作对电极
c工作电极为被测电极
注意:三电极底端最好在同一直线上。
大黑夹子夹参比电极,小黑夹子夹未压过的泡沫镍,小红夹在大红上,大红夹被测电极。
启动设置工步→恒流充电→电压输入→电流输入→恒流放电(同上)→循环例如从1~1000→结束
注意:a.电压输入=循环伏安设置的最大电压
b.电流输入=活性物质含量比例*电流密度(例如1A/g也可以设置其它数值,参考文献)*极片上活性炭混合物质量。
例如按一开始给出的比例,活性物质为0.85*1*0.4mg
数据导出:打开数据右边有个导出Excel图标点击即可。
