DAPI染色
DAPI和Hoechst-PI染料

DAPI和Hoechst-PI染料DAPIDAPI即4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole),是一种能够与DNA强力结合的荧光染料,常用于荧光显微镜观测。
因为DAPI可以透过完整的细胞膜,它可以用于活细胞和固定细胞的染色。
DAPI介绍在荧光显微镜观察下,DAPI染剂是利用紫外光波长的光线激发。
当DAPI与双股DNA 结合时,最大吸收波长为358nm,最大发射波长为461nm,其发散光的波长范围含盖了蓝色至青绿色。
DAPI也可以和RNA结合,但产生的荧光强度不及与DNA结合的结果,其发散光的波长范围约在500nm左右。
DAPI的发散光为蓝色,且DAPI和绿色荧光蛋白(Green fluorescent protein, GFP)或Texas Red染剂(红色荧光染剂)的发散波长,仅有少部分重叠,研究员可以善用这项特性在单一的样品上进行多重荧光染色。
DAPI能快速进入活细胞中与DNA结合,因此DAPI对生物体而言,也被视为一种毒性物质与致癌物。
使用过程中应注意操作与抛弃的处理程序。
中文名:4,6-联脒-2-苯基吲哚(?)英文名:4',6-diamidino-2-phenylindole,2-(4-amidinophenyl)-1H -indole-6-carboxamidine,DAPI dihydrochloride分子式:C16H15N5分子量:277.324CAS number:28718-90-3光谱性质:DAPI的最大激发波长为340nm,最大发射波长为488nm与双链DNA结合时最大吸收/最大发射为358 nm/461 nm;与RNA结合时,最大发射移动到400 nm左右。
DAPI染色原理:DAPI 为一种荧光染料,可以穿透细胞膜与细胞核中的双链DNA 结合而发挥标记的作用,可以产生比DAPI自身强20多倍的荧光,和EB相比,对双链DNA的染色灵敏度要高很多倍。
DAPI染色

DAPI (4',6-diamidino-2-phenylindole)的配
制
贮存液:70%酒精溶解,浓度100 μg/ml,配好后用锡纸包起来,避光,可在4摄氏度下长期保存。
使用浓度:贮存液用1xPBS稀释1000倍,最终浓度100 ng/ml。
10x PBS的配制
80 g NaCl
2 g KCl
6.1 g 无水Na2HPO4
2 g 无水KH2PO4
加水到1000ml
贮存液可根据需要用蒸馏水稀释
荧光封片液
0.5 mol/L碳酸盐缓冲液与甘油等体积混合,pH9.5
染色与观察:
制好的玻片上滴加几滴DAPI染液,染色10分钟,流水冲去染液,滤纸吸除多余水分,加一滴荧光封片液,置于荧光显微镜下观察,激发波长360-400nm.
注意事项:
DAPI可能具有致癌性,全部操作过程中必须带塑料或乳胶手套。
上:正常绍鸭成纤维细胞核,下:凋亡核。
dapi染色方法

dapi染色方法
DAPI染色方法是一种常用的细胞核染色方法,它可以用于检测DNA含量、核型分析、染色体计数和核型鉴定等方面。
DAPI染色方法的原理是利用DAPI(4',6-diamidino-2-phenylindole)这种荧光染料,它可以与DNA结合,使DNA发出蓝色荧光,从而实现对细胞核的染色。
DAPI染色方法的步骤如下:
1.将细胞固定在载玻片上,可以使用甲醛、乙醛、乙醇等固定剂进行固定。
2.用PBS(磷酸盐缓冲液)或者其他缓冲液进行洗涤,去除细胞表面的蛋白质和其他杂质。
3.将DAPI染料加入到载玻片上,使其与细胞核中的DNA结合。
4.在黑暗中孵育10-15分钟,使DAPI染料充分结合到DNA上。
5.用PBS或其他缓冲液进行洗涤,去除未结合的DAPI染料。
6.在显微镜下观察细胞核的荧光信号,可以使用荧光显微镜或者激光共聚焦显微镜进行观察。
DAPI染色方法的优点是可以快速、简单地染色,同时可以同时检测多个样本。
此外,DAPI染色方法还可以与其他荧光染料结合使用,
如FITC、TRITC等,从而实现多重染色,提高检测的准确性和灵敏度。
但是,DAPI染色方法也存在一些缺点,如DAPI染料对细胞有毒性,需要控制染色时间和浓度,避免对细胞造成伤害。
此外,DAPI染色方法只能检测DNA含量和核型分析等方面,不能检测其他细胞器和分子的信息。
DAPI染色方法是一种常用的细胞核染色方法,具有快速、简单、灵敏等优点,可以用于多种细胞学研究和临床检测中。
DAPI染色

DAPI即4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole),是一种能够与DNA强力结合的荧光染料,常用与荧光显微镜观测1。
因为DAPI可以透过完整的细胞膜,它可以用于活细胞和固定细胞的染色。
DAPI - 染色机理DAPI 为一种荧光染料,可以穿透细胞膜与细胞核中的双链DNA结合而发挥标记的作用,可以产生比DAPI自身强20多倍的荧光,和EB相比,对双链DNA的染色灵敏度要高很多倍。
显微镜下可以看到显蓝色荧光的细胞,荧光显微镜观察细胞标记的效率高(几乎为100 %) ,且对活细胞无毒副作用。
DAPI染色常用于细胞凋亡检测,染色后用荧光显微镜观察或流式细胞仪检测。
DAPI也常用于普通的细胞核染色以及某些特定情况下的双链DNA染色。
细胞经热激处理后用DAPI染色3分钟,在荧光显微镜下可以看到到细胞核的形态变化。
a、正常的烟草细胞核:核形完整,染色质均匀。
b、染色质固缩,向外周聚集,形成周边化。
c、染色质进一步固缩,形成很多颗粒物质。
d、细胞核破裂形成碎片,核解体。
DAPI的发散光为蓝色,且DAPI和绿色荧光蛋白(Green fluorescent protein, GFP)或Texas Red染剂(红色荧光染剂)的发散波长,仅有少部分重叠,研究员可以善用这项特性在单一的样品上进行多重荧光染色。
DAPI能快速进入活细胞中与DNA结合,因此DAPI对生物体而言,也被视为一种毒性物质与致癌物。
使用过程中应注意操作与抛弃的处理程序。
在细胞移植前,将DAPI 以一定的浓度加入培养基中,与细胞共同孵育过夜,用PBS 缓冲液漂洗至少6 次以洗掉未结合的DAPI,在用酶消化后离心收集细胞,加入DMEM培养基制成细胞悬液以备用。
储存条件-20℃避光保存1、DAPI强烈致癌,操作时要戴上手套。
2、贮存液用70%酒精配制,浓度100 µg/ml,可用黑纸包住,长期冻存。
dapi和merge染色原理

dapi和merge染色原理Dapi和Merge染色是生物医学研究中常用的染色方法,它可以通过荧光显微镜观察细胞内的染色体、细胞核以及其他细胞器的分布情况,帮助研究员们更加深入地了解细胞的结构和功能。
本文将详细介绍Dapi和Merge染色的原理和步骤。
一、Dapi染色原理Dapi染料的名称是4’,6-diamidino-2-phenylindole,它是一种荧光染料,能够通过自然荧光发射出蓝色的光,进而染色观测细胞内的DNA、染色体和细胞核。
Dapi染色的步骤如下:1.将组织或细胞样品固定。
2.用PBS或其他缓冲液冲洗细胞,以去除污染物质和杂质。
3.将Dapi染料加入样品中,使其能够进入细胞并与DNA结合。
4.在荧光显微镜下观察样品,Dapi染料自发发射出蓝色光线,并通过荧光镜头捕捉到光的信号,从而观察样品内DNA的分布情况。
二、Merge染色原理Merge指的是多种染色剂混合使用的染色方法,简单来说就是将多种不同颜色的染料混合在一起,能够同时染色显示不同的细胞组分结构。
Merge染色的步骤如下:1.将细胞或组织样品固定。
2.用PBS或其他缓冲液清洗样品。
3.将多个生物染色剂混合而成的Merge染剂加入样品中。
4.在荧光显微镜下观察样品,各种染剂自发发射不同的荧光信号,观察样品内不同的组分结构和分布情况。
需要注意的是,Merge染色结果的可视性和检测灵敏度,一定程度上取决于样品的样质量和染色试剂的稳定性。
总结:Dapi和Merge染色是生物医学研究中常用的染色方法,直接观察生物样品内的各种结构和细胞器分布情况。
学会掌握这两种染色方法的原理和步骤,有助于研究员能够从不同角度更深入地研究细胞及其相关治疗方法,为生命科学领域的发展做出更大的贡献。
精选DAPI染色液(5ugml-含封片剂).doc
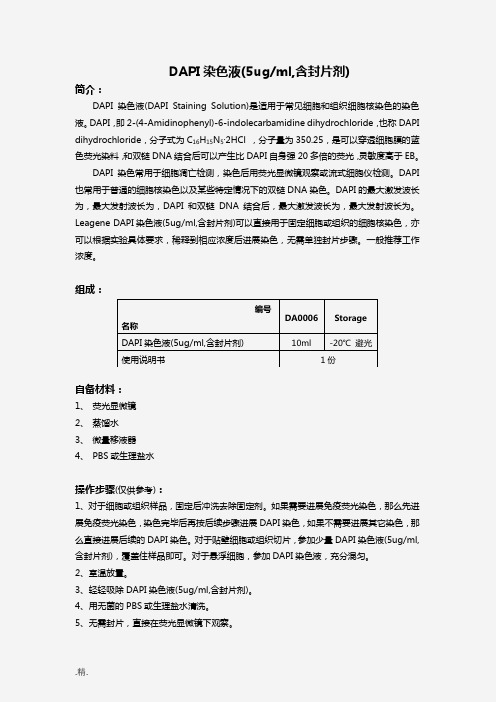
DAPI 染色液(5ug/ml,含封片剂)简介:DAPI 染色液(DAPI Staining Solution)是适用于常见细胞和组织细胞核染色的染色液。
DAPI ,即2-(4-Amidinophenyl)-6-indolecarbamidine dihydrochloride ,也称DAPI dihydrochloride ,分子式为C 16H 15N 5·2HCl ,分子量为350.25,是可以穿透细胞膜的蓝色荧光染料,和双链DNA 结合后可以产生比DAPI 自身强20多倍的荧光,灵敏度高于EB 。
DAPI 染色常用于细胞凋亡检测,染色后用荧光显微镜观察或流式细胞仪检测。
DAPI 也常用于普通的细胞核染色以及某些特定情况下的双链DNA 染色。
DAPI 的最大激发波长为,最大发射波长为,DAPI 和双链DNA 结合后,最大激发波长为,最大发射波长为。
Leagene DAPI 染色液(5ug/ml,含封片剂)可以直接用于固定细胞或组织的细胞核染色,亦可以根据实验具体要求,稀释到相应浓度后进展染色,无需单独封片步骤。
一般推荐工作浓度。
组成:自备材料:1、 荧光显微镜2、 蒸馏水3、 微量移液器4、 PBS 或生理盐水操作步骤(仅供参考):1、对于细胞或组织样品,固定后冲洗去除固定剂。
如果需要进展免疫荧光染色,那么先进展免疫荧光染色,染色完毕后再按后续步骤进展DAPI 染色,如果不需要进展其它染色,那么直接进展后续的DAPI 染色。
对于贴壁细胞或组织切片,参加少量DAPI 染色液(5ug/ml,含封片剂),覆盖住样品即可。
对于悬浮细胞,参加DAPI 染色液,充分混匀。
2、室温放置。
3、轻轻吸除DAPI 染色液(5ug/ml,含封片剂)。
4、用无菌的PBS 或生理盐水清洗。
5、无需封片,直接在荧光显微镜下观察。
编号 名称 DA0006 Storage DAPI 染色液(5ug/ml,含封片剂) 10ml-20℃ 避光 使用说明书 1份染色结果:细胞发生凋亡时,会看到凋亡细胞的细胞核呈致密浓染,或呈碎块状致密浓染。
dapi染色相关资料
dapi染色相关资料DAPI标记的原理,应用以及优缺点一、DAPI的特性DAPI荧光染料是由Dann等人于1971年合成的,共化学名称为4',6-diamidino-2-phenylindole, dihydrochloride (DAPI) 的中文名称是4,6-联脒-2-苯基吲哚,其结构式为是一种常用的荧光染料,分子量为350.3.这种二价阳离于的荧光染料是一种黄色晶体易镕于水,最大溶解度为2.5%.可按高浓度的两价或高价阴离于(硫酸盐离子和磷酸盐离子)所沉淀,其作用机理与溴化乙锭等染色剂的机理类似:DAPI具有与各种来源的、富古A—T 碱基对的DNA专一结合的特点.DAPI与DNA形成的复合物发出志强度的浅蓝色荧光.共最大的激发波长为372nm,最大的发射波长为454nm,其荧光可按适当浓度的SO42-加强.DAPI最初是作为一种杀锥虫剂合成的,以后用于DNA的检测.Brunk等和Coleman 等人证明了DAPI荧光强度与细胞内的DNA含量呈正比,并指出,在pH4—8范围内,DAPI -DNA 复合物的荧光强度不受pH变化的影响.用DAPI染色法可以测出2x10-16g DNA。
近年来,DAPI多用于细胞生物学和细胞遗传学的研究,由于死、活细胞的细胞膜对DAPI 的通透性不同,极低浓度(0.5ug/ml)的DAPI就可与死亡细胞的DNA结合,产生明亮而稳定的荧光,所以人们开始把这一理想的话体荧光染科用于微生物、植物和动物细胞的细胞生物学和生物化学的研究。
作为一种新型的DNA荧光染科,它具有专一性强、灵敏度高、稳定性好等特点,而且迄今尚来见到DAPI致癌。
致畸等毒性报告.有文献称之为无毒性荧光染料(Renard,1982).利用DAPI能与细胞DNA稳定结合这一特性,最近被人们用于干细胞的体内示踪。
如造血干细胞和间充质干细胞的体内移植。
SsxDAPI是一种标记细胞核的荧光染料,因其与dsDNA有高度的亲和力,与DNA结合后会发出强烈的荧光。
根的dapi染色原理
根的dapi染色原理
根的dapi染色原理
植物的根是植物体的重要组成部分,主要负责吸收水分和养分,并为
植物提供支持。
研究根的生长和发育对于植物学和生物学都有着重要
的意义。
在根的研究中,使用dapi染色是一种常见的方法,本文将介
绍根的dapi染色原理。
dapi染色是一种核酸染色方法,主要通过结合核酸分子的特殊化学性
质来染色。
在dapi染色中,染料分子会通过静电作用和氢键作用与其
他带有电荷的分子结合。
这种静电作用和氢键作用的条件是分子带有
一些特定的基团,如氨基和甲基。
对于根的dapi染色,我们需要使用dapi染料溶液和显微镜。
首先,将
待染色的植物根样品在水中清洗。
接下来,将根样品置于dapi染料溶
液中,在黑暗环境下孵育5至10分钟,让染料渗透到根细胞中。
然后,将根样品移入显微镜盖玻片上并覆盖漆黑的封片。
最后,在荧光显微
镜下观察根细胞的染色情况。
使用dapi染色后,根细胞的染色情况非常明显。
通过dapi染料的选择
性结合,使细胞核染成绿色,细胞质染成暗蓝色。
这使得研究者可以
更清晰地观察和分析根细胞的结构和形态。
此外,通过dapi染色,还
可以检测细胞核内的DNA含量和分布,以及核仁和核糖体等细胞器的
分布。
总的来说,dapi染色是一种快速而有效的根细胞染色方法,可用于研
究根的结构和功能,以及分析细胞器分布和细胞核的DNA含量和分布。
通过对根的dapi染色的了解,更深入地了解植物的生长和发育,对于
植物学和生物学的研究有很大的帮助。
甲醛固定细胞的dapi染色流程
甲醛固定细胞的dapi染色流程甲醛固定后的细胞需用PBS洗涤三次,每次五分钟。
Cells fixed with formaldehyde need to be washed with PBS three times, each time for five minutes.接着,将细胞用PBS溶液浸泡十分钟。
Then, immerse the cells in PBS solution for ten minutes.将PBS溶液倒掉后,用70%乙醇冲洗细胞,每次五分钟。
After discarding the PBS solution, rinse the cells with 70% ethanol, each time for five minutes.继续用PBS溶液洗涤细胞三次,每次五分钟。
Continue to wash the cells with PBS solution three times, each time for five minutes.将PBS倒掉后,用3.7%甲醛固定细胞十分钟。
After discarding the PBS, fix the cells with 3.7% formaldehyde for ten minutes.再次用PBS溶液洗涤细胞三次,每次五分钟。
Wash the cells with PBS solution three times again, each time for five minutes.接着,用0.1% Triton X-100在PBS中渗透细胞膜,持续十五分钟。
Next, permeabilize the cell membrane with 0.1% Triton X-100 in PBS for fifteen minutes.用5%牛血清蛋白封闭细胞孔,持续三十分钟。
Block the cells with 5% bovine serum albumin for thirty minutes.接下来,将DAPI染料添加到细胞上,孵育二十分钟。
DAPI染色液(1mgml)
DAPI 染色液(1mg/ml)简介:DAPI 染色液(DAPI Staining Solution)是适用于常见细胞和组织细胞核染色的染色液。
DAPI ,即2-(4-Amidinophenyl)-6-indolecarbamidine dihydrochloride ,也称DAPI dihydrochloride ,分子式为C 16H 15N 5 · 2HCl ,分子量为350.25,是可以穿透细胞膜的蓝色荧光染料,和双链DNA 结合后可以产生比DAPI 自身强20多倍的荧光,灵敏度高于EB 。
DAPI 染色常用于细胞凋亡检测,染色后用荧光显微镜观察或流式细胞仪检测。
DAPI 也常用于普通的细胞核染色以及某些特定情况下的双链DNA 染色。
DAPI 的最大激发波长为,最大发射波长为,DAPI 和双链DNA 结合后,最大激发波长为,最大发射波长为。
Leagene DAPI 染色液是浓缩的储存液,稀释后使用,一般推荐工作浓度,用于固定细胞或组织的细胞核染色。
组成:自备材料:1、 荧光显微镜2、 蒸馏水3、 微量移液器4、 PBS 或生理盐水操作步骤(仅供参考):1、根据实验具体要求,用无菌去离子水稀释到自己所需浓度,即为DAPI 染色工作液。
细胞核染色时,一般推荐工作浓度。
2、对于细胞或组织样品,固定后冲洗去除固定剂。
如需要进行免疫荧光染色,则先进行免疫荧光染色,染色完毕后再按后续步骤进行DAPI 染色,如果不需要进行其它染色,则直接进行后续的DAPI 染色。
对于贴壁细胞或组织切片,加入少量DAPI 染色工作液,覆盖住样品即可。
对于悬浮细胞,加入DAPI 染色工作液,充分混匀。
3、室温放置。
4、轻轻吸除DAPI 染色工作液。
编号 名称 DA0004 Storage DAPI 染色液(1mg/ml) 1ml-20℃ 避光 使用说明书 1份5、用无菌的PBS或生理盐水清洗。
6、直接在荧光显微镜下观察或封片后荧光显微镜下观察。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
DAPI染色
1.原理DAPI为4’,6二脒基-2-苯吲哚(4’,6—diamidino-2—phenylindole)能与双链DNA小槽,特别是AT碱基结合,也可插入少于3个连续AT碱基对的DNA序列中。
当它与双链DNA结合时,荧光强度增强20倍,而与单链DNA结合则无荧光增强现象,因此是一种简易、快速和敏感地检测DNA的方法。
DAPI的荧光强度虽较Hoechst低,但荧光稳定性优于Hoechst;其特异性较溴化乙啶(ethidlium bromide,EB)和碘化丙啶(propidium iodide,P1)高。
2.溶液配制
(1)0.01mol/L PBS(pH7.0):取0.1mol/L NaH2PO4·H2O 34ml、0.1mol/LNa2HPO4 66ml、NaCl 0.9g,溶于900m1双蒸水;
(2)DAPI储存液:将0.5mgDAPI溶于5.0ml PBS中,分装,低温长期保存;
(3)DAPI工作液:用PBS稀释DAPI储存液,终浓度为0.1ug/ml。
3.染色程序
(1)培养的单层细胞(未固定)或新鲜组织的冰冻切片等,PBS漂洗5分钟;
(2)DAPI工作液室温染色5~20分钟(可根据实验材料的染色结果而定);
(3)PBS漂洗;
(4)水溶性封片剂封片,游离细胞也可直接用含DAPI的PBS封片;
(5)荧光显微镜观察。
结果:正常的细胞核呈强荧光,细胞质无荧光;固定的组织细胞同样处理,亦可得到相似的染色结果。
在有支原体污染的细胞质和细胞表面可见孤立的点状荧光,在感染痘苗病毒的细胞质中存在独特的“星状”荧光簇(star-like fluorescent clusters),腺病毒感染早期胞质中也可出现荧光。
DAPI
分子式C16H17Cl2N5 分子量350.25 性质 1. 外观黄色粉末2. 纯度≥95%
HPLC
3. 产品描述DAPI是一种可以穿透细胞膜的蓝色荧光染料。
和双链DNA结合后可以产生比DAPI自身强20多倍的荧光。
和EB ethidium bromide相比对双链DNA的染色灵敏度要高很多倍。
DAPI染色常用于细胞凋亡检测染色后用荧光显微镜观察或流式细胞仪检测。
DAPI也常用于普通的细胞核染色以及某些特定情况下的双链DNA染色。
因为DAPI 是含有特定AT序列DNA的一种嵌入剂它能像Hoechst染料一样粘附在DNA双螺旋的小沟区。
尽管DAPI不能通过活细胞膜但却能穿透扰乱的细胞膜而对核染色。
DAPI具有很高的光漂白承受水平能用来检测酵母线粒体DNA叶绿体DNA病毒DNA microplasm DNA以及染色体DNA。
DAPI-DNA复合物的激发和发射波长分别为360nm和460nm。
4. 染色过程
1用1mLddH2O将DAPI溶解制得2.9mM的DAPI溶液1mgDAPI/1mL H2O。
注DAPI不能直接用PBS等缓冲溶液溶解需要先用水将其溶解。
2取适量DAPI水溶液加到PBS中制备成10~50µM的DAPI溶液。
推荐以下PBS的配制方法将8.00g NaCl、0.20g KCl、2.9g Na2HPO4·12H2O、0.2g KH2PO4溶解于1L纯水中。
3将1/10培养基体积的DAPI溶液加入到细胞培养基中。
也可以用1/10浓度的DAPI缓冲液代替培养基。
4在37℃培养细胞10~20分钟。
5用PBS或合适的缓冲液洗细胞两次。
6用带有360nm激发波长460nm发射波长的滤光片的荧光显微镜观察细胞。
储存条件-20℃避光保存
注意事项DAPI对人体有一定刺激性请注意适当防护。
荧光染料都存在淬灭的问题建议染色后尽量当天完成检测。
为减缓荧光淬灭可以使用抗荧光淬灭封片液
DAPI保存放在4℃保存。
DAPI配制使用无菌三蒸水溶解可以将10mgDAPI溶解在10ml水中使用冻存管分装每一管1ml20℃冻存。
使用的时候先取一管放在4℃。
染色把培养皿中的培养基换一次液每一个皿中放4-8ml培养基使用微量加样器加DAPI到培养皿中。
浓度50ug/ml,也就是4ml培养基对0.2ml DAPI工作液注意避光无菌操作。
移植前使用PBS洗6遍使用DMEM混悬每一皿细胞混悬在1mlDMEM中放在1ml管中备用。
染色可以2小时或者移植前一天染色都可以。
